Углерод: формула, химические свойства, характеристики
Поможем понять и полюбить химию
Начать учиться
В этой статье мы дадим характеристику углерода с точки зрения химии: узнаем, металл это или неметалл, какими свойствами он обладает, с какими веществами реагирует и где находят применение различные модификации углерода.
Углерод — это химический элемент, неметалл, расположенный в таблице Д. И. Менделеева в главной подгруппе IV группы, во 2-м периоде, имеет порядковый номер 6.
Агрегатное состояние углерода при нормальных условиях — твердое вещество с атомной кристаллической решеткой. Молекула углерода одноатомна. Химическая формула углерода — С.
Строение углерода
В нейтральном атоме углерода находится шесть электронов. Два из них расположены вблизи ядра и образуют первый слой (1s-состояние). Следующие четыре электрона образуют второй электронный слой. Два из четырех электронов находятся в 2s-состоянии, а два других — в 2р-состоянии. Нейтральный атом углерода в основном состоянии двухвалентен и имеет электронно-графическую конфигурацию 1s22s22р2.
Следующие четыре электрона образуют второй электронный слой. Два из четырех электронов находятся в 2s-состоянии, а два других — в 2р-состоянии. Нейтральный атом углерода в основном состоянии двухвалентен и имеет электронно-графическую конфигурацию 1s22s22р2.
Несмотря на наличие двух неспаренных электронов на внешнем уровне, в большинстве химических соединений углерод четырехвалентен. Возможность образовывать четыре связи углерод получает при переходе одного электрона из состояния 2s в 2р — происходит «распаривание», т. е. переход атома углерода из нейтрального состояния в возбужденное. Этому возбужденному состоянию атома углерода соответствует электронная конфигурация 1s22s12p3.
Возможные валентности: II, IV.
Возможные степени окисления: −4, 0, +2, +4.
Твоя пятёрка по английскому.
С подробными решениями домашки от Skysmart
Аллотропия углерода
Углерод существует во множестве аллотропных модификаций с очень разнообразными физическими свойствами. Разнообразие модификаций обусловлено способностью углерода образовывать химические связи разного типа.
Разнообразие модификаций обусловлено способностью углерода образовывать химические связи разного типа.
Выделяют два вида углерода в зависимости от образования модификаций:
Кристаллический углерод входит в состав твердых веществ (алмаз, графит, графен, фуллерен, карбин).
Аморфный углерод образует мягкие вещества (уголь, кокс, сажа).
Рассмотрим подробнее основные аллотропные модификации углерода, их физические свойства и применение.
Алмаз
Алмаз — трехмерный полимер, бесцветное кристаллическое вещество, самый твердый природный минерал, имеет высокую теплопроводность. Его используют в промышленности для обработки различных твердых материалов, для бурения горных пород. Несмотря на то что алмаз твердый, в то же время он хрупкий.
В кристаллической решетке атомы углерода связаны ковалентной связью. Расстояние между всеми атомами одинаковое, поэтому связи прочные по всем направлениям.
Одно из уникальных свойств алмазов — способность преломлять свет (люминесценция). При действии излучения алмазы начинают светиться разными цветами. Такая игра света, хороший показатель преломления и прозрачность делают этот драгоценный камень одним из самых дорогих. При этом необработанный алмаз не обладает такими качествами.
В промышленных масштабах алмазы получают при высоком давлении (тысячи МПа) и высоких температурах (1 500–3 000 °С). Процесс протекает в присутствии катализатора (например, Ni).
При нагревании алмаза до 1 000 °С и высоком давлении без доступа воздуха получают графит.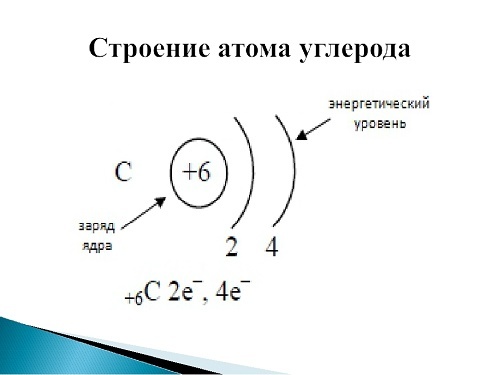 При температуре 1 750 °С переход из алмаза в графит протекает существенно быстрее. При прокаливании в кислороде алмаз сгорает, образуя диоксид углерода.
При температуре 1 750 °С переход из алмаза в графит протекает существенно быстрее. При прокаливании в кислороде алмаз сгорает, образуя диоксид углерода.
Графит
Графит — темно-серое мягкое кристаллическое вещество со слабым металлическим блеском. Хорошо электро- и теплопроводен, стоек при нагревании в вакууме. Имеет слоистую структуру. На поверхности оставляет черные черты. На ощупь графит жирный и скользкий.
Графит термодинамически устойчив, поэтому в расчетах термодинамических величин он принимается в качестве стандартного состояния углерода.
На воздухе графит не загорается даже при сильном накаливании, но легко сгорает в чистом кислороде с образованием диоксида углерода.
При температуре 3 000 °С в электрических печах получают искусственный графит из лучших сортов каменного угля.
Графен
Графен представляет собой монослой графита. Впервые графен был получен ручным механическим отщеплением в лабораторных условиях, что не предполагает широкого производства.
Впервые графен был получен ручным механическим отщеплением в лабораторных условиях, что не предполагает широкого производства.
В более крупных масштабах графен получают при помощи нагревания кремниевых пластин, верхний слой которых состоит из карбида кремния. Под действием высоких температур происходит отщепление атомов углерода, которые остаются на пластинке в виде графена, а кремний испаряется. Графен представляет собой тонкое и прочное вещество с высокой электропроводностью. В настоящее время он широко используется в микроэлектронике и автомобилестроении.
Карбин
Карбин — твердое черное вещество. Состоит из линейных полимерных цепей, которые соединены чередующимися одинарными и тройными связями в линейные цепочки: −С≡С−С≡С−С≡С−.
Впервые карбин был открыт в 60-х годах, но его существование не признавали до тех пор, пока его не обнаружили в природе — в метеоритном веществе.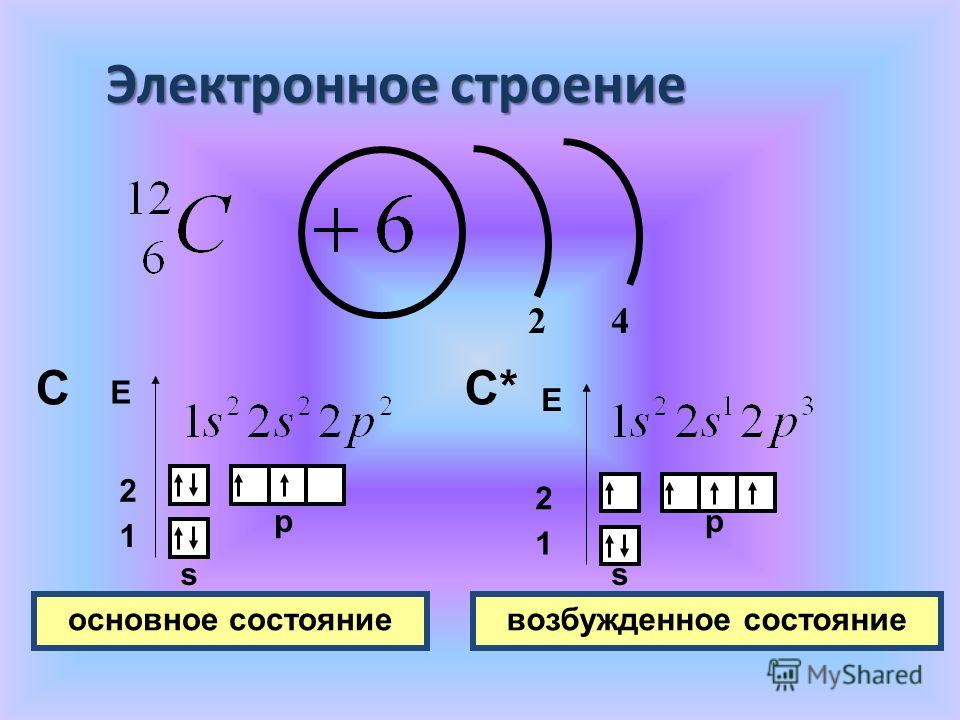
Карбин — полупроводник, под действием света его проводимость сильно увеличивается. Переход в графит возможен при нагревании до 2 300 °С.
Карбин применяют в медицине для изготовления искусственных кровеносных сосудов.
Уголь
Уголь — мельчайшие кристаллики графита, полученные путем термического разложения углеродсодержащих соединений без доступа воздуха.
Угли имеют разные свойства в зависимости от веществ, из которых получены. Наиболее важные сорта угля — кокс, древесный уголь, сажа.
Кокс получается при нагревании каменного угля без доступа воздуха. Применяется в металлургии при выплавке металлов из руд.
Древесный уголь образуется при нагревании дерева без доступа воздуха. Благодаря пористому строению он обладает высокой адсорбционной способностью.

Сажа — очень мелкий графитовый кристаллический порошок. Образуется при сжигании углеводородов (природного газа, ацетилена, скипидара и др.) с ограниченным доступом воздуха.
Активные угли — пористые промышленные адсорбенты, получаемые из твердого топлива, дерева и продуктов его переработки. Применяются для поглощения паров летучих жидкостей из воздуха.
Сравнение основных аллотропных модификаций углерода
Нахождение углерода в природе
Согласно справочнику Дж. Эмсли «Элементы», углерод занимает 11-е место по распространенности в природе. Содержание углерода составляет 0,1% массы земной коры. Свободный углерод представлен в виде алмаза и графита.
Основная масса углерода существует в виде природных карбонатов кальция CaCO3 (мела, мрамора, известняка) и магния MgCO3, а также горючих ископаемых.
Доля углерода в составе горючих ископаемых
Название | Содержание углерода |
|---|---|
Антрацит | 93% |
Бурые угли | 72% |
Каменные угли | 84% |
Горючие сланцы | 60% |
Нефть | 80% |
Горючие природные газы | До 99% метана |
Торф | 50% |
В атмосфере находится в виде диоксида углерода СО2 (~0,03%). В воде углерод содержится в составе растворимых гидрокарбонатов кальция Ca(HCO3)2 и магния Mg(HCO3)2. Углерод входит в состав растений и животных (~20%).
В воде углерод содержится в составе растворимых гидрокарбонатов кальция Ca(HCO3)2 и магния Mg(HCO3)2. Углерод входит в состав растений и животных (~20%).
Химические свойства углерода
Взаимодействие со фтором
Углерод обладает низкой реакционной способностью и из галогенов реагирует только со фтором:
С + 2F2 = CF4.
Взаимодействие с кислородом
При нагревании взаимодействует с кислородом, образуя оксиды СО и СО2:
2С + О2 = 2СО;
С + О2 = СО2.
Взаимодействие с другими неметаллами
Реагирует с серой:
С + 2S = CS2.
Не взаимодействует с азотом и фосфором.
Углерод взаимодействует с водородом и кремнием в присутствии никелевого катализатора:
C + Si = SiC;
C + 2H2 = CH4.
Взаимодействие с металлами
Способен взаимодействовать с металлами, образуя карбиды:
Ca + 2C = CaC2.
Взаимодействие с водой
При пропускании водяных паров через раскаленный уголь образуется оксид углерода (II) и водород:
C + H2O = CO + H2.
Восстановительные свойства
Углерод способен восстанавливать многие металлы из их оксидов (карботермия):
2ZnO + C = 2Zn + CO2.
Концентрированные серная и азотная кислоты при нагревании окисляют углерод до оксида углерода (IV):
C + 2H2SO4 = CO2 + 2SO2 + 2H2O;
C + 4HNO3 = CO2 + 4NO2 + 2H2O.
Вопросы для самопроверки
Что такое углерод? Дайте характеристику его положения в Периодической системе химических элементов Д.
 И. Менделеева.
И. Менделеева.Как распределяются электроны по энергетическим уровням в атоме углерода? Напишите электронную конфигурацию углерода.
Углерод является окислителем в реакции с:
Кислородом
Хлором
Водородом
Серой
Возможно ли взаимопревращение алмаза и графита? Объясните почему.
В виде каких соединений углерод находится в природе?
Для какого аллотропного видоизменения углерода характерна совместимость с тканями человеческого организма?
Опишите физические свойства графена и карбина.
Для чего используют карботермию?
Чем обусловлено наличие аллотропных видоизменений углерода?
В чем заключается различие между нейтральным состоянием атома углерода и возбужденным? Какие возможны степени окисления?
Красота химии — в том, что она изучает окружающий нас мир. Но это не всегда получается увидеть на школьных занятиях. Онлайн-уроки химии в Skysmart помогут не только подтянуть оценки и подготовиться к экзаменам, но и полюбить этот предмет, тесно связанный с окружающим нас миром.
Но это не всегда получается увидеть на школьных занятиях. Онлайн-уроки химии в Skysmart помогут не только подтянуть оценки и подготовиться к экзаменам, но и полюбить этот предмет, тесно связанный с окружающим нас миром.
Татьяна Сосновцева
К предыдущей статье
Химия сероводорода
К следующей статье
Простые и сложные вещества
Получите план обучения, который поможет понять и полюбить химию
На вводном уроке с методистом
Выявим пробелы в знаниях и дадим советы по обучению
Расскажем, как проходят занятия
Подберём курс
Строение атома углерода, свойства и схема элемента
4.1
Средняя оценка: 4.1
Всего получено оценок: 548.
4.1
Средняя оценка: 4.1
Всего получено оценок: 548.
Углерод (С) – шестой элемент периодической таблицы Менделеева с атомным весом 12. Элемент относится к неметаллам и имеет изотоп 14С. Строение атома углерода лежит в основе всей органической химии, т. к. все органические вещества включают молекулы углерода.
Атом углерода
Положение углерода в периодической таблице Менделеева:
- шестой порядковый номер;
- четвёртая группа;
- второй период.
Опираясь на данные из таблицы, можно заключить, что строение атома элемента углерода включает две оболочки, на которых расположено шесть электронов. Валентность углерода, входящего в состав органических веществ, постоянна и равна IV. Это значит, что на внешнем электронном уровне находится четыре электрона, а на внутреннем – два.
Из четырёх электронов два занимают сферическую 2s-орбиталь, а оставшиеся два – 2p-орбиталь в виде гантели. В возбуждённом состоянии один электрон с 2s-орбитали переходит на одну из 2p-орбиталей. При переходе электрона с одной орбитали на другую затрачивается энергия.
При переходе электрона с одной орбитали на другую затрачивается энергия.
Таким образом, возбуждённый атом углерода имеет четыре неспаренных электрона. Его конфигурацию можно выразить формулой 2s12p3. Это даёт возможность образовывать четыре ковалентные связи с другими элементами. Например, в молекуле метана (СН4) углерод образует связи с четырьмя атомами водорода – одна связь между s-орбиталями водорода и углерода и три связи между p-орбиталями углерода и s-орбиталями водорода.
Схему строения атома углерода можно представить в виде записи +6C)2)4 или 1s22s22p2.
Рис. 2. Строение атома углерода.Физические свойства
Углерод встречается в природе в виде горных пород. Известно несколько аллотропных модификаций углерода:
- графит;
- алмаз;
- карбин;
- уголь;
- сажа.
Все эти вещества отличаются строением кристаллической решётки. Наиболее твёрдое вещество – алмаз – имеет кубическую форму углерода. При высоких температурах алмаз превращается в графит с гексагональной структурой.
Наиболее твёрдое вещество – алмаз – имеет кубическую форму углерода. При высоких температурах алмаз превращается в графит с гексагональной структурой.
Химические свойства
Атомное строение углерода и его способность присоединять четыре атома другого вещества определяют химические свойства элемента. Углерод реагирует с металлами, образуя карбиды:
- Са + 2С → СаС2;
- Cr + C → CrC;
- 3Fe + C → Fe3C.
Также реагирует с оксидами металлов:
- 2ZnO + C → 2Zn + CO2;
- PbO + C → Pb + CO;
- SnO2 + 2C → Sn + 2CO.
При высоких температурах углерод реагирует с неметаллами, в частности с водородом, образуя углеводороды:
С + 2Н2 → СН4.
С кислородом углерод образует углекислый газ и угарный газ:
- С + О2 → СО2;
- 2С + О2 → 2СО.
Угарный газ также образуется при взаимодействии с водой:
C + H2O → CO + H2.
Концентрированные кислоты окисляют углерод, образуя углекислый газ:
- 2H2SO4 + C → CO2 + 2SO2 + 2H2O;
- 4HNO3 + C → CO2 + 4NO2 + 2H2O.
Активность углерода возрастает при нагревании. При низких температурах элемент относительно стабилен.
Что мы узнали?
Углерод – типичный неметалл с шестью электронами на s- и р-орбиталях. В активном состоянии приобретает валентность IV и способен присоединять четыре атома вещества. Углерод может быть представлен в виде угля, сажи, графита, алмаза. Элемент реагирует с металлами, неметаллами, кислотами, кислородом, оксидами.
Тест по теме
Доска почёта
Чтобы попасть сюда — пройдите тест.
Natasha Zolotareva
5/5
Даниил Шкарин
5/5
Оценка доклада
4. 1
1
Средняя оценка: 4.1
Всего получено оценок: 548.
А какая ваша оценка?
Chem4Kids.com: Углерод: информация об орбитах и соединениях
Посмотрите на доску. В этом поле слева есть вся информация, которую вам нужно знать об одном элементе. Он сообщает вам массу одного атома, сколько частей внутри и где он должен быть помещен в периодической таблице.
В следующем разделе мы рассмотрим электронные орбитали или электронные оболочки. Это может быть новой темой для некоторых из вас.
Взгляните на картинку ниже. Каждый из этих цветных шаров является электроном. В атоме электроны вращаются вокруг центра, также называемого ядром. Электроны любят быть отдельными снаряды/орбитали . Оболочка номер один может содержать только 2 электрона, оболочка номер два может содержать 8, а для первых восемнадцати элементов оболочка номер три может содержать максимум восемь электронов. Когда вы узнаете об элементах с более чем восемнадцатью электронами, вы обнаружите, что третья оболочка может содержать больше восьми. Как только одна оболочка заполнена, следующий добавленный электрон должен перейти на следующую оболочку.
Когда вы узнаете об элементах с более чем восемнадцатью электронами, вы обнаружите, что третья оболочка может содержать больше восьми. Как только одна оболочка заполнена, следующий добавленный электрон должен перейти на следующую оболочку.
Итак… для элемента УГЛЕРОДА вы уже знаете, что атомный номер говорит вам о количестве электронов. Это означает, что в атоме углерода 6 электронов. Глядя на картинку, вы можете видеть, что на первой оболочке два электрона, а на второй — четыре электрона.
► Подробнее об истории и местах, где можно найти углерод.
► Следующий элемент периодической таблицы.
- Скажи/Найди
- Орбитали/связи
- Предыдущий элемент
- Следующий элемент
- Список элементов
- Периодическая таблица
- Дополнительные темы
Это углекислый газ молекула. Когда вы выдыхаете, вы обычно выдыхаете углекислый газ. Формула CO 2 означает наличие двух атомов кислорода (O) и одного атома углерода (C). Если вы внимательно посмотрите на точечную структуру, то увидите, что у каждой из них по четыре общих электрона. Если связь имеет два общих электрона, это означает, что это одинарная связь. Если связь состоит из четырех электронов, это двойная связь. Это означает, что атом углерода имеет две двойные связи, по одной с каждым атомом кислорода. Когда вы выдыхаете, вы обычно выдыхаете углекислый газ. Формула CO 2 означает наличие двух атомов кислорода (O) и одного атома углерода (C). Если вы внимательно посмотрите на точечную структуру, то увидите, что у каждой из них по четыре общих электрона. Если связь имеет два общих электрона, это означает, что это одинарная связь. Если связь состоит из четырех электронов, это двойная связь. Это означает, что атом углерода имеет две двойные связи, по одной с каждым атомом кислорода. | ||
| Вот что-то новое! У нас есть три разных элемента: углерод (C), азот (N) и хлор (Cl). В этом нет ничего особенного, но то, как они сочетаются! Посмотрите на углерод и азот, у них шесть общих электронов! Когда два атома имеют два общих электрона, это одинарная связь. Если их четыре, это двойная связь. Ну, эти двое делят шестерых, это тройная связь. Это чрезвычайно сильно и мощно. Еще одно! Поскольку связь между углеродом и азотом настолько сильна, ученые называют их « цианоген » вместо углерод-азот. Ученые знают, что цианоген всегда CN . | ||
| Два атома бериллия (Be) могут соединиться с одним атомом углерода (C) с образованием Be 2 C . Атомы бериллия позволяют углероду использовать свои электроны, так что углерод становится «счастливым». Каждый бериллий отдает два своих дополнительных электрона углероду. Посмотрите и посмотрите, как распределяются все электроны. | ||
Вопросы и ответы — Как найти количество протонов, электронов и нейтронов в атоме элемента?
Предыдущий вопрос
(Не могли бы вы объяснить плотность?)
Вопросы и ответы
Основной индекс
Следующий вопрос
(Сколько протонов, нейтронов и электронов в атоме?)
Предыдущий вопрос
(Не могли бы вы объяснить плотность?)
Вопросы и ответы Основной индекс
Следующий вопрос
(Сколько протонов, нейтронов и электронов в атоме?)
Вопросы и ответы Основной индекс
Сколько протонов, электронов и нейтронов в атоме криптона, углерода, кислорода, неона, серебра, золота и т. д…?
д…?
Чтобы найти количество протонов, электронов и нейтронов в атоме, выполните следующие простые шаги:
Шаг 1 — Сбор информации
Первое, что вам нужно сделать, это найти некоторую информацию о вашем элементе. Перейдите в периодическую таблицу элементов и нажмите на свой элемент. Если это упрощает задачу, вы можете выбрать элемент из алфавитного списка.
Используйте Таблицу элементов, чтобы найти атомный номер и атомный вес вашего элемента. Атомный номер — это число, расположенное в верхнем левом углу, а атомный вес — это число, расположенное внизу, как в этом примере для криптона:
Шаг 2. Число протонов равно…
атомный номер — это количество протонов в атоме элемента. В нашем примере атомный номер криптона равен 36. Это говорит нам о том, что атом криптона имеет в ядре 36 протонов.
Интересно, что каждый атом криптона содержит 36 протонов. Если в атоме нет 36 протонов, он не может быть атомом криптона. Добавление или удаление протонов из ядра атома создает другой элемент. Например, удаление одного протона из атома криптона создает атом брома.
Добавление или удаление протонов из ядра атома создает другой элемент. Например, удаление одного протона из атома криптона создает атом брома.
Шаг 3. Число электронов равно…
По определению, атомы не имеют общего электрического заряда. Это означает, что должен существовать баланс между положительно заряженными протонами и отрицательно заряженными электронами. Атомов должно быть одинаковое количество протонов и электронов . В нашем примере атом криптона должен содержать 36 электронов, поскольку он содержит 36 протонов.
Электроны особым образом расположены вокруг атомов. Если вам нужно знать, как электроны расположены вокруг атома, взгляните на статью «Как читать таблицу конфигурации электронов?» страница.
Атом может приобретать или терять электроны, становясь так называемым ионом . Ион — это не что иное, как электрически заряженный атом. Добавление или удаление электронов из атома не меняет того, какой это элемент, а только его суммарный заряд.
Например, удаление электрона из атома криптона образует ион криптона, который обычно записывается как Kr + . Знак плюс означает, что это положительно заряженный ион. Он заряжен положительно, потому что из атома был удален отрицательно заряженный электрон. Оставшихся 35 электронов было меньше, чем 36 положительно заряженных протонов, что привело к заряду +1.
Шаг 4. Число нейтронов равно…
Атомный вес в основном является измерением общее число частиц в ядре атома . На самом деле, это не такой чистый срез. Атомный вес на самом деле представляет собой средневзвешенное значение всех встречающихся в природе изотопов элемента по отношению к массе углерода-12. Не понял? Не имеет значения. Все, что вам действительно нужно найти, это то, что называется массовым числом . К сожалению, массовое число не указано в таблице элементов. К счастью, чтобы найти массовое число, все, что вам нужно сделать, это округлить атомный вес до ближайшего целого числа 9. 0140 . В нашем примере массовое число криптона равно 84, так как его атомный вес, 83,80, округляется до 84.
0140 . В нашем примере массовое число криптона равно 84, так как его атомный вес, 83,80, округляется до 84.
Массовое число — это количество частиц в ядре атома. Помните, что ядро состоит из протонов и нейтронов. Итак, если мы хотим, мы можем написать:
Массовое число = (Количество протонов) + (Количество нейтронов)
Для криптона это уравнение принимает вид:
84 = (Количество протонов) + (Количество нейтронов)
Если бы мы только знали, сколько протонов у криптона, мы могли бы вычислить, сколько у него нейтронов. Подожди… Нам do узнай сколько протонов у криптона! Мы сделали это еще в Шаге 2 ! Атомный номер (36) — это количество протонов в криптоне. Подставив это в уравнение, мы получим:
84 = 36 + (Число нейтронов)
Какое число прибавить к 36, получится 84? Надеюсь, вы сказали 48. Это количество нейтронов в атоме криптона.
Интересно, что добавление или удаление нейтронов из атома не создает новый элемент.


 И. Менделеева.
И. Менделеева. Потребуется много работы, чтобы разделить C и N !
Потребуется много работы, чтобы разделить C и N !