Синтез тригидрат трис(оксалато)кобальтата (III) калия K3[Co(C2O4)3]… — Курсовая
ВВЕДЕНИЕ
Целью данной работы является синтез комплексного соединения тригидрат трис(оксалато)кобальтата (III) калия K3[Co(C2O4)3] ∙ 3h3O.
Качество синтеза предполагалось проверить с помощью инфракрасной и электронной спектроскопии.
Данная работа является учебной. А сам метод синтеза достаточно универсален, и применим для широкого круга аналогичных комплексов переходных металлов.
Литературный обзор
Свойства кобальта и его соединения
Кобальт был открыт в тысяча семьсот тридцать пятом году Брандтом Кобальтом.
Характеристика металла. Серо-стальной; очень вязкий; твердость 5,5 по Моосу; ферромагнетик, легко растворяется в окисляющих кислотах, медленно растворяется в неокисляющих кислотах в простых соединениях самая устойчивая степень окисления +2, для комплексных соединений более устойчивой является степень окисления +3.
Важнейшие минералы: смальтин CoAs2 кобальтовый шпейс, кобальтин CoAsS кобальтовый блеск, эритрит Co3(AsО4)2 • 8Н2О кобальтовый цвет, гетерогенит Со2О3 • Н2О или Со2О3 • 2Н2О, линнеит Co3S4 кобальтовый колчедан.
Главные месторождения: Заир, Канада, Россия, Германия, Швеция, Норвегия.
Основное получение. Кобальт можно получить, восстанавливая углем из его оксида:
Со₂O₃ + ЗС → 2Co + 2CO
Кобальт является компонентом сплавов, составной частью катализатора (синтез Фишера — Троппа), а также искусственный изотоп 60Со используют в технике и медицине.
Соединения кобальта
Простые неорганические соединения наиболее устойчивы для кобальта в степени окисления +2. Стандартный природный потенциал Co³⁺/Co²⁺ сильно зависит от природы лиганда.
Стандартный природный потенциал Co³⁺/Co²⁺ сильно зависит от природы лиганда.
Стабилизация кристаллическим полем делает более благоприятным образование кобальта (III) и ослабляет его окислительные свойства. Таким образом, для кобальта в степени окисления +3 характерна очень богатая химия координационных соединений, в то время как его простые неорганические соли неустойчивы в водных растворах, так как являются сильными окислителями. Акцепторные лиганды стабилизируют металл в низких степенях окисления.
1. Соединения кобальта +2.
Степень окисления +2 наиболее устойчива для кобальта. Электронная конфигурация d7,которую он приобретает в этом состоянии, и сравнительно низкая энергия расщепления обеспечивают существование парамагнитных октаэдрических комплексов.
Синтез тригидрат трис(оксалато)кобальтата (III) калия K3[Co(C2O4)3]×3h3O
Новосибирский Государственный Университет
Курсовая работа по неорганической химии
Синтез тригидрат трис(оксалато)кобальтата (III) калия
K3[Co(C2O4)3]×3H2O
Выполнили:
Буркова Е.
Гусельникова О.
Проверил:
Ельцов И.В.
Новосибирск, 2010
Оглавление
Литературный обзор2
Практическая часть 6
Исследование свойств синтезированного соединения 8
Вывод
Свойства кобальта и его
соединения
Кобальт был открыт в тысяча семьсот тридцать
пятом году Брандтом Кобальтом.
Серо-стальной; очень вязкий;
твердость 5,5 по Моосу; ферромагнетик,
легко растворяется в окисляющих кислотах,
медленно растворяется в неокисляющих
кислотах в простых соединениях самая
устойчивая степень окисления +2, для комплексных
соединений более устойчивой является
степень окисления +3.
Важнейшие минералы: смальтин CoAs2 кобальтовый
шпейс , кобальтин CoAsS кобальтовый блеск
, эритрит Co3(As04)2 • 8Н20 кобальтовый цвет
, гетерогенит Со203 • Н20 или Со203 • 2Н20 ,
линнеит Co3S4 кобальтовый колчедан.
Главные месторождения: Заир, Канада ,
Россия, Германия, Швеция, Норвегия.
Кобальт можно получить,
восстанавливая углем из его оксида:
Кобальт является компонентом сплавов, составной частью катализатора (синтез Фишера — Троппа), а также искусственный изотоп 60Со используют в технике и медицине.
Соединения кобальта
Простые неорганические соединения наиболее устойчивы для кобальта в степени окисления +2. Стандартный природный потенциал Co³⁺/Co²⁺ сильно зависит от природы лиганда.
Стабилизация кристаллическим полем делает более благоприятным образование кобальта (III) и ослабляет его окислительные свойства. Таким образом, для кобальта в степени окисления +3 характерна очень богатая химия координационных соединений, в то время как его простые неорганические соли неустойчивы в водных растворах, так как являются сильными окислителями. Акцепторные лиганды стабилизируют металл в низких степенях окисления.
Соединения кобальта +2
Степень окисления +2 наиболее
устойчива для кобальта.
Низкая энергия стабилизации октаэдрическим окружением приводит к энергетической близости между октаэдрическими и тетраэдрическими комплексами, объясняет легкость взаимных переходов между ними. В ажную роль в формировании геометрии образующейся комплексной частицы играет стерический фактор: объемные отрицательно заряженные лиганды, такие как CL⁻, Br⁻, I⁻, SO²⁻, CO²⁻, CO²⁻, способствуют образованию тетраэдрических комплексов, а компактные молекулы H₂O, NH₃ – октаэдрических. В случае некоторых отрицательно заряженных лигандов (OH⁻, NCS⁻, F⁻) в зависимости от условий синтеза могут быть получены комплексы разной геометрии. Часто об изменении координационного числа металла легко судить по переходу одной окраски в другую.
Соединения кобальта +3
Недавние исследования убедительно
доказали, что ион [Co(H₂O)₆]³⁺ диамагнитен.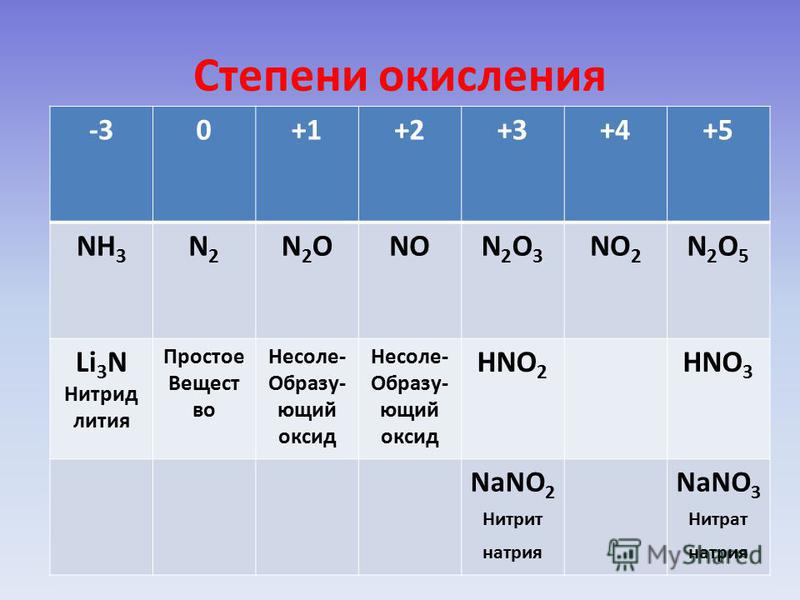 Это единственный
пример низкоспинового аквакомплекса
среди 3d-элементов. Его образование энергетически
выгодно. Фторидные комплексы кобальта
(III) [CoF₃(H₂O)] – высокоспиновые. Они представляют
собой светло-желтые порошки, разлагающиеся
водой. Гексафторокобальтат (III) калия
K₃[CoF₆] образуется при фторировании
смеси хлоридов кобальта (II) и калия при
температуре 400° C.
Это единственный
пример низкоспинового аквакомплекса
среди 3d-элементов. Его образование энергетически
выгодно. Фторидные комплексы кобальта
(III) [CoF₃(H₂O)] – высокоспиновые. Они представляют
собой светло-желтые порошки, разлагающиеся
водой. Гексафторокобальтат (III) калия
K₃[CoF₆] образуется при фторировании
смеси хлоридов кобальта (II) и калия при
температуре 400° C.
Свойства некоторых соединений кобальта.
Формула | р. г • см-3 | t плавления | Окраска | Прочие свойства |
СоО | 5,68 | 1800 | Оливково-зеленый | Порошок |
Со(ОН)2 | 3,597 | — | Розовый | Кристаллический |
CoF2 | 4,46 | 1200 | Розовый | Кристаллический |
СоС12 | 3,367 | 740 | Синий | Кристаллический; листочки; очень гигроскопичен |
СоВг2 | 4,849 | 687 | Зеленый | Порошок |
СоJ2 | 5,584 | 515 | Черный (а-), цвета охры (в-) | — |
СоС03 | 4,13 | — | Светло-красный | Микрокристаллический порошок |
СоН3 | 0,523 | — | Темно-серый | + разбавленная кислота —> Н2 |
CoS | 5,45 | 1100 | Черный | Осадок полиморфный |
Оксид кобальта
Формула | р. | Окраска | Прочие свойства |
Со203 | 5,18 | Коричнево-черный | Порошок; не растворим в Н20 |
Со(ОН)3 | — | Коричневый | Растворимость в Н20 при 20 °С -3,2 • 10~* % |
CoF3 | 3,89 | Светло-коричневый | Порошок; бурная реакция с Н20 |
Co2S3 | 4,897 | Серо-черный | Блестящий; кристаллический |
Кобальт, один из микроэлементов,
жизненно важных организму. Он входит
в состав витамина В12 (кобаламин). Кобальт
задействован при кроветворении, функциях
нервной системы и печени, ферментативных
реакциях. Потребность человека в
кобальте 0,007-0,015 мг, ежедневно. В теле
человека содержится 0,2 мг кобальта на
каждый килограмм массы человека. При отсутствии кобальта развивается
акобальтоз.
При отсутствии кобальта развивается
акобальтоз.
Избыток кобальта для человека вреден.
В 1960-х годах соли кобальта использовались некоторыми пивоваренными компаниями для стабилизации пены. Регулярно выпивавшие более четырёх литров пива в день получали серьёзные побочные эффекты на сердце, и, в отдельных случаях, это приводило к смерти. Известные случаи т.н. кобальтовой кардиомиопатии в связи с употреблением пива происходили с 1964 по 1966 годы в Омахе (штат Небраска), Квебеке (Канада), Левене (Бельгия), и Миннеаполисе (штат Миннесота). С тех пор его использование в пивоварении прекращено, и в настоящее время является незаконным [3].
Особенно токсичны пары октакарбонила кобальта Со2(СО)8.
Практическая часть
Оборудование:
стакан емкостью 150мл, стакан емкостью 250 мл, магнитная мешалка,пипетка, воронка Бюхнера, стеклянная коническая воронка, бумажные фильтры, пробирки, электроплитка, стеклянная палочка.
Реактивы:
H2O, K2C2O4, H2C2O4,
CoCO3, PbO2, CH3COOH, C2H5OH.
Ход работы:
В стакан емкостью 150 мл налили 60 мл h3O и нагрели до 80oC на плитке. В горячую воду внесли 1.9 г h3C2O4, 7 г K2C2O4 и растворили при нагревании.
K2C2O4+h3C2O4=2KHC2O4 (в водном растворе при нагревании).
При этом образовалась кислая соль KHC2O4.
Затем, перемешивая раствор на магнитной мешалке, добавили небольшими порциями 2.5 г CoCO3.
KHC2O4+CoCO3=K2[Co(C2O4)2]+
При этом бурно выделялся углекислый газ.
Смесь охладили до 40о C. При энергичном перемешивании добавили 2.5 г PbO2. Затем добавили 2.5 мл Ch4COOH из пипетки со скоростью 0.5 мл за 2-3 мин (реакционная смесь изменила красную окраску на зеленую).
3K2[Co(C2O4)2]+PbO2+4Ch4COOH=
Полученный раствор  Скорее
всего, это был нерастворившийся
PbO2.
Скорее
всего, это был нерастворившийся
PbO2.
К отфильтрованному раствору прилили без перемешивания 75мл C2H5OH.
K3[Co(C2O4)3]+C2H5OH+3h3O=K3[
В осадок выпали изумрудные кристаллы.
Выпавшие кристаллы
При синтезе было выделено
2 пробы комплекса. В дальнейшем по
результатам ИК-спектроскопии
Исследование свойств синтезированного соединения.
Изумрудно-зеленые игольчатые кристаллы.
Температура плавления комплекса 112оС.
Результаты ИК-спектроскопии в области 4000-400 см-1
(проба 1)
Положение максимумов | Отнесение к связи | Примечания | |
Литературное | Экспериментальное | ||
3500 | 3554. | Валентные колебания ОН | |
— — — — | 3473.2 3075.6 2937.2 2750.2 | Результат загрязнения препарата | |
1702 | 1702.5 | Валентные колебания С=О | |
1661 | 1662.0 | Деформационные колебания НОН | |
1393 | 1390.0 1378.6 | Валентные колебания С=О, С — С | |
1250 | 1248.5 | Валентные колебания С-О, деформационные колебания ОС=О | |
— | 1186.6 | Валентные колебания С-О | Результат загрязнения препарата |
911 | 903. | Деформационные колебания ОС=О, валентные колебания С-О | |
893 | 824.0 | Валентные колебания Со-О | |
869 | 805.5 | Валентные колебания С-С | |
565 | 563.2 | Деформационные колебания ОС=С | |
Проба 2
Положение максимумов | Отнесение к связи | Примечания | |
Литературное | Экспериментальное | ||
3500 | 3444.2 | Валентные колебания ОН | |
— — — | 3067.0 2917.3 2267.9 | Результат загрязнения препарата | |
1702 | 1700. | Валентные колебания С=О | |
1661 | 1666.2 | Деформационные колебания НОН | |
1393 | 1388.9 | Валентные колебания С=О, С — С | |
1250 | 1248.5 | Валентные колебания С-О, деформационные колебания ОС=О | |
911 | 988.0 | Деформационные колебания ОС=О, валентные колебания С-О | |
893 | 902.4 | Валентные колебания Со-О | |
869 | 805.3 | Валентные колебания С-С | |
— | 805.3 | Результат загрязнения препарата | |
565 | 563. | Деформационные колебания ОС=С | |
ИК-спектроскопия подтвердила то, что полученное вещество является комплексом K3[Co(C2O4)3]×3H2O в обеих пробах.
Электронный спектр поглощения свежеприготовленного раствора
(5*10-3М) в области 350-800 нм
Проба 1
Пики поглощения | Коэффицент экстинкции | ||
Литературный | Экспериментальный | Литературный | Рассчитанный по экспериментальным данным |
430 | 423 | 2.37 | 2.25 |
613 | 602 | 2.25 | 2.1 |
Проба 2
Пики поглощения | Коэффицент экстинкции | ||
Литературный | Экспериментальный | Литературный | Рассчитанный по экспериментальным данным |
430 | 423 | 2. | 2.46 |
613 | 603 | 2.25 | 2.34 |
Пики поглощения экспериментальные
и коэффициенты экстинкции близки к
эталону, отличия незначительные, скорее
всего это связано с
Удельная электропроводность X1=1.8*10-3Ом-1см-1
X2=2.2*10-3 Ом-1см-1
Молярная электропроводность М1=360 Ом-1см2
Выход комплекса в процентах
Ожидаемая масса полученного комплекса 13.84 г
m1=5.52 г m2=0.86г
всего mобщ=6.38 г
общий выход 46.1%
Реакции водного раствора комплекса (1*10-2) с различными реагентами (результаты проведения реакций обеих проб совпадают):
- 2K3[Co(C2O4)]*3h3O+3Na2S(р-р)=
Co2S3+3Na2C2O4+6h3O+3K2C2O4
Выпадает черный осадок.
- 2K3[Co(C2O4)]*3h3O+NaClO4=Cl2+
NaK2[Co(C2O4)]*3h3O+NaCl
Наблюдается выделение газа, раствор становится светлее.
- 2K3[Co(C2O4)]*3h3O+NaOH=K3[Co(
OH)6]*3h3O+NaC2O4
Раствор становится коричневым.
- 2K3[Co(C2O4)]*3h3O+KMnO4+2HCl=
MnCl2+K4[Co(C2O4)]+7h3O
Раствор становится темно-фиолетовым.
Вывод
В результате синтеза неорганического комплексного соединения было получено ожидаемое соединение 2K3[Co(C2O4)]*3h3O, которое по внешнему виду, химическим и физическим свойствам соответствует эталону. Соответствие было подтверждено снятием ИК и электронного спектров, измерением температуры плавления, удельной и молярной электропроводности, а также проведением химических реакций с характерными для данного вещества результатами.
Степень окисления Fe в $Fe{{C}_{2}}{{O}_{4}}$ составляет?
Ответить
Проверено
235,5 тыс. + просмотров
+ просмотров
Подсказка: В нейтральной молекуле алгебраическая сумма степеней окисления всех атомов в соединении должна быть равна нулю. Степень окисления кислорода в основном -2. В этой молекуле степень окисления углерода равна +3.
Полный пошаговый ответ:
Число окисления — это число, присвоенное элементу, которое представляет собой количество электронов, потерянных или приобретенных атомом этого элемента соединения.
Ниже приведены некоторые правила определения степени окисления.
— В элементах каждый атом имеет нулевую степень окисления в свободном или несвязанном состоянии.
— Степень окисления кислорода в основном равна -2, но для пероксидов и супероксидов существуют исключения, и когда кислород связан со фтором, он имеет степень окисления, например, +1, +2.
— В нейтральной молекуле алгебраическая сумма степеней окисления всех атомов в соединении должна быть равна нулю, а в многоатомном ионе алгебраическая сумма степеней окисления атома иона равна заряду иона.
В данной молекуле давайте рассмотрим степень окисления Fe как x.
Как мы знаем, степень окисления кислорода равна -2, а так как атомов кислорода четыре, то степень окисления четырех атомов кислорода равна -8.
-так как мы знаем, что углерод может иметь переменную валентность, а $Fe{{C}_{2}}{{O}_{4}}$ не имеет заряда, поэтому сумма степеней окисления всех атомов должна быть равна нулю, поэтому сумма степень окисления обоих атомов углерода равна +6, поэтому каждый атом углерода имеет степень окисления +3.
$\Rightarrow$ х + 2(3) + 4 (-2) = 0
$\Rightarrow$ x + 6 — 8 = 0
$\Rightarrow$ x — 2 = 0
$\Rightarrow$ x = +2
Степень окисления Fe в $Fe{{C}_{2}}{ {O}_{4}}$ равно +2.
Примечание: Во всех своих соединениях фтор имеет степень окисления -1. В нейтральной молекуле алгебраическая сумма степеней окисления всех атомов в соединении должна быть равна нулю.
Недавно обновленные страницы
В Индии по случаю бракосочетания фейерверк 12 класса химии JEE_Main
Щелочноземельные металлы Ba Sr Ca и Mg могут быть организованы 12 класса химии JEE_Main
Что из следующего имеет самый высокий электродный потенциал 12 класса химии JEE_Main
Что из следующего является истинным пероксидом A rmSrmOrm2 класса 12 химии JEE_Main
Какой элемент обладает наибольшим радиусом атомов А класса 11 химии JEE_Main
Получен фосфин из следующей руды Кальций класса 12 химии JEE_Main
В Индии по случаю бракосочетания фейерверк класса 12 химии JEE_Main
Щелочноземельные металлы Ba Sr Ca и Mg могут быть организованы класс 12 химии JEE_Main
Что из следующего имеет самый высокий электродный потенциал 12 класса химии JEE_Main
Что из следующего является истинным пероксидом A rmSrmOrm2 класса 12 химии JEE_Main
Какой элемент обладает наибольшим радиусом атомов А класса 11 химии JEE_Main
Получен фосфин из следующей руды A Кальций класс 12 химия JEE_Main
Тенденции сомнения
ChemTeam: Redox Rules: Tasks 11-30
ChemTeam: Redox Rules: Tasks 11-30Правила окислительно-восстановительного потенциала
Какова степень окисления .
 . .
. . Проблемы 11 — 30
Двадцать примеров
Проблемы 1-10
Примеры и задачи без ответов
Возврат в меню Redox
Гидриды представляют собой соединения металла и водорода. Каковы степени окисления элементов, присутствующих в каждой формуле, приведенной в 11-13?
Проблема №11: NaH
Из других соединений, таких как NaCl, мы знаем, что Na представляет собой +1. Таким образом, H равно a −1.
Задача №12: CaH 2
Ca = +2. Каждый H равен −1.
Проблема № 13: SH 6
По состоянию на июль 2017 года этот гидрид был предсказан, но еще не обнаружен. S — это +6, а каждый из шести гидридов — это -1.
Пероксиды содержат многоатомный ион O 2 2 ¯. Две проблемы:
Задача №14: H 2 O 2
Каждый водород равен +1, перекись равна −2.Это означает, что каждый кислород в перекиси представляет собой -1. Однако будьте осторожны. Если вы ссылаетесь на значение -1, вы должны четко указать, что имеете в виду атомы кислорода в перекиси. Если вы просто ссылаетесь на O без какого-либо контекста, предполагается, что вы имеете в виду оксид, степень окисления которого равна -2.
Задача №15: CaO 2
Кальций +2, перекись -2, если рассматривать как группу. Если бы вопрос заключался в том, чтобы задать степень окисления каждого кислорода в перекиси, ответ был бы -1.Комментарий: PbO 2 является примером возможной путаницы с идентификацией пероксидов. Является ли Pb = +4? В этом случае часть O 2 относится к двум оксидам, каждый из которых равен -2. Или Pb = +2? Если это так, то O 2 9Часть 0095 представляет собой перекись и имеет общий заряд -2, где каждый O равен -1 в перекиси.
Как узнать, какой из них имеется в виду? Вы бы сделали это в зависимости от контекста, в котором формула представлена.
если контекст отсутствует, обратитесь за помощью к учителю. Если это онлайн-курс и помощь в реальном времени получить сложно (или невозможно), выберите ответ Pb = +4. Если это неправильно, дайте другой.
Задача №16: HIO 3 йод имеет степень окисления:
Три атома кислорода в сумме дают -6, а водород добавляет +1, в результате чего -5 компенсируется йодом. Йод имеет степень окисления +5.
Задача №17: S 2 O 3 2 ¯, тиосульфат:
Три атома кислорода, каждый из которых равен −2, в сумме дают −6. Поскольку остается -2, в общей сложности -4 должно быть компенсировано двумя серами. Каждая сера имеет степень окисления +2.
Задача №18: Какова степень окисления всех свободных элементов? Другой способ спросить об этом — сказать, что элементы находятся в несвязанном состоянии.
Ноль.Кстати, молекулярные элементы (семь двухатомных плюс O 3 , P 4 и S 8 ) считаются несвязанными.
Элементы считаются комбинированными только в том случае, если они связаны хотя бы с одним другим (другим) элементом.
Задача №19: Определить степень окисления P в P 2 O 5 .
Сумма пяти атомов кислорода равна -10. Каждый P равен +5.
Задача №20: Определите степень окисления S в Al 2 S 3 .
Алюминий принимает степень окисления +3 во всех распространенных алюминийсодержащих соединениях. Примеры включают AlCl 3 и Al 2 O 3 .Сера может принимать несколько различных степеней окисления. Когда он один и находится в положении неметалла бинарного соединения, он принимает степень окисления -2. Примером этого является Na 2 S.
В этом соединении два Al, всего +6. Таким образом, три S должны в сумме давать −6. Это означает, что каждый S равен −2.
Задача №21: Определить степень окисления Te в Sc 2 Te 3 .
Известно, что существует соединение H 2 Te, что означает, что Te имеет степень окисления −2, когда действует как неметалл.Наличие трех Те означает общую отрицательную степень окисления -6.
Чтобы компенсировать это (и чтобы формула имела нулевой заряд), каждый Sc должен быть +3.
Задача №22: Определить степень окисления Si в SiF 6 2 ¯.
F равно -1. Мы знаем это из существования HF. Шесть из них дают в сумме -6. Чтобы осталось −2, Si должен быть +4.
Задача №23: Все одноатомные ионы имеют степени окисления, равные ______.
(а) разность протонов и электронов
(б) количество протонов
(в) количество электронов
(d) различие протонов и нейтроновОтвет: (а). Примеры включают Na + , Са 2+ и F¯.
Проблема № 24: В редких случаях степени окисления не обязательно должны быть целыми числами. Определите степень окисления S в S 4 O 6 2 ¯.
Определите степень окисления S в S 4 O 6 2 ¯.
Есть шесть O, которые в сумме дают -12 в степени окисления. Поскольку остается -2, остается -10, чтобы компенсировать четыре серы.Таким образом, каждая сера равна + 10 ⁄ 4 . Уменьшено будет + 5 ⁄ 2 (также рассматривается как +2,5).
По правде говоря, четыре атома серы в сумме будут иметь степень окисления +10, и каждая степень окисления четырех атомов будет целым значением. Например, если каждая из трех S равна +2, а одна S равна +4, то в сумме получится +10. Химические вещества не имеют дробных степеней окисления.
Задача № 25: Каковы степени окисления каждого Mn в Mn 3 O 4 ? За каждое Fe в Fe 3 O 4 ?
Четыре атома кислорода дают в сумме -8 в степени окисления.Каждый из трех атомов Mn должен иметь целочисленную степень окисления.
Это выполняется, если каждое из двух Mn равно +3, а третье Mn равно +2.
Для оксида железа (II, III) ответ тот же: каждый из двух атомов железа соответствует +3, а один атом железа соответствует +2.
Задача № 26: В каком соединении водород имеет степень окисления -1?
(а) НХ 3
(б) КХ
(в) HCl
(г) Н 2 О
Решение:
1) Правильный ответ (б).
2) Немного обсуждения:
Вы можете сделать неверный вывод из-за аммиака, так как водород стоит последним в формуле. Однако последнее место в формуле является исторической случайностью и не должно рассматриваться как указание на то, что водород представляет собой -1 в аммиаке. Помните, что гидриды состоят из металла и водорода. Азот — неметалл. Ч. 4 является примером другого соединения, которое не является гидридом, хотя водород пишется последним.KH — это гидрид, химическое соединение металла и водорода.
NaH и CaH 2 являются другими примерами гидридов.
Задача № 27: В каком соединении кислород имеет степень окисления -1?
(а) О 2
(б) Н 2 О 2
(в) Н 2 О
(г) ОФ 2
(д) КО 2
Решение:
1) Правильный ответ (б).
2) Немного обсуждения:
Перекись — это O 2 2 ¯, поэтому считается, что каждый кислород имеет степень окисления -1.Возможный ответ: супероксид, O 2 ¯. Обратите внимание, что в супероксиде считается, что каждый кислород имеет степень окисления — 1 ⁄ 2 , в отличие от одного кислорода, имеющего -1, и одного кислорода, имеющего нулевую степень окисления.
Супероксид — хороший пример того, что степени окисления просто учитываются. Каждый из двух атомов кислорода в супероксиде буквально не имеет заряда − 1 ⁄ 2 , но мы вынуждены использовать − 1 ⁄ 2 , если мы спросим степень окисления каждого кислорода.
Точнее говоря, двухкислородная сущность, являющаяся супероксидом, имеет заряд -1, который распределяется по всей единице двух атомов кислорода и не является единственным свойством одного или другого атома кислорода. см. ниже более подробное обсуждение.
Кстати зарядка по кислороду в ОФ 2 +2. Фтор сильнее кислорода притягивает к себе электроны и поэтому заставляет кислород играть положительную роль в состояниях окисления. Следующий снизу галоген (хлор) слабее кислорода притягивает электроны, поэтому его формула Cl 2 O. Кислород имеет степень окисления -1, а хлор выталкивается в степень окисления +1.
Задача № 28: Супероксид обычно не упоминается на вводных уроках химии. Это многоатомный ион O 2 ¯. KO 2 является наиболее известным из супероксидов. Каковы степени окисления каждого кислорода в анионе супероксида?
Решение:
Похоже, что в супероксиде каждый кислород должен иметь степень окисления — 1 ⁄ 2 .Команда ChemTeam считает, но не уверена на 100%, что электронная структура аниона супероксида такова, что один O имеет степень окисления 0, а другой O имеет степень окисления -1. Тот факт, что существуют две резонансные структуры супероксида, приводит в среднем к — 1 ⁄ 2 на каждый атом кислорода.
Задача № 29: Некоторые химические соединения содержат один (или несколько) атомов, где степень окисления равна нулю. Примером этого является глюкоза, C 6 H 12 O 6 .
Решение:
Шесть атомов кислорода (каждый в степени окисления -2) в сумме дают -12.Двенадцать атомов водорода (каждый в степени окисления +1) в сумме дают +12.
+12 и -12 прибавить к нулю.
Таким образом, вклад шести атомов углерода в общую степень окисления равен нулю.
Реальность немного сложнее.
Задача № 30: Какова степень окисления P в HPO 4 2 ¯?
Решение:
H добавляет +1.

 г • см-3
г • см-3 4
4 5
5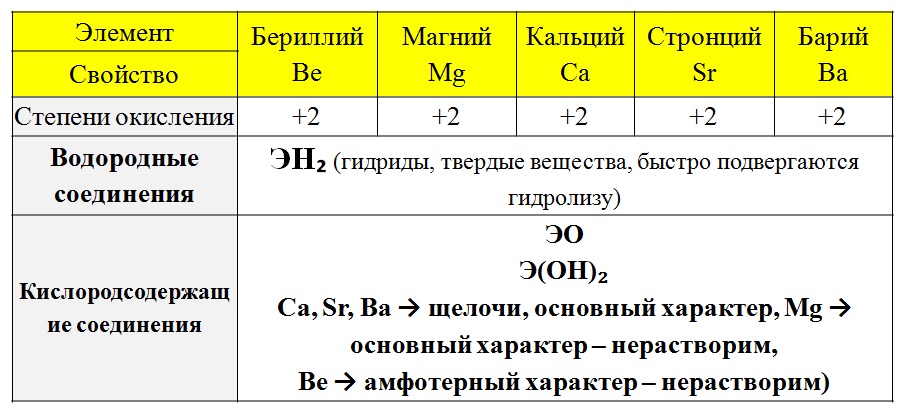 2
2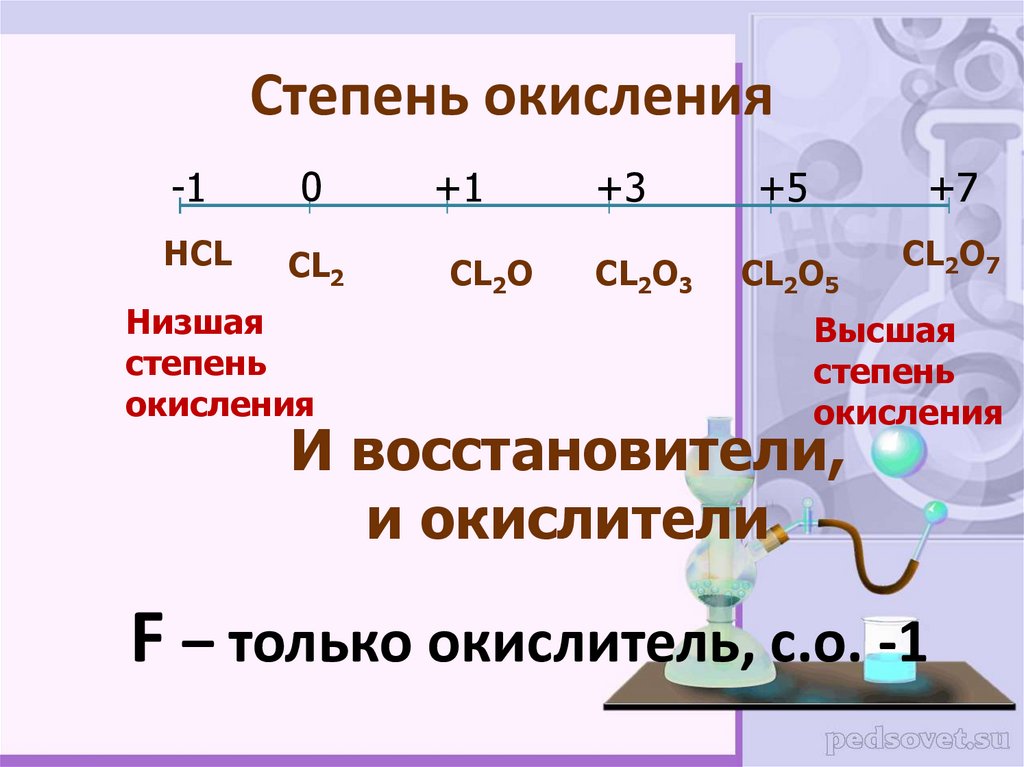 2
2 37
37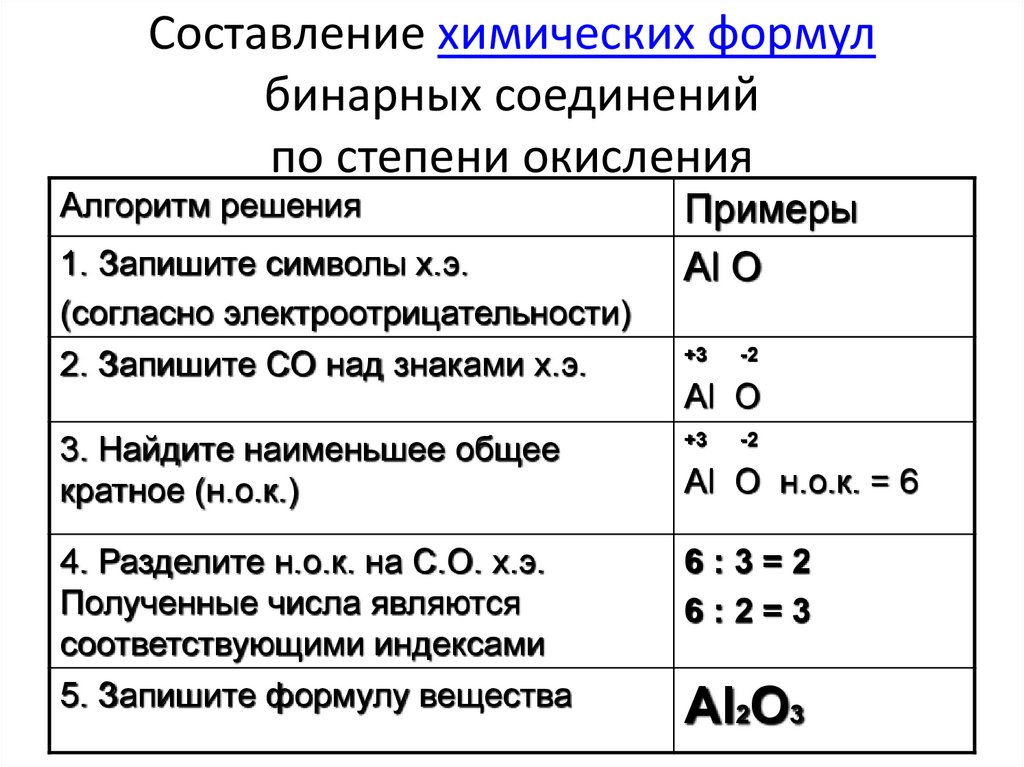 Это означает, что каждый кислород в перекиси представляет собой -1. Однако будьте осторожны. Если вы ссылаетесь на значение -1, вы должны четко указать, что имеете в виду атомы кислорода в перекиси. Если вы просто ссылаетесь на O без какого-либо контекста, предполагается, что вы имеете в виду оксид, степень окисления которого равна -2.
Это означает, что каждый кислород в перекиси представляет собой -1. Однако будьте осторожны. Если вы ссылаетесь на значение -1, вы должны четко указать, что имеете в виду атомы кислорода в перекиси. Если вы просто ссылаетесь на O без какого-либо контекста, предполагается, что вы имеете в виду оксид, степень окисления которого равна -2. если контекст отсутствует, обратитесь за помощью к учителю. Если это онлайн-курс и помощь в реальном времени получить сложно (или невозможно), выберите ответ Pb = +4. Если это неправильно, дайте другой.
если контекст отсутствует, обратитесь за помощью к учителю. Если это онлайн-курс и помощь в реальном времени получить сложно (или невозможно), выберите ответ Pb = +4. Если это неправильно, дайте другой. Элементы считаются комбинированными только в том случае, если они связаны хотя бы с одним другим (другим) элементом.
Элементы считаются комбинированными только в том случае, если они связаны хотя бы с одним другим (другим) элементом. NaH и CaH 2 являются другими примерами гидридов.
NaH и CaH 2 являются другими примерами гидридов.

