Окисление CO и Ch5 в совмещенном плазменно-каталитическом процессе + «
Текст научной работыДиссертация по географии, кандидата химических наук, Чумадова, Елена Сергеевна, Иваново
ИВАНОВСКИЙ ГОСУДАРСТВЕННЫЙ ХИМИКО-ТЕХНОЛОГИЧЕСКИЙ УНИВЕРСИТЕТ
На правах рукописи
Чумадова Елена Сергеевна
ОКИСЛЕНИЕ СО И СН4 В СОВМЕЩЕННОМ ПЛАЗМЕННО-КАТАЛИТИЧЕСКОМ ПРОЦЕССЕ.
11.00.11. «Охрана окружающей среды и рациональное использование природных ресурсов».
Диссертация на соискание ученой степени кандидата химических наук.
Научный руководитель, доктор технических наук профессор Костров В.В.
Иваново -
1998 г.
СОДЕРЖАНИЕ
Стр.
ВВЕДЕНИЕ………………………………………………………………………………..3
1. ОБЗОР ЛИТЕРАТУРЫ………………………………………………………………..5
1.1. Краткий анализ существующих методов
очистки газов. ……………………………………………………………………………..5
……………………………………………………………………………..5
1.2. Катализаторы окисления СО и СН4
и механизмы этих процессов……………………………………………………..18
1.3. Реакции, происходящие в смеси СО-СНгвоздух
при воздействии на нее плазмы барьерного разряда…………………….27
1.4. Моделирование процессов, происходящих в газах……………………….37
1.5. Цели и постановка задач исследования……………………………………….44
2. МЕТОДИКА ЭКСПЕРИМЕНТА………………………………………………..46
3. СРАВНИТЕЛЬНАЯ ХАРАКТЕРИСТИКА ПЛАЗМЕННЫХ И СОВМЕЩЕННЫХ ПЛАЗМЕННО-КАТАЛИТИЧЕСКИХ ПРОЦЕССОВ……………………………………………………………………………57
3.1. Исследование процессов окисления СО и СН4 в условиях барьерного разряда и совмещенных с катализаторами…………….. …..57
…..57
3.2. Влияние гетерогенных катализаторов на эффективность плазменного окисления СО и СН4 в отходящих газах…………………..68
4. МЕХАНИЗМЫ И МОДЕЛЬ ПРОЦЕССОВ ТРАНСФОРМАЦИИ СО И СН4 В ПЛАЗМЕ БАРЬЕРНОГО РАЗРЯДА……………………….101
ВЫВОДЫ……………………………………………………………………………….124
СПИСОК ИСПОЛЬЗОВАННЫХ ЛИТЕРАТУРНЫХ ИСТОЧНИКОВ
ВВЕДЕНИЕ
Увеличение масштабов антропогенного воздействия делает целесообразной разработку эффективных и экономичных технологий защиты природы, а также способов предупреждения от вредного воздействия загрязняющих атмосферу веществ. Самыми распространенными соединениями, выбрасываемыми в атмосферу, являются монооксид углерода, оксиды азота, серы, углеводороды и твердые взвешенные частицы.
Существующие технологические процессы по улавливанию, нейтрализации и утилизации этих веществ в основном базируются на химических, сорбционных и каталитических способах обезвреживания отходящих технологических и вентиляционных газов. Большинство технологических процессов связано с использованием различных катализаторов (особенно содержащих металлы платиновой группы) в условиях повышенных температур от 150°С до 600°С, что не всегда экологически и экономически выгодно.
Большинство технологических процессов связано с использованием различных катализаторов (особенно содержащих металлы платиновой группы) в условиях повышенных температур от 150°С до 600°С, что не всегда экологически и экономически выгодно.
Использование низкотемпературной плазмы газового разряда, возбуждаемого при атмосферном давлении наряду с традиционными каталитическими методами, представляется весьма перспективным для снижения концентраций загрязняющих веществ в промышленных выбросах.
Совмещение каталитических процессов с активирующими свойствами плазмы в одном технологическом цикле может дать выигрыш в снижении энергозатрат или эффективности процессов трансформации токсичных соединений, а также заменить дорогостоящие платиновые катализаторы на более дешевые промышленные образцы.
Поэтому разработка совмещенных плазменно-каталитических процессов и исследование механизмов трансформации СО и СН4 в плазме поверхностно-барьерного разряда (ПБР) имеют актуальное научно-практическое значение с точки зрения охраны воздушного бассейна от за-
грязнения промышленными газовыми выбросами и выхлопными газами двигателей внутреннего сгорания.
Данная работа посвящена изучению процессов трансформации газовой смеси, содержащей СО и СН4, как в плазме барьерного разряда, так и в совмещенных плазменно-каталитических процессах, а также выбору наиболее эффективных параметров проведения низкотемпературных процессов, включая подбор активных и стабильных катализаторов более глубокого окисления СО и СН4 и подавляющих образование побочных продуктов плазменного взаимодействия.
1. Обзор литературы.
1.1. Краткий анализ существующих методов очистки газов.
Отходящие газы, содержащие в своем составе оксиды углерода, серы и азота, а также различные органические соединения, могут образовываться при неполном сгорании углеводородного сырья и нефтепродуктов. Данные ингредиенты входят в основной состав газов, выделяющихся в процессах выплавки и переработки черных и цветных металлов, дымовых газов теплоэнергетических установок и выхлопных газов двигателей внутреннего сгорания.
Существующие технологические решения по утилизации и нейтрализации СО, 80х, ЫОх, углеводородов в отходящих газах (ОГ) весьма разнообразны. Выбор метода очистки во многом определяется составом газов, их концентрацией и величиной материального ущерба, наносимого их присутствием в атмосфере, гидросфере и литосфере [3].
Выбор метода очистки во многом определяется составом газов, их концентрацией и величиной материального ущерба, наносимого их присутствием в атмосфере, гидросфере и литосфере [3].
Для очистки газов от монооксида углерода применяются сорбционные методы, в частности абсорбция жидкими поглотителями, адсорбция твердыми веществами и промывка газа жидким азотом. Абсорбцию проводят водно-аммиачными растворами солей ацетата, формиата или карбоната меди [10]. Этот способ является наиболее старым, но в технике защиты атмосферы он приобрел в последние годы широкое распространение за рубежом [11]. Однако значительные проблемы возникают на пути утилизации продуктов превращение монооксида углерода, из-за сложной эксплуатации при повышенном давлении, устойчивости медно-аммиачных растворов, крупных габаритов газоочистного оборудования, высокой энергоемкости и значительных потерь в окружающую среду.
Для удаления СО их технических выбросов используется процесс конденсации [12]. Значительная часть загрязняющих примесей удаляется за счет охлаждения до температуры ниже точки росы данного вещества.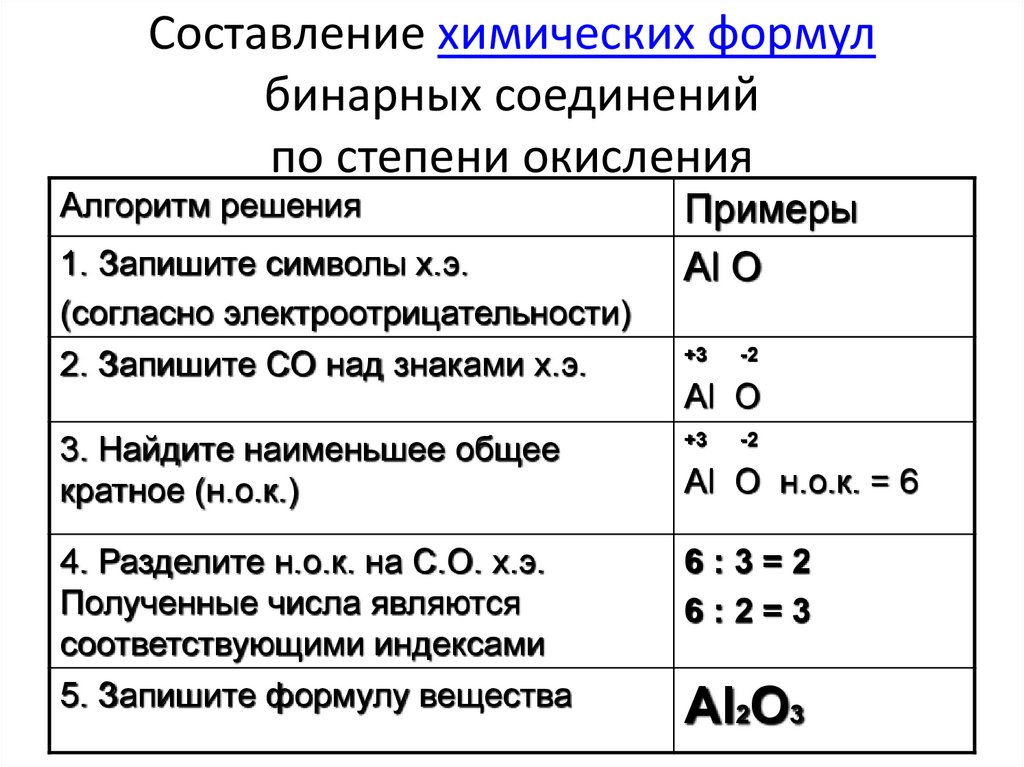 Процесс конденсации осуществляется в поверхностных конденсаторах, таких как спиральные или трубчатые теплообменники, с использованием жидкой охлаждающий среды. Для выделения монооксида используется жидкий азот. В данном методе наряду с оксидом углерода поглощаются и другие компоненты газовой смеси. Процесс очистки состоит из трех стадий: предварительного охлаждения и сушки исходного газа от влаги; глубокого охлаждения газа и частичной конденсации высококипящих компонентов; отмывки газа от монооксида углерода, кислорода и метана. Преимущество данного способа состоит в том, что при регенерации промывного азота выделившиеся СО, СН4 и О2 можно вернуть в технологический цикл или использовать как топливные газы. К недостаткам этого способа очистки можно отнести значительные потери жидкого азота на промывке и при регенерации, а также большую энергоемкость.
Процесс конденсации осуществляется в поверхностных конденсаторах, таких как спиральные или трубчатые теплообменники, с использованием жидкой охлаждающий среды. Для выделения монооксида используется жидкий азот. В данном методе наряду с оксидом углерода поглощаются и другие компоненты газовой смеси. Процесс очистки состоит из трех стадий: предварительного охлаждения и сушки исходного газа от влаги; глубокого охлаждения газа и частичной конденсации высококипящих компонентов; отмывки газа от монооксида углерода, кислорода и метана. Преимущество данного способа состоит в том, что при регенерации промывного азота выделившиеся СО, СН4 и О2 можно вернуть в технологический цикл или использовать как топливные газы. К недостаткам этого способа очистки можно отнести значительные потери жидкого азота на промывке и при регенерации, а также большую энергоемкость.
Адсорбционные методы используют для очистки газов с невысоким содержанием газообразных примесей. В отличие от абсорбционных методов очистка газов проводится при повышенных температурах [10,12].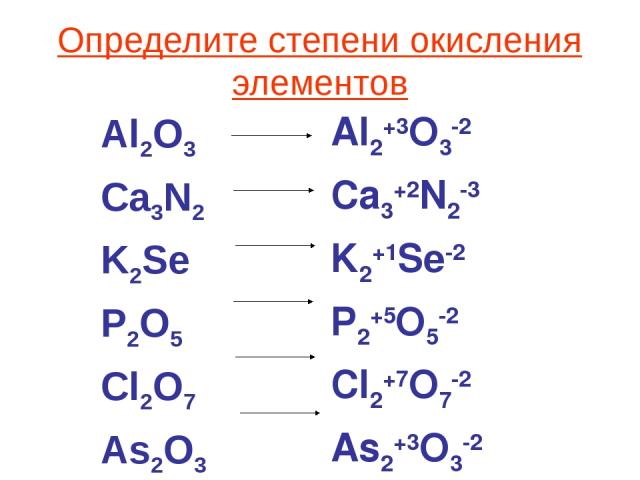 К основным типам промышленных адсорбентов относятся активные угли, силикагели, алюмогели (активный оксид алюминия), цеолиты и иониты. Значительный интерес к решению задач газоочистки в последнее время вызывают такие нетрадиционные углеродные адсорбенты, как активные угли из полимерных материалов, молекулярные сита и активированные углеродные волокна.
К основным типам промышленных адсорбентов относятся активные угли, силикагели, алюмогели (активный оксид алюминия), цеолиты и иониты. Значительный интерес к решению задач газоочистки в последнее время вызывают такие нетрадиционные углеродные адсорбенты, как активные угли из полимерных материалов, молекулярные сита и активированные углеродные волокна.
Хемосорбционная очистка отходящих газов организована на основе использования различных твердых веществ, способных вступать в химическое
взаимодействие с удаляемыми компонентами. Недостатком метода является ограниченный круг универсальных адсорбентов.
Выбросы химических производств, особенно нефтехимических и перегонки сырой нефти, содержат углеводороды и другие органические вещества, которые могут быть сожжены с образованием диоксида углерода и воды или других нетоксичных веществ [12]. Методы прямого сжигания применяют для обезвреживания газов от легко окисляемых токсичных органических примесей, углеводородов и монооксида углерода [13]. Преимуществами огневой утилизации является относительная простота аппаратурного оформления и универсальность использования, так как на работу термических нейтрализаторов мало влияет состав обрабатываемых газов. Суть этих способов заключается в термическом окислении примесей кислородом воздуха до образования диоксида углерода и паров воды, но они не применимы для обезвреживания паров и газов, содержащих в своем составе соединения хлора, серы и фосфора.
Преимуществами огневой утилизации является относительная простота аппаратурного оформления и универсальность использования, так как на работу термических нейтрализаторов мало влияет состав обрабатываемых газов. Суть этих способов заключается в термическом окислении примесей кислородом воздуха до образования диоксида углерода и паров воды, но они не применимы для обезвреживания паров и газов, содержащих в своем составе соединения хлора, серы и фосфора.
Термическое дожигание при высоких температурах (800-1150°С) применяется при очистке смеси газов, в том числе в присутствии твердых веществ (сажа, древесная пыль), и несмотря на высокую степень окисления, не всегда удается обеспечить предельно допустимую концентрацию в воздухе образующихся оксидов, поэтому в ряде случаев, термический метод используется только на стадии пред очистки. Компактные термические установки просты в обслуживании, однако себестоимость очистки газа при термическом обезвреживании достаточно высока [13].
Вместе с тем, в смеси углеводородов и СО процесс термоокисления не протекает нацело по реакции:
С0+-02->С02, (1. 1)
1)
так как при I > 600°С возможно протекает обратный процесс диссоциации СО2, когда устанавливаются равновесные концентрации СО и СО2. Недостатками данного метода, кроме неполного сгорания токсичных компонентов, являются избыточное количество потребляемого воздуха, необходимого для процессов горения.
Термокаталитические методы за счет снижения температуры процесса до (200-400)°С уменьшают расходы на подогрев газа, а также обеспечивают более полное удаление примесей (96-99.9%), чем при огневой утилизации. Применение каталитического дожигания является экономически оправданным и полезным при малых концентрациях загрязняющих веществ (ниже предела воспламенения), или в том случае, когда газ требует предварительного нагрева выше 500°С. Катализаторы окисления гарантируют весьма быстрое и полное протекание реакции окисления или деструкции даже при относительно низких температурах, поскольку химические превращения на поверхности катализатора протекают с более низкой энергией активации. Существенным недостатком каталитического окисления является то, что в нем чаще всего применяются дорогостоящие катализаторы, такие как платина, палладий, и другие металлы платиновой группы, а также соединения хрома, кобальта, никеля, ванадия, меди, молибдена и др. Несмотря на высокую каталитическую активность таких систем, поиск более дешевых заменителей благородных металлов, активных в окислении СО, БОг, М)х и углеводородов кислородом, представляется весьма актуальным [14,15]. Кроме того, катализаторы чувствительны к присутствию в сжигаемых газах некоторых веществ, действующих как каталитические яды, так что универсальности их применения нет. Высокая температура (выше 600°С) как правило дезактивирует катализаторы.
Существенным недостатком каталитического окисления является то, что в нем чаще всего применяются дорогостоящие катализаторы, такие как платина, палладий, и другие металлы платиновой группы, а также соединения хрома, кобальта, никеля, ванадия, меди, молибдена и др. Несмотря на высокую каталитическую активность таких систем, поиск более дешевых заменителей благородных металлов, активных в окислении СО, БОг, М)х и углеводородов кислородом, представляется весьма актуальным [14,15]. Кроме того, катализаторы чувствительны к присутствию в сжигаемых газах некоторых веществ, действующих как каталитические яды, так что универсальности их применения нет. Высокая температура (выше 600°С) как правило дезактивирует катализаторы.
В промышленности обычно выгодно сочетание в одном производстве различных технологических приемов, более низкие эксплуатационные расхо-
ды и энергетические затраты следует ожидать при сочетании сорбционных (на активированном угле, цеолитах и алюмогелях) и каталитических способов с периодическим нагревом сорбентов и дожиганием адсорбированного вещества на катализаторе.
При использовании нестационарного режима каталитической очистки газов, разработанного в Институте катализа СО АН РФ [16], осуществляемого при периодическом изменении направления потоков при определенных концентрациях обеспечивает работу без подогрева. Тепло реакции в результате переключения потоков реакционной смеси не выносится из реактора, что обеспечивает высокую температуру в реакционной зоне по сравнению с низкой на выходе в реактор. Это позволяет снизить по сравнению со стационарным способом на 20 — 30 % себестоимость очистки и другие затраты на обезвреживание газов [17]. Недостаток метода — выпуск части неочищенных газов в момент переключения потоков.
В ряде технологических решений с использованием катализаторов, в том числе медьсодержащих цеолитов, предполагается восстановление оксидов азота углеводородами в присутствие Ог, ЭОг и НгО. Одновременное присутствие в отходящих газах углеводородов (пропан, этилен, пропилен) и О2 приводит к резкому увеличению активности низкотемпературной (473 — 673 К) очистки от N0 [18] и получению ценных химических продуктов [19].
Для повышения эффективности каталитических процессов окисления (восстановления) используют различные физические методы, в частности, электрические и магнитные поля, воздействие ультрафиолетового излучения и другие физические факторы [20].
Несмотря на существующие достижения в области охраны окружающей среды, поиск новых эффективных, по возможности комбинированных путей извлечения, нейтрализации и утилизации вредных примесей по-прежнему актуален.
Использование радиации в процессах газоочистки позволяет ускорить реакции связывания примесей и сделать окислительный реактор существенно более компактным и простым, это открывает пути к утилизации продуктов в качестве минеральных удобрений [21].
Возникающие при облучении основного компонента смеси ионы, свободные радикалы и возбужденные частицы избирательно атакуют микропримеси, превращая их в нужном направлении (в случае оксидов серы и азота — в серную и азотную кислоты). При этом наблюдаемые радиационные выходы процессов окисления достаточно высоки и могут позволить использовать в газоочистной технологии электронные пучки приемлимой мощности [22,23]. Последние годы отмечены растущим интересом к использованию электронных пучков в различных технологических процессах для очистки дымовых газов [24, 25].
Последние годы отмечены растущим интересом к использованию электронных пучков в различных технологических процессах для очистки дымовых газов [24, 25].
Например, использование импульсного электронного пучка с мощностью дозы 10-100 Гр/с [26] позволяет реализовать цепной механизм окисления Б02 с участием отрицательных ионов, что приводит к резкому увеличению выхода конечных продуктов реакции и снижению энергозатрат.
В качестве альтернативы газоочистным сооружениям можно рассматривать установки, предложенные авторами работ [27,28], использующие пучки высокоэнергетических электронов (400-800 КэВ) для удаления диоксида серы из отработанных технологических газов [29]. Высокоэнергетические электроны осуществляют возбуждение, диссоциацию и ионизацию молекул газа, приводя к формированию радикалов (О, ОН, НО2 и другие). Эти радикалы реагируют с диоксидом серы и образуют аэрозоли, которые могут быть собраны с помощью электростатических или обычных рукавных фильтров. Первые, несмотря на высокую эффективность являются дорогостоящими из-за высоких капитальных затрат и большого потребления электроэнергии.
К недостаткам радиационных методов очистки следует отнести большие энергозатраты, недостаточно эффективное использование электроэнергии на процессы очистки от вредных примесей, а также электромагнитное излучение от оборудования.
Для решения экологических задач по улучшению состояния воздушного бассейна в последнее время наряду с традиционными химическими методами очистки отходящих газов промышленных предприятий начинают использоваться другие методы, основанные на конверсии вредных газообразных примесей в жидкие и твердые продукты под действием различных типов излучений [30].
Наиболее перспективными для очистки отходящих газов являются методы, описанные авторами работ [31, 32], которые используют различные виды электрического разряда (тлеющий, барьерный, коронный, стриммерный). Эти методы применяются для снижения токсичности отходящих газов, содержащих СО, БОг, КОх, пары органических соединений.
Преимущество плазмохимического способа по сравнению с обычными химическими способами состоит в том, что продукт, извлекаемый из плазмы, оказывается более чистым и получается при меньшем числе стадий процесса. Наряду с этим, использование плазмы в химическом производстве требует меньших производственных площадей, дает меньше отходов, и поэтому плазменные методы осуществления многих химических процессов широко внедряется в химическое производство. Неравновесная низкотемпературная плазма может быть использована для очистки отходящих газов как от органических [33], так и неорганических (СО, Ж)х, 80г, ИНз) примесей [34, 35]. Недостатки — образование побочных продуктов при возбуждении разряда, в частности озона и оксидов азота.
Наряду с этим, использование плазмы в химическом производстве требует меньших производственных площадей, дает меньше отходов, и поэтому плазменные методы осуществления многих химических процессов широко внедряется в химическое производство. Неравновесная низкотемпературная плазма может быть использована для очистки отходящих газов как от органических [33], так и неорганических (СО, Ж)х, 80г, ИНз) примесей [34, 35]. Недостатки — образование побочных продуктов при возбуждении разряда, в частности озона и оксидов азота.
Одним из актуальных направлений плазмохимии является создание экологически эффективных технологий и оборудования для обезвреживания
отходящих газов в электродуговой плазме, исследования которой ведутся с 70-х годов в различных странах [36] . Плазмохимический метод привлекает известными достоинствами, такими как легкость в управлении параметрами и уменьшение габаритов технологического оборудования, что позволяет создавать высокопроизводительные передвижные (мобильные) установки. Коэффи
Коэффи
Свойства метана (Ch5) (25 фактов, которые вы должны знать) —
Метан является экономически привлекательным топливом из-за его относительной распространенности на Земле. Рассмотрим некоторые наблюдения метана.
Метан действительно поглощает видимый свет из-за обертоновых полос, особенно в красной части спектра, но эффект заметен только в том случае, если световой путь очень длинный. Синий цвет Урана и Нептуна вызван светом, проходящим через их наполненную метаном атмосферу, а затем рассеивающимся обратно в космос.
Более подробная информация о метане будет представлена ниже, включая его название IUPAC, цвет, молекулярную массу, степень окисления, плотность и реакцию с металлами в этой статье.
Метан Название ИЮПАККомпания IUPAC (Международный союз теоретической и прикладной химии) метан называется Метан.
Химическая формула метанаХимическая формула метана CH4. Он содержит один углерод, присоединенный к четырем атомам водорода.
Он содержит один углерод, присоединенный к четырем атомам водорода.
Компания Номер по CAS (Идентификационный номер соединения, по которому можно отличить химическое вещество от его названия) метана — 74-82-8.
Метан ChemSpider IDКомпания ChemSpider ID метана 291.
Химическая классификация метанаМетан — простейший химически классифицированный алкан, содержащий один углерод и четыре атома водорода. Это гидрид группы 14, из которого состоит большая часть природного газа.
метан Молярная массаМолярная масса 16г/моль характеризует метан (масса одного моля вещества. (12Х1 + 1Х4).
Цвет метанаМетан — бесцветный газ.
Вязкость метанаВязкость метана составляет 953 мПа (273К).
Молярная плотность метанаМолярная плотность метана 41. 0 моль/м.3 .
0 моль/м.3 .
Температура плавления метана 90.55К.
Температура кипения метанаТемпература кипения метана 111.51К.
Состояние метана при комнатной температуреМетан является газом при комнатной температуре, но если темп. уменьшается, становится твердым.
Ковалентная связь метанаМетан обычно образует Ковалентная связь в основном по той причине, что при соединении одного неметалла с другим неметаллом образуется ковалентная связь.Склеивание в метане
Ковалентный радиус метанаКовалентный радиус можно рассчитать только для одного атома, поэтому его нельзя установить для молекулы.
Электронная конфигурация метанаРаспределение электронов на орбиталях атома изображается электронными конфигурациями. Давайте подробно рассмотрим электронную конфигурацию метана.
Давайте подробно рассмотрим электронную конфигурацию метана.
Электронная конфигурация углерода (6) равна 1s2 2s2 2p2 . Кроме того, для водорода (1) это 1s1.Как правило, центральный атом металла молекулы — в данном случае углерод — изображает электронная конфигурация этой молекулы.
Степень окисления метанаСтепень окисления углерода +4, водорода +1. В разделе степень окисления в этом случае есть углерод и водород.
Кислотность/основность метанаКак и все другие углеводороды, метан является чрезвычайно слабой кислотой со значением pKa 56. Однако он может отдавать протон, благодаря чему он также может действовать как основание Льюиса.
Метан без запахаМетан – газ без запаха.
Метан ПарамагнитныйМеталлы со слабым магнитным притяжением известны как парамагнетики. Остановимся подробнее на парамагнетизме метана.
Остановимся подробнее на парамагнетизме метана.
Метан обладает диамагнитным свойством. Это можно объяснить двумя факторами: во-первых, у него нет дипольного момента; во-вторых, он диамагнитен, поскольку не имеет неспаренных электронов на валентной оболочке. Следовательно, он не является парамагнитным по своей природе.
Гидраты метанаМетан и вода реагируют при высоком давлении и низкой температуре, в результате чего образуются газогидраты метана. Метан не попадает в атмосферу за счет гидратов метана, которые активно образуются в неглубокой коре.
Кристаллическая структура метанаМетан имеет кубическую кристаллическую структуру и тетраэдрическую форму с валентным углом 109.5°.◦. В элементарной ячейке 58 молекул. Длина куба 11.91 А.◦.
Полярность и проводимость метана- Поскольку в молекуле нет чистого дипольного момента, метан является неполярной молекулой.

- Ковалентные связи в молекуле метана препятствуют его растворению в ионы, что делает его очень плохим проводником электричества.
Когда метан реагирует с кислотой, он обычно производит ряд продуктов вместе с водой. Как и в этом случае, когда метан реагирует с концентрированной азотной кислотой, вместе с водой образуется нитрометан.
Реакция метана с основаниемПри взаимодействии метана с основанием реакции не происходит.
Реакция метана с оксидомКогда метан реагирует с кислородом, это называется горением метана. Химически эта реакция происходит, когда метан вступает в реакцию с кислородом и продуктами, представляющими собой углекислый газ и воду, а также с огромным количеством энергии.
Реакция метана с металломЭта реакция протекает только при чрезвычайно высоких температурах и в присутствии катализатора на основе металла (например, никеля).
Метан весит меньше воздуха. Пламя очень горячее, бледное и едва светящееся. Он легко сгорает на воздухе, образуя углекислый газ и водяной пар. Метан, в дополнение к нескольким органическим химическим веществам, является важным источником водорода.
How to Solve the Oxidation State of Ch5
Обновлено 04 июня 2018 г.
Автор Chris Deziel
Концепция окисления в химии несколько сбивает с толку, в основном потому, что она предшествует пониманию структуры атома и того, как химические процессы происходят реакции. Термин возник, когда химики анализировали реакции с участием кислорода, который был первым известным окислителем.
Для современных химиков, знакомых с обменом электронами в реакциях, окисление означает потерю электронов, а восстановление — приобретение электронов. Современное определение применяется к реакциям, в которых участвует кислород, а также в реакциях, в которых он не участвует, например, производство метана (CH 4 ) из углерода и водорода.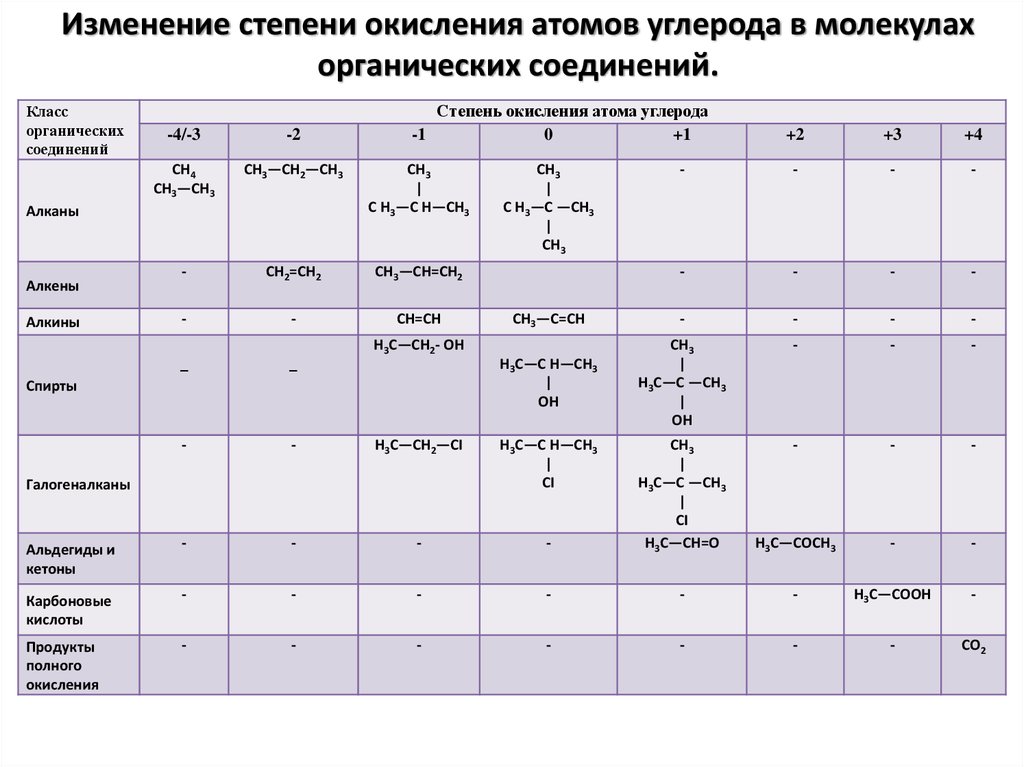 Когда вы добавляете кислород к метану, чтобы получить углекислый газ и воду, это тоже окисление. Атом углерода теряет электроны, и его степень окисления изменяется, в то время как атомы кислорода приобретают электроны и восстанавливаются. Это известно как окислительно-восстановительная реакция.
Когда вы добавляете кислород к метану, чтобы получить углекислый газ и воду, это тоже окисление. Атом углерода теряет электроны, и его степень окисления изменяется, в то время как атомы кислорода приобретают электроны и восстанавливаются. Это известно как окислительно-восстановительная реакция.
TL;DR (слишком длинно, не читал)
Степень окисления углерода в молекуле метана равна -4, а водорода +1.
Степень окисления углерода в метане
Благодаря четырем валентным электронам углерод может существовать в различных степенях окисления от +4 до -4. Вот почему он образует так много соединений, больше, чем любой другой элемент. Чтобы определить его состояние в конкретном соединении, обычно нужно смотреть на связи, которые он образует с другими элементами в соединении.
Водород имеет только один валентный электрон, и, поскольку этот электрон находится в его первой оболочке, ему нужен только один электрон, чтобы заполнить оболочку. Это делает его аттрактором электронов со степенью окисления +1. Водород также может потерять электрон и существовать в степени окисления -1, когда он соединяется с металлами группы 1 с образованием гидридов металлов, таких как NaH и LiH, но в большинстве случаев, например, когда он соединяется с углеродом, он всегда находится в + 1 степень окисления.
Это делает его аттрактором электронов со степенью окисления +1. Водород также может потерять электрон и существовать в степени окисления -1, когда он соединяется с металлами группы 1 с образованием гидридов металлов, таких как NaH и LiH, но в большинстве случаев, например, когда он соединяется с углеродом, он всегда находится в + 1 степень окисления.
Чтобы вычислить степень окисления углерода в молекуле метана, вы рассматриваете каждую связь углерод-водород, как если бы она была ионной. У молекулы нет суммарного заряда, поэтому сумма всех углерод-водородных связей должна быть равна 0. Это означает, что атом углерода отдает четыре электрона, что делает его степень окисления -4.
Степень окисления углерода изменяется при сжигании метана
При соединении метана с кислородом образуются углекислый газ, вода и энергия в виде тепла и света. Сбалансированное уравнение для этой реакции:
CH 4 + 2 O 2 -> CO 2 + 2 H 2 O + энергия
Углерод претерпевает резкое изменение степени окисления в этой реакции. В то время как его степень окисления в метане равна -4, в углекислом газе +4. Это потому, что кислород является акцептором электронов, который всегда имеет степень окисления -2, и на каждый атом углерода в CO 9 приходится два атома кислорода.0009 2 . С другой стороны, степень окисления водорода остается неизменной.
В то время как его степень окисления в метане равна -4, в углекислом газе +4. Это потому, что кислород является акцептором электронов, который всегда имеет степень окисления -2, и на каждый атом углерода в CO 9 приходится два атома кислорода.0009 2 . С другой стороны, степень окисления водорода остается неизменной.
Степени окисления органических молекул
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 15376
К концу поколения химии вычисление степеней окисления различных металлов должно быть довольно привычным делом. Вот что вы делаете. Возьмем типичное соединение, например, \(FeCl_3\). Рассматривайте каждую связь между металлом и другим атомом, как если бы это была ионная связь. Это означает, что более электроотрицательные элементы (например, хлор или кислород) несут отрицательный заряд, а менее электроотрицательный элемент (например, металл) несет положительный заряд.
Это означает, что более электроотрицательные элементы (например, хлор или кислород) несут отрицательный заряд, а менее электроотрицательный элемент (например, металл) несет положительный заряд.
Если соединение является нейтральным, сумма степеней окисления также должна быть нейтральной. (Если соединение имеет заряд, вы соответственно корректируете степени окисления, чтобы их сумма равнялась заряду).
А теперь веселое упражнение. Попробуйте применить те же правила к углероду. Это будет немного странно. Почему? Потому что есть два ключевых отличия:
- Первый , углерод часто более электроотрицательный (2,5), чем некоторые из атомов, с которыми он связан (например, H, 2,2). Так что же делать в этом случае?
- Во-вторых, в отличие от связей металл-металл связи углерод-углерод распространены повсеместно. Итак, как вы справляетесь с ними?
Два ответа.
- В связи C-H H рассматривается так, как если бы он имел степень окисления +1.
 Это означает, что каждая связь C-H будет уменьшать степень окисления углерода на 1, .
Это означает, что каждая связь C-H будет уменьшать степень окисления углерода на 1, . - Любые две связи между одним и тем же атомом не влияют на степень окисления (напомним, что степень окисления Cl в Cl-Cl (и H в H-H) равна нулю. Таким образом, углерод, присоединенный к 4 атомам углерода, имеет нулевую степень окисления
Таким образом, в отличие от металлов, которые почти всегда находятся в положительной степени окисления, степень окисления углерода может варьироваться в широких пределах, от -4 (в Ch5) до +4 (например, в CO2). Вот некоторые примеры.
(Не забывайте, что это называется «формализмом» по какой-то причине. Заряд углерода не равен на самом деле +4 или –4. Но формализм степени окисления помогает нам отслеживать, куда движутся электроны, что очень скоро пригодится).
Поняв, как рассчитать степени окисления углерода, мы готовы к следующему шагу: понимание того, как изменяет в степени окисления углерода посредством реакций, известных как окисления
 Подробнее об этом в следующий раз.
Подробнее об этом в следующий раз.- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или страница
- Лицензия
- CC BY-NC-SA
- Версия лицензии
- 4,0
- Показать страницу TOC
- нет на странице
- Метки
- автор@Джеймс Эшенхерст
- source@http://www.masterorganicchemistry.



 Это означает, что каждая связь C-H будет уменьшать степень окисления углерода на 1,
Это означает, что каждая связь C-H будет уменьшать степень окисления углерода на 1,