Химия 110 Эксперимент 10 — Дополнения
Химия 110 Эксперимент 10 — ДополненияЭксперимент 10
Периодические свойства Элементов
Этот эксперимент позволяет вам изучить элементы и предсказать периодические тенденции. Вы сначала исследовать образцы различных элементов и делать наблюдения на основе цвета, состояние вещества и т. д. для их характеристики. Для вашего экспериментального раздела, вы проведете эксперименты и сделаете выводы об элементах в группах вы изучаете. Для галогеновой части эксперимента (выполненной во время первый день) вы определите порядок окислительной способности различных галогены.
Галогены — Группа VIIа
В этой части эксперимента
вы будете использовать шесть растворов (содержащих либо галоген, либо галогенидную соль) и
органический растворитель для этой части эксперимента. Вам нужно будет приобрести
5-10 мл каждого раствора (KCl(водн.), KBr(водн.), KI(водн. ), Cl 2 вода, Br
), Cl 2 вода, Br
Растворы, содержащие галогенидные соли (KCl, KBr и KI) всегда бесцветны. Когда галогены (Cl 2 , Br 2 , I 2 ) растворяются в воде, может присутствовать цвет, но он может не соответствовать характерному цвету, показанному ниже. Истинный цвет этих галогенов будет очевиден только при просмотре в гексановая фаза. Цвет галогена в гексановой фазе, в частности, приведен в таблице ниже. Не обращайте особого внимания на цвет водный раствор.
| Галоген | Цвет в воде | Цвет гексан | Список цветов слоя гексана вы наблюдаете |
| Класс 2 | бледно-желто-зеленый | желто-зеленый ( нет оранжевый ) | |
| Бр 2 | красноватый | красноватый или желтоватый оранжевый | |
| I 2 | от бесцветного до фиолетового | фиолетовый (розоватый) |
Чтобы увидеть цвета
что эти галогены имеют при растворении в гексане, проделайте следующий опыт. Добавьте около 1 мл (не более) каждого раствора галогена (т. е. Cl 2 воды, Br 2 воды и I 2 воды) отделить небольшой тест
трубы. Осторожно налейте около 0,5 мл гексана в каждую из
пробирки с растворами галогенов (поскольку гексан менее плотный, чем
вода будет плавать сверху). Смешайте содержимое каждой пробирки и наблюдайте
цвет, полученный в верхнем слое гексана. Используйте эти трубки для цвета
сравнения.
Добавьте около 1 мл (не более) каждого раствора галогена (т. е. Cl 2 воды, Br 2 воды и I 2 воды) отделить небольшой тест
трубы. Осторожно налейте около 0,5 мл гексана в каждую из
пробирки с растворами галогенов (поскольку гексан менее плотный, чем
вода будет плавать сверху). Смешайте содержимое каждой пробирки и наблюдайте
цвет, полученный в верхнем слое гексана. Используйте эти трубки для цвета
сравнения.
Пожалуйста, будьте осторожны чтобы не спутать цвет хлора (который был бы желтым, но с зеленоватым оттенок) и цвет брома (который может быть желтоватым, но с оранжевый оттенок). Также обратите внимание только на гексановый слой. Посмотрите на слой гексана горизонтально, на уровне глаз; не обращай внимания к нижнему, водному слою, только верхний гексановый слой.
Прежде чем вы сможете интерпретировать результаты ваших экспериментов, вам необходимо понять следующую информацию.
- Предположим, что вы смешиваете
KI(водн.
 ) и Cl 2 вода: KI(водн.) + Cl 2 → KCl(водн.)
+ я 2
) и Cl 2 вода: KI(водн.) + Cl 2 → KCl(водн.)
+ я 2 - Глядя на реагент
стороны ( KI(aq) + Cl 2 ), задайте себе следующий вопрос:
«Если бы не было реакции, какого цвета был бы слой гексана?»
- Если нет реакции произошло, так как вы начали с хлора (Cl 2 ), цвет гексанового слоя будет бледно-желто-зеленым (если наблюдается какая-либо окраска совсем).
- Если слой гексана не желто-зеленый (стал фиолетовым), то произошла реакция, которая произведено I 2 .
- Если произошла реакция,
посмотрите на стороне продукта ( KCl(водн.) + I 2 ). Что будет
быть цветом гексанового слоя (в зависимости от образующегося галогена)?
- Поскольку продукт
сторона содержит йод, гексановый слой будет фиолетовым (розовым), если реакция
произошел.

- Если слой гексана фиолетовый, так как произошла реакция.
- Поскольку продукт
сторона содержит йод, гексановый слой будет фиолетовым (розовым), если реакция
произошел.
На основе описанного примера выше, если произошла реакция, галоген, с которым вы начали (Cl 2 в этом примере) является более сильным окислителем (I 2 будет слабый окислитель). С другой стороны, если реакции не было, то галоген, с которого вы начали (в этом примере Cl 2 ), будет слабее окислитель.
Вы должны провести эксперимент
сами, чтобы определить свои результаты. Однако, пожалуйста, помните, что
если есть реакция, галоген, с которого вы начали, будет более сильным окислителем
агент. (Окислитель забирает электрон у восстановителя.
Окислитель восстанавливается, а восстановитель окисляется.)
Галогенид (который теряет электрон) становится галогеном. галоген
вы начинаете с становится галогенидом, когда он получает электрон. Не путайте
термины галоген и галогенид. Галоген представляет собой элемент (например, Cl 2 ,
Br 2 , или I 2 ), а галогенид представляет собой ион (например, Cl — ,
Бр — или I — ). В ходе реакции ион окисляется
(он теряет электрон), чтобы стать элементом, и элемент уменьшается, чтобы стать
ион.
В ходе реакции ион окисляется
(он теряет электрон), чтобы стать элементом, и элемент уменьшается, чтобы стать
ион.
Настройте свой эксперимент следующее:
Трубка номер | Калий раствор галогенида | Галоген вода | Цвет гексанового слоя после смешивания |
1 | KBr(водн.) | Cl 2 вода 1 |
|
2 | КИ(водн.) | Cl 2 вода 1 |
|
3 | KCl(водн. | Бр 2 вода |
|
4 | КИ(водн.) | Бр 2 вода |
|
5 | KBr(водн.) | я 2 вода | |
6 | KCl (водн.) | I 2 вода |
|
1 После
вы добавили воду Cl 2 в первые две пробирки, перемешайте их
полностью. Теперь обратите внимание на цвет верхнего слоя гексана. Поскольку вы
добавлен Кл 2 вода, если реакции не произошло, можно ожидать
гексановый слой становится желто-зеленым, что соответствует цвету Cl 2 .
Если происходит изменение цвета, значит, произошла реакция. Например, если
трубка №1 имеет желто-оранжевый гексановый слой, затем был получен Бр Поскольку вы
добавлен Кл 2 вода, если реакции не произошло, можно ожидать
гексановый слой становится желто-зеленым, что соответствует цвету Cl 2 .
Если происходит изменение цвета, значит, произошла реакция. Например, если
трубка №1 имеет желто-оранжевый гексановый слой, затем был получен Бр | |||
На основании
наблюдения выше, предсказать порядок окислителя. Помните, если
идет реакция (т.е. если конечный цвет гексана отличается от цвета галогена
вы начали с), то галоген является лучшим окислителем (он занимает
электрон из галогенид-иона) и сам становится ионом; оригинальный галогенид
ион (после потери своего электрона) становится галогеном.
Сильнейший окислитель Агент: __________ >
__________ > __________ Самый слабый окислительСейчас ищем периодические тенденции, покажите, где, по вашему прогнозу, будет находиться F 2 :
Сильнейший окислитель: __________ > __________ > __________ > __________ Слабо окисляющая Агент
Активность металлов
Группа 1А | Группа 2А | Переход Металлы | Группа 4А | Группа 5А/6А | |
Элементы |
|
|
|
|
|
Реагент | НОХ | НОХ |
|
| О 2 |
Кислота |
| HCl | HCl | HCl |
|
На основе
скорости реакции, составьте список для следующих металлических элементов, которые ранжируют их
исходя из их активности.
Ранг следующие элементы: K, Na, Mg, Ca, Mn, Fe, cCu, Zn
Самые активные: _____ > _____ > _____ > _____ > _____ > _____ > _____ > _____ > Наименее активный
Перейти к эксперименту:
1 2 3
4 5 6
7 8 9
10 11 12
Вернуться к указателю экспериментов Chem110
Бр2 + 2КИ = И2 + 2КБр
| Поиск |
бром + иодид калия = йод + бромид калия |
Новости Только 5% НАСЕЛЕНИЯ знают
Реклама
Содержание
Нажмите, чтобы увидеть более подробную информацию и рассчитать вес/моль >>
Oxidation-reduction reaction
| Br 2 | + | jpg» substance-weight=»166.00277 ± 0.00013″> 2KI | → | I 2 | + | 2KBr | |
| bromine | калия йодид | йод | калия бромид | ||||
| (rắn) | (rắn) | (dd) | |||||
| (nâu đỏ) | (trắng) | (đen tím) | (vàng) | ||||
| 1 | 2 | 1 | 2 | Hệ số | |||
| Nguyên — Phân tử khối (g/mol) | |||||||
| Số mol | |||||||
| Khối lượng (g) |
Реклама
Дополнительная информация об уравнении Br
2 + 2KI → I 2 + 2KBrВ каких условиях Br2 (бром) реагирует с KI (йодидом калия)?
Для этого химического уравнения не найдено информации
Объяснение: идеальные условия окружающей среды для реакции, такие как температура, давление, катализаторы и растворитель. Катализаторы — это вещества, которые ускоряют темп (скорость) химической реакции, не потребляясь и не становясь частью конечного продукта.
Катализаторы не влияют на равновесные ситуации.
Катализаторы — это вещества, которые ускоряют темп (скорость) химической реакции, не потребляясь и не становясь частью конечного продукта.
Катализаторы не влияют на равновесные ситуации.
Как могут происходить реакции с образованием I2 (йода) и KBr (бромида калия)?
Передача Бр2 через КИ
В полном предложении вы также можете сказать, что Br2 (бром) реагирует с KI (йодидом калия) и производит I2 (йод) и KBr (бромид калия)
Явление после того, как Br2 (бром) реагирует с KI (йодидом калия)
Нажмите, чтобы увидеть явление уравнения
Какую другую важную информацию вы должны знать о реакции
У нас нет дополнительной информации об этой химической реакции.
Категории уравнений
Другие вопросы, связанные с химическими реакциями Br
2 + 2KI → I 2 + 2KBrВопросы, связанные с реагентом Br2 (бром)
Каковы химические и физические характеристики Br2 (брома)? ?
Вопросы, связанные с реагентом KI (йодид калия)
Каковы химические и физические характеристики KI (йодида калия)? В каких химических реакциях используется KI (йодид калия) в качестве реагента?
Вопросы, связанные с продуктом I2 (йод)
Каковы химические и физические характеристики I2 (йодида калия)? Каковы химические реакции, в которых I2 (йод) является продуктом?
Вопросы, связанные с продуктом KBr (бромид калия)
Каковы химические и физические характеристики KBr (йодида калия)? Какие химические реакции происходят с KBr (бромидом калия) в качестве продукта?
Essentt — Товары, подобранные вручную
Продукты, подобранные вручную Необходимы для работы из дома!
Уравнения с Br2 в качестве реагента
бром
BR 2 + H 2 O + (NH 4 ) 2 SO 3 → (NH 4 ) 2 SO 4 + 2HBR BR 2 SO 4 + 2HBR.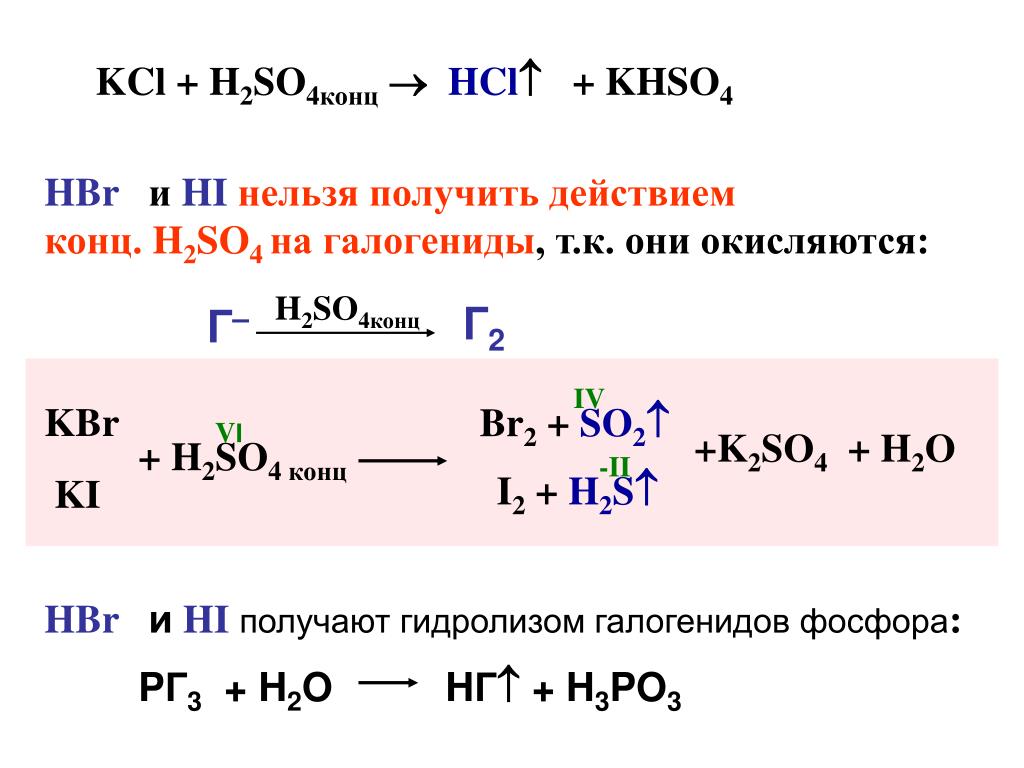

 ) и Cl 2 вода: KI(водн.) + Cl 2 → KCl(водн.)
+ я 2
) и Cl 2 вода: KI(водн.) + Cl 2 → KCl(водн.)
+ я 2 
 )
)