Nh5, степень окисления азота в ионе аммония
Общие сведения об ионе аммония и степени окисления в Nh5
Атом азота имеет на внешнем энергетическом уровне два спаренных и три неспаренных электрона:
7N 1s22s22p3;
Неспаренные 2з-электроны атома азота в молекуле аммиака образуют три электронные пары с электронами атомов водорода. У атома азота остается неподеленная пара электронов 2s2, т.е. два электрона с антипараллельными спинами на одной атомной орбитали. Атомная орбиталь иона водорода не содержит электронов (вакантная орбиталь). При сближении молекулы аммиака и иона водорода происходит взаимодействие неподеленной пары электронов атома азота и вакантной орбитали иона водорода, возникает химическая связь по донорно-акцепторному механизму. Атом азота молекулы аммиака является донором, а ион водорода – акцептором. Обозначив неподеленную пару электронов двумя точками, вакантную орбиталь квадратом, а связи черточками, можно представить образование иона аммония схемой, изображенной на рис. 1.
Рис. 1. Схема образования иона аммония.
Nh5, степени окисления элементов в нем
Из выше указанного ясно, что ион аммония имеет заряд (+). Чтобы определить степени окисления элементов, входящих в его состав, сначала необходимо разобраться с тем, для каких элементов эта величина точно известна.
Так как аммиак является гидридом азота, то степень окисления водорода в ионе аммония равна (+1). Для нахождения степени окисления азота примем её значение за «х» и определим его при помощи уравнения электронейтральности:
x + 4×(+1) = -1;
x — 4 = -1;
x = -3.
Значит степень окисления азота в ионе аммония равна (-3):
(N-3H+14)—.
Примеры решения задач
| Понравился сайт? Расскажи друзьям! | |||
ru.solverbook.com
Электроотрицательность. Степень окисления и валентность химических элементов. » HimEge.ru
Электроотрицательность. Степень окисления и валентность химических элементов.
Реакции окислительно-восстановительные.
1) Установите соответствие между схемой изменения степени окисления элемента и уравнением реакции, в которой это изменение происходит.
| ИЗМЕНЕНИЕ СО ЭЛЕМЕНТА | СХЕМА РЕАКЦИИ |
| А) S-2 → S+6 Б) S-2 → S+4 В) S+6→ S+4 | 1) 2H2SO4(конц) + C = 2H2O + CO2 + 2SO2 2) 2H2S + 3O2 = 2SO2 + 2H2O 3) 5H2SO4(конц) +4Zn = 4ZnSO4 + H2S + 4H2O 4) H2S + 2NaOH = Na2S + 2H2O 5) PbS + 4H2O2 = PbSO4 +4H2O |
2) Установите соответствие между формулой вещества и степенью окисления азота в нем.
| ФОРМУЛА ВЕЩЕСТВА А) NOF Б) (CH3)2NH В) NH4Br Г) N2H4 | СТЕПЕНЬ ОКИСЛЕНИЯ АЗОТА 1) -3 2) -2 3) +2 4) +3 5) +4 6) +5 |
3) Установите соответствие между уравнением окислительно-восстановительной реакции и свойством азота, которое он проявляет в этой реакции.
| УРАВНЕНИЕ РЕАКЦИИ А) 2NO + O2 = 2 NO2 Б) 3CuO + 2NH3 = N2+ 3Cu + 3H2O В) 4NH3 + 5O2 = 4NO + 6H2O Г) 6Li + N2 → 2Li3N | СВОЙСТВО АЗОТА |
| 1) окислитель 2) восстановитель 3) и окислитель, и восстановитель 4) не проявляет окислительно-восстановительных св-в |
4) Установите соответствие между формулой вещества и степенью окисления хлора в нем.
| ФОРМУЛА ВЕЩЕСТВА А) Сa(OCl) В) КClO3 В) НClO2 Г) FeCl3 | СТЕПЕНЬ ОКИСЛЕНИЯ ХЛОРА 1) +1 2) +2 3) +3 4) +5 5) -1 |
5) Установите соответствие между уравнением реакции и изменением степени окисления окислителя.
| СХЕМА РЕАКЦИИ А) SO2+ NO2 → SO3 + NO В) 2NH3 + 2Na → 2NaNH2 + H2 В) 4NO + O2 + 2H2O → 4HNO3 Г) 4NH3 + 6NO → 5N2 + 6H2O | ИЗМЕНЕНИЕ СО ОКИСЛИТЕЛЯ | |
| 1) –1 → 0 2) 0 → —2 3) +4 → +2 4) +1 → 0 5) +2 → 0 6) 0 → -1 | ||
6) Установите соответствие между свойствами азота и уравнением окислительно-восстановительной реакции, в которой он проявляет в эти свойства.
| СВОЙСТВО АЗОТА А) только окислитель Б) только восстановитель В) и окислитель, и восстановитель Г) ни окислитель, ни восстановитель | УРАВНЕНИЕ РЕАКЦИИ |
| 1) 4NH3 + 5O2 = 4NO + 6H2O 2) 6Li + N2 → 2Li3N 3) 2NH4Cl + Ca(OH)2 = 2NH3 + CaCl2 + 2H2O 4) 3NO2 + H2O = 2HNO3 + NO |
7) Установите соответствие между формулой вещества и степенью окисления азота в нем.
| ФОРМУЛА ВЕЩЕСТВА А) NaNO2 Б) NH4NO3 В) NH4NO2 Г) HNO3 | СТЕПЕНЬ ОКИСЛЕНИЯ АЗОТА 1) +5 2) +3 3) –3, +5 4) 0, +2 5) –3, +3 6) +4, +2 |
8) Установите соответствие между схемой реакции и изменением степени окисления окислителя в ней.
| СХЕМА РЕАКЦИИ А) Cu + HNO3(конц) → Сu(NO3)2 + NO2 + H2O Б) NH4NO2 → N2 + H2O В) CuO + NH3 → Cu + N2 + H2O Г) NaNO3 → NaNO2 + O2 | ИЗМЕНЕНИЕ СО ОКИСЛИТЕЛЯ | |
| 1) Cu+2 → Cu0 2) N+3 →N0 3) N+5 → N+4 4) N—3 → N 0 5) Cu0 → Cu+2 6) N+5 → N+3 | ||
9) Установите соответствие между формулой соли и степенью окисления углерода в ней.
| ФОРМУЛА СОЛИ А) K2CO3 Б) Ca(HCO3)2 В) HCOONa Г) NaHC2O4 | СТЕПЕНЬ ОКИСЛЕНИЯ УГЛЕРОДА 1) -4 2) -2 3) 0 4) +2 5) +3 6) +4 |
10. Установите соответствие между формулой соли и степенью окисления хрома в ней.
| ФОРМУЛА СОЛИ А) K2CrO4 Б) CaCr2O7 В) CrO2F2 Г) Ba3[Cr(OH)6]2 | СТЕПЕНЬ ОКИСЛЕНИЯ ХРОМА 2) +2 6) +6 3) +3 4) +4 |
11. Установите соответствие между схемой реакции и формулой окислителя в ней
| СХЕМА РЕАКЦИИ А) K2CO3 + Br2 → KBr + KBrO3 + CO2 Б) Br2 + Cl2 → BrCl В) Br2 + I2 → IBr Г) HBr + HBrO3 → Br2 + H2O | ФОРМУЛА ОКИСЛИТЕЛЯ | |
| 1) K2CO3 2) Br2 3) Cl2 4) I2 5) HBr 6) HBrO3 | ||
12. Установите соответствие между схемой реакции и формулой восстановителя в ней
| СХЕМА РЕАКЦИИ А) K2CO3 + Br2 → KBr + KBrO3 + CO2 Б) Br2 + Cl2 → BrCl В) Br2 + I2 → IBr Г) HBr + HBrO3 → Br2 + H2O | ФОРМУЛА ВОССТАНОВИТЕЛЯ | |
| 1) K2CO3 2) Br2 3) Cl2 4) I2 5) HBr 6) HBrO3 | ||
13. Установите соответствие между схемой реакции и формулой окислителя в ней
| СХЕМА РЕАКЦИИ А) NaOH + Br2 → NaBr + NaOBr + H2O Б) Br2 + O3 → BrO2 + O2 В) Cl2 + I2 → ICl Г) HCl+ HClO3 → Cl2 + H2O | ФОРМУЛА ОКИСЛИТЕЛЯ | |
| 1) NaOH 2) Br2 3) Cl2 4) I2 5) HClO3 6) O3 | ||
14. Установите соответствие между формулой вещества и степенью окисления азота в нем.
| ФОРМУЛА ВЕЩЕСТВА А) (NH4)2HPO4 Б) NO2F В) NOCl Г) BaN2O2 | СТЕПЕНЬ ОКИСЛЕНИЯ АЗОТА 1) -3 2) -2 3) -1 4) +1 5) +3 6) +5 |
15. Установите соответствие между формулой вещества и степенью окисления серы в нем.
| ФОРМУЛА ВЕЩЕСТВА А) K2S2O7 Б) NaHSO3 В) SO2Cl2 Г) S2O | СТЕПЕНЬ ОКИСЛЕНИЯ СЕРЫ 1) -2 5) +5 2) -1 6) +6 3) +1 4) +4 |
16. Установите соответствие между формулой соли и степенью окисления хрома в ней.
| ФОРМУЛА СОЛИ А) KCrO3Сl Б) Na2Cr2O7 В) CrOF Г) Na3[Cr(OH)6] | СТЕПЕНЬ ОКИСЛЕНИЯ ХРОМА 1) 0 5) +5 2) +2 6) +6 3) +3 4) +4 |
17. Установите соответствие между схемой реакции и формулой окислителя в ней
| СХЕМА РЕАКЦИИ А) SO2 + O2 → SO3 Б) SO2 + H2S→ S + H2O В) SO2 + Cl2 → SO2Cl2 Г) K2SO3 → K2S + K2SO4 | ФОРМУЛА ОКИСЛИТЕЛЯ | |
| 1) O2 2) SO2 3) H2S 4) K2SO3 | 5) Cl2 | |
18. Установите соответствие между схемой реакции и формулой восстановителя в ней
| СХЕМА РЕАКЦИИ А) Ca+ H2 → CaH2 Б) NH3 +Ca → Ca(NH2)2 + H2 В) N2 + H2 → NH3 Г) NH3 + Cl2 → NH4Cl + N2 | ФОРМУЛА ВОССТАНОВИТЕЛЯ | |
| 1) кальций 2) водород 3) аммиак 4) азот | 5) хлор | |
19. Установите соответствие между схемой реакции и изменением степени окисления восстановителя.
| СХЕМА РЕАКЦИИ А) Cl2 + P → PCl5 Б) HCl+ KMnO4 → Cl2 + MnCl2 + KCl + H2O В) HClO + H2O2 → O2 + H2O + HCl Г) Cl2 + KOH → KCl + KClO3 + H2O | ИЗМЕНЕНИЕ СО ВОССТАНОВИТЕЛЯ | |
| 1) Cl0 → Cl-1 2) Cl-1 →Cl0 3) Cl0 → Cl+1 4) O-1 → O0 | 5) Cl0 → Cl+5 6) Mn+7 → Mn+2 7) P0 → P+5 | |
20. Установите соответствие между схемой реакции и изменением степени окисления окислителя.
| СХЕМА РЕАКЦИИ А) Na2SO3 + I2 +NaOH → Na2SO4 + NaI + H2O Б) I2 + H2S → S + HI В) SO2 + NaIO3 + H2O → H2SO4 + NaI Г) H2S + SO2 → S + H2O | ИЗМЕНЕНИЕ СО ОКИСЛИТЕЛЯ | |
| 1) S-2 → S0 2) S+4 →S0 3) S+4→ S+6 4) S0 → S-2 | 5) I+5 → I-1 6) I-1 → I0 7) I0 → I-1 | |
21. Установите соответствие между схемой реакции и изменением степени окисления восстановителя.
| СХЕМА РЕАКЦИИ А) HI + Cl2 → HCl + I2 Б) Na2SO3 + I2 + NaOH → Na2SO4 + NaI + H2O В) HIO → HIO3 + I2 + H2O Г) KIO3 + H2O2 → O2 + H2O + KI | ИЗМЕНЕНИЕ СО ВОССТАНОВИТЕЛЯ | |
| 1) I+5 → I-1 2) I-1 → I0 3) I+1 → I0 4) I+1 → I+5 | 5) I0 → I+5 6) O-1 → O0 7) S+4 → S+6 8) Cl+5 → Cl0 | |
22. Установите соответствие между формулой вещества и степенью окисления хлора в нем.
| ФОРМУЛА ВЕЩЕСТВА А) Ba(ClO3)2 Б) LiClO4 В) Ca(ClO)2 Г) Cl2O | СТЕПЕНЬ ОКИСЛЕНИЯ ХЛОРА 1) -1 5) +5 2) 0 6) +7 3) +1 4) +3 |
23. Установите соответствие между формулой вещества и степенью окисления хрома в нем.
| ФОРМУЛА ВЕЩЕСТВА А) Cr(NO3)3 Б) [Cr(NH3)6]Cl3 В) Cr(OH)2 Г) (NH4)2Cr2O7 | СТЕПЕНЬ ОКИСЛЕНИЯ ХРОМА 1) +2 5) +7 2) +3 3) +4 4) +6 |
24. Установите соответствие между формулой вещества и степенью окисления азота в нем.
| ФОРМУЛА ВЕЩЕСТВА А) NaNO3 Б) N2H4 В) NO2 Г) NH4Cl | СТЕПЕНЬ ОКИСЛЕНИЯ АЗОТА 1) -3 5) +3 2) -2 6) +4 3) -1 7) +5 4) +2 |
25. Установите соответствие между схемой реакции и изменением степени окисления восстановителя.
| СХЕМА РЕАКЦИИ А) PCl3 + O2 → POCl3 Б) Ca3(PO4)2 + C + SiO2 → P4 + CaSIO3 + CO В) P4+ H2SO4 +KMnO4 → KH2PO4 + MnSO4 Г) P4 + AgNO3 + H2O → Ag + H3PO4 + HNO3 | ИЗМЕНЕНИЕ СО ВОССТАНОВИТЕЛЯ | |
| 1) P0 → P+5 2) P+5 →P0 3) P+3 → P+5 4) Ag+1 → Ag0 | 5) C0 → C+2 6) Cu0 → Cu+1 7) Cl0 → Cl-1 | |
26. Установите соответствие между формулой вещества и коэффициентом перед ней в уравнении реакции: HIO → HIO3 + I2 + H2O
| ФОРМУЛА ВЕЩЕСТВА А) HIO Б) HIO3 В) I2 Г) H2O | КОЭФФИЦИЕНТ 1) 1 5) 5 2) 2 6) 6 3) 3 4) 4 |
27. Установите соответствие между схемой реакции и изменением степени окисления окислителя.
| СХЕМА РЕАКЦИИ А) HNO3 + S → H2SO4 + NO2 + H2O Б) KNO2 + Br2 + H2O → KNO3 + HBr В) NH4NO2 → H2O + N2 Г) NO2 + H5IO6 → HNO3 + HIO3 + H2O | ИЗМЕНЕНИЕ СО ОКИСЛИТЕЛЯ | |
| 1) N+3 → N0 2) N+3 →N+5 3) I+7→ I+5 4) N+4 → N+5 | 5) O-2 → O0 6) Br0 → Br-1 7) N+5 → N+4 | |
28. Установите соответствие между формулой вещества и коэффициентом перед ней в уравнении реакции: HNO3 + S → H2SO4 + NO2 + H2O
| ФОРМУЛА ВЕЩЕСТВА А) HNO3 Б) S В) H2SO4 Г) NO2 | КОЭФФИЦИЕНТ 1) 1 5) 5 2) 2 6) 6 3) 3 7) 7 4) 4 8) 8 |
himege.ru
4.2. Фосфор
Фосфор представлен в природе одним изотопом — 31Р, кларк фосфора равен 0,05 мол.%. Встречается в виде фосфатных минералов: Ca3(PO4)2 — фосфорит, Ca5(PO4)3X (X = F,Cl,OH) — апатиты. Входит в состав костей и зубов животных и человека, а также в состав нуклеиновых кислот (ДНК и РНК) и аденозинфосфорных кислот (АТФ, АДФ и АМФ).
Получают фосфор восстановлением фосфорита коксом в присутствии диоксида кремния.
t
Ca3(PO4)2 + 3SiO2 + 5C = 3CaSiO3 + 2P + 5CO
Простое вещество — фосфор — образует несколько аллотропных модификаций, из которых основными являются белый, красный и черный фосфор. Белый фосфор образуется при конденсации паров фосфора и представляет собой белое воскоподобное вещество (т.пл. 44 С), нерастворимое в воде, растворимое в некоторых органических растворителях. Белый фосфор имеет молекулярное строение и состоит из тетраэдрических молекул P4.
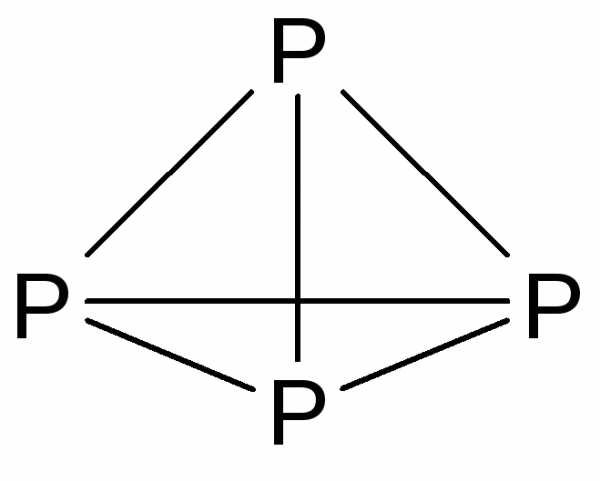
Напряженность связей (валентный угол P-P-P составляет всего 60 ) обусловливает высокую реакционную способность и токсичность белого фосфора (смертельная доза около 0,1 г). Поскольку белый фосфор хорошо растворим в жирах, в качестве антидота при отравлении нельзя применять молоко. На воздухе белый фосфор самопроизвольно воспламеняется, поэтому хранят его в герметически упакованной химической посуде под слоем воды.
Красный фосфор имеет полимерное строение. Получается при нагревании белого фосфора или облучении его светом. В отличие от белого фосфора малореакционноспособен и нетоксичен. Однако остаточные количества белого фосфора могут придавать красному фосфору токсичность!
Черный фосфор получается при нагревании белого фосфора под давлением 120 тыс.атм. Имеет полимерное строение, обладает полупроводниковыми свойствами, химически устойчив и нетоксичен.
Химические свойства. Белый фосфор самопроизвольно окисляется кислородом воздуха при комнатной температуре (окисление красного и черного фосфора идет при нагревании). Реакция протекает в два этапа и сопровождается свечением (хемилюминесценция).
t t
2P + 3O2 = 2P2O3; P2O3 + O2 = P2O5
Ступенчато происходит также взаимодействие фосфора с серой и галогенами.
t t
2P + 3Cl2 = 2PCl3; PCl3 + Cl2 = PCl5
При взаимодействии с активными металлами фосфор выступает в роли окислителя, образуя фосфиды — соединения фосфора в степени окисления -3.
t
3Ca + 2P = Ca3P2
Кислотами-окислителями (азотная и концентрированная серная кислоты) фосфор окисляется до фосфорной кислоты.
P + 5HNO3(конц) = H3PO4 + 5NO2 + H2O
При кипячении с растворами щелочей белый фосфор диспропорционирует:
4P0 + 3KOH + 3H2O = P-3H3 + 3KH2P+1O2
фосфин гипофосфит калия
Соединения фосфора
Соединения со степенью окисления –3. Фосфиды s-элементов представляют соединения с ионно-ковалентным типом связи, они солеподобны, легко разлагаются водой:
Mg3P2 + 6H2O = 3Mg(OH)2 + 2PH3
Фосфиды d-металлов являются соединениями переменного состава (бертолидами), обычно тугоплавки, имеют металлический блеск, электропроводны и химически малоактивны.
Ковалентным фосфином является PH3 — фосфин — бесцветный газ, с характерным неприятным запахом чеснока, очень токсичен. На воздухе самопроизвольно воспламеняется, в воде малорастворим. В отличие от аммиака образует соли только с очень сильными кислотами.
2PH3 + 4О2 = Р2O5 + 3H2O; PH3 + HI = РH4I
иодид фосфония
Образуется фосфин при диспропорционировании белого фосфора в щелочных растворах. Лабораторным методом получения является гидролиз фосфидов:
Ca3P2 + 6H2O = 3Ca(OH)2 + 2PH3
Соединения со степенью окисления +1. Наиболее важными соединениями фосфора в степени окисления +1 являются фосфорноватистая кислота и ее соли — гипофосфиты. Фосфорноватистая кислота — H[H2PO2] — бесцветное кристаллическое вещество, хорошо растворимое в воде, сильная одноосновная кислота (Ka = 810-2).
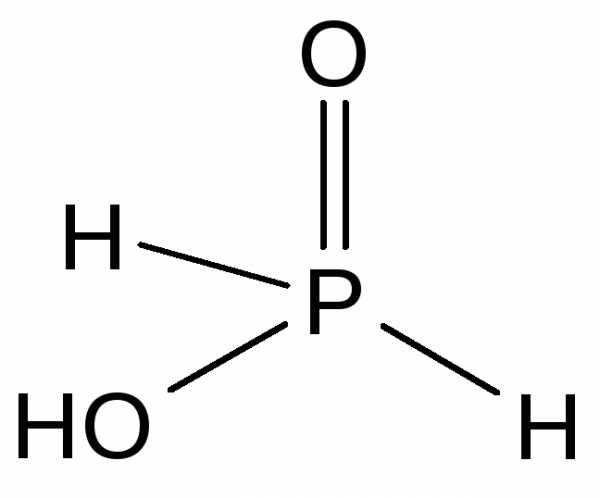
Фосфорноватистая кислота и гипофосфиты — сильные восстановители. При нагревании фосфорноватистая кислота диспропорционирует:
3H[H2P+1O2] = P-3H3 + 2H2[HP+3O3]
фосфористая кислота
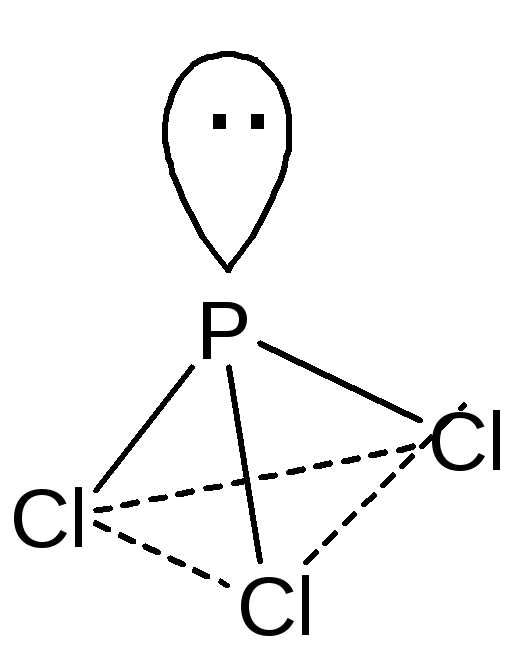
Соединения со степенью окисления +3. Степень окисления +3 фосфор имеет в галогенидах, оксиде, фосфористой кислоте – H2[HPO3] — и ее солях — фосфитах. PF3 — газ, PCl3 и PBr3 – жидкости, дымящиеся на воздухе вследствие гидролиза.
PCl3 + 3H2O = H2[HPO3] + 3HCl
Молекула тригалогенида фосфора имеет геометрию тригональной пирамиды с атомом фосфора в вершине. В образовании связей принимают участие sp3-гибридные орбитали, валентный угол составляет приблизительно 100.
Оксид фосфора(III) — P2O3 – существует в нескольких модификациях, построенных из пирамидальных структурных единиц — PO3. Обычная форма имеет молекулярную решетку, образованную молекулами – P4O6 – бесцветное кристаллическое вещество следующего строения:
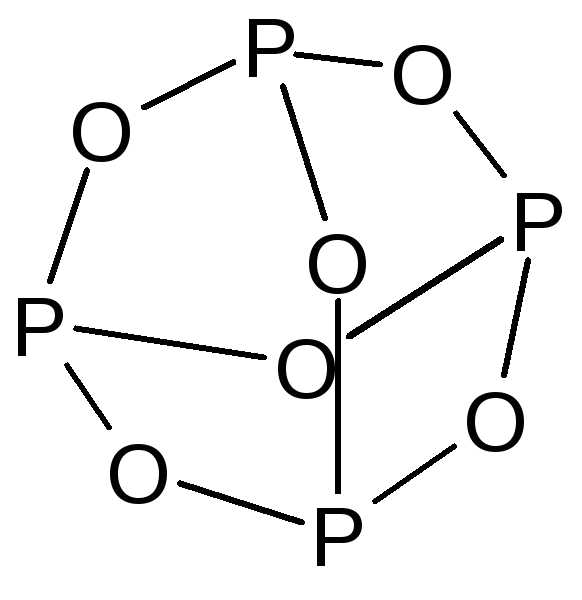
По химическим свойствам типичный кислотный оксид — ангидрид фосфористой кислоты.
P2O3 + 3H2O = 2H2[HPO3]; P2O3 + 4NaOH = 2Na2[HPO3] + H2O
Фосфористая кислота — H2[HPO3] — бесцветные гигроскопичные кристаллы, хорошо растворимые в воде. H2[HPO3] является сильной двухосновной кислотой (K1 = 210-2, K2 = 610-7).
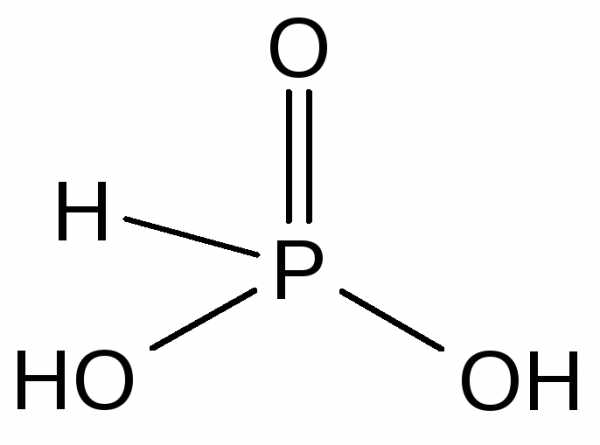
Фосфористая кислота и её соли — фосфиты — сильные восстановители.
Hg+2Cl2 + H2[HP+3O3] + H2O = H3P+5O4 + Hg0 + 2HCl
Соединения со степенью окисления +5. Основные соединения фосфора в степени окисления +5: PHal5, POHal3 (Hal = F, Cl, Br), P2O5, H3PO4 и ее соли.
Фторид фосфора(V) — газообразное вещество, молекула которого имеет геометрию тригональной бипирамиды:
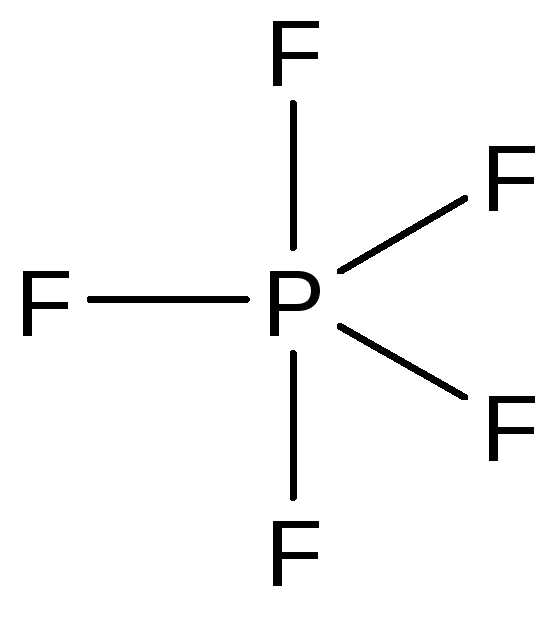
Аналогичное строение имеют другие галогениды фосфора(V) в газообразном состоянии. В кристаллах их строение соответствует следующим формулам: [PCl4]+[PCl6]—, [PBr4]+Br—. Галогениды фосфора — реакционноспособные и гидролитически неустойчивые соединения.
PF5 + HF = H[PF6]; PCl5 + 4H2O = H3PO4 + 5HCl
Оксогалогениды фосфора(V) также гидролитически неустойчивы, например:
POCl3 + 3H2O = H3PO4 + 3HCl
Широко применяются в органической химии для получения хлорсодержащих и фосфорорганических соединений.
Оксид фосфора(V) — P2O5, точнее P4O10 — бесцветное снегоподобное вещество.
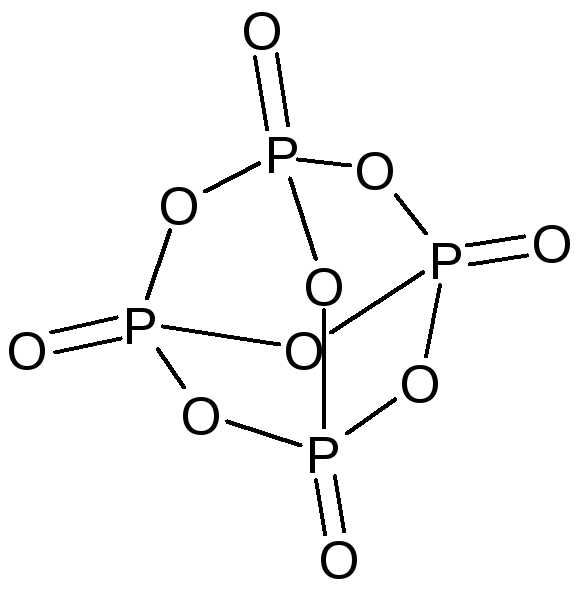
Типичный кислотный оксид, реакция с водой идет ступенчато и приводит в конечном счете к образованию ортофосфорной кислоты:
t
P2O5 + H2O = 2HPO3; HPO3 + H2O = H3PO4
метафосфорная кислота ортофосфорная кислота
Повышенное сродство к воде позволяет использовать оксид фосфора(V) для осушки газов и органических растворителей, а также в качестве водоотнимающего средства, например:
P2O5 + 2HClO4 = 2HPO3 + Cl2O7
Ортофосфорная кислота — H3PO4 — бесцветные гигроскопичные кристаллы (т.пл. 42 С) неограниченно растворимые в воде.
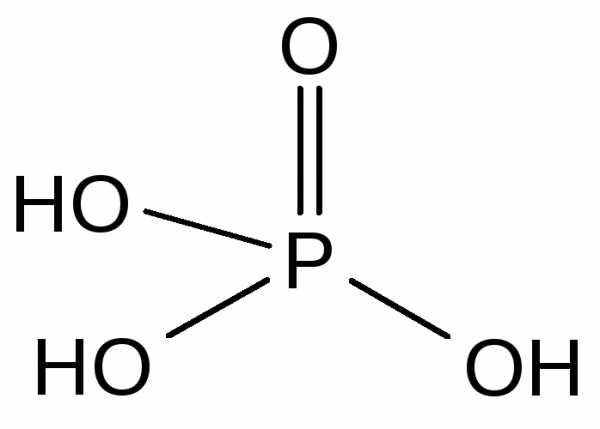
Кислота средней силы при диссоциации по первой ступени (K1 = 810-3), слабая — при диссоциации по второй и третьей ступеням (K2 = 610-8, K3 = 110-12). Образует три ряда солей, например, NaH2PO4 — дигидрофосфат натрия; Na2HPO4 — гидрофосфат натрия; Na3PO4 — фосфат (ортофосфат) натрия. Фосфаты щелочных металлов и аммония хорошо растворимы в воде. Фосфаты остальных металлов малорастворимы. Переход к кислым солям сопровождается заметным повышением растворимости. Фосфаты щелочноземельных металлов и аммония применяются в качестве фосфорных удобрений: Ca3(PO4)2 — фосфоритная мука; CaHPO42H2O — преципитат; Ca(H2PO4)2H2O — двойной суперфосфат; Ca(H2PO4)2H2O + 2CaSO4 — суперфосфат; NH4H2PO4 + (NH4)2HPO4 — аммофос. Широко применяются комбинированные удобрения, содержащие несколько питательных элементов: аммофос + KNO3 — азофоска; (NH4)2HPO4 + NH4NO3 + KCl — нитрофоска.
Присоединение фосфорного ангидрида к фосфорной кислоте приводит к образованию ряда полифосфорных кислот, простейшей из которых является дифосфорная (пирофосфорная) кислота — H4P2O7.
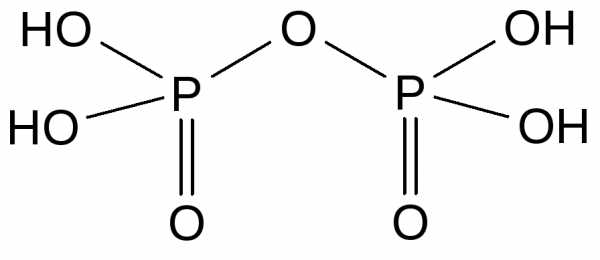
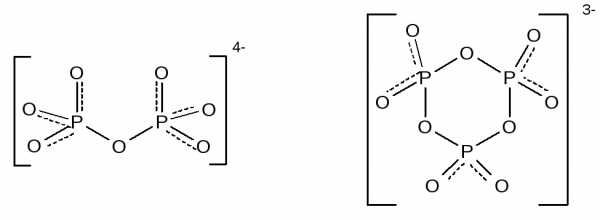
Полифосфорные кислоты образуют ряд солей с открытой цепью из 2 – 10 атомов фосфора –полифосфаты – или циклического строения – метафосфаты. Полифосфаты представляют собой соли аниона общей формулы – [PnO3n+1](n+2)-. Например, Na4P2O7 – диполифосфат (пирофосфат), Na5P3O10 — триполифосфат. К метафосфатам относятся соли аниона общей формулы – [PnO3n]n-. Например, Na3P3O9 – триметафосфат, Na4P4O12 — тетраметафосфат. Структура диполифосфат- и триметафосфат-анионов:
studfiles.net
