What, How to Balance & FAQs —
By Aditi Roy
Гидроксид железа [Fe(OH) 3 ] является основанием переходного металла и реагирует с сернистой кислотой. Обсудим продукты, полученные при взаимодействии Fe(OH) 3 с H 2 SO 3 .
H 2 SO 3 и Fe(OH) 3 реагируют друг с другом и образуют сульфит железа [Fe 2 (SO 35 и
вода) Fe(ОН) 3 является слабым основанием, а H 2 SO 3 также является слабой кислотой. Они подвергаются реакции нейтрализации с образованием соли и воды.
В этой статье основное внимание уделяется продуктам, изменению энтальпии, типу, методу балансировки, сопряженным парам, межмолекулярным силам и некоторым более важным темам реакции.
Что является продуктом H 2 SO 3 и Fe(OH) 3 ? Гидроксид железа, Fe (OH) 3 реагирует со слабой кислотой, H 2 SO 3 и производит сульфит железа [Fe 2 (так 3 ) 3 ] вода (Н 2 О).
2FE (OH) 3 (aq) + 3H 2 Таким образом, 3 (aq) = Fe 2 (Итак, 3 ) 3 (aq) + 6H 2 O ( l)
Какой тип реакции H 2 SO 3 + Fe(OH) 3 ?Реакция между H 2 SO 3 + FE (OH) 3 — один тип реакции-
- Acdation-Base.
- Реакция двойного замещения или Реакция метатезиса
- Экзотермическая реакция
- Необратимая реакция
Чтобы сбалансировать химическую реакцию, необходимо выполнить следующие шаги:
- Сначала напишите несбалансированное химическое уравнение, используя знак со стрелкой вправо, поскольку оно еще не уравновешено.
 Fe(OH) 3 (водн.) + H 2 SO 3 (водн.) → Fe 2 (SO 3 ) +
Fe(OH) 3 (водн.) + H 2 SO 3 (водн.) → Fe 2 (SO 3 ) +5 3 6 (Ha
30005 2 O (ж) - Молярные числа каждого из реагирующих элементов должны быть определены на стороне реагента и продукта.
| Elements | Mole numbers on the reactant side | Mole numbers on the product side |
| Fe | 1 | 2 |
| S | 1 | 3 |
| О | 6 | 10 |
| H | 5 | 2 |
 с числом молей Fe(OH) 3 , 3 с числом молей H 2 SO 3 на стороне реагента и 6 с числом молей H 2 O на стороне продукта.
с числом молей Fe(OH) 3 , 3 с числом молей H 2 SO 3 на стороне реагента и 6 с числом молей H 2 O на стороне продукта. Титром между H 2 SO 3 + Fe (OH) 3 3 6 3 6 3 6 3 6 3 6 3 6 потому что H 2 SO 3 — слабая кислота, а Fe(OH) 3 — слабое основание. Титрование между слабой кислотой и слабым основанием невозможно, потому что точка эквивалентности не может быть точно определена из-за отсутствия резкого изменения кривой титрования.
H 2 SO 3 + Fe (OH) 3 Чистое ионное уравнениеЧистое ионное уравнение химической реакции H 2 SO 3 9000 + Fe (OH) Fe (OH) Fe (OH) Fe (OH) Fe (OH) Fe (OH) Fe (OH) Fe (OH) Fe (OH) Fe (OH) Fe (OH) Fe (OH) 3 IS —
2FE 3+ (AQ) + 3OH — (AQ) + 6H + + 3SO 3 2- (AQ) = 2FE 2- (AQ) = 2FE 3 2- (AQ) = 2FE 3 2- (AQ) = 2FE 3 2- (AQ) = 2FE 3 2- (AQ) (водн. ) + 3SO 3 2- (водн.) + 6H 2 O (л)
) + 3SO 3 2- (водн.) + 6H 2 O (л)
The conjugate pairs (pair of compounds differ by one proton) equation of H 2 SO 3 + Fe (OH) 3 IS-
- СОЗДАТЕЛЬНАЯ ПАА H 2 SO 3 IS HSO 3 —
- . СООБЩЕНИЯ ПАРА 9000 2 2 2 2 2 2
- . –
The intermolecular forces act on H 2 SO 3 + Fe(OH) 3 аре-
- Электростатическая сила притяжения действует в Fe(OH) 3.
 В решетке гидроксида железа ион железа (Fe 3+ ) OH – ) притягиваются друг к другу этой сильной межионной колумбовой силой.
В решетке гидроксида железа ион железа (Fe 3+ ) OH – ) притягиваются друг к другу этой сильной межионной колумбовой силой. - Поскольку H 2 SO 3 является ковалентным соединением, диполь-дипольное взаимодействие и дисперсионные силы Лондона присутствуют. Он также может образовывать очень прочные межмолекулярные водородные связи как с молекулами воды, так и с самим собой.
- Один из продуктов, сульфит железа, является ионным, а вода представляет собой ковалентную молекулу. Следовательно, между ними также присутствуют указанные выше межмолекулярные силы.
Энтальпия реакции H 2 SO 3 + FE (OH) 3 написана ниже
| Formation enthalpy | |
| H 2 SO 3 | -552 KJ/mol (𐤃H gas ) -600.  45 KJ/mol ( 𐤃H liquid ) 45 KJ/mol ( 𐤃H liquid ) |
| Fe(OH) 3 | -824 KJ/mol |
| H 2 O | -286 KJ/mol |
H 2 SO 3 + Fe(OH) 3 не является буферным раствором, поскольку он не является смесью слабой кислоты и сопряженного с ней основания (СН 3 COOH и CH 3 COONa, кислотный буфер) или слабое основание и сопряженная с ним кислота (NH 4 OH и NH 4 Cl, щелочной буфер). В этой смеси H 2 SO 3 является слабой кислотой, а Fe(OH) 3 выступает в роли слабого основания.
Является ли H 2 SO 3 + Fe(OH) 3 полной реакцией? Только H 2 SO 3 + Fe(OH) 3 не может быть полной реакцией, поскольку здесь указаны только реагенты. Если вместе с реагентами будут записаны фактические продукты, такие как вода и сульфит железа, то это будет считаться полной реакцией. Поэтому полная реакция написана ниже-
Если вместе с реагентами будут записаны фактические продукты, такие как вода и сульфит железа, то это будет считаться полной реакцией. Поэтому полная реакция написана ниже-
2FE (OH) 3 (aq) + 3H 2 Таким образом, 3 (aq) = Fe 2 (Итак, 3 ) 3 (aq) + 6H 2 O ( l)
Является ли H 2 SO 3 + Fe(OH) 3 экзотермической или эндотермической реакцией?H 2 SO 3 + Fe(OH) 3 считается экзотермической реакцией, поскольку энтальпия нейтрализации всегда экзотермическая. Энергия, выделяющаяся при образовании молекул воды, больше энергии, поглощаемой для протекания реакции. Энергетическая диаграмма экзотермической реакции
Является ли H 2 SO 3 + Fe(OH) 3 окислительно-восстановительной реакцией? H 2 SO 3 + Fe(OH) 3 не является окислительно-восстановительной реакцией, поскольку в этой реакции не происходит перенос электрона. Следовательно, степень окисления Fe, H, O и S не меняется. Все элементы сохраняют свою степень окисления на протяжении всей реакции.
Следовательно, степень окисления Fe, H, O и S не меняется. Все элементы сохраняют свою степень окисления на протяжении всей реакции.
| Elements | Oxidation state on the reactant side | Oxidation state on the product side |
| Fe | +3 | +3 |
| H | +1 | +1 |
| S | +4 | +4 |
| O | -2 | -2 |
H 2 SO 3 + Fe(OH) 3 не является реакцией осаждения, т. к. завершение реакции. Продукт, сульфит железа [Fe 2 (SO 3 ) 3 ], полностью растворим в воде. Это скорее реакция смещения.
к. завершение реакции. Продукт, сульфит железа [Fe 2 (SO 3 ) 3 ], полностью растворим в воде. Это скорее реакция смещения.
H 2 SO 3 + Fe(OH) 3 является необратимой реакцией, поскольку сторона продукта более стабильна, чем сторона реагента. Кроме того, это реакция нейтрализации, и все реакции нейтрализации становятся необратимыми из-за образования более стабильной соли и воды.
Is H 2 SO 3 + Fe(OH) 3 реакция замещения? H 2 SO 3 + Fe(OH) 3 является реакцией двойного замещения, поскольку каждый из реагирующих химических веществ замещается друг другом с образованием продуктов. В этой реакции Fe вытесняется водородом из гидроксида железа, тогда как водород вытесняется Fe из сернистой кислоты. Двойная реакция смещения
Двойная реакция смещения
Гидроксид железа действует как добавка железа в живой организм и помогает вылечить железодефицитную анемию. Сернистая кислота также находит различное применение в производстве удобрений, красителей, моющих средств, неорганических солей и т. д.
3) Что отменяется при сложении уравнений:
1 ⁄ 2 Н 2 (ж) ⇒ первое и третье уравнения
C(s) ⇒ второе и третье уравнения
1 ⁄ 2 H 2 (g) в левой части третьего уравнения сокращает 1 ⁄ 2 H 2 (g) в правой части, оставляя в сумме 90 0 3 (г) справа (именно то, что нам нужно)
4) Рассчитайте ΔH для нашей реакции:
(+45,9 кДж) + (+74,9 кДж) + (+135,15) = +255,95 кДжОкругление цифр до трех знаков дает +260. кДж (обратите внимание на явное использование десятичной точки)
Пример №6: Определить теплоту реакции окисления железа:
2Fe(s) + 3 ⁄ 2 O 2 (g) —> Fe 2 O 3 (s)
с учетом термохимических уравнений:
2Fe(т) + 6H 2 O(ℓ) —> 2Fe(OH) 3 (т) + 3H 2 (г) 2 кДж = +322 ΔH Fe 2 O 3 (s) + 3H 2 O(ℓ) —> 2Fe(OH) 3 (с) ΔH = +289 кДж 2H 2 (г) + O 2 (г) —> 2H 2 O(ℓ) ΔH = –572 кДж
Решение:
1) Вот что нужно сделать:
2Fe(т) + 6H 2 O(ℓ) —> 2Fe(OH) 3 (т) + 3H 2 (г) ΔH = +39005 2Fe(OH) 3 (с) —> Fe 2 O 3 (s) + 3H 2 O(ℓ) ΔH = −289 kJ 3H 2 (g) + 3 ⁄ 2 O 2 ( g) —> 3H 2 O(ℓ) ΔH = –858 кДж 3 ⁄ 2
2) Сложение уравнений дает целевое уравнение. Добавление энтальпий дает нам наш ответ:
Добавление энтальпий дает нам наш ответ:
2Fe(т) + 3 ⁄ 2 O 2 (г) —> Fe 2 O 3 (с) ΔH = −825 кДж
Обратите внимание, что коэффициент умножения не обязательно должен быть целым числом.
Пример #7: Используя следующие термохимические уравнения, рассчитайте стандартную энтальпию сгорания одного моля жидкого ацетона (C 3 H 6 O).
3C (S) + 3H 2 (G) + 1 ⁄ 2 O 2 (G)-> C 3 H 6 O (G) ΔH° = −285,0 кДж C(т) + O 2 (г) —> CO 2 (г) ΔH° = −394,0 кДж H 2 (г) + 1 ⁄ 2 O 2 (г) —> H 2 O(ℓ°H) −2 O(ℓ°H) −2 Δ 908 k = 908
Решение:
1) Горение жидкого ацетона является целевым уравнением. Напишите (и сбалансируйте) это:
Напишите (и сбалансируйте) это:
С 3 Н 6 O(л) + 4O 2 (г) —> 3CO 2 (г) + 3H 2 О(л)
2) Необходимо обратить первое уравнение данных, чтобы поставить ацетон на стороне реагента. Вот все три уравнения данных с измененным первым:
C 3 H 6 O (ℓ) —> 3C (S) + 3H 2 (G) + 1 ⁄ 2 O 2 (G) 5 2 O 2 (G) 95 2 2 (G) 9. ΔH° = +285,0 кДж C(s) + O 2 (g) —> CO 2 (г) ΔH° = −394,0 кДж H 2 (г) + 1 ⁄ 2 O 2 (г) —> H 2 O(ℓ°H) −2 O(ℓ°H) −2 Δ 908 k = 908Обратите внимание на изменение знака энтальпии при обращении уравнения.
3) Необходимо изменить второе уравнение данных, чтобы создать ситуацию, при которой 3C (и) будут сокращаться, когда уравнения складываются вместе:
С 3 H 6 O(ℓ) —> 3C(s) + 3H 2 (g) + 1 ⁄ 2 O 2 (g) = ΔH3C(т) + 3O 2 (г) —> 3CO 2 (г) ΔH° = −1182,0 кДж H 2 (г) + 1 ⁄ 2 O 2 (г) —> H 2 O(ℓ°H) −2 O(ℓ°H) −2 Δ 908 k = 908Обратите внимание, что энтальпия также была умножена на три.
4) 3H 2 (g) (присутствует в первом уравнении данных) также необходимо удалить из окончательного ответа. Используется другое умножение на 3:
C 3 H 6 O (ℓ) —> 3C (S) + 3H 2 (G) + 1 ⁄ 2 O 2 (G) 5 2 O 2 (G) 95 2 2 (G) 9. ΔH° = +285,0 кДж 3C(т) + 3O 2 (г) —> 3CO 2 (г) ΔH° = −1182,0 кДж 3H 2 (г) + 3 ⁄ 2 O 2 (г) —> 3H 2 O(ℓ) ΔH0 = −8 Обратите внимание, что энтальпия также была умножена на три.
5) Сложите вместе три уравнения данных, чтобы восстановить целевое уравнение, составленное на шаге 1. Обратите внимание на следующее:
1 ⁄ 2 O 2 (g) сокращаются с каждой стороны, оставляя 4O 2 (g) с левой стороны.Энтальпии складываются вместе, чтобы получить окончательный ответ −1755 кДж.
Пример #8: Стандартное изменение энтальпии образования пропана невозможно измерить напрямую. Это потому, что углерод и водород не будут напрямую реагировать с образованием пропана. Однако стандартные изменения энтальпии сгорания относительно легко измерить.
C 3 H 8 (г) ΔH 1 = −2219,9 кДж C(s, gr) ΔH 2 = −393,5 кДж H 2 (г) ΔH 3 = −285,8 кДж
Определить энтальпию образования пропана.
Решение:
1) Представляющее интерес химическое уравнение выглядит следующим образом:
3C(s, gr) + 4H 2 (g) —> C 3 H 8 (g) ΔH = ???
2) Напишите химические уравнения горения трех данных химических соединений:
C 3 H 8 (G) + 5O 2 (G) —> 3CO 2 (G) + 4H 2 O (ℓ) ΔH 16 O (ℓ) ΔH 666666666. C(s, gr) + O 2 —> CO 2 (g) ΔH 2 H 2 + 1 ⁄ 2 O 2 (г) —> H 2 O(ℓ) ΔH 3
3) Измените три уравнения данных, чтобы воспроизвести целевое уравнение:
3CO 2 (G) + 4H 2 O (ℓ) —> C 3 H 8 (G) + 5O 2 (G) -ar- 10005 2 (G) -H 9000 10005 2 (G) (обратное уравнение) 3C(s, gr) + 3O 2 —> 3CO 2 (g) 3ΔH 2 (умножить на 3) 4H 2 + 2O 2 (g) —> 4H 2 O(ℓ) 4ΔH 3 (умножить на 4)
4) Добавьте энтальпии к ответу:
−ΔH 1 + 3ΔH2 + 4ΔH 3 −(−2219,9) + (3) (−393,5) + (4) (−285,8) = −103,8 кДж
Ответ можно проверить здесь.
Пример #9: Определите стандартную энтальпию образования бутана, используя следующие данные:
C 4 H 10 (ж) + 13 ⁄ 2 O 2 (ж) —> 4CO 2 (г) + 5H 2 O(г) ΔH 1 = −2657,4 кДж C(т, г) + O 2 (г) —> CO 2 (г) ΔH 2 = −393,5 кДж 2H 2 (г) + O 2 (г) —> 2H 2 O(г) ΔH 3 = −483,6 кДж
Комментарий: обратите внимание, что первое и третье уравнения не являются стандартными уравнениями горения. Вода в каждом уравнении представляет собой газ. В стандартных уравнениях горения вода является жидкостью (ее стандартное состояние).
Решение:
1) Уравнение образования бутана выглядит следующим образом:
4C(s, gr) + 5H 2 (g) —> C 4 H 10 (g)
2) Три уравнения данных изменены следующим образом:
4CO 2 (G) + 5H 2 O (G) —> C 4 H 10 (G) + 13 ⁄ 2 O 2 (G ) −ΔH 1 4C(s, gr) + 8 ⁄ 2 O 2 (g) —> 4CO 2 (g) 4ΔH 2 5H 2 (g) + 5 ⁄ 2 O 2 (г) —> 5H 2 O(г) 2. 5ΔH 3 0
4) Энтальпии складываются вместе:
−ΔH 1 + 4ΔH 2 + 2,5ΔH 3−(−2657,4) + (−1574) + (−1209) = −125,6 кДж
Это правильно? Конечно, это является.
Пример №10: Рассчитайте энтальпию образования ацетилена (C 2 H 2 ), имея следующие данные:
C(т, г) + O 2 (г) —> CO 2 (г) ΔH = −393,5 кДж H 2 (г) + 1 ⁄ 2 O 2 (г) —> H 2 O(ℓ) 5H 908Δ3 666939 ΔH = −2598 KJ 2C 2 H 2 (G) + 5O 2 (G) —> 4CO 2 (G) + 2H 2 O (ℓ) ΔH = -2598 KJ 666679. Решение:
1) Первое, что нужно сделать, это сформулировать уравнение образования ацетилена:
2C(s, gr) + H 2 (g) —> C 2 H 2 (g)Помните, что в реакции образования все вещества находятся в их стандартных состояниях, и образуется только один моль продукта.
2) Работа с уравнениями данных:
eq 1 —> не переворачивать, умножить на 2 (получаем 2C, которые нам нужны на стороне реагента)
eq 2 —> оставить нетронутым (сохраняет H 2 на стороне реагента и в желаемом количестве)
eq 3 —> перевернуть, разделить на 2 (положить C 2 H 2 на стороне продукта в нужном количестве)3) Результат:
2C(s, gr) + 2O 2 (g) —> 2CO 2 (g) ΔH = −787,0 кДж H 2 (г) + 1 ⁄ 2 O 2 (г) —> H 2 O(ℓ) 5H 908Δ3 2CO 2 (G) + H 2 O (ℓ) —> C 2 H 2 (G) + 5 ⁄ 2 O 2 (G) ΔH = +1299 кДж 4) Сложение трех реакций вместе дает желаемое уравнение.
Сложение трех энтальпий дает энтальпию образования ацетилена:
2C(s, gr) + H 2 (ℓ) —> C 2 H 2 (g) ΔH = +226,2 кДж 677Бонус Пример: Дано:
2C 2 H 6 + 7O 2 —> 4CO 2 + 6H 2 O ΔH = −3119,7 KJ (1) (1) (1) (1) (1) (1) (1) (1) (1) (1) (1) (1) (1) (1) (1) (1) (1) (1) (1) (1) (1) (1) (1) (1) (1). 2H 2 + O 2 —> 2H 2 O ΔH = −478,84 кДж (2) 2CO + O 2 —> 2CO 2 ΔH = −565,98 кДж (3) 0
рассчитайте дельту H для следующей реакции:
C 2 H 6 + O 2 —> 3H 2 + 2COРешение:
Комментарий: это не обычная манера ChemTeam решать проблемы с законом Гесса.
Вот почему я справился с этим, чтобы вы могли проанализировать, как другой мозг подходит к этим проблемам. Обратите особое внимание на рассуждения, происходящие в шаге 4.
1) Умножить уравнение (2) на 3 и обозначить как уравнение (4):
6H 2 + 3O 2 —> 6H 2 O ΔH = −1436.52 kJ (4) 2) Умножить уравнение (3) на 2 и обозначить как уравнение (5): (5)
3) Добавьте уравнение (4) и уравнение (5) и обозначьте как уравнение (6):
6H 2 + 4CO + 5O 2 —> 6H 2 O + 4CO 2 ΔH = −2568,48 KJ (6) (6) 4) Вычесть уравнение (6) из уравнения (1) и обозначить как уравнение (7):
2C 2 H 6 + 7O 2 -(6H 2 + 4CO + 5O 2 ) —> 4CO 2 + 6CH 2 O-(6H 2 + 6H 2 6.

 Fe(OH) 3 (водн.) + H 2 SO 3 (водн.) → Fe 2 (SO 3 ) +
Fe(OH) 3 (водн.) + H 2 SO 3 (водн.) → Fe 2 (SO 3 ) +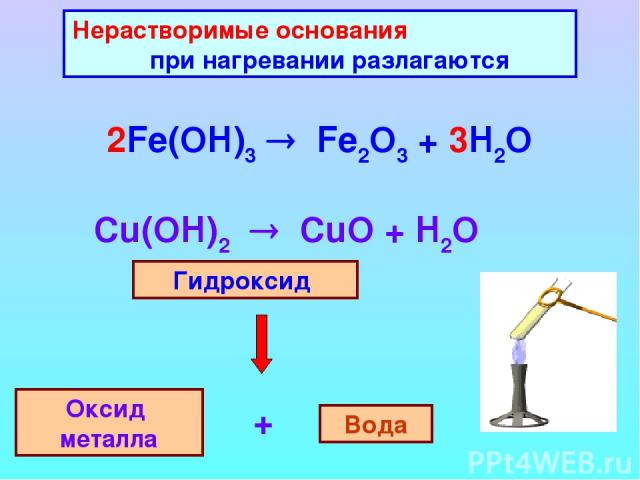 В решетке гидроксида железа ион железа (Fe 3+ ) OH – ) притягиваются друг к другу этой сильной межионной колумбовой силой.
В решетке гидроксида железа ион железа (Fe 3+ ) OH – ) притягиваются друг к другу этой сильной межионной колумбовой силой. 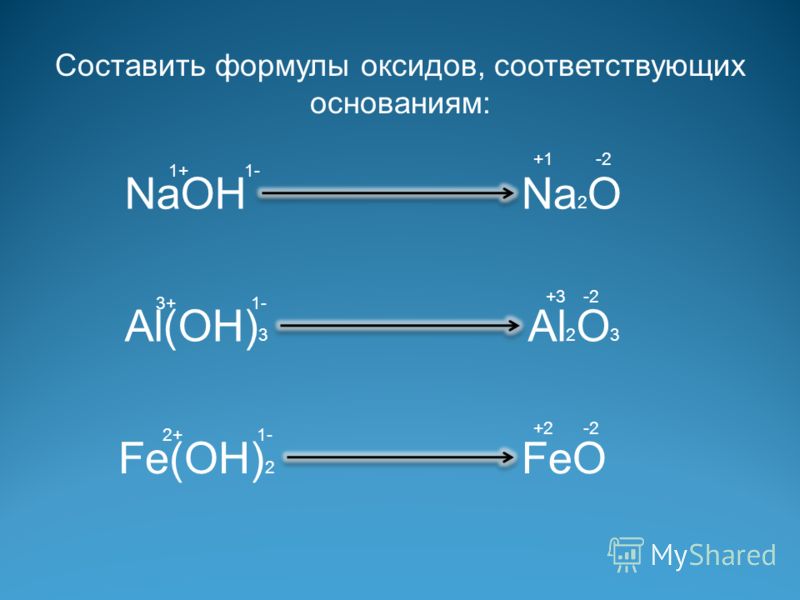

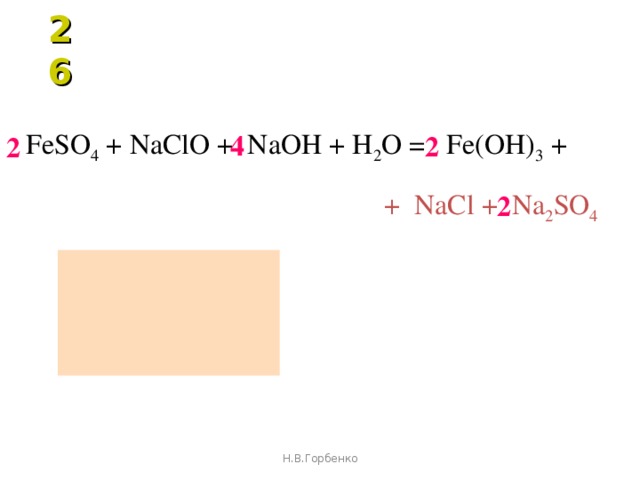



 Сложение трех энтальпий дает энтальпию образования ацетилена:
Сложение трех энтальпий дает энтальпию образования ацетилена: Вот почему я справился с этим, чтобы вы могли проанализировать, как другой мозг подходит к этим проблемам. Обратите особое внимание на рассуждения, происходящие в шаге 4.
Вот почему я справился с этим, чтобы вы могли проанализировать, как другой мозг подходит к этим проблемам. Обратите особое внимание на рассуждения, происходящие в шаге 4.