Окислительно-восстановительные реакции — tarologiay.ru
Реакции, которые называют окислительно-восстановительными (ОВР), происходят с изменением степеней окисления атомов, находящихся в составе молекул реагентов. Эти изменения происходят в связи с переходом электронов от атомов одного элемента к другому.
Процессы, протекающие в природе и осуществляемые человеком, в большинстве своём представляют ОВР. Такие важнейшие процессы, как дыхание, обмен веществ, фотосинтез (6CO2+h3O = C6h22O6 + 6O2), — всё это ОВР.
В промышленности с помощью ОВР получают аммиак, серную, соляную кислоты и многое другое.
Восстановление металлов из руд — фактически основа всей металлургической промышленности — тоже окислительно-восстановительные процессы. Например, реакция получения железа из гематита: 2Fe2O3 + 3С = 4Fe+3CO2.
Окислители и восстановители: характеристика
Атомы, которые в процессе химического превращения электроны отдают, называются восстановителями, их степень окисления (СО) в результате увеличивается. Атомы, принимающие электроны, называют окислителями, и их СО уменьшается.
Атомы, принимающие электроны, называют окислителями, и их СО уменьшается.
Говорят, что окислители, принимая электроны, восстанавливаются, а восстановители — окисляются в процессе отдачи электронов.
Важнейшие представители окислителей и восстановителей представлены в следующей таблице:
| Типичные окислители | Типичные восстановители |
| Простые вещества, состоящие из элементов с высокой электроотрицательностью (неметаллы): йод, фтор, хлор, бром, кислород, озон, сера и т. п. | Простые вещества, состоящие из атомов элементов с низкой электроотрицательностью (металлы или неметаллы): водород h3, углерод C (графит), цинк Zn, алюминий Al, кальций Ca, барий Ba, железо Fe, хром Cr и так далее. |
Молекулы или ионы, содержащие в составе атомы металлов или неметаллов с высокими степенями окисления:
| Молекулы или ионы, имеющие в своём составе атомы металлов или неметаллов с низкими степенями окисления:
|
| Ионные соединения, содержащие катионы некоторых металлов с высокими СО: Pb3+, Au3+, Ag+, Fe3+ и другие. | Органические соединения: спирты, кислоты, альдегиды, сахара. |
На основе периодического закона химических элементов чаще всего можно предположить окислительно-восстановительные способности атомов того или иного элемента. По уравнению реакции также несложно понять, какие из атомов являются окислителем и восстановителем.
Как определить, является атом окислителем или восстановителем: достаточно записать СО и понять, какие атомы её увеличили впроцессе реакции (восстановители), а какие уменьшили (окислители).
Вещества с двойственной природой
Атомы, имеющие промежуточные СО, способны и принимать и отдавать электроны, в результате этого вещества, содержащие в своём составе такие атомы, будут иметь возможность проявить себя как окислителем, так и восстановителем.
Примером может быть пероксид водорода. Содержащийся в его составе кислород в СО -1 может как принять электрон, так и отдать его.
При взаимодействии с восстановителем пероксид проявляет окислительные свойства, а с окислителем — восстановительные.
Рассмотреть подробнее можно при помощи следующих примеров:
- восстановление (пероксид выступает как окислитель) при взаимодействии с восстановителем,
SO2 + h3O2 = h3SO4
О-1 +1е = О-2
- окисление (пероксид является в этом случае восстановителем) при взаимодействии с окислителем.
2KMnO4 + 5h3O2 + 3h3SO4 = 2MnSO4 + 5О2 + K2SO4 + 8h3O
2О-1 -2е = О20
Классификация ОВР: примеры
Различают следующие типы окислительно-восстановительных реакций:
- межмолекулярное окисление-восстановление (окислитель и восстановитель находятся в составе разных молекул),
- внутримолекулярное окисление-восстановление (окислитель находится в составе той же молекулы, что и восстановитель),
- диспропорционирование (окислителем и восстановителем является атом одного и того же элемента),
- репропорционирование (окислитель и восстановитель образуют в результате реакции один продукт).

Примеры химических превращений, относящихся к различным типам ОВР:
- Внутримолекулярные ОВР — это чаще всего реакции термического разложения вещества:
2KCLO3 = 2KCl + 3O2
(Nh5)2Cr2O7 = N2 + Cr2O3 + 4h3O
2NaNO3 = 2NaNO2 + O2
- Межмолекулярные ОВР:
3Cu + 8HNO3 = 3Cu(NO3)2 + 2NO + 4h3O
2Al + Fe2O3 = Al2O3 + 2Fe
N2 + 3h3 = 2Nh4
- Реакции диспропорционирования:
3Br2 + 6KOH = 5KBr + KBrO3 + 6h3O
3HNO2 = HNO3 + 2NO + h3O
2NO2 + h3O = HNO3 + HNO2
4KClO3 = KCl + 3KClO4
- Реакции репропорционирования:
2h3S + SO2 = 3S + 2h3O
HOCl + HCl = h3O + Cl2
Токовые и бестоковые ОВР
Окислительно-восстановительные реакции также разделяют на токовые и бестоковые.
Первый случай — это получение электрической энергии за счёт химической реакции (такие источники энергии могут использоваться в двигателях машин, в радиотехнических устройствах, приборах управления), либо электролиз, то есть химическая реакция, наоборот, возникает за счёт электроэнергии (с помощью электролиза можно получать различные вещества, обрабатывать поверхности металлов и изделий из них).
Примерами бестоковых ОВР можно назвать процессы горения, коррозии металлов, дыхания и фотосинтеза и т.д.
Метод электронного баланса ОВР в химии
Уравнения большинства химических реакций уравниваются несложным подбором стехиометрических коэффициентов. Однако при подборе коэффициентов для ОВР можно столкнуться с ситуацией, когда количество атомов одних элементов не удаётся уравнять, не нарушая при этом равенство количеств атомов других. В уравнениях таких реакций подбирают коэффициенты методом составления электронного баланса.
Основывается метод на том, что сумма принимаемых окислителем электронов и количество отдаваемых восстановителем приводится к равновесию.
Метод складывается из нескольких этапов:
- Записывается уравнение реакции.
- Определяются СО элементов.
- Определяются элементы, которые в результате реакции изменили свои степени окисления. Отдельно записываются полуреакции окисления и восстановления.

- Подбираются множители для уравнений полуреакций так, чтобы уравнять принятые в полуреакции восстановления и отданные в полуреакции окисления электроны.
- Подобранные коэффициенты проставляются в уравнение реакции.
- Подбираются остальные коэффициенты реакции.
На простом примере взаимодействия алюминия с кислородом удобно написать уравнивание поэтапно:
- Уравнение: Al + O2 = Al2О3
- СО у атомов в простых веществах алюминия и кислорода равны 0.
Al0 + O20 = Al+32O-23
- Составим полуреакции:
Al0 -3е = Al+3,
O20 +4e = 2O-2
- Подбираем коэффициенты, при умножении на которые сравняется количество принятых и количество отданных электронов будет одинаковым:
Al0 -3е = Al+3 коэффициент 4,
O20 +4e = 2O-2 коэффициент 3.
- Проставляем коэффициенты в схему реакции:
4Al + 3O2 = Al2O3
- Видно, что для уравнивания всей реакции достаточно поставить коэффициент перед продуктом реакции:
4Al + 3O2 = 2Al2O3
Примеры заданий на составление электронного баланса
Могут встречаться следующие задания на уравнивания ОВР:
- Взаимодействие перманганата калия с хлоридом калия в кислой среде с выделением газообразного хлора.

Марганцевокислый калий KMnO4 (перманганат калия, «марганцовка») — сильный окислитель за счёт того, что в KMnO4 степень окисления Mn равна +7. С его помощью часто получают газообразный хлор в лабораторных условиях по следующей реакции:
KCl + KMnO4 + h3SO4 = Cl2 + MnSO4 + K2SO4 + h3O
K+1Cl-1 + K+1Mn+7O4-2 + h3+1S+6O4-2 = Cl20 + Mn+2S+6O4-2 + K2+1S+6O4-2 + h3+1O-2
Электронный баланс:
Как видно после расстановки СО, атомы хлора отдают электроны, повышая свою СО до 0, а атомы марганца электроны принимают:
Mn+7 +5е = Mn+2 множитель два,
2Cl-1 -2е = Cl20 множитель пять.
Проставляем в уравнение коэффициенты в соответствии с подобранными множителями:
10K+1Cl-1 + 2K+1Mn+7O4-2 +h3SO4 = 5Cl20 + 2Mn+2S+6O4-2 + K2SO4 + h3O
Уравниваем количество остальных элементов:
10KCl + 2KMnO4 + 8h3SO4 = 5Cl2 + 2MnSO4 + 6K2SO4 + 8h3O
- Взаимодействие меди (Cu) с концентрированной азотной кислотой(HNO3) с выделением газообразного оксида азота (NO2):
Cu + HNO3(конц. ) = NO2 + Cu(NO3)2 + 2h3O
) = NO2 + Cu(NO3)2 + 2h3O
СО :
Cu0 + H+1N+5O3-2 = N+4O2 + Cu+2(N+5O3-2)2 + h3+1O-2
Электронный баланс :
Как видно, атомы меди повышают свою СО с нуля до двух, а атомы азота — снижают с +5 до +4
Cu0 -2е = Cu+2 множитель один,
N+5 +1е = N+4 множитель два.
Проставляем в уравнение коэффициенты:
Cu0 + 4H+1N+5O3-2 = 2N+4O2 + Cu+2(N+5O3-2)2 + h3+1O-2
Уравниваем остальные элементы:
Cu + 4HNO3(конц.) = 2NO2 + Cu (NO3)2 + 2h3O
- Взаимодействие дихромата калия с Н2S в кислой среде:
Запишем схему реакции, расставим СО:
К2+1Сr2+6О7-2 + Н2+1S-2 + Н2+1S+6O4-2 = S0 + Сr2+3(S+6O4-2)3 + K2+1S+6O4-2 + h3O
S-2 –2e = S0 коэффициент 3,
2Cr+6 +6e = 2Cr+3 коэффициент 1.
Подставляем:
К2Сr2О7 + 3Н2S + Н2SО4 = 3S + Сr2(SО4)3 + K2SO4 + Н2О
Уравниваем остальные элементы:
К2Сr2О7 + 3Н2S +4Н2SО4 = 3S + Сr2(SО4)3 + K2SO4 + 7Н2О
Влияние реакционной среды
Характер среды влияет на протекание тех или иных ОВР. Роль реакционной среды можно проследить на примере взаимодействия перманганата калия (KMnO4) и сульфита натрия (Na2SO3) при различных значениях рН:
Роль реакционной среды можно проследить на примере взаимодействия перманганата калия (KMnO4) и сульфита натрия (Na2SO3) при различных значениях рН:
- Na2SO3 + KMnO4 = Na2SO4 + MnSO4 + K2SO4 (pH <,7 кислая среда),
- Na2SO3 + KMnO4 = Na2SO4 + MnO2 + KOH (pH =7 нейтральная среда),
- Na2SO3 + KMnO4 = Na2SO4 + K2MnO4 + h3O (pH >,7 щелочная среда).
Видно, что изменение кислотности среды приводит к образованию разных продуктов взаимодействия одних и тех же веществ. При изменении кислотности среды они происходят и для других реагентов, вступающих в ОВР. Аналогично показанным выше примерам реакции с участием дихромат-иона Cr2O72- будут проходить с образованием разных продуктов реакции в различных средах:
в кислой среде продуктом будет Cr3+,
в щелочной — CrO2, CrO33+,
в нейтральной — Cr2O3.
Окислительно-восстановительные реакции — презентация онлайн
Похожие презентации:
Сложные эфиры. Жиры
Физические, химические свойства предельных и непредельных карбоновых кислот, получение
Газовая хроматография
Хроматографические методы анализа
Искусственные алмазы
Титриметрические методы анализа
Биохимия гормонов
Антисептики и дезинфицирующие средства. (Лекция 6)
(Лекция 6)
Клиническая фармакология антибактериальных препаратов
Биохимия соединительной ткани
Процессы восстановления ( +е )
P⁰ + 3e → P‾³
Na⁺ + 1e → Na⁰
S⁺6 + 2e → S⁺4
S+4
Cl⁰ + 1e → Cl‾
Cl⁺⁷ + 8e→ Cl-¹
степень окисления
+ 4e→ S0
УМЕНЬШАЕТСЯ
Процессы окисления ( — е )
Ba⁰ — 2e → Ba⁺²
S‾² — 2e → S⁰
Fe⁺² — 1e→ Fe⁺³
N⁺3 — 2e → N+5
S⁺4 — 2e→ S⁺6
Na⁰ — 1e → Na⁺
степень окисления
УВЕЛИЧИВАЕТСЯ
СОСТАВЛЕНИЕ ОВР методом электронного баланса
2. Подчеркнем символы элементов, изменяющие степени
окисления.
3. Составим электронный баланс
( уравнения процессов окисления – восстановления).
Находим множители для уравнений процессов
окисления-восстановления.
4. Найденные множители запишем перед формулами продуктов
окислителя и восстановителя, то есть в правую часть уравнения
реакции.
5. Расставим коэффициенты в уравнении реакции
( в последнюю очередь перед кислородом и водородом).

6. Проверяем себя по кислороду
ПРИМЕРЫ
H₂S‾² + O₂⁰ = H₂O‾² + S⁺⁴O₂
Окисление:
Восстановление:
Окислитель : O₂⁰
S‾² — 6e → S⁺⁴ |4 | 2
O₂⁰ + 4e → 2O‾² | 6| 3
Восстановитель: S‾²
2H₂S‾² + 3 O₂⁰ = 2 H₂O‾² + 2 S⁺⁴O₂
Na2 SO3 + KMnO4 + h3SO4 = K2SO4 + MnSO4 + Na2 SO4 + h3O
Восстановление: Mn+7 + 5e → Mn+2 | 2
Окисление:
S+4 — 2e → S+6
| 5
Mn — окислитель
S – восстановитель
5Na2 SO3 + 2KMnO4 + 3h3SO4 = K2SO4 + 2MnSO4 +5 Na2 SO4+ 3h3O
Расставьте коэффициенты методом
электронного баланса
Na +
O₂ → Na₂O
(1)
Al + Cl₂ → AlCl₃
(3)
(4)
Fe₂O₃ + H₂ →Fe + H₂O
Mg + HCl → H₂ + MgCl₂
H₂SO₄ + Al → H₂ + Al₂(SO₄) ₃
(2)
H₂SO₄ + Na → Na₂SO₄ + H₂O + H₂S
(5)
Na⁰ — 1 e → Na⁺| 4
O⁰₂ + 2 ∙ 2e → 2O⁻² | 1
Al⁰ — 3e → Al⁺³ | 2
Cl⁰₂ + 2 ∙ 1 e → 2Cl⁻ | 3
4 Na + O₂ = 2Na₂O
2 Al + 3 Cl₂ = 2 AlCl₃
Al⁰ — 3 e → Al⁺³ | 2
2H⁺ + 2 ∙ 1e → H⁰₂ | 3
Mg⁰ — 2 e → Mg⁺² | 2 | 1
2H⁺ + 2 ∙ 1e → H⁰₂ | 2 | 1
2Al + 3H₂SO₄ = Al₂(SO₄)₃ + 3H₂
Mg + 2 HCl = MgCl₂ + H₂
Na⁰ — 1 e → Na⁺ | 8
S⁺⁶ + 8 e → S⁻² | 1
5H₂SO₄ + 8Na = 4Na₂SO₄ + 1H₂S + 4H₂O
ТЕСТ
1.
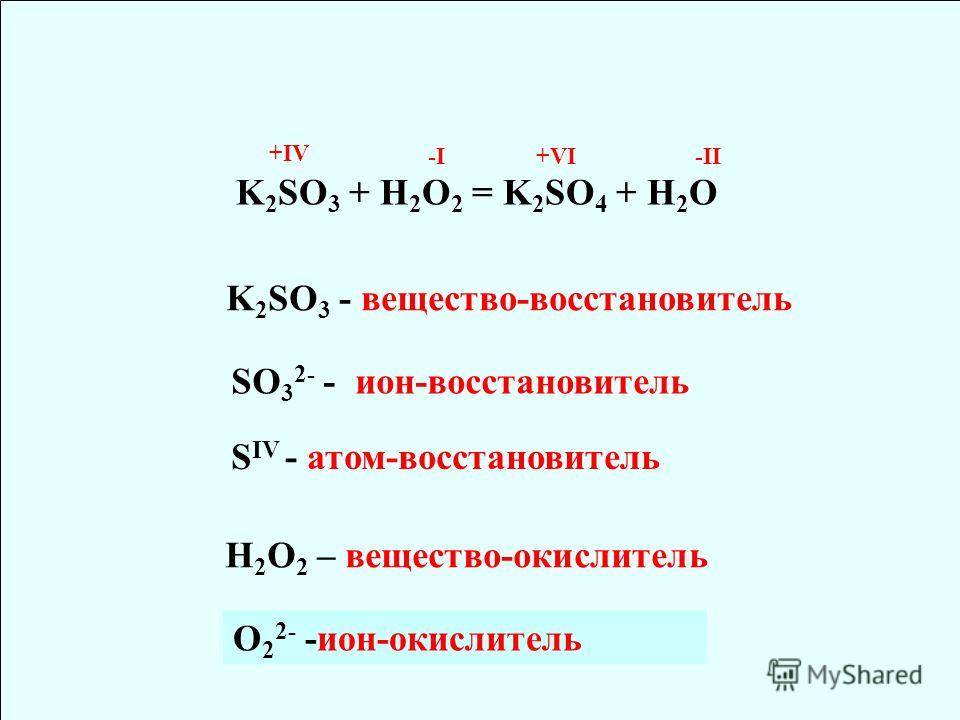 Укажите ОВР: а) PH₃ + 2O₂ = H₃PO₄
Укажите ОВР: а) PH₃ + 2O₂ = H₃PO₄б) KOH + HCl = KCl + H₂O
в) CO₂ + CaO = CaCO₃
2. Укажите какие процессы происходят:
а) N⁰₂ — 4e→ 2N⁺²
б) S⁺⁶ + 2e→ S⁺⁴
в) Fe⁰ — 3e→ Fe⁺³
г) P⁺³ + 2e→ P⁺⁵
3. Cоставьте ОВР методом электронного баланса.
Определите окислитель и восстановитель.
а) S + N₂O→ SO₂ + N₂
б) Br₂ + Zn → ZnBr₂
в) HBr + O₂ → H₂O + Br₂ г) Fe₂O₃ + H₂→ H₂O + Fe
English Русский Правила
Дегидратация спиртов для получения алкенов
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 3901
- Джим Кларк
- Школа Труро в Корнуолле
На этой странице обсуждается дегидратация спиртов в лаборатории для получения алкенов, например, дегидратация этанола для получения этилена.
Дегидратация этанола с получением этилена
Это простой метод получения газообразных алкенов, таких как этилен. Если пары этанола пропускают через нагретый порошок оксида алюминия, этанол по существу расщепляется с образованием этилена и водяного пара.
Для приготовления нескольких пробирок с этиленом можно использовать следующее оборудование:
Эта система может быть увеличена путем кипячения этанола в колбе и пропускания пара над оксидом алюминия, который нагревается в длинной трубке.
Дегидратация спиртов с использованием кислотного катализатора
Кислотными катализаторами, обычно используемыми при дегидратации спиртов, являются либо концентрированная серная кислота, либо концентрированная фосфорная (V) кислота, H 3 PO 4 . Концентрированная серная кислота дает грязные результаты. Поскольку серная кислота также является сильным окислителем, она окисляет часть спирта до двуокиси углерода и одновременно сама восстанавливается до двуокиси серы. Оба эти газа должны быть удалены из алкена. Серная кислота также реагирует со спиртом с образованием массы углерода. Есть и другие побочные реакции (здесь не обсуждаются).
Оба эти газа должны быть удалены из алкена. Серная кислота также реагирует со спиртом с образованием массы углерода. Есть и другие побочные реакции (здесь не обсуждаются).
Дегидратация этанола с получением этилена
В этом процессе этанол нагревают с избытком концентрированной серной кислоты при температуре 170°C. Образовавшиеся газы пропускают через раствор гидроксида натрия для удаления двуокиси углерода и двуокиси серы, образующихся в результате побочных реакций. Этен собирают над водой.
Концентрированная серная кислота является катализатором. Поэтому он написан над стрелкой реакции, а не в уравнении.
Дегидратация циклогексанола с получением циклогексена
Это препарат, обычно используемый для иллюстрации образования и очистки жидкого продукта. Тот факт, что атомы углерода соединены в кольцо, не имеет отношения к химическому составу реакции. Циклогексанол нагревают с концентрированной фосфорной (V) кислотой, жидкий циклогексен отгоняют, собирают и очищают. Фосфорную (V) кислоту обычно используют вместо серной, поскольку она более безопасна и способствует менее сложной реакции.
Фосфорную (V) кислоту обычно используют вместо серной, поскольку она более безопасна и способствует менее сложной реакции.
Дегидратация более сложных спиртов
С более сложными спиртами возможно образование более чем одного алкена. Хорошим примером этого является бутан-2-ол, при дегидратации которого образуются три разных алкена.
Пример 1: Дегидратация бутан-2-ола
При дегидратации спирта группа -ОН и атом водорода от следующего атома углерода в цепи удаляются. С такими молекулами, как бутан-2-ол, для этого есть две возможности.
Образуются следующие продукты:
Продукты: бут-1-ен, CH 2 =CHCH 2 CH 3 , и бут-3 CH 9005 , CH =ЧЧЧ 3 .
Эта ситуация еще более осложняется тем фактом, что бутен-2-ен проявляет геометрическую изомерию; при этом образуется смесь двух изомеров: цис -бут-2-ен и транс -бут-2-ен.
Соединение цис -бут-2-ен также известен как (Z)-бут-2-ен;  Какой изомер образуется, зависит от случая.
Какой изомер образуется, зависит от случая.
Таким образом, дегидратация бутанола-2 приводит к смеси, содержащей следующие соединения:
- бутан-1-ен
- цис -бут-2-ен (также известный как (Z)-бут-2-ен)
- транс -бут-2-ен (также известный как (Е)-бут-2-ен)
Авторы
Джим Кларк (Chemguide.co.uk)
Эта страница под названием «Обезвоживание спиртов для производства алкенов» распространяется по незаявленной лицензии, автором, ремиксом и/или куратором этой страницы является Джим Кларк.
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или страница
- Автор
- Джим Кларк
- Показать страницу TOC
- № на стр.

- Теги
Парожидкостные равновесия для водной серной кислоты (Технический отчет)
Парожидкостные равновесия для водной серной кислоты (Технический отчет) | ОСТИ.GOVперейти к основному содержанию
- Полная запись
- Другое связанное исследование
Состав паровой фазы над серной кислотой экспериментально не измерялся из-за низкой летучести H{sub 2}SO{sub 4}. Описан метод расчета парциальных давлений H {sub 2} O, H {sub 2} SO {sub 4} и SO {sub 3} на основе парциально-моляльных термодинамических величин жидкой фазы. Приведены таблицы и графики, которые дают приведенные выше значения парциального давления от -50 до 400°С для тридцати шести составов с содержанием кислоты от 10 до 100 мас.%.
Приведены таблицы и графики, которые дают приведенные выше значения парциального давления от -50 до 400°С для тридцати шести составов с содержанием кислоты от 10 до 100 мас.%.
- Авторов:
- Гмитро, Джон Ирвинг; Вермельен, Теодор
- Дата публикации:
- Исследовательская организация:
- Национальная лаборатория Лоуренса в Беркли. (LBNL), Беркли, Калифорния (США)
- Организация-спонсор:
- Директор Департамента науки Министерства сельского хозяйства США
- Идентификатор ОСТИ:
- 876220
- Номер(а) отчета:
- UCRL-10886; TID-4500
РНН: US200620%%810
- Номер контракта с Министерством энергетики:
- ДЭ-АС02-05Ч21231
- Тип ресурса:
- Технический отчет
- Страна публикации:
- США
- Язык:
- Английский
- Тема:
- 37 НЕОРГАНИЧЕСКАЯ, ОРГАНИЧЕСКАЯ, ФИЗИЧЕСКАЯ И АНАЛИТИЧЕСКАЯ ХИМИЯ; РАВНОВЕСИЕ; ПАРЫ; ЖИДКОСТИ; СЕРНАЯ КИСЛОТА; ХИМИЧЕСКИЙ СОСТАВ; ВОДЯНОЙ ПАР; ТРИОКСИД СЕРЫ
Форматы цитирования
- ГНД
- АПА
- Чикаго
- БибТекс
Гмитро, Джон Ирвинг, и Вермёлен, Теодор. Парожидкостные равновесия для водной серной кислоты . США: Н. П., 1963.
Веб. дои: 10.2172/876220.
Парожидкостные равновесия для водной серной кислоты . США: Н. П., 1963.
Веб. дои: 10.2172/876220.
Копировать в буфер обмена
Гмитро, Джон Ирвинг, и Вермёлен, Теодор. Парожидкостные равновесия для водной серной кислоты . Соединенные Штаты. https://doi.org/10.2172/876220
Копировать в буфер обмена
Гмитро, Джон Ирвинг, и Вермёлен, Теодор. 1963 год.
«Парожидкостные равновесия водной серной кислоты». Соединенные Штаты. https://doi.org/10.2172/876220. https://www.osti.gov/servlets/purl/876220.
Копировать в буфер обмена
@статья{osti_876220,
title = {Парожидкостные равновесия для водной серной кислоты},
автор = {Гмитро, Джон Ирвинг и Вермёлен, Теодор},
abstractNote = {Состав паровой фазы над серной кислотой экспериментально не измерялся из-за низкой летучести H{sub 2}SO{sub 4}.
дои = {10.2172/876220},
URL = {https://www.osti.gov/biblio/876220},
журнал = {},
номер =,
объем = ,
место = {США},
год = {1963},
месяц = {6}
}
Копировать в буфер обмена
Посмотреть технический отчет (4,30 МБ)
https://doi.org/10.2172/876220
Экспорт метаданных
Сохранить в моей библиотеке
Вы должны войти в систему или создать учетную запись, чтобы сохранять документы в своей библиотеке.

 ).
).


