What, How To Balance & FAQs – Lambda Geeks
КМnО4 is a strong oxidizing agent and can react with molecules having higher reduction potential. Let us see in detail the mechanism of its reaction with h3SO4.
Potassium permanganate is a purple violate solid molecule and it is a powerful reagent as the central metal Mn presents a +7 oxidation state. It can react with a cold and concentrated form of sulfuric acid and form different oxidized products. In this reaction, KMnO4 acts as a self catalyst.
О механизме реакции между серной кислотой и железом, энтальпии реакции, типе реакции, образовании продукта и т.д. поговорим в следующей части статьи.
1. Чему равно произведение H
2SO4 и KMnO4?Manganese sulfate and Potassium sulfate are formed as major products when H2SO4 and KMnO4 are reacted together. Water molecules and oxygen gas are also evolved due to their reaction.
between H2SO4 и KMnO4
2. Какой тип реакции Н
2SO4 + KMnO4?H2SO4 + KMnO4 reaction is an example of a double displacement reaction along with redox and precipitation reactions. It is also oxygen evolved reaction along with a hydrolysis reaction.
3. Как сбалансировать H
2SO4 + KMnO4?H2SO4 + KMnO4 = MnSO4 + К2SO4 + H2О + О2 We have to balance the equation in the following way:
- Шаг 1 – Маркировка всех реагентов и продуктов необходимым количеством алфавитов
- First, we labeled all the reactants and products by A, B, C, D, and E as there are only five different atoms obtained for this reaction and the reaction looks like: AH2SO4 + B KMnO4 = C MnSO4 + D K2SO4 + ЭХ2O + F O2
- Шаг 2 – Приравнивание всех коэффициентов для всех элементов одного типа путем их перестановки
- After the rearrangement of all the coefficients of the same elements by their stoichiometric proportion we get, H = 2A = 2E, S = A = C = D, O = 4A = 4B = 4C = 4D = E =2F, Mn = B = C, K = B = 2d
- Шаг 3 – Использование метода исключения Гаусса для определения значений коэффициентов
- Using the Gaussian elimination and equating all the equations we get, A = 6, B = 4, C = 4, D = 2, E = 6, and F= 5,
- Шаг 4- теперь запишите все уравнение в сбалансированной форме
- Общее сбалансированное уравнение будет,
- 6 H2SO4 + 4 KMnO4 = 4 MnSO4 + 2 K2SO4 + 6H2O + 5 O2
4.
 Ч2SO4 + КМnО4 титрование
Ч2SO4 + КМnО4 титрованиеTo estimate the quantity of potassium or manganese we can perform a titration between KMnO4 и H2SO4
Используемый аппарат
Для этого титрования нам потребуются бюретка, коническая колба, держатель бюретки, мерная колба и стаканы.
Титр и титрант
H2SO4 versus KMnO4, H2SO4 акты as a titrant which is taken in the burette and the molecule to be analyzed is KMnO4 который отбирают в коническую колбу.
Индикаторные
The whole titration is done in acidic pH as the concentration of H2SO4 is high and for this reaction, KMnO4 acts as a self-indicator because it is a colored solution and in different pH, it changes color.
Процедура
Бюретка заполнялась стандартизированным H2SO4 и KMnO4 was taken in a conical flask along with the respective indicator. H2SO4 is added dropwise to the conical flask and the flask was shaking constantly. After a certain time when the endpoint arrived KMnO4 changes its color.
H2SO4 is added dropwise to the conical flask and the flask was shaking constantly. After a certain time when the endpoint arrived KMnO4 changes its color.
We repeat the titration several times for better results and then we estimate the potassium as well as manganese quantity by the formula V1S1 V =2S2.
5. Ч
2SO4+ КМnО4 чистое ионное уравнениеЧистое ионное уравнение между H2SO4 + КМnО4 как следует,
2H+ + ТАК42- + K+ + MnO4– = Мн2+ + K+ + SO42- + H+ + OH– + О2
- Чтобы получить чистое ионное уравнение, необходимы следующие шаги:
- First H2SO4 will be ionized in proton and sulfate ions as it is a strong electrolyte
- After that KMnO4 also dissociated to K+ ион и SO42-.

- After that, the product MnSO4 also dissociated to Mn2+ which is d5 stable configuration and corresponding SO42-.
- Water is also ionized to H+ и ОН-.
- O2 remains undissociated.
6. Ч
2SO4+ КМnО4 сопряженные парыВ реакции Н2SO4 + КМnО4 conjugate pairs will be the corresponding de-protonated and protonated form of that particular species which are listed below-
- Сопряженная пара H2SO4 = ТАК42-
- Conjugate pair of OH– = H2O
7. Ч
2SO4 и KMnO4 межмолекулярные силыThe intermolecular force between H2SO4 is an electrostatic, covalent force. For the KMnO4 it is ionic interaction and for MnSO4 и K2SO4 the ionic interaction is along with the coulombic force. H-bonding is present in water and van der waal’s force acts in O2 молекулы.
For the KMnO4 it is ionic interaction and for MnSO4 и K2SO4 the ionic interaction is along with the coulombic force. H-bonding is present in water and van der waal’s force acts in O2 молекулы.
| молекула | и.о. сила |
| H2SO4 | электростатический, Ван дер Вааль Диполь взаимодействие |
| КМnО4 | Ionic, metallic, and электростатический |
| K2SO4 / MnSO4 | Coulombic force, strong ionic interaction |
| H2O | ковалентный, Н-связь |
| O2 | Van der Waal’s force, London force |
8.
 ЧАС2SO4 + КМnО4 энтальпия реакции
ЧАС2SO4 + КМnО4 энтальпия реакцииВ реакции Н2SO4 + КМnО4 энтальпия реакции is,-4400.4 KJ/mol which can be obtained by the formula enthalpy of products – enthalpy of reactants, and here the change in enthalpy is positive.
| молекула | энтальпия (кДж/моль) |
| KMnO4 | -813 |
| H2SO4 | -814 |
| MnSO4 | -1130 |
| K2SO4 | -1437.8 |
| H2O | -68 |
| O2 | 0 |
и продукты
9.
 Н2SO4 + КМnО4 буферный раствор?
Н2SO4 + КМnО4 буферный раствор?Реакция между H2SO4 + KMnO4 gives a buffer solution and they can control the pH of the solution.
10. Н
2SO4 + КМnО4 полная реакция?Реакция между H2SO4 + КМnО4 is the complete reaction because it gives two complete products MnSO4 и K2SO4 along with O2 газ.
11 Н2SO4 + КМnО4 экзотермическая или эндотермическая реакция?Реакция H2SO4 + KMnO4 is exothermic in terms of thermodynamics first law. So, the reaction releases more energy and temperature to the surrounding so we have to be more осторожный, Where δH is always negative.
12. Н
2SO4 + КМnО4 окислительно-восстановительная реакция?Реакция между H2SO4 + КМnО4 — это окислительно-восстановительная реакция because in this reaction many elements get reduced and oxidized.
Окислительно-восстановительная схемаH2SO4 и KMnO4 реакция
13. Н
2SO4 + КМnО4 реакция осажденияРеакция Н2SO4 + КМnО4 is a precipitation reaction because it gets precipitated in the solution and is not soluble in the reaction mixture.
14. Н
2SO4 + КМnО4 обратимая или необратимая реакция?Реакция между H2SO4+ KMnO4 is irreversible because we get O2 gas as a product. When gas is formed during the reaction, the entropy of the reaction increases and the equilibrium of the reaction shifts towards the right-hand side only.
15. Н
2SO4 + КМnО4 реакция смещения?Реакция между H2SO4+ КМnО4 это пример одинарное перемещение reaction because in the above reaction Mn and K are displaced by H+ в H2SO4 И O2 газ освобождается от реакции.
Single Displacement ReactionЗаключение
H2SO4 и KMnO4 reaction mainly gives us K2SO4 and MnSO4 along with oxygen gas so it is a commercially important reaction for the production of oxygen gas. Also, the quantitative analysis of the H2SO4 и KMnO4 give the amount of Mn and K in the respective sample.
Помощь студентам в учёбе от Людмилы Фирмаль
Здравствуйте!
Я, Людмила Анатольевна Фирмаль, бывший преподаватель математического факультета Дальневосточного государственного физико-технического института со стажем работы более 17 лет. На данный момент занимаюсь онлайн обучением и помощью по любыми предметам. У меня своя команда грамотных, сильных бывших преподавателей ВУЗов. Мы справимся с любой поставленной перед нами работой технического и гуманитарного плана. И не важно: она по объёму на две формулы или огромная сложно структурированная на 125 страниц! Нам по силам всё, поэтому не стесняйтесь, присылайте.
На данный момент занимаюсь онлайн обучением и помощью по любыми предметам. У меня своя команда грамотных, сильных бывших преподавателей ВУЗов. Мы справимся с любой поставленной перед нами работой технического и гуманитарного плана. И не важно: она по объёму на две формулы или огромная сложно структурированная на 125 страниц! Нам по силам всё, поэтому не стесняйтесь, присылайте.
Срок выполнения разный: возможно онлайн (сразу пишите и сразу помогаю), а если у Вас что-то сложное – то от двух до пяти дней.
Для качественного оформления работы обязательно нужны методические указания и, желательно, лекции. Также я провожу онлайн-занятия и занятия в аудитории для студентов, чтобы дать им более качественные знания.
Моё видео:
Вам нужно написать сообщение в Telegram . После этого я оценю Ваш заказ и укажу срок выполнения. Если условия Вас устроят, Вы оплатите, и преподаватель, который ответственен за заказ, начнёт выполнение и в согласованный срок или, возможно, раньше срока Вы получите файл заказа в личные сообщения.
После этого я оценю Ваш заказ и укажу срок выполнения. Если условия Вас устроят, Вы оплатите, и преподаватель, который ответственен за заказ, начнёт выполнение и в согласованный срок или, возможно, раньше срока Вы получите файл заказа в личные сообщения.
Стоимость заказа зависит от задания и требований Вашего учебного заведения. На цену влияют: сложность, количество заданий и срок выполнения. Поэтому для оценки стоимости заказа максимально качественно сфотографируйте или пришлите файл задания, при необходимости загружайте поясняющие фотографии лекций, файлы методичек, указывайте свой вариант.
Какой срок выполнения заказа?Минимальный срок выполнения заказа составляет 2-4 дня, но помните, срочные задания оцениваются дороже.
Как оплатить заказ?Сначала пришлите задание, я оценю, после вышлю Вам форму оплаты, в которой можно оплатить с баланса мобильного телефона, картой Visa и MasterCard, apple pay, google pay.
В течение 1 года с момента получения Вами заказа действует гарантия. В течении 1 года я и моя команда исправим любые ошибки в заказе.
Качественно сфотографируйте задание, или если у вас файлы, то прикрепите методички, лекции, примеры решения, и в сообщении напишите дополнительные пояснения, для того, чтобы я сразу поняла, что требуется и не уточняла у вас. Присланное качественное задание моментально изучается и оценивается.
Теперь напишите мне в Telegram или почту и прикрепите задания, методички и лекции с примерами решения, и укажите сроки выполнения. Я и моя команда изучим внимательно задание и сообщим цену.
Если цена Вас устроит, то я вышлю Вам форму оплаты, в которой можно оплатить с баланса мобильного телефона, картой Visa и MasterCard, apple pay, google pay.
Мы приступим к выполнению, соблюдая указанные сроки и требования. 80% заказов сдаются раньше срока.
После выполнения отправлю Вам заказ в чат, если у Вас будут вопросы по заказу – подробно объясню.
youtube.com/embed/vOuj6t2Zyeg» frameborder=»0″ allow=»accelerometer; autoplay; encrypted-media; gyroscope; picture-in-picture» allowfullscreen=»»/>
youtube.com/embed/ElMEic2MJ-U» frameborder=»0″ allow=»accelerometer; autoplay; encrypted-media; gyroscope; picture-in-picture» allowfullscreen=»»/>
Можете смело обращаться к нам, мы вас не подведем. Ошибки бывают у всех, мы готовы дорабатывать бесплатно и в сжатые сроки, а если у вас появятся вопросы, готовы на них ответить.
В заключение хочу сказать: если Вы выберете меня для помощи на учебно-образовательном пути, у вас останутся только приятные впечатления от работы и от полученного результата!
Жду ваших заказов!
С уважением
Пользовательское соглашение
Политика конфиденциальности
Окисление органических молекул KMnO4
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 15387
Перманганат калия, KMnO 4 , является сильным окислителем и имеет множество применений в органической химии.
Введение
Из всех окислителей, обсуждаемых в учебниках по органической химии, перманганат калия, KMnO 4 , вероятно, является наиболее распространенным, а также наиболее применимым. Как будет показано ниже, KMnO 4 можно использовать для окисления широкого круга органических молекул. Полученные продукты могут варьироваться в зависимости от условий, но поскольку KMnO 4 является таким сильным окислителем, конечными продуктами часто являются карбоновые кислоты. 9o = 0,6\, V\]
Как будет показано ниже, KMnO 4 можно использовать для окисления широкого круга органических молекул. Полученные продукты могут варьироваться в зависимости от условий, но поскольку KMnO 4 является таким сильным окислителем, конечными продуктами часто являются карбоновые кислоты. 9o = 0,6\, V\]
Общая реакционная способность с органическими молекулами
KMnO 4 способен окислять атомы углерода, если они содержат достаточно слабые связи, в том числе
- Атомы углерода с \(\pi\) связями, как в алкенах и алкинах
- Атомы углерода со слабыми связями C-H, такие как
- С-Н связи в альфа-положениях замещенных ароматических колец
- связи C-H в атомах углерода, содержащих связи C-O, включая спирты и альдегиды
- Углерод с исключительно слабыми связями С-С, такие как
- С-С связи в гликоле
- С-С связи рядом с ароматическим кольцом И кислородом
KMnO 4 также окисляет фенол до парабензохинона.
Пример
Примеры неокисленных углеродов
- Алифатические углероды (кроме тех, которые находятся в альфа-положении к ароматическому кольцу, как указано выше)
- Ароматические углероды (кроме фенола, указанного выше)
- Углерод без связи С-Н, за исключением пункта (3) выше
Исчерпывающее окисление органических молекул KMnO 4 будет происходить до образования карбоновых кислот. Следовательно, спирты будут окисляться до карбонилов (альдегидов и кетонов), а альдегиды (и некоторые кетоны, как в (3) выше) будут окисляться до карбоновых кислот.
Реакции со специфическими функциональными группами
Используя приведенные выше принципы, мы ожидаем, что KMno 4 будет реагировать с алкенами, алкинами, спиртами, альдегидами и ароматическими боковыми цепями. Примеры приведены ниже. Легче всего начать сверху.
Альдегиды
Альдегиды RCHO легко окисляются до карбоновых кислот.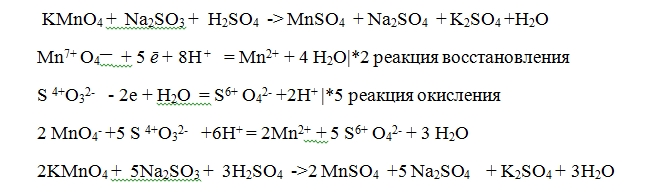
Если не предпринимать больших усилий для поддержания нейтрального значения pH, окисление KMnO 4 имеет тенденцию происходить в щелочных условиях. Фактически наиболее эффективные условия для окисления альдегидов KMnO 4 включают t -бутанол в качестве растворителя с буфером NaH 2 PO 4 . 2 Реакции, приведенные выше, намеренно не сбалансированы. Уравновешивание реакций потребует использования методов, изученных в общей химии, требующих полуреакций для всех процессов.
Спирты
Первичные спирты, такие как октан-1-ол, могут быть эффективно окислены KMnO 4 в присутствии основных солей меди. 3 Однако продукт представляет собой преимущественно октановую кислоту с небольшим количеством альдегида, образующегося в результате переокисления.
Хотя переокисление представляет меньшую проблему для вторичных спиртов, KMnO 4 в целом не считается подходящим для превращения спиртов в альдегиды или кетоны.
Алкены
4В мягких условиях перманганат калия может влиять на превращение алкенов в гликоли. Однако он способен к дальнейшему окислению гликоля с разрывом углерод-углеродной связи, поэтому необходим тщательный контроль условий реакции. Циклический диэфир марганца является промежуточным продуктом в этих окислениях, что приводит к образованию гликолей при добавлении syn .
С добавлением тепла и/или более концентрированного KMnO 4 , гликоль может быть дополнительно окислен, разрывая связь C-C.
Более замещенные олефины будут заканчиваться кетоном
Окислительное расщепление диола можно проводить более мягко, используя IO 4 в качестве окислителя.
Расщепление алкенов до кетонов/карбоновых кислот можно использовать для определения положения двойных связей в органических молекулах. 5
Алкины
4 Вместо бис-гидроксилирования, которое происходит с алкенами, перманганатное окисление алкинов сначала приводит к образованию дионов.
В более жестких условиях дион расщепляется с образованием двух карбоновых кислот.
Ароматические боковые цепи
6Обработка алкилбензола перманганатом калия приводит к окислению с образованием бензойной кислоты.
Примечание
Положение, непосредственно примыкающее к ароматической группе, называется «бензильным» положением.
Реакция работает, только если к углероду присоединен хотя бы один водород. Однако, если есть хотя бы один водород, окисление продолжается до карбоновой кислоты.
Примеры:
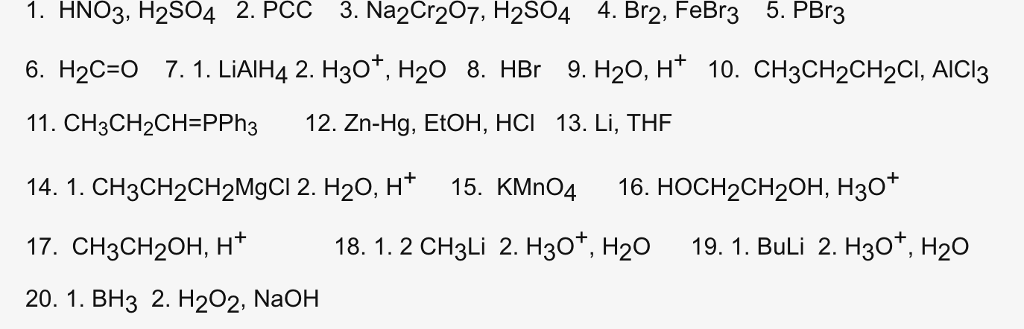
Примечания: Обратите внимание, что в примере 2 лишние атомы углерода отщепляются с получением того же продукта, что и в примере 1. А в примере 3 образуются две бензойные кислоты. Наконец, когда на бензиловом углероде нет атомов водорода, реакция не происходит (пример 4).
Окисление алкильных боковых цепей с образованием бензойных кислот исторически использовалось в качественном анализе для определения положения алкильных групп в замещенных ароматических системах.

