15 невероятных фактов о реакции HNO3 + Ba(OH)2
By Сана Хан
HNO3 бесцветная минеральная кислота реагирует с кристаллическим неорганическим соединением Ba(OH)2. Изучим, как протекает реакция
HNO3 реагирует с Ba (OH)2 с получением соответствующей соли и побочного продукта. HNO3 является сильной кислотой с pka менее 1, используется для производства аммиака, а также является основным компонентом удобрений, реагирует с неорганическими соединениями Ва (ОН)2 потому что это гидроксиды щелочноземельных металлов.
В этой статье мы узнаем, как оба неорганических соединения реагируют вместе, их продукты, тип реакции и ее сбалансированную форму.
Что такое продукт HNO
3 + Ва (ОН)2HNO3 реагирует Ba (OH)2 чтобы дать нитрат бария Ba (NO3)2 и вода Н2O.
HNO3 + Ва (ОН)2 → Ba (НЕТ3)2 + H2O
Какой тип реакции HNO?
3 + Ва (ОН)2HNO3 + Ва (ОН)2 is нейтрализация реакция. Смешивание сильного основания Ba(OH)2 с сильной кислотой HNO3 дать соль и воду имеет место быть.
Смешивание сильного основания Ba(OH)2 с сильной кислотой HNO3 дать соль и воду имеет место быть.
Как сбалансировать HNO
3 + Ва (ОН)2Мы должны сбалансировать заданную реакцию.
HNO3 + Ва (ОН)2→ Ba (НЕТ3)2 + H2O
- Сбалансированная реакция показывает одинаковое количество элементов как на стороне реагента, так и на стороне продукта. Здесь мы должны выделить числовые коэффициенты, чтобы сделать реакцию сбалансированной.
- Мы должны присвоить каждому соединению соответствующие алфавитные коэффициенты, такие как A, B, C, D.
- А HNO3 + В Ва(ОН)2 → С Ва(НЕТ3)2 + ЦТ2O
| Ср № | Элемент | A | B | C | D |
|---|---|---|---|---|---|
| 1 | H | 1 | 2 | 0 | 2 |
| 2 | N | 1 | 0 | 1 | 0 |
| 3 | O | 3 | 2 | 6 | 1 |
| 4 | Ba | 0 | 1 | 1 | 0 |

- Введите значения коэффициентов в метод исключения для оценки.
- Получите наименьшие целые целые значения из результата, упростив его.
- А = 2, В = 1, С = 1, Г = 2
- Сбалансированное уравнение
- 2 ННО3 + Ва (ОН)2 → Ba (НЕТ3)2+ 2H2O.
HNO
3 + Ва (ОН)2 титрование- HNO3 + Ва (ОН)2 подвергают кислотно-основному титрованию. Сильная кислота HNO3 соединяется с сильным основанием Ba(OH)2 дать реакцию нейтрализации путем титрования стандартного раствора до получения точки эквивалентностиt.
- Титрование будет происходить как
Используемый аппарат
Штатив для титрования, пипетка, бюретка, мерная колба, коническая колба, мешалка, воронка.
Химия
Неизвестная концентрация HNO3, известная концентрация Ba(OH)2.
индикаторы
фенолфталеин Индикатор обычно используется для такого титрования.
Процедура
- Во-первых, заполните бюретку до кончика, прежде чем промыть ее известным раствором гидроксида бария.
- При этом титровании азотная кислота аналит а титрант — это гидроксид бария, так как азотная кислота находится в неизвестном количестве, концентрацию которой нам нужно найти с помощью гидроксида бария.
- Затем отсосать точное количество раствора азотной кислоты в коническую колбу.
- В коническую колбу с неизвестной концентрацией азотной кислоты добавить 2-3 капли фенолфталеинового индикатора.
- Затем при помощи бюретки в конический флакон добавляют по капле раствор гидроксида бария известной концентрации до изменения его цвета с бесцветного на розовый.
- Обратите внимание на чтение и повторите его 3 раза.
- Для нахождения нормальности аналита формулы имеют вид:
- N1V1 = N2V2
- По значению нормальности можно найти массу азотной кислоты.

- Масса = уравнение Вес. × нормальность × громкость / 1000
HNO
3 + Ва (ОН)2 чистое ионное уравнениеЧистое ионное уравнение, для HNO3 + Ва (ОН)2 is
OH– (Вода) + Н+(Aq) → Н2О (л)
- При составлении молекулярного уравнения необходимо учитывать фазу каждого соединения.
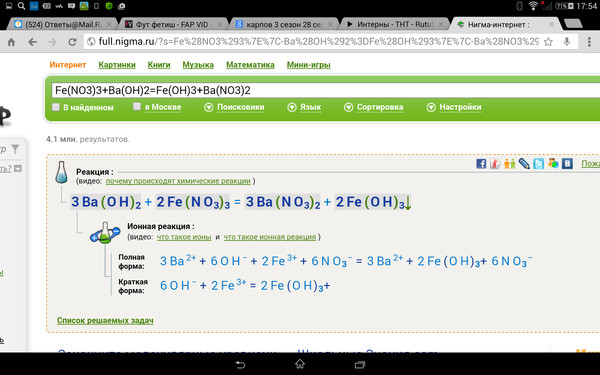
- 2 ННО3 (Водный) + Ва(ОН)2 (Aq) → Ba(NO3)2 (водн.) + 2H2О (л)
- Водные соли или химические вещества в уравнении должны быть преобразованы в ионы. Разлагать следует только сильные электролиты, так как они полностью диссоциируют.
- Вот, ХНО3 сильная кислота, Bа (ОН)2 является сильным основанием, а Ba (NO3)2 это сильная соль. Так, они подвергаются диссоциации.

- 2 H+ + 2 НЕТ3– + Ба+2 + 2 ОН– → Ба+2 + 2НО3– + 2H2O
- Ионы-зрители должны быть нейтрализованы, чтобы показать виды, действительно участвующие в реакции.
- Оставшееся вещество представляет собой чистое ионное уравнение.
- OH– (водн.) + Н+(вода) → H2О (л)
HNO
3 и Ва (ОН)2 сопряженные парысопряженный пары для HNO3 и Bа (ОН)2 заключаются в следующем:
- HNO3, отпустите H+, чтобы дать НЕТ3– как сопряженные пары.
- Сопряженная кислота Ba (OH)2 Ба+2.
- Сопряженное основание Ba (OH)2 это ОХ–.
- Сопряженная кислота H2О есть Н3O+.

- H2O подвергается депротонированию с образованием сопряженного основания OH–.
- В (НЕТ3)2 не образуют сопряженных пар.
HNO
3 и Ва (ОН)2 межмолекулярные силыМежмолекулярные силы, присутствующие между HNO3 и Ва (ОН)2 Он,
- HNO3 показывают водородные связи, силы Лондона и диполь-дипольное притяжение из-за разделенных ионов водорода и нитрат-ионов в водных растворах.
- Ва (ОН)2 проявляют сильные ионные межмолекулярные силы притяжения.
- H2O демонстрирует водородную связь, диполь-дипольные силы и дисперсионные силы Лондона из-за различий в электроотрицательности между атомами O и H.
HNO
3 + Ва (ОН)2 энтальпия реакцииHNO3 + Ва (ОН)2 имеет отрицательную энтальпию -948 кДж/моль,
- Энтальпия образования HNO3 составляет -173.
 1 кДж/моль.
1 кДж/моль. - Энтальпия образования Ba(OH)2 составляет -643.9 кДж/моль.
- Энтальпия образования Ba(NO3)2 составляет -78 кДж/моль.
- Энтальпия образования H2O – 285.8 кДж/моль.
HNO
3 + Ва (ОН)2 буферный растворHNO3 + Ва (ОН)2 не является буферным раствором. Буферные соли состоят из слабой кислоты и сопряженного с ней основания, но здесь и кислота, и основание являются сильными по своей природе, поэтому это противоречит критериям буферного раствора.
HNO
3 + Ва (ОН)2 полная реакцияHNO3 + Ва (ОН)2 является полной реакцией из-за сильной кислотной и основной природы HNO3 и Ва (ОН)2 решения, чтобы сделать их полностью диссоциированными. Таким образом, реагент полностью расходуется в ходе реакции, и в дальнейшем не остается никаких следов.
HNO
3 + Ва (ОН)2 экзотермическая или эндотермическая реакцияHNO3 + Ва (ОН)2 является эндотермической реакцией. При смешении обоих реагентов температура смеси падает до 450°С. Достаточно холодно, чтобы заморозить химический стакан с реакционной смесью.Эндотермическая реакция
HNO
3 + Ва (ОН)2 окислительно-восстановительная реакцияHNO3 + Ва (ОН)2 не является окислительно-восстановительной реакцией. На обеих сторонах реагента нет одинакового продукта. степени окисления соответствующих элементов.
HNO
3 + Ва (ОН)2 реакция осажденияHNO3 + Ва (ОН)2 не является реакцией осаждения. Здесь происходит образование соли нитрата бария, хорошо растворимой в воде.
HNO
3 + Ва (ОН)2 обратимая или необратимая реакцияHNO3 + Ва (ОН)2 является необратимой реакцией. Константа равновесия реакции высока, что означает, что реакция движется в прямом направлении с образованием продуктов из-за высокой ионизирующей способности сильной кислоты и сильного основания, присутствующих в нашей реагентной стороне.
Константа равновесия реакции высока, что означает, что реакция движется в прямом направлении с образованием продуктов из-за высокой ионизирующей способности сильной кислоты и сильного основания, присутствующих в нашей реагентной стороне.
HNO
3+ Ва (ОН)2 реакция смещенияHNO3 + Ва (ОН)2 дает двойную реакцию замещения. Обмен облигациями происходит между HNO3 и Ва (ОН)2 молекул, дающих различные смешанные продукты.
Заключение
HNO3 реагирует с Ba (OH)2 дать соответствующую соль и воду с поглощением тепла из окружающей среды. Нитрат бария — бесцветное нерастворимое в воде соединение, широко используемое в военных целях для изготовления тротила и связующих.
Нитрат бария: способы получения и химические свойства
Нитрат бария Ba(NO3)2 — соль металла бария и азотной кислоты. Белый, при нагревании плавится и разлагается. Хорошо растворяется в воде (гидролиза нет). Вступает в реакции обмена.
Хорошо растворяется в воде (гидролиза нет). Вступает в реакции обмена.
Относительная молекулярная масса Mr = 261,34; относительная плотность для тв. и ж. состояния d = 3,23; tпл = 594º C (разлагается).
1. Нитрат бария можно путем взаимодействия бария и разбавленной азотной кислоты, образуется нитрат бария, оксид азота (I) и вода:
4Ba + 10HNO3 = 4Ba(NO3)2 + N2O↑ + 5H2O,
если барий будет взаимодействовать с очень разбавленной азотной кислотой, то образуются нитрат бария, нитрат аммония и вода:
4Ba + 10HNO3 = 4Ba(NO3)2 + NH4NO3 + 3H2O
2. В результате взаимодействия сульфида бария и концентрированной азотной кислоты образуется нитрат бария, сера, оксид азота (IV) и вода:
BaS + 4HNO3 = Ba(NO3)2 + S↓ + 2NO2↑ + 2H2O
Качественная реакция на нитрат бария — взаимодействие с медью при нагревании в присутствии концентрированной кислоты:
1. При взаимодействии с серной кислотой и медью, нитрат бария образует сульфат бария, нитрат меди, бурый газ оксид азота и воду:
При взаимодействии с серной кислотой и медью, нитрат бария образует сульфат бария, нитрат меди, бурый газ оксид азота и воду:
Cu + 2Ba(NO3)2 + 2H2SO4 = Cu(NO3)2 + 2BaSO4 + 2NO2 ↑ + 2H2O
1. Hитрат бария разлагается при температуре 594 — 620º С с образованием нитрита бария и кислорода:
Ba(NO3)2 = Ba(NO2)2 + O2,
а если температуре поднимется до 620 — 670о С, то на выходе реакции будут образовываться оксид бария, оксид азота (IV) и кислород:
2Ba(NO3)2 = 2BaO + 4NO2 + O2
2. Нитрат бария реагирует с простыми веществами:
Нитрат бария реагирует с простыми веществами:
2.1. Нитрат бария вступает в реакцию с атомным водородом (цинком и в присутствии соляной кислоты). В результате реакции образуется нитрат бария, хлорид цинка и вода:
Ba(NO3)2 + 2Zn + 4HCl = Ba(NO2)2 + 2ZnCl2 + 2H2O
3. Возможны реакции между нитратом бария и сложными веществами:
3.1. Нитрат бария вступает в реакцию с кислотами:
В результате реакции между нитратом бария и разбавленной серной кислотой образуется сульфат бария и азотная кислота:
Ba(NO3)2 + H2SO4 = BaSO4↓ + 2HNO3
3.2. Нитрат бария вступает в реакцию с солями:
Нитрат бария вступает в взаимодействие с гидрофосфатом натрия при кипении. В результате реакции образуется фосфат бария, нитрат натрия и азотная кислота:
В результате реакции образуется фосфат бария, нитрат натрия и азотная кислота:
3Ba(NO3)2 + 2Na2HPO4 = Ba3(PO4)2↓ + 4NaNO3 + 2HNO3
Понравилось это:
Нравится Загрузка…
15 Невероятные факты о реакции HNO3 + Ba(OH)2 —
Сана Хан
HNO 3 бесцветная минеральная кислота реагирует с кристаллическим неорганическим соединением Ba(OH) 2 . Давайте изучим, как протекает реакция
HNO 3 реагирует с Ba(OH) 2 с образованием соответствующей соли и побочного продукта. HNO 3 — сильная кислота с pka менее 1, используемая для производства аммиака, а также являющаяся основным компонентом удобрений, вступает в реакцию с неорганическим соединением Ba(OH) 2 , поскольку это гидроксиды щелочноземельных металлов.
В этой статье мы узнаем, как оба неорганических соединения реагируют вместе, их продукты, тип реакции и ее сбалансированную форму.
Что является продуктом HNO
3 + Ba(OH) 2HNO 3 реагирует Ba(OH) 2 с образованием нитрата бария Ba (NO 90 0 6 3 90) и воды Н 2 О.
HNO 3 + BA (OH) 2 → BA (№ 3 ) 2 + H 2 O
Какой тип реакции HNO
3 + BA (OH) 2 6.HNO 3 + Ba(OH) 2 – реакция нейтрализации. Происходит смешивание сильного основания Ba(OH) 2 с сильной кислотой HNO 3 с образованием соли и воды.
Как сбалансировать HNO
3 + Ba(OH) 2Мы должны сбалансировать данную реакцию.
HNO 3 + BA (OH) 2 → BA (№ 3 ) 2 + H 2 O
- Сбалансированная реакция показывает равное количество элементов на Реагенте и продукт.
 сторона. Здесь мы должны выделить числовые коэффициенты, чтобы сделать реакцию сбалансированной.
сторона. Здесь мы должны выделить числовые коэффициенты, чтобы сделать реакцию сбалансированной. - Мы должны присвоить каждому соединению соответствующие алфавитные коэффициенты, такие как A, B, C, D.
- A HNO 3 + B Ba(OH) 2 → C Ba(NO 3 ) 2 + D H 2 O
| Sr No. | Element | A | B | C | D |
|---|---|---|---|---|---|
| 1 | H | 1 | 2 | 0 | 2 |
| 2 | N | 1 | 0 | 1 | 0 |
| 3 | O | 3 | 2 | 6 | 1 |
| 4 | Ba | 0 | 1 | 1 | 0 |
 of элементы, присутствующие в реагентах и продуктах.
of элементы, присутствующие в реагентах и продуктах. - Введите значения коэффициентов в метод исключения для оценки.
- Получите наименьшие целые целые значения из результата, упростив его.
- A = 2, B = 1, C = 1, D = 2
- Сбалансированное уравнение: ) 2 + 2 Н 2 О .
HNO
3 + Ba(OH) 2 титрование. Сильная кислота HNO 3 соединяется с сильным основанием Ba(OH) 2 с образованием реакции нейтрализации путем титрования стандартного раствора для получения степени эквивалентности т.Используемый аппарат
Штатив для титрования, пипетка, бюретка, мерная колба, коническая колба, мешалка, воронка.
Химикаты
Неизвестная концентрация HNO 3 , известная концентрация Ba(OH) 2 .
Индикаторы
Индикатор фенолфталеин обычно используется для такого титрования.
Процедура
- Во-первых, заполните бюретку до кончика, прежде чем промыть ее известным раствором гидроксида бария.
- В данном титровании азотная кислота является аналитом, а титрантом является гидроксид бария, так как азотная кислота находится в неизвестном количестве, концентрацию которой нам нужно найти с помощью гидроксида бария.
- Затем отсосать точное количество раствора азотной кислоты в коническую колбу.
- Добавьте 2-3 капли индикатора фенолфталеина в коническую колбу, содержащую азотную кислоту неизвестной концентрации.
- Затем с помощью бюретки по капле добавляйте раствор гидроксида бария известной концентрации в конический флакон до изменения его цвета с бесцветного на розовый.
- Запишите показания и повторите их 3 раза.

- Для поиска нормальности аналита, формулы приведены как:
- N 1 V 1 = N 2 V 2
- Из нормстного значения. азотная кислота.
- Масса = Ур. Вес. × Нормальность × объем / 1000
HNO
3 + BA (OH) 2 Чистое ионное уравнение Чистое ионное уравнение, для HNO 3 + BA (OH) 2 9001 1 OH – (Aq) + H + (Aq) → H 2 O (l)
3 + BA (OH) 2 11111111111111000 + BA (OH) 2 1111111111111000 + BA (OH) 2 111111111111111000 3 + BA (OH) 2 1111111111000 3 + BA (OH) 1 1111111111000 3 + BA (OH).
Водный соли или химические вещества в уравнении должны быть преобразованы в ионы. Разлагать следует только сильные электролиты, так как они полностью диссоциируют. 

HNO
3 and Ba(OH) 2 conjugate pairsConjugate pairs for HNO 3 and B a(OH) 2 :
- HNO 3 , высвобождение H+ дает NO 3 – в виде сопряженных пар.
- Сопряженная кислота Ba(OH) 2 представляет собой Ba +2 .
- Сопряженное основание Ba(OH) 2 представляет собой OH – .
- Сопряженная кислота H 2 O есть H 3 O + .
- H 2 O подвергаются депротонированию с образованием сопряженного основания OH – .
- Ba(NO 3 ) 2 не составляют сопряженных пар.

HNO
3 и Ba(OH) 2 межмолекулярные силыМежмолекулярные силы между HNO 3 и Ba(OH) 2 равны ,
- HNO 3 проявляют водородные связи, силы Лондона и диполь-дипольное притяжение из-за разделенных ионов водорода и нитрат-ионов. в водных растворах.
- Ba(OH) 2 демонстрируют сильные ионные межмолекулярные силы притяжения.
- H 2 O показывают водородную связь, диполь-дипольные силы и дисперсионные силы Лондона из-за различий в электроотрицательности между атомами O и H.
HNO
3 + Ba(OH) 2 reaction enthalpyHNO 3 + Ba(OH) 2 has the enthalpy of -948 KJ/Mol which is negative,
- Энтальпия образования HNO 3 составляет -173,1 кДж/моль.

- Энтальпия образования Ba(OH) 2 составляет -643,9 кДж/моль.
- Энтальпия образования Ba(NO 3 ) 2 составляет -78 кДж/моль.
- Энтальпия образования H 2 O is – 285,8 кДж/моль.
Is HNO
3 + Ba(OH) 2 буферный растворHNO 3 + Ba(OH) 2 не является буферным раствором. Буферные соли состоят из слабой кислоты и сопряженного с ней основания, но здесь и кислота, и основание являются сильными по своей природе, поэтому это противоречит критериям буферного раствора.
Is HNO
3 + Ba(OH) 2 полная реакция HNO 3 + Ba(OH) 2 является полной реакцией из-за сильной кислотной и основной природы растворов HNO 3 и Ba(OH) 2 , что приводит к их полной диссоциации. Таким образом, реагент полностью расходуется в ходе реакции, и в дальнейшем не остается никаких следов.
Is HNO
3 + Ba(OH) 2 экзотермическая или эндотермическая реакцияHNO 3 + Ba(OH) 2 эндотермическая реакция. При смешении обоих реагентов температура смеси падает до 450°С. Достаточно холодно, чтобы заморозить химический стакан с реакционной смесью. Эндотермическая реакция
Is HNO
3 + Ba(OH) 2 окислительно-восстановительная реакцияHNO 3 + Ba(OH) 2 не является окислительно-восстановительной реакцией. На обеих сторонах реагента нет одинакового продукта. степени окисления соответствующих элементов.
Is HNO
3 + Ba(OH) 2 реакция осажденияHNO 3 + Ba(OH) 2 не является реакцией осаждения. Здесь происходит образование соли нитрата бария, хорошо растворимой в воде.
Is HNO
3 + Ba(OH) 2 обратимая или необратимая реакция HNO 3 + Ba(OH) 2 необратимая реакция. Константа равновесия реакции высока, что означает, что реакция движется в прямом направлении с образованием продуктов из-за высокой ионизирующей способности сильной кислоты и сильного основания, присутствующих в нашей реагентной стороне.
Константа равновесия реакции высока, что означает, что реакция движется в прямом направлении с образованием продуктов из-за высокой ионизирующей способности сильной кислоты и сильного основания, присутствующих в нашей реагентной стороне.
Is HNO
3 + Ba(OH) 2 реакция замещенияHNO 3 + Ba(OH) 2 дает двойную реакцию замещения. Происходит перестановка связей между молекулами HNO 3 и Ba(OH) 2 с образованием различных смешанных продуктов.
Заключение
HNO 3 реагирует с Ba(OH) 2 с образованием соответствующей соли и воды с поглощением тепла из окружающей среды. Нитрат бария — бесцветное нерастворимое в воде соединение, широко используемое в военных целях для изготовления тротила и связующих.
Нитрат бария | AMERICAN ELEMENTS®
РАЗДЕЛ 1. ИДЕНТИФИКАЦИЯ
Наименование продукта: Нитрат бария
Номер продукта: Все применимые коды продуктов American Elements, например. БА-НАТ-02
, БА-НАТ-03
, БА-НАТ-04
, БА-НАТ-05
, BA-NAT-06
БА-НАТ-02
, БА-НАТ-03
, БА-НАТ-04
, БА-НАТ-05
, BA-NAT-06
Номер CAS: 10022-31-8
Соответствующие установленные области применения вещества: Научные исследования и разработки
Информация о поставщике:
American Elements
10884 Weyburn Ave.
Los Angeles, CA
Тел.: +1 310-208-0551
Факс: +1 310-208-0351
Телефон службы экстренной помощи:
Внутренний, Северная Америка: +1 800-44 -9300
Международный: +1 703-527-3887
РАЗДЕЛ 2. ИДЕНТИФИКАЦИЯ ОПАСНОСТИ
Классификация вещества или смеси
Классификация в соответствии с Регламентом (ЕС) № 1272/2008
GHS03 Пламя над кругом
Ox. Сол. 3 ч372 Может усилить огонь; окислитель.
GHS07
Острый токсикоз. 4 h402 Вреден при проглатывании.
Острый токсикоз. 4 h432 Вреден при вдыхании.
Опасности, не классифицированные иначе
Данные отсутствуют
Элементы маркировки
Маркировка в соответствии с Регламентом (ЕС) № 1272/2008
Вещество классифицируется и маркируется в соответствии с регламентом CLP.
Пиктограммы опасности
GHS03 GHS07
Сигнальное слово: Осторожно
Краткая характеристика опасности
h372 Может усилить возгорание; окислитель.
h402+h432 Вреден при проглатывании или вдыхании.
Меры предосторожности
P221 Примите все меры предосторожности, чтобы избежать смешивания с горючими веществами.
P210 Хранить вдали от источников тепла/искр/открытого огня/горячих поверхностей. — Курение запрещено.
P220 Хранить/хранить вдали от одежды/горючих материалов.
P261 Избегать вдыхания пыли/дыма/газа/тумана/паров/аэрозолей.
P304+P340 ПРИ ВДЫХАНИИ: Вынести пострадавшего на свежий воздух и обеспечить ему покой в удобном для дыхания положении.
P501 Утилизируйте содержимое/контейнер в соответствии с местными/региональными/национальными/международными нормами.
Классификация WHMIS
C — Окисляющие материалы
D1B — Токсичные материалы, вызывающие немедленные и серьезные токсические эффекты
Здоровье (острое воздействие) = 2
Воспламеняемость = 0
Физическая опасность = 3
Другие опасности
Результаты оценки PBT и vPvB
PBT: N/A
vPvB: N/A
Вещества
Номер CAS / Название вещества:
10022-31-8 Нитрат бария
Идентификационный номер(а):
Номер ЕС: 233-020-5
Индексный номер: 056-002-00-7
РАЗДЕЛ 4.
 МЕРЫ ПЕРВОЙ ПОМОЩИ
МЕРЫ ПЕРВОЙ ПОМОЩИ Описание мер первой помощи
При вдыхании:
Обеспечить пострадавшего свежим воздухом. Если не дышит, сделайте искусственное дыхание. Держите пациента в тепле.
Немедленно обратитесь к врачу.
При попадании на кожу:
Немедленно промыть водой с мылом; тщательно промыть.
Немедленно обратитесь к врачу.
При попадании в глаза:
Промыть открытые глаза в течение нескольких минут под проточной водой. Проконсультируйтесь с врачом.
При проглатывании:
Обратитесь за медицинской помощью.
Информация для врача
Наиболее важные симптомы и эффекты, как немедленные, так и замедленные
Нет данных
Указание на необходимость немедленной медицинской помощи и специального лечения
Нет данных
РАЗДЕЛ 5. ПРОТИВОПОЖАРНЫЕ МЕРЫ
Средства пожаротушения
Подходящие средства пожаротушения
Продукт не воспламеняется. Используйте меры пожаротушения, подходящие для окружающего огня.
Неподходящие огнетушащие вещества из соображений безопасности
Галоидный огнетушитель
Особые опасности, исходящие от вещества или смеси
Это вещество является окислителем, и теплота его реакции с восстановителями или горючими веществами может вызвать возгорание.
При возгорании этого продукта могут образоваться следующие вещества:
Оксид бария
Оксиды азота (NOx)
Рекомендации для пожарных
Защитное снаряжение:
Надеть автономный респиратор.
Носите полностью защитный непроницаемый костюм.
РАЗДЕЛ 6. МЕРЫ ПРИ СЛУЧАЙНОМ ВЫБРОСЕ
Меры предосторожности для персонала, защитное снаряжение и чрезвычайные меры
Использовать средства индивидуальной защиты. Держите незащищенных людей подальше.
Обеспечьте достаточную вентиляцию.
Меры предосторожности по охране окружающей среды:
Не допускайте попадания материала в окружающую среду без официального разрешения.
Методы и материалы для локализации и очистки:
Утилизировать загрязненный материал как отходы в соответствии с разделом 13.
Обеспечить достаточную вентиляцию.
Предотвращение вторичных опасностей:
Действует как окислитель на органические материалы, такие как дерево, бумага и жиры
Хранить вдали от горючих материалов.
Ссылка на другие разделы
См. Раздел 7 для информации о безопасном обращении
См. Раздел 8 для информации о средствах индивидуальной защиты.
Информацию об утилизации см. в Разделе 13.
РАЗДЕЛ 7. ОБРАЩЕНИЕ И ХРАНЕНИЕ
Обращение
Меры предосторожности для безопасного обращения
Работать под сухим защитным газом.
Держите контейнер плотно закрытым.
Хранить в прохладном, сухом месте в плотно закрытой таре.
Обеспечьте хорошую вентиляцию на рабочем месте.
Информация о защите от взрывов и пожаров:
Вещество/продукт может снизить температуру воспламенения горючих веществ.
Это вещество является окислителем, и теплота его реакции с восстановителями или горючими веществами может вызвать воспламенение.
Условия безопасного хранения, включая любые несовместимости
Требования, которым должны соответствовать складские помещения и емкости:
Особых требований нет.
Информация о хранении в одном общем хранилище:
Хранить вдали от легковоспламеняющихся веществ.
Хранить вдали от восстановителей.
Не хранить вместе с органическими материалами.
Хранить вдали от металлических порошков.
Хранить вдали от воды/влаги.
Хранить вдали от окислителей.
Дополнительная информация об условиях хранения:
Хранить в сухом инертном газе.
Этот продукт гигроскопичен.
Держите контейнер плотно закрытым.
Хранить в прохладном, сухом месте в хорошо закрытых контейнерах.
Беречь от влаги и воды.
Конкретное конечное применение
Данные отсутствуют
РАЗДЕЛ 8. КОНТРОЛЬ ВОЗДЕЙСТВИЯ ВОЗДЕЙСТВИЯ/СРЕДСТВА ИНДИВИДУАЛЬНОЙ ЗАЩИТЫ
Дополнительная информация о конструкции технических систем: не менее 100 футов в минуту.
Параметры контроля
Компоненты с предельными значениями, требующими контроля на рабочем месте:
10022-31-8 Нитрат бария (100,0%)
PEL (США) Длительное значение: 0,5 мг/м 3 как Ba
REL (США) ) Долгосрочное значение: 0,5 мг/м 3 как Ba
TLV (США) Долгосрочное значение: 0,5 мг/м 3 как Ba
EL (Канада) Долговременное значение: 0,5 мг/м 3 как Ba
Дополнительная информация: Нет данных
Средства контроля воздействия
Средства индивидуальной защиты
Соблюдайте стандартные меры защиты и гигиены при обращении с химическими веществами.
Хранить вдали от пищевых продуктов, напитков и кормов.
Немедленно снимите всю испачканную и загрязненную одежду.
Мыть руки перед перерывами и по окончании работы.
Поддерживайте эргономически подходящую рабочую среду.
Дыхательное оборудование:
При наличии высоких концентраций используйте подходящий респиратор.
Рекомендуемое фильтрующее устройство для краткосрочного использования:
Используйте респиратор с картриджами типа P100 (США) или P3 (EN 143) в качестве резерва средств технического контроля. Необходимо провести оценку риска, чтобы определить, подходят ли респираторы для очистки воздуха. Используйте только оборудование, проверенное и одобренное в соответствии с соответствующими государственными стандартами.
Необходимо провести оценку риска, чтобы определить, подходят ли респираторы для очистки воздуха. Используйте только оборудование, проверенное и одобренное в соответствии с соответствующими государственными стандартами.
Защита рук: Непроницаемые перчатки
Осмотрите перчатки перед использованием.
Пригодность перчаток должна определяться как материалом, так и качеством, последнее из которых может варьироваться в зависимости от производителя.
Материал перчаток
Нитриловый каучук, NBR
Время проникновения материала перчаток (в минутах)
480
Толщина перчаток
0,11 мм
Защита глаз: Защитные очки
Защита тела: Защитная рабочая одежда.
РАЗДЕЛ 9. ФИЗИЧЕСКИЕ И ХИМИЧЕСКИЕ СВОЙСТВА
Информация об основных физических и химических свойствах
Внешний вид: Форма:
Различные формы (порошок/чешуйки/кристаллы/гранулы и т.д.)
Цвет: Белый
Запах: Нет данных
Порог запаха: Нет данных.
pH: нет данных
Точка плавления/диапазон плавления: 592 °C (1098 °F) (разл. )
)
Точка/диапазон кипения: данные отсутствуют
Температура сублимации/начало: данные отсутствуют
Воспламеняемость (твердое вещество, газ)
Контакт с горючим материалом может привести к пожару.
Температура воспламенения: Данные отсутствуют
Температура разложения: Данные отсутствуют
Самовоспламенение: Данные отсутствуют.
Опасность взрыва: Данные отсутствуют.
Пределы взрываемости:
Нижний: Данные отсутствуют
Верхний: Данные отсутствуют
Давление паров: Н/Д
Плотность при 20 °C (68 °F): 3,24 г/см 3 (27,038 фунтов/галлон)
Относительный Плотность: Данные отсутствуют.
Плотность пара:
Скорость испарения:
Растворимость в воде (H 2 O): данные отсутствуют
Коэффициент распределения (н-октанол/вода): данные отсутствуют.
Вязкость:
Динамическая: Н/Д
Кинематика: Н/Д
Другая информация
Данные отсутствуют
РАЗДЕЛ 10. СТАБИЛЬНОСТЬ И РЕАКЦИОННАЯ СПОСОБНОСТЬ
Реакционная способность
Может усилить возгорание; окислитель.
Химическая стабильность
Стабилен при соблюдении рекомендуемых условий хранения.
Термическое разложение / условия, которых следует избегать:
Разложение не происходит, если используется и хранится в соответствии со спецификациями.
Возможность опасных реакций
Реагирует с сильными окислителями
Реагирует с восстановителями
Реагирует с легковоспламеняющимися веществами
Условия, которых следует избегать
Данные отсутствуют Металлические порошки
Опасные продукты разложения:
Оксид бария
Оксиды азота
РАЗДЕЛ 11. ТОКСИКОЛОГИЧЕСКАЯ ИНФОРМАЦИЯ
Информация о токсикологическом воздействии
Острая токсичность:
Вреден при вдыхании.
Вреден при проглатывании.
Реестр токсических эффектов химических веществ (RTECS) содержит данные об острой токсичности компонентов этого продукта.
Значения LD/LC50, важные для классификации:
Пероральная LD50 355 мг/кг (крыса)
Раздражение или коррозия кожи: Может вызывать раздражение
Раздражение или коррозия глаз: Может вызывать раздражение
Сенсибилизация: Сенсибилизирующие эффекты неизвестны.
Мутагенность зародышевых клеток: Эффекты неизвестны.
Канцерогенность:
EPA-D: Не классифицируется в отношении канцерогенности для человека: неадекватные доказательства канцерогенности для людей и животных или данные отсутствуют.
ACGIH A4: Не классифицируется как канцероген для человека: Недостаточно данных для классификации агента с точки зрения его канцерогенности для людей и/или животных.
Репродуктивная токсичность: Эффекты неизвестны.
Специфическая токсичность для системы органов-мишеней — многократное воздействие: Эффекты неизвестны.
Специфическая токсичность для системы органов-мишеней — однократное воздействие: Эффекты неизвестны.
Опасность при вдыхании: Эффекты неизвестны.
От подострой до хронической токсичности: Эффекты неизвестны.
Дополнительная токсикологическая информация:
Насколько нам известно, острая и хроническая токсичность этого вещества полностью не известна.
Канцерогенные категории
OSHA-Ca (Управление по безопасности и гигиене труда)
Вещество не указано.
РАЗДЕЛ 12. ЭКОЛОГИЧЕСКАЯ ИНФОРМАЦИЯ
Токсичность
Акватоксичность:
Нет данных
Стойкость и способность к разложению
Нет данных
Способность к биоаккумуляции
Нет данных
Мобильность в почве
Нет данных
Дополнительная экологическая информация:
Не допускать попадания материала в окружающую среду без официальных разрешений.
Не допускайте попадания неразбавленного продукта или больших количеств в грунтовые воды, водотоки или канализационные системы.
Избегайте попадания в окружающую среду.
Результаты оценки PBT и vPvB
PBT: н/д
vPvB: н/д
Другие неблагоприятные воздействия
Данные отсутствуют
РАЗДЕЛ 13. РЕКОМЕНДАЦИИ ПО УТИЛИЗАЦИИ
Методы обработки отходов
Рекомендация
Для обеспечения надлежащей утилизации см. официальные правила .
Неочищенная упаковка:
Рекомендация:
Утилизация должна производиться в соответствии с официальными правилами.
РАЗДЕЛ 14. ИНФОРМАЦИЯ О ТРАНСПОРТИРОВКЕ
Номер ООН
DOT, IMDG, IATA
UN1446
Правильное транспортное наименование ООН
DOT
Нитрат бария
IMDG, IATA
НИТРАТ БАРИЯ
Класс(ы) опасности при транспортировке
DOT
Класс
5.1 Окисляющие вещества.
Маркировка
5.1+6.1
Класс
5.1 (OT2) Окисляющие вещества
Маркировка
5.1+6.1
IMDG, IATA
Класс
5.1 Окисляющие вещества.
Этикетка
5.1+6.1
Группа упаковки
DOT, IMDG, IATA
II
Опасности для окружающей среды:
Н/Д
Особые меры предосторожности для пользователя
Предупреждение: Окисляющие вещества
Транспортировка наливом в соответствии с Приложением II MARPOL73/78 и Кодексом IBC
N/A
Транспортировка/Дополнительная информация:
DOT
Загрязнитель морской среды (DOT):
№
«Модельный регламент ООН»:
UN1446, Нитрат бария, 5.1 (6.1), II
РАЗДЕЛ 15.
 НОРМАТИВНАЯ ИНФОРМАЦИЯ
НОРМАТИВНАЯ ИНФОРМАЦИЯ Правила/законодательные акты по безопасности, охране здоровья и окружающей среды, относящиеся к данному веществу или смеси
Национальные правила
Все компоненты этого продукта перечислены в Агентство по защите Закон о контроле за токсичными веществами Инвентаризация химических веществ.
Все компоненты этого продукта перечислены в Канадском национальном списке веществ (DSL).
Раздел 313 SARA (списки конкретных токсичных химических веществ)
10022-31-8 Нитрат бария
Предложение штата Калифорния 65
Предложение 65 — Химические вещества, вызывающие рак
Вещество не указано в списке.
Prop 65 — Токсичность для развития
Вещество не указано.
Prop 65 — Токсичность для развития у женщин
Вещество не указано.
Предложение 65 — Токсичность для развития, мужчины
Вещество не указано.
Информация об ограничении использования:
Только для использования технически квалифицированными лицами.
Другие правила, ограничения и запретительные положения
Вещество, вызывающее особую озабоченность (SVHC) в соответствии с Регламентом REACH (ЕС) № 1907/2006.
Вещество не указано.
Необходимо соблюдать условия ограничений согласно Статье 67 и Приложению XVII Регламента (ЕС) № 1907/2006 (REACH) для производства, размещения на рынке и использования.
Вещество не указано.
Приложение XIV Регламента REACH (требуется разрешение на использование)
Вещество не указано.
Оценка химической безопасности:
Оценка химической безопасности не проводилась.
РАЗДЕЛ 16. ПРОЧАЯ ИНФОРМАЦИЯ
Паспорт безопасности в соответствии с Регламентом (ЕС) № 1907/2006 (REACH). Приведенная выше информация считается верной, но не претендует на полноту и должна использоваться только в качестве руководства. Информация в этом документе основана на современном уровне наших знаний и применима к продукту с учетом соответствующих мер предосторожности. Это не является гарантией свойств продукта.



 1 кДж/моль.
1 кДж/моль. сторона. Здесь мы должны выделить числовые коэффициенты, чтобы сделать реакцию сбалансированной.
сторона. Здесь мы должны выделить числовые коэффициенты, чтобы сделать реакцию сбалансированной.