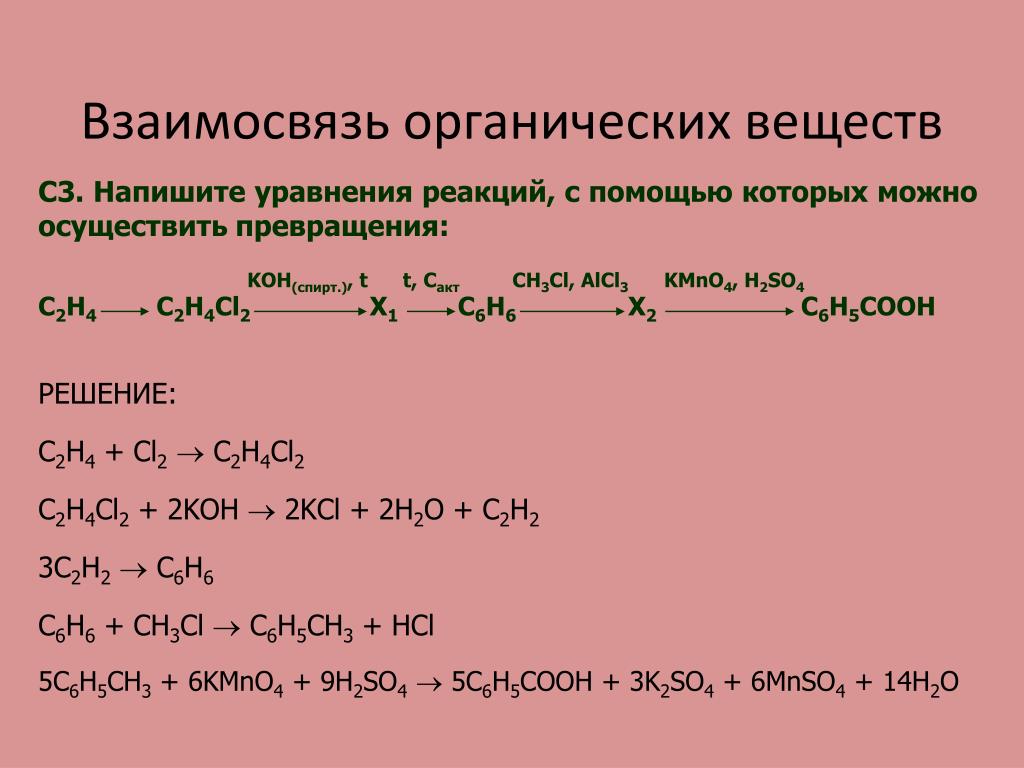
Алкани. Алкени. Алкіни | Тест з хімії – «На Урок»
Запитання 1
Загальна формула насичених вуглеводів:
варіанти відповідей
СnН2nОn;
СnН2n+2;
СnН2n- — 2;
Запитання 2
Записати рівняння горіння метану
варіанти відповідей
CH4 + 2O2 = CO2 + 2H2O
2CH4 + 3O2 = 2CO + 4H2O
CH3· +CL2 → CH3CL + CL·
Запитання 3
Тип зв’язку, характерний для вуглеводнів ряду ацетилену:
варіанти відповідей
подвійний;
потрійний;
одинарний
Запитання 4
Укажіть хімічні реакції, характерні для етилену
варіанти відповідей
взаємодія з галогенами;
взаємодія з галогеноводнями.
горіння;
Запитання 5
Вкажіть агрегатний стан, у якому за звичайних умов перебуває етин:
варіанти відповідей
твердий
рідкий
плазма
газоподібний
Запитання 6
Загальні формули ненасичених вуглеводнів (алкенів і алкінів)
варіанти відповідей
CnH2n+1
CnH2n;
CnH2n+2
CnH2n-2
Запитання 7
Позначте назву алкіну, що містить три атоми Карбону
варіанти відповідей
Пропін
Гексін
Запитання 8
З переліку речовин випишіть формули алкенів: С2Н6, С3Н4, С4Н8, С6Н14, С7Н14, С8Н16, С5Н8, С2Н2.
варіанти відповідей
Запитання 9
Густина парів вуглеводню за киснем дорівнює 2,44. Виведіть його молекулярну формулу, якщо масова частка Карбону в ньому становить 92,31%. Правильна відповідь:
варіанти відповідей
Запитання 10
Вкажіть валентність Карбону в органічних сполуках
варіанти відповідей
Запитання 11
Виберіть ряд, у якому розташовані гомологи метану:
варіанти відповідей
етан, бутан, гексан, гептан
декан, октан, пропен, пентан
метан, пропан, бутан, целофан
метан, етан, циклогексан, нонан
Запитання 12
Речовина, зображена на рис. має назву
варіанти відповідей
2-метилпропан
2-метилпропен
2-метилбутан
Бутан
Запитання 13
Масова частку Карбону і Гідрогену в молекулі гексану становить
варіанти відповідей
в) С — 83,72%, Н — 16,28%
а) С — 24,35%, Н — 35, 65%
б) С — 36%, Н — 64%
г) С — 13,48%, Н — 86,52%
Запитання 14
Вкажіть назву даної речовини за міжнародною номенклатурою
СН3–СН –СН2 – СН2 –СН3
│
СН3
варіанти відповідей
2,6- диметилгексан
2- метилпентан
6- метилгексан
2,5- диметилпентан
Запитання 15
Який тип зв’язку переважає у органічних речовинах ?
варіанти відповідей
Йонний
Металічний
Ковалентний
Водневий
Запитання 16
Вказати коефіцієнт перед киснем у рівнянні реакції горіння етану
варіанти відповідей
Запитання 17
Молекулярна маса алкану становить 86. Вкажіть назву алкану
Вкажіть назву алкану
варіанти відповідей
пентан
гексан
гептан
Запитання 18
Скільки молекул хлору приймають участь у хлоруванні пропану, якщо утворюється речовина C3Н5Cl3?
варіанти відповідей
Запитання 19
Вказати гомолог бутану
варіанти відповідей
C5H10
Запитання 20
Назва запропонованої сполуки CH2=CH-CH2-CH3
варіанти відповідей
2 метилпроп — 1 — ен
бут-1-ен
бут-2-ен
Запитання 21
Алкани вступають в реакції:
варіанти відповідей
Заміщення
Приєднання
Окиснення
Полімерізаціі
Ізомерізації
Запитання 22
З якого вуглеводню починається ряд алканів?
варіанти відповідей
з пропану
з метану
з декану
з пентану
Запитання 23
У молекулі етану між атомами Карбону є:
варіанти відповідей
подвійний зв’язок
потрійний зв’язок
одинарний зв’язок
два потрійних зв’язки
два подвійних зв’язки
Запитання 24
Серед запропонованих речовин вибрати алкени :
варіанти відповідей
ацетилен
пентен
гексен
Запитання 25
Допишіть рівняння реакції та вкажіть суму коефіцієнтів
С6Н12 + О2 →:
варіанти відповідей
Запитання 26
Для алкенів характерні реакції:
варіанти відповідей
приєднання, окиснення, полімеризації
приєднання, окиснення, поліконденсації
заміщення, окиснення, полімеризації
заміщення, окиснення ,поліконденсації
Запитання 27
Укажіть рядок, що містить лише формули алкінів:
варіанти відповідей
С3Н4, С4Н6, С5Н8
С4Н8, С4Н10, С4Н6
С6Н10, С6Н12, С6Н14
С3Н8, С3Н6, С2Н6
Запитання 28
Позначте тип реакції C2H6 + Cl2 → C2H5Cl + HCl
варіанти відповідей
заміщення
обміну
приєднання
розкладу
Створюйте онлайн-тести
для контролю знань і залучення учнів
до активної роботи у класі та вдома
Створити тест
Натисніть «Подобається», щоб слідкувати за оновленнями на Facebook
Алканы
Главная \ Подготовка к ЕГЭ \ Химия \ Алканы
Алканы
Общая характеристика
Алканы — предельные углеводороды. Это значит, что все связи одинарные (предельные).
Это значит, что все связи одинарные (предельные).
Напишем гомологический ряд алканов (формулы в нем соответствуют общей формуле алканов Cnh3n+2, таким образом, зная количество атомов углерода в молекуле можно посчитать количество атомов водорода).
Метан — СН4
Этан — С2Н6
Пропан — С3Н8
Бутан — С4Н10
Пентан — С5Н12
Гексан — С6Н14
Гептан — С7Н16
Октан — С8Н18
Нонан — С9Н20
Декан — С10Н22
Здесь нужно обратить внимание на окончание -ан (оно, как и в названии класса, обозначает предельность). Каждому алкану соответствует радикал:
Метил — СН3-
Этил — С2Н5-
Пропил — С3Н7-
Бутил — С4Н9-
Пентил — С5Н11-
Гексил — С6Н13-
Гептил — С7Н15-
Октил — С8Н17-
Нонил — С9Н19-
Декил — С10Н21-
Получение алканов
Получение метана
1. Из простых веществ
Из простых веществ
С + 2Н2 →(t, kat) Ch5
2. Из карбида алюминия
Al4C3 + h3O → Al(OH)3↓ + Ch5↑
3. В лаборатории из безводного гидроксида натрия с ледяной уксусной кислотой
2NaOH + Ch4COOH →(t) Na2CO3 + h3O + Ch5↑
4. Сплавление ацетата натрия с гидроксидом натрия
Ch4COONa + NaOH → Ch5↑ + Na2CO3
Получение гомологов метана
1. Реакция Вюрца
Ch5 + Cl2 →(hν) Ch4Cl + HCl
2Ch4Cl + 2Na → 2NaCl + Ch4-Ch4
При помощи этой реакции лучше не получать углеводороды с нечетным количеством атомов углерода, так как в этом случае получается смесь продуктов.
Пример: 3Ch4Cl + 3C2H5Cl + 6Na → Ch4-Ch4 + C2H5-Ch4 + C2H5-C2H5 + 6NaCl
2. Каталитическое гидрирование галоген-алканов
Ch4Ch3Cl + h3 →(Pd) Ch4Ch4 + HCl
3. Восстановление йодалканов при нагревании с йодоводородной кислотой:
Ch4Ch3I + HI →(t) Ch4Ch4 + I2↓
4. При восстановлении спиртов
Ch4OH →(LiAlh5) Ch4Ch4 + h3O
5. Реакция Кижнера-Вольфа
Реакция Кижнера-Вольфа
Ch3 — C(O) — Ch4 + N2h5(изб) →(присутствие KOH) Ch4-Ch3-Ch4 + N2↑ + h3O
6. Гидрирование непредельных углеводородов
С2Н4 + Н2 → С2Н6
С2Н2 + 2Н2 → С2Н6
7. Синтез Фишера-Тропша
nCO + (2n+1)h3 → Cnh3n+2 + nh3O
8. Синтез Кольбе
2RCOO‾ → 2CO2 + R-R + 2e
Реакцию проводят в водных, этанольных или метанольных электролитах на гладких анодах из платины или анодах из непористого угля при температуре 20-50С.
Химические свойства алканов
1. Галогенирование
Ch5 + Cl2 →(hν) Ch4Cl + HCl
Ch4Cl + Cl2 →(hv) Ch3Cl2 + HCl
Ch3Cl2 + Cl2 →(hv) CHCl3 + HCl
CHCl3 + Cl2 →(hv) CCl4 + HCl
Механизм реакции
1. Инициация цепи
Cl2 →(hv) 2Cl°
2. Рост цепи
Cl° + Ch5 → HCl + Ch4°
Ch4° + Cl2 → Ch4Cl + Cl°
Эти реакции идут пока не произойдет обрыв цепи.
3. Обрыв цепи
Cl° + Cl° → Cl2
Ch4° + Ch4° → C2H6
Ch4° + Cl° → Ch4Cl
Суммарное уравнение: Ch5 + Cl2 →(hv) Ch4Cl + HCl
2.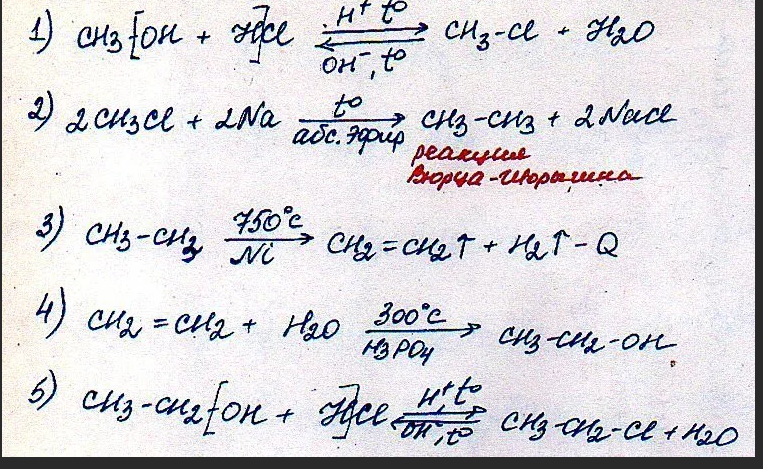 Реакция нитрования (реакция Коновалова)
Реакция нитрования (реакция Коновалова)
Ch5 + HNO3 →(140C, p) Ch4 — NO2 + h3O
3. Реакция изомеризации
Ch4Ch3Ch3Ch4 →(AlCl3, 100C) Ch4CH(Ch4)Ch4
4. Крекинг алканов
C10h32 →(t, kat) C5h22 + C5h20
2Ch5 →(t, kat) C2h3 + 3h3
C2H6 →(t, kat) C2h3 + 2h3
5. Сульфохлорирование (реакция Рида)
Ch5 →(SO2, Cl2, hv) Ch4 — SO2Cl + HCl
6. Окисление
а) Кислородом воздуха
Ch5 + 2O2 → CO2 + 2h3O
б) Каталитическое окисление
2Ch5 + O2 → 2Ch4OH
Ch5 + O2 → HCHO + h3O
2Ch5 + 3O2 → 2HCOOH + 2h3O
7. Термическое разложение алканов
Ch5 →(t) C + 2h3
C2H6 →(t) 2C + 3h3
8. Дегидрирование
Ch4-Ch4 → Ch3=Ch3 + h3
Ch4-Ch3-Ch3-Ch4 → Ch3=CH-CH=Ch3 + 2h3
Ch4-Ch3-Ch3-Ch4 → Ch3=C-CH-Ch4 + 2h3
9. Конверсия метана
Ch5 + h3O →(Ni) CO + 3h3 (CO+h3 — синтез-газ)
Когда этан, C_2H_6, реагирует с газообразным хлором, основным продуктом является C_2H_5Cl, но образуются небольшие количества C_2H_4Cl_2.
 Каков процент выхода C_2H_5Cl, если реакция 125 г этана с 255 г газообразного хлора дает 206 г C2H_5Cl?
Каков процент выхода C_2H_5Cl, если реакция 125 г этана с 255 г газообразного хлора дает 206 г C2H_5Cl?Здесь важно сосредоточиться исключительно на реакции, в результате которой образуется хлорэтан , #»C»_2″H»_5″Cl»#, и игнорировать реакцию, в результате которой образуется дихлорэтан , #»C»_2″H» _4″Cl»#, побочный продукт реакции.
Начните с составления сбалансированного химического уравнения для хлорирование этана
#»C»_2″H»_text(6(g)) + «Cl»_text(2(g]) -> «C»_2″H»_5″Cl»_text((g]) + «HCl» _текст((г])#
Следующим шагом будет использование молярного отношения #1:1# , которое существует между этаном и газообразным хлором, чтобы определить, имеете ли вы дело с ограничивающим реагентом .
Итак, вы смешиваете #»125 г»# этана с #»255 г»# газообразного хлора. Преобразуйте массы двух реагентов в моля , используя их соответствующие молярные массы
#125 цвет(красный)(отменить(цвет(черный)(«g»))) * («1 моль C»_2″H»_6)/(30.
07цвет(красный)(отменить(цвет(черный)(» г»)))) = «4,157 моль C»_2″H»_6# #255цвет(красный)(отменить(цвет(черный)(«g»))) * «1 моль Cl»_2/(70,91цвет(красный)(отменить(цвет(черный)(«g»)))) = «3,596 моль Cl»_2#
Реакция будет всегда потреблять равное количество молей каждого реагента, что означает, что газообразный хлор будет действовать как ограничивающий реагент здесь.
Точнее, из #4.157# молей этана только #3.596# будут реально участвовать в реакции. Остальные будут сверх .
Теперь у вас также есть мольное соотношение #1:1# между реагентами и хлорэтаном. Это означает, что в результате реакции образуется #3,596# молей хлорэтана, поскольку именно столько молей каждого реагента принимает участие в реакции.
Используйте молярную массу хлорэтана, чтобы определить, сколько граммов будет содержать это количество молей
#3,596 цвет(красный)(отменить(цвет(черный)(«моли C»_2″H»_5″Cl»))) * «64,51 г»/(1цвет(красный)(отменить(цвет(черный)(» моль C»_2″H»_5″Cl»)))) = «231,98 г»#
Итак, что это вам говорит?
В теории реакция должна дать #»231,98 г»# хлорэтана. Однако вы знаете, что в результате реакции образовалось только #»206 г»# хлорэтана.
Однако вы знаете, что в результате реакции образовалось только #»206 г»# хлорэтана.
Разница между теоретическим выходом хлорэтана, который получается, когда #100%# реагентов превращаются в хлорэтан и хлористый водород, и фактический выход , который получается при производстве дихлорэтана , будет представлять -процентный выход хлорэтана.
#color(blue)(«% yield» = «что вы на самом деле получите»/»что вы должны получить» xx 100)#
В вашем случае у вас будет
#»% доходности» = (206 цвет(красный)(отмена(цвет(черный)(«g»))))/(231.98цвет(красный)(отмена(цвет(черный)(«g»)))) xx 100 = цвет (зеленый) («88,8 %»)#
C2H6 + Cl2 = HCl + C2H5Cl
| Поиск |
этан + хлор = хлороводород + |
Содержание
Нажмите, чтобы увидеть более подробную информацию и рассчитать вес/моль >>
| png» substance-weight=»30.0690″> C 2 H 6 | + | Класс 2 900 90 | → | HCl | + | C 2 H 5 Cl | |
| этан | хлор | 9009 0 | хлористый водород | ||||
| (ки) | (хи) | (лонг) | (ки) | ||||
| (хонг мау) | (хонг мау) | 90 089(Хонг Мау) | |||||
| 1 | 1 | 1 | 1 | Hệ số | |||
| Нгуен — Фантой Кхой (г/моль) 900 90 | |||||||
| Сомол | |||||||
| 9 0158 | Khối lượng (g) |
Реклама
Дополнительная информация об уравнении C
2 H 6 + Cl 2 → HCl + C 2 H 5 ClУсловия реакции реакции C2H6 (этан) s с Cl2 (хлор) ?
Для этого химического уравнения не найдено информации
Объяснение: идеальные условия окружающей среды для реакции, такие как температура, давление, катализаторы и растворитель.