Гидроксид кальция — хим. свойства и получение CHEMEGE.RU
Гидроксид кальция Ca(OH)2 — неорганическое соединение. Белый, при нагревании разлагается без плавления. Проявляет основные свойства.
Относительная молекулярная масса Mr = 74,09; относительная плотность для тв. и ж. состояния d = 2,08.
1. Гидроксид кальция получают в результате взаимодействия гидрида кальция и воды, на выходе образуется водород и гидроксид кальция:
CaH2 + 2H2O = Ca(OH)2↓ + 2H2↑
2. При взаимодействии кальция с водой при комнатной температуре образуется гидроксид кальция и водород:
Ca + 2H2O = Ca(OH)2↓ + H2↑
3. Оксид кальция при взаимодействии с водой при комнатой температуре образует гидроксид кальция:
Оксид кальция при взаимодействии с водой при комнатой температуре образует гидроксид кальция:
CaO + H2O = Ca(OH)2
Качественная реакция на гидроксид кальция — окрашивание фенолфталеина в малиновый цвет.
1. Гидроксид кальция вступает в реакцию с простыми веществами:
1.1. Холодный гидроксид кальция (суспензия) взаимодействует с хлором и образует гипохлорит кальция, хлорид кальция и воду:
2Ca(OH)2 + 2Cl2 = Ca(ClO)2 + CaCl2 + 2H2O,
если с хлором реагирует горячий гидроксид кальция (суспензия), то в итоге образуется хлорат кальция, хлорид кальция и вода:
Ca(OH)2 + 6Cl2 = Ca(ClO3)2 + 5CaCl2 + 6H2O
2. Гидроксид кальция взаимодействует со сложными веществами:
Гидроксид кальция взаимодействует со сложными веществами:
2.1. Гидроксид кальция реагирует с кислотами:
2.1.1. В результате реакции между гидроксидом кальция и разбавленной соляной кислотой образуется хлорид кальция и вода:
Ca(OH)2 + 2HCl = CaCl2 + 2H2O
2.1.2. Гидроксид кальция взаимодействует с серной кислотой, образуя сульфат кальция и воду:
Ca(OH)2 + H2SO4 = CaSO4↓ + 2H2O
2.1.3. В результате взаимодействия гидроксида кальция и разбавленной фосфорной кислоты образуется фосфат кальция и вода:
3Ca(OH)2 + 2H3PO4 = Ca3(PO4)2↓ + 6H2O,
если с гидроксидом кальция будет взаимодействовать концентрированная фосфорная кислота, то в результате реакции образуется гидрофосфат кальция и вода:
Ca(OH)2 + H3PO4 = CaHPO4↓ + 2H2O
2. 1.4. С гидроксидом кальция реагирует сероводородная кислота, образуя гидросульфид кальция и воду:
1.4. С гидроксидом кальция реагирует сероводородная кислота, образуя гидросульфид кальция и воду:
Ca(OH)2 + 2H2S = Ca(HS)2 + 2H2O
2.2. Гидроксид кальция взаимодействует с оксидами:
2.2.1. В результате взаимодействия гидроксида кальция и углекислого газа образуется карбонат кальция и вода:
Ca(OH)2 + СO2 = CaСO3 + H2O,
если с углекислым газом реагирует карбонат кальция в виде суспензии, то образуется гидрокарбонат кальция в растворе:
Ca(OH)2 + 2СO2 = Ca(HСO3)2
2.2.2. Гидроксид кальция вступает в реакцию с оксидом серы (IV), образуя на выходе сульфит кальция и воду:
Ca(OH)2 + SO2 = CaSO3 + H2O,
если с оксидом серы (IV) взаимодействует гидроксид кальция в виде суспензии, то на выходе происходит образование гидросульфита кальция в растворе:
Ca(OH)2 + 2SO2 = Ca(HSO3)2
2. 4. Гидроксид кальция реагирует с солями:
4. Гидроксид кальция реагирует с солями:
2.4.1. Гидроксид кальция (суспензия) взаимодействует с холодным гипохлоритом натрия, образуя гипохлорит кальция и гидроксид натрия:
Ca(OH)2 + 2NaClO = Ca(ClO)2↓ + 2NaOH
2.5. Гидроксид кальция взаимодействует с пероксидом водорода при 40 — 50º С с образованием пероксида кальция и воды:
Ca(OH)2 + H2O2 = CaO2↓ + 2H2O
3. Гидроксид кальция разлагается при температуре 520 — 580º С, образуя на выходе оксид кальция и воду:
Ca(OH)2 = CaO + H2O
Понравилось это:
Нравится Загрузка.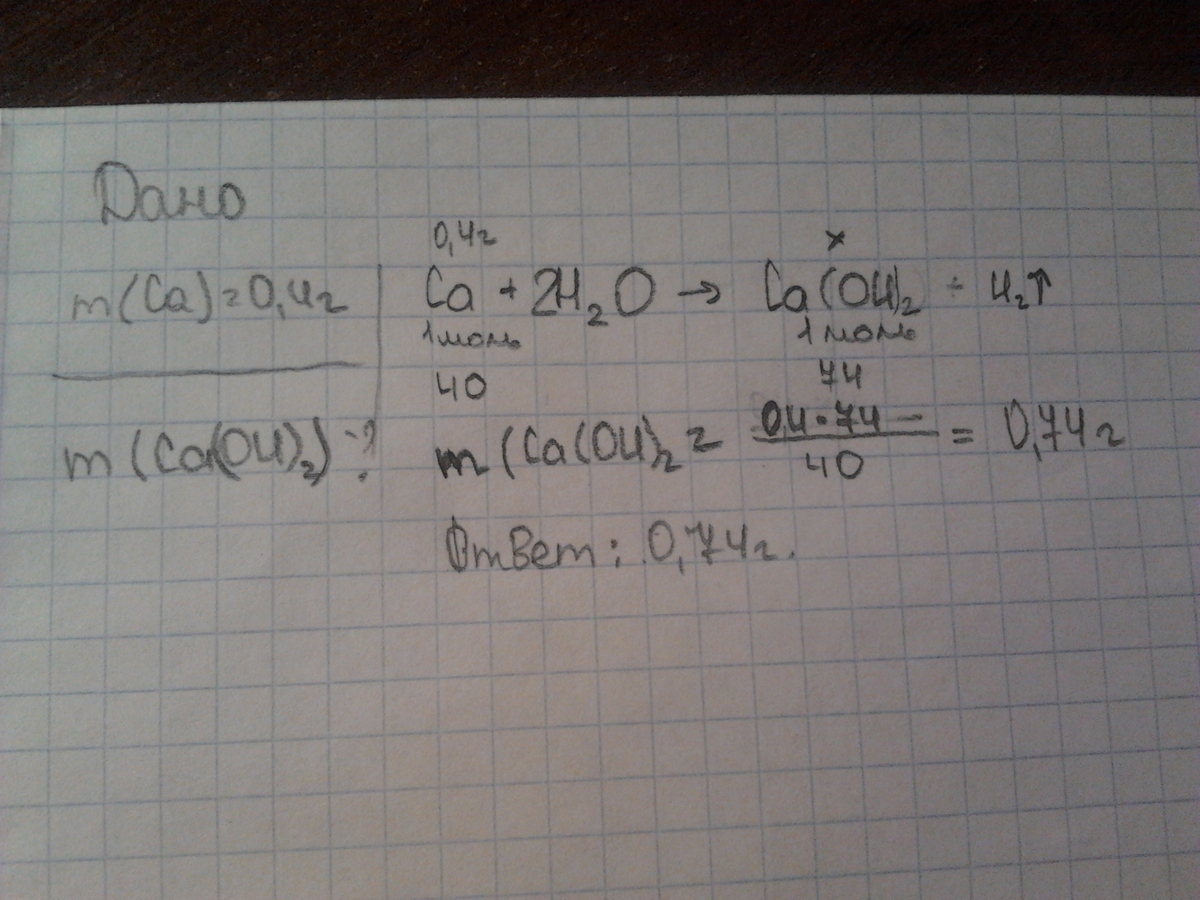 ..
..
Ответы | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||
|
|
| |||||||||||||||||||||||||||||||||||||||||||||||||||
Посмотреть всех экспертов из раздела Учеба и наука
| Похожие вопросы |
В треугольнике ABC известно, что AC=6, BC=8, угол C равен 90°.

