| ||||||||||||
| ||||||||||||
По мнению автора лучший ответ отсутствует.
|
|
| |||||||||||||||||||||||||||||||||||||||||||||||||||
Посмотреть всех экспертов из раздела Учеба и наука > Химия
| Похожие вопросы |
Структурная формула всех изомеров С7Н16
какие металлы могут вытеснить водород из разбавленной серной кислоты. напишите соответсвующие уравнения а)Zn,б)Fe,в)Cu,г)AL,д)Ag,е)Mg,ж)Hg,з)Ca,и)Au
напишите соответсвующие уравнения а)Zn,б)Fe,в)Cu,г)AL,д)Ag,е)Mg,ж)Hg,з)Ca,и)Au
h3S + h3SO4 = SO2 + S + h3O МОЖНО ОВР
Решено
3адача. Вывести молекулярную формулу углеводорода по данным: массовая доля углерода — 85,7%,, относительная плотность вещества по водороду равна 28.
составьте уравнения реакций, укажите условия, с помощью которых можно осуществить следующие превращения веществ:
Пользуйтесь нашим приложением
Карбид кальция: формула, реакция с водой (гидролиз), получение и хранение
Карбид кальция имеет резкий чесночный запах и сильно поглощает воду. Его плотность повышается с увеличением количества примесей и изменяется в пределах 2,22-2,8 г/см
Содержание
- История получения
- Получение
- Гидролиз
- Количество воды необходимое для реакции
- Параметры влияющие на скорость реакции
- Карбид кальция плюс азот
- Карбид кальция плюс водород
- Хранение
- Карбид кальция
- химическое соединение кальция с углеродом, в чистом виде представляющее собой белое кристаллическое вещество.
 Химическая формула — СаС2
Химическая формула — СаС2
- Технический карбид кальция
- твердый кускообразный материал, цвет излома которого меняется в зависимости от содержания карбида кальция. При содержании 60-75% СаС2 — имеет излом серого цвета, переходящий в фиолетовый при более высоком содержании CaC 2. Высокопроцентный (80% СаС2 и выше) — имеет окраску от светло-коричневого до голубовато-черного.
История получения карбида кальция
Карбид кальция был получен случайно в 1862 г. Немецкий химик Фридрих Вёлер (Friedrich W?hler) при попытке выделения металлического кальция из извести (карбоната кальция СаСО3) путем длительного прокаливания смеси, состоящей из извести и угля, получил массу сероватого цвета, в которой не обнаружил признаков металла. Как результат неудавшегося эксперимента он выбросил эту массу на свалку во дворе. Во время дождя лаборант заметил выделение какого-то газа из выброшенной массы. Это заинтересовало Фридриха Вёлера, он провел анализ газа и установил, что это ацетилен (С2Н2), ранее открытый Эдмундом Дэви (Edmund Davy), в 1836 г.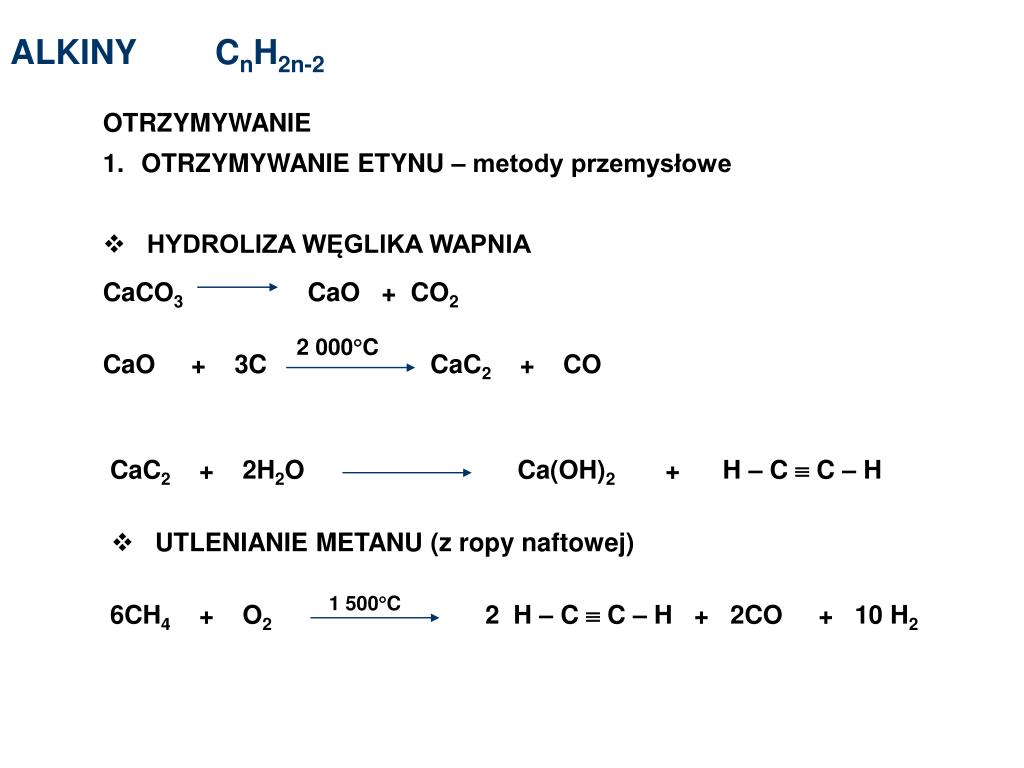
Однако имя этому газу присвоил французский химик Пьер Эжен Марселен Бертло (Marcellin Berthelot) после того, как в 1863 году получил ацетилен, пропуская водород над раскалёнными электрической дугой графитовыми электродами.
Томас Уилсон (Thomas Leopold «Carbide» Willson) в 1888 году и Фердинанд Фредерик Анри Муассан (Ferdinand Frederic Henri Moissan) в 1892 независимо друг от друга открыли метод получения карбида кальция в дуговой электропечи, что послужило толчком для дальнейшего развития промышленного получения технического карбида кальция.
В России первые заводы по изготовлению карбида кальция были построены акционерным обществом «Перун» в 1908 г. в Земковицах, а в 1910 г. в Петербурге. В 1914 г. на этом заводе работали две карбидные печи мощностью по 500 кВт и две печи по 900 кВт.
В 1917 г. при Макеевском металлургическом заводе была построена установка с электропечью мощностью 1800 кВт. Почти одновременно на заводе в Баку для нужд нефтепромышленности и на Аллавердском медеплавильном заводе также были пущены карбидные печи.
В 1930 г. был построен и пущен первый большой карбидный завод в Растяпино (ныне г. Дзержинск Нижегородской области). На этом заводе карбид кальция впервые стал выпускаться не только как товарный продукт, но и для получения цианамида кальция.
Получение карбида кальция
Технический карбид кальция получают в результате взаимодействия обожженной извести (СаО) с коксом (3С) или антрацитом в электрических печах при температуре 1900-2300°С. Шихту, состоящую из смеси кокса или антрацита и извести в определенной пропорции, загружают в электропечь, шихта расплавляется, при этом происходит эндотермическая химическая реакция (с поглощением тепла) по формуле:
СаО+3С = СаС2+СО -108 ккал/моль
Таким образом, для получения 1 т карбида кальция требуется:
- 4000 кг извести
- 600 кг кокса
- 1965 кВт·ч электроэнергии
Однако вследствие значительных потерь энергии в карбидных печах практически для получения 1 т технического карбида кальция расходуется от 2800 до 3700 кВт·ч в зависимости от мощности печи.
Расплавленный карбид кальция сливают из печи в специальные изложницы, в которых он остывает и затвердевает. После затвердевания его дробят в щековых дробилках и сортируют в решетчатых барабанах на куски различной величины от 2 до 80 мм.
Выход кусков различных размеров при дроблении приведен ниже:
| Грануляция, мм | 25-80 | 15-25 | 8-15 | 2-8 | до 2 |
|---|---|---|---|---|---|
| Выход, % | 66-80 | 8-10 | 6-14 | 4,5-6,5 | 1,5-3,0 |
Товарным карбидом кальция считается грануляцией от 2 до 100 мм. Карбидная пыль, получающаяся при дроблении, непригодна для нормальных ацетиленовых генераторов из-за слишком энергической реакции с водой, перегрева и опасности взрыва.
Зависимость удельного веса технического карбида кальция от содержания в нем СаС2, приведена в таблице ниже:
| Содержание СаС2 в техническом карбиде, % | 80 | 75 | 70 | 65 | 60 | 55 |
|---|---|---|---|---|---|---|
| Удельный вес технического карбида | 2,32 | 2,37 | 2,41 | 2. 45 45 | 2,49 | 2,53 |
Технический карбид кальция, получаемый в электропечах, содержит ряд примесей, попадающих в него из исходных материалов, которыми пользуются при его производстве. Средний химический состав применяемого для сварки:
| Компонент | Содержание, % (по массе) |
|---|---|
| Карбид кальция (СаС2) | 72,5 |
| Известь (СаО) | 17,3 |
| Окись магния (MgO) | 0,4 |
| Окись железа (Fe2O3) и окись алюминия (Al2O3) | 2,5 |
| Окись кремния (SiO2) | 2,0 |
| Сера (S) | 0,3 |
| Углерод (С) | 1,0 |
| Другие примеси | 4,0 |
Как видно из приведенного состава, основной примесью является известь.
Примеси, содержащиеся в исходных материалах, применяемых для производства, ухудшают его качество. Особенно вредными примесями являются фосфор и сера, которые переходят в карбид кальция в виде фосфористых и сернистых соединений кальция, а при разложении карбида попадают в ацетилен в виде фосфористого водорода и сероводорода.
Гидролиз или карбид кальция плюс вода
При взаимодействии карбида кальция и воды происходит реакция, которая называется гидролиз. Когда-то гидролиз карбида кальция был основным промышленным способом для получения ацетилена — горючего газа, применяемого при газовой сварке и газовой резке. Еще об одном способе получения можно узнать из статьи о получении ацетилена.
При взаимодействии карбида кальция (CaC2) с водой (H2O) получается газ — ацетилен (C2H2) и гашеная известь (Ca(OH)2), являющаяся отходом. Химическая активность карбида кальция по отношению к воде столь велика, что он разлагается даже кристаллизационной водой, содержащейся в солях.
Экзотермическая реакция (т.е. с выделением тепла) взаимодействия карбида кальция с водой протекает бурно по уравнению:
CaC2+2H2O=C2H2+Ca(OH)2 +30,4 ккал/моль
Тепловой эффект реакции слагается из тепла, выделяемого при взаимодействии с водой карбида кальция и негашеной извести. Взаимодействие извести с водой протекает по уравнению:
СаО+H2O = Ca(OH)2 +15,2 ккал/моль
- Выход ацетилена
- объем ацетилена в литрах, выделяемый при разложении 1 кг карбида, приведенный к 20° и 760 мм рт. ст.
Для разложения 1 кг химически чистого карбида кальция теоретически необходимо 0,562 кг воды, при этом получается 0,406 кг ацетилена (285 л) и 1,156 кг гашеной извести.
Значительный тепловой эффект реакции карбида кальция и опасность перегрева ацетилена заставляют вести процесс с большим избытком воды для охлаждения. Это делает процесс более безопасным. Температура выходящего из генератора ацетилена при этом превышает температуру окружающей среды всего на 10-15°С.
Количество воды необходимое для реакции с карбидом кальция
Минимальное количество воды, необходимое для охлаждения при реакции 1 кг карбида кальция, может быть рассчитано следующим образом.
При разложении 1 кг 70%-го карбида кальция образуется 0,284 кг ацетилена и 1,127 кг гидрата окиси кальция т.е. гашеной извести (принимая содержание окиси кальция в карбиде кальция равным 24%).
Принимаем, что начальная температура воды равна 15° С, а температура в генераторе во время работы равна 60° С. Уравнение теплового баланса для 1 кг карбида кальция выражается следующим образом:
q=q1+q2+q3+q4+q5
где q — количество тепла, выделяющееся при разложении 1 кг 70%-го карбида кальция, равное 397 ккал/кг
q1 — количество тепла, затрачиваемое на нагревание получаемой гашеной извести с 15 до 60°С:
q1= 1,127?(60-15)-0,23= 11,7 ккал
0,23 — средняя теплоемкость гидрата окиси кальция в ккал/кг
q2 — количество тепла, затрачиваемое на нагревание получаемого ацетилена с 15 до 60° С:
q2=0,284?(60-15)-0,336 = 4,3 ккал
0,336 — средняя теплоемкость 1 кг ацетилена в ккал в указанном интервале температур
q3 — тепло, затрачиваемое на испарение воды в количестве 0,034 кг (при 60° С содержание водяных паров, насыщающих ацетилен, полученный из 1 кг карбида кальция, равно 34 г) скрытая теплота парообразования воды — 539 ккал/кг
q3 = 0,034?539+0,034?1?(60-15) -19,9 ккал
q4 — потеря тепла в окружающую среду и на нагревание стенок генератора, она составляет примерно 7% от общего количества выделяющегося тепла:
q4=397?7/100=27,8 ккал
q5 — количество тепла, расходуемое на нагревание воды до температуры 60° С:
q5=q?(q1+q2+q3+q4)=397?(11,7+4,3+19,9+27,8) = 336,3 ккал
Искомый минимальный безопасный объем воды равен:
V=q5/(60-15)?1=336,3/45?7,5 л
Так как 1 м3 ацетилена при абсолютном давлении 1 кгс/мм2 и 20°С весит 1,09 кг, следовательно, из 1 кг химически чистого карбида кальция теоретически можно получить 0,406/1,09 = 0,3725 м3, или 372,5 л ацетилена.
Как уже говорилось выше, технический карбид кальция обычно содержит не более 70-80% CaC2. Поэтому из 1 кг технического карбида кальция можно получить от 230 до 280 л ацетилена.
Если учесть потери ацетилена на растворение в воде и продувку ацетиленового генератора, то для получения 1 м3 (1000 дм3) ацетилена практически приходится расходовать 4,3-4,5 кг карбида кальция. Более точные данные о фактическом выходе ацетилена в зависимости от количества примесей (сорта) и размеров «кусков» (грануляции) указаны в ГОСТ 1460.
Параметры влияющие на скорость реакции с водой
Чем меньше размеры кусков, тем быстрее происходит реакция карбида кальция с водой.
Карбид кальция размером 50?80 мм разлагается полностью в течение 13 мин, а размером 8?15 мм — в течение 6,5 мин.
При величине кусков менее 2 мм карбид кальция считается отходом и называется карбидной пылью. Карбидная пыль разлагается практически мгновенно. При взаимодействии с водой реакция карбидной пыли происходит на поверхности воды и выделяемое тепло не может быть быстро отведено. Это приводит к повышению температуры в зоне реакции и перегреву частиц карбида и выделяющегося ацетилена. При этом особенно опасно присутствие воздуха, так как быстро достигается температура воспламенения ацетилено-воздушной смеси. Поэтому карбидную пыль нельзя применять в обычных ацетиленовых генераторах, рассчитанных для работы на кусковом карбиде кальция, так как это может вызвать взрыв ацетилена в генераторе. Для разложения карбидной пыли применяют генераторы специальной конструкции.
Это приводит к повышению температуры в зоне реакции и перегреву частиц карбида и выделяющегося ацетилена. При этом особенно опасно присутствие воздуха, так как быстро достигается температура воспламенения ацетилено-воздушной смеси. Поэтому карбидную пыль нельзя применять в обычных ацетиленовых генераторах, рассчитанных для работы на кусковом карбиде кальция, так как это может вызвать взрыв ацетилена в генераторе. Для разложения карбидной пыли применяют генераторы специальной конструкции.
Чем выше температура воды, тем быстрее идет реакция карбида кальция. Если вода сильно загрязнена гашеной известью, образующейся при реакции карбида кальция, то реакция замедляется.
При разложении неподвижного карбида кальция в недостаточном количестве воды куски его могут покрываться коркой гашеной извести и сильно перегреваться, при этом может иметь место реакция:
СаС2+Ca(ОН)2 = C2H2+2СаО
В этом случае реакция карбида кальция происходит за счет отнятия влаги, содержащейся в гашеной извести. В результате повышается плотность корки, что приводит к еще большему перегреву. Поэтому непрерывное удаление извести из зоны реакции имеет большое значение, так как перегрев может привести к взрыву ацетилено-воздушной смеси или вызвать взрывчатый распад ацетилена.
В результате повышается плотность корки, что приводит к еще большему перегреву. Поэтому непрерывное удаление извести из зоны реакции имеет большое значение, так как перегрев может привести к взрыву ацетилено-воздушной смеси или вызвать взрывчатый распад ацетилена.
Если производить разложение одинаковых количеств карбида кальция различными постепенно уменьшающимися количествами воды, то температура получаемой смеси ацетилен — водяной пар будет соответственно повышаться. При температуре около 90°С почти все тепло (за исключением тепла, затрачиваемого на нагревание ацетилена и карбидного ила) расходуется на образование водяного пара. Эти условия реакции соответствуют процессу, при котором получается сухой гидрат окиси кальция, поскольку вся вводимая в реакцию вода расходуется на разложение карбида и образование водяного пара.
При погружении карбида кальция в воду процесс разложения протекает также весьма неравномерно: вначале реакция идет очень активно с бурным выделением ацетилена, а затем скорость реакции уменьшается. Это объясняется уменьшением поверхности кусков и тем, что они покрываются коркой извести, препятствующей свободному доступу воды.
Это объясняется уменьшением поверхности кусков и тем, что они покрываются коркой извести, препятствующей свободному доступу воды.
При перемешивании воды с находящимся в ней карбидом кальция реакция происходит быстрее и равномернее.
Скорость реакции карбида кальция в воде зависит от чистоты карбида кальция и поверхности соприкосновения кусков карбида кальция с водой.
Скорость реакции карбида кальция в воде является весьма важным элементом, характеризующим качество карбида кальция. Для практических целей пользуются понятием продолжительности разложения.
Продолжительностью разложения считают время, в течение которого выделяется 98% от всего количества ацетилена, который может быть выделенным из карбида кальция, так как остаток разлагается очень медленно и не характеризует процесс разложения применительно к условиям работы ацетиленовых генераторов.
В таблице ниже приведены экспериментальные данные о продолжительности разложения карбида кальция в зависимости от размеров его кусков.
| Размеры кусков, мм | Пыль | 2/4 | 5/8 | 8/15 | 15/25 | 25/50 | 50/80 |
|---|---|---|---|---|---|---|---|
| Продолжительность разложения, мин. | Несколько секунд | 1,17 | 1,65 | 1,82 | 4,23 | 13,5 | 16,6 |
Следует, оговорить, что данные таблицы характеризуют лишь те образцы карбида кальция, с которыми были проведены опыты. Практически могут иметь место значительные отклонения, главным образом в сторону уменьшения скорости реакции.
Скорость разложения в значительной степени зависит от выхода ацетилена из карбида кальция. Чем ниже выход, тем меньше скорость реакции.
На диаграмме ниже показаны изменения в скорости разложения карбида кальция двух сортов с одинаковыми размерами кусков (25/50).
При разложении 1 кг карбида кальция с выходом ацетилена 263 л/кг за первые 3 минуты выделяется 220 л ацетилена, а соответственно при выходе 226 л/кг — только 150 л.
Карбид кальция плюс азот
При температуре 1000°С карбид кальция, взаимодействуя с азотом, образует цианамид кальция. Уравнение реакции имеет следующий вид:
CaC2+N2=CaCN2+C
Эта реакция используется для промышленного производства цианамида кальция. Цианамид кальция применяется в качестве удобрения и как исходный продукт для получения цианидов.
Карбид кальция плюс водород
С водородом карбид кальция вступает в реакцию при температуре выше 2200°С с образованием ацетилена и металлического кальция. При высокой температуре карбид кальция восстанавливает большинство окислов металлов.
Хранение карбида кальция
После того как был получен карбид кальция хранение его допускается в специальных герметичных барабанах и специально оборудованных помещениях, но все это уже рассмотрено в статье о том, где и как хранить карбид кальция.
Регистрационное досье — ECHA
Реакция карбида кальция с водой
Химическая реакция между карбидом кальция и водой дает кальций дигидроксид (Ca(OH)2, CAS 1305-62-0) и газообразный ацетилен (C2h3, CAS 74-86-2), сопровождающееся выделением тепла:
CaC2 + 2h3O → Ca(OH)2 + C2h3 (H=-130 кДж/моль) Уравнение 1
Различные применения карбида кальция
Производство ацетилена является важным применением карбида кальция. В
В начале двадцатого века CaC2 широко использовался в качестве источника света в таких
называемые переносными «карбидными лампами» в горнодобывающей промышленности. Корпус этих ламп
образован двумя контейнерами, которые расположены вертикально. Вода
капает из верхней емкости в нижнюю, наполненную
карбид кальция. Образовавшийся ацетиленовый газ воспламеняется и сгорает с
яркий, широкий свет.
В
В начале двадцатого века CaC2 широко использовался в качестве источника света в таких
называемые переносными «карбидными лампами» в горнодобывающей промышленности. Корпус этих ламп
образован двумя контейнерами, которые расположены вертикально. Вода
капает из верхней емкости в нижнюю, наполненную
карбид кальция. Образовавшийся ацетиленовый газ воспламеняется и сгорает с
яркий, широкий свет.
Кроме того, для сварки используется выработка ацетиленового газа. применения и органический синтез (например, хлорэтилены и виниловые ацетатные мономеры). Производство удобрения цианистый кальций (CaCN2), а также обессеривание и раскисление железа и стали. на основе карбида кальция.
Реакция CaC2 с водой также используется для определение содержания воды в пробах вещества карбидом метод согласно DIN 18121-2.
Стандарт DIN 53 922
С помощью методов испытаний согласно DIN 53 922 скорость реакции
и можно определить выход C2h3 из карбида кальция. DIN 53 922
специфицирует технический CaC2, в том числе требования по размеру зерна, пыли
содержание, выход газа (газообразный ацетилен) и содержание Ph4. В качестве условия для
определение выхода газообразного ацетилена, CaC2 должен разлагаться в
контакт с водой.
DIN 53 922
специфицирует технический CaC2, в том числе требования по размеру зерна, пыли
содержание, выход газа (газообразный ацетилен) и содержание Ph4. В качестве условия для
определение выхода газообразного ацетилена, CaC2 должен разлагаться в
контакт с водой.
Выход газа определяют газификацией образца CaC2 с
избыток воды, насыщенный газообразным ацетиленом и находящийся при
температура Тводы = 15-25°С. Отношение карбида кальция к воде
составляет 1:8. Взвешенный образец карбида кальция пропускают через газ.
насыщенной водой в газонепроницаемом испытательном аппарате и объемом
отмечается образовавшийся газ. Измеренный выход газа в условиях испытаний составляет
затем пересчитывается в выход газа при p = 1013 мбар и T = 15 °C
(насыщенные водяным паром). Чтобы соответствовать стандарту DIN
требованиям, выход газа при p = 1013 мбар и T = 15°C пересчитывается
получить средний выход газа, т.е. л ацетиленового газа на кг
карбид кальция.
л ацетиленового газа на кг
карбид кальция.
Гидролиз
Карбид кальция разлагается в воде с образованием ацетилена и гидроксид кальция в соответствии с уравнением 1 (см. выше). Реакция карбид кальция, т.е. технический, с водой протекает почти мгновенно. Образующийся при этом ацетилен полностью образуется в течение очень нескольких минут.
Для конечной точки гидролиза нет конкретной информации в виде теста. результаты в соответствии с тестом OECD №. 111 было найдено в общедоступных литературные базы данных. Поэтому приблизительный расчет реактивность карбида кальция с водой на основании имеющейся информации было выполнено. Цель состояла в том, чтобы получить числовое значение и сделать заявление о периоде полураспада гидролиза карбида кальция.
В связи с этим численные результаты для реактивности технических
CaC2 с водой. Ссылочный тест был проведен для патента
применение.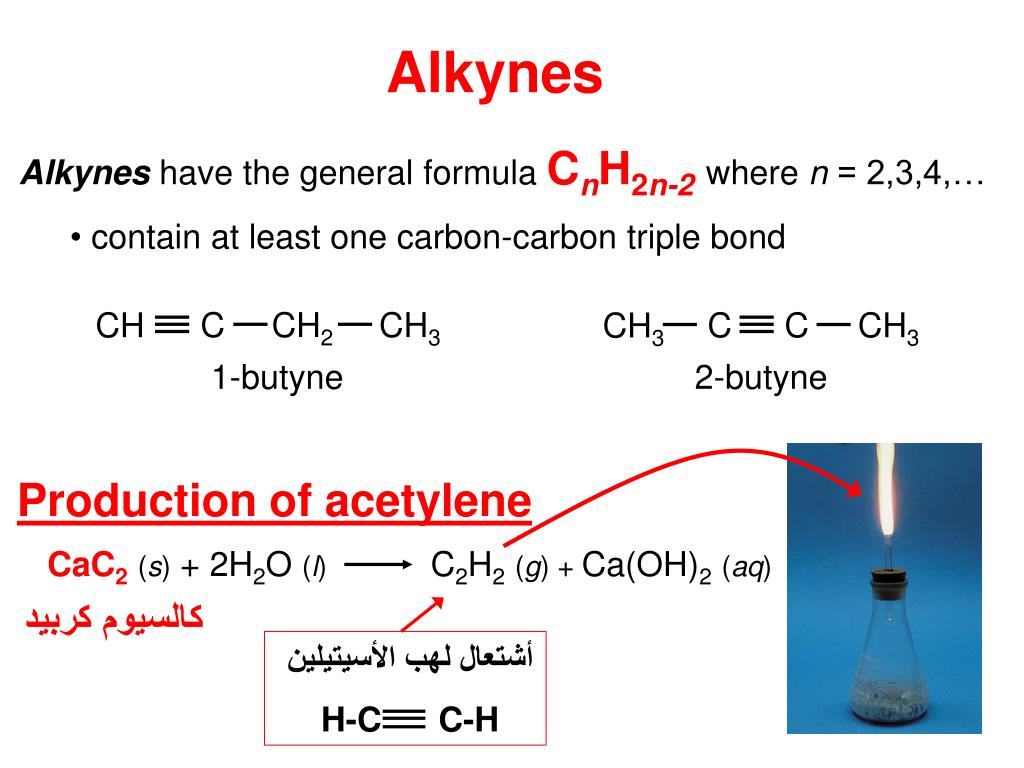 В этом испытании было использовано 2 г порошкообразного образца карбида кальция.
помещают в 30 мл воды и объем выделившегося ацетилена за
секунда была измерена. Для карбида кальция технической чистотой 90 %
чистота скорость потока V ̇(C2h3 ) = 70 мл/с для генерируемого ацетилена
измеряли газ.
В этом испытании было использовано 2 г порошкообразного образца карбида кальция.
помещают в 30 мл воды и объем выделившегося ацетилена за
секунда была измерена. Для карбида кальция технической чистотой 90 %
чистота скорость потока V ̇(C2h3 ) = 70 мл/с для генерируемого ацетилена
измеряли газ.
Объем газообразного ацетилена, выделившегося при реакции 2 г кальция карбид можно рассчитать относительно стехиометрии уравнения 1. С этими двумя значениями приблизительное время t_R, необходимое для кальция можно определить карбид, разлагающийся реакцией с водой.
Следующие расчеты включают определение объема выделяющийся газообразный ацетилен (А) и время реакции t_R (В) (см. ниже).
Расчет:
А) Расчет объема выделяющегося газообразного ацетилена V(C2h3)
A.1) Интересующий параметр: Молярность n(CaC2)
Данные значения:
— Взвешенная масса m(CaC2) = 2 г
— Скорректированная масса (с чистотой 90 %): m(CaC2,cor) = 1,8 г.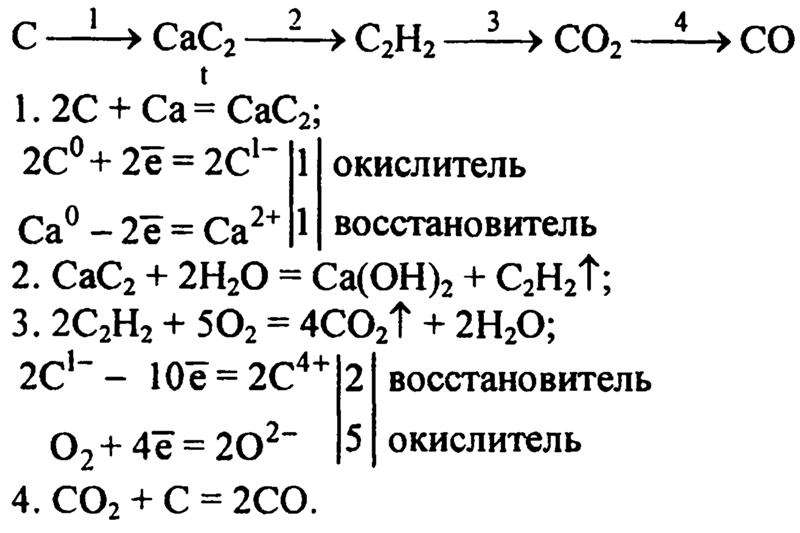
— Молекулярная масса: M(CaC2) = 64,1 г/моль
n(CaC2) = m(CaC2)/M(CaC2) = 1,8 г/64,1 г/моль = 0,028 моль Уравнение 2
В соответствии со стехиометрическим соотношением (см. уравнение 1) следующее применяется:
n(CaC2) = n(C2h3) = 0,028 моль Уравнение 3
A.2) Интересующий параметр: Объем выделяемого газообразного ацетилена V(C2h3)
Предполагается, что испытание на реактивность воды проводилось при нормальных условиях. условиях (нормальное давление p = 101,3 кПа, нормальная температура T = 298 K) и эффект выделения тепла из-за реакции игнорируется. При нормальных условиях значение молярного объема идеального газа равно 24,46 л/моль.
Поскольку 1 моль C2h3 занимает объем Vm = 24,46 л, объем n(C2h3) = 0,028 моль это:
V(C2h3) = 0,68 л = 680 мл.
B) Расчет времени реакции t_R
Объемная доля ацетилена и измеренный расход
указывает время реакции.
t_R = V(C2h3)/V ̇(C2h3) = (690 мл)/(70 мл/с) = 9,71 с Уравнение 4
Расчетное время реакции 90,71 с. Этот результат поддерживает утверждение, что карбид кальция и вода реагируют практически мгновенно. Поэтому предполагается, что гидролиз протекает очень быстро и в течение короткого времени. период полувыведения можно ожидать. Карбид кальция гидролитически нестабилен. и имеет прогнозируемый период полувыведения менее 12 часов.
Инструкции по тестированию для теста ОЭСР №. 111 включает тестирование гидролиз вещества при различных значениях рН (рН 4, 7 и 9). Согласно учебникам (например, Mortimer, 2001) присутствие кислот на карбидов (CaC2) приводит к образованию газообразного ацетилена. Как чистая вода имеет рН 7, предполагается, что реакция между водой и кальцием карбид также встречается при рН 4, когда кислотность увеличивается по сравнению с рН 7.
Реакция карбида кальция и воды может быть классифицирована как двойная. разложение. При контакте с водой/влагой карбид кальция
разлагается на газообразный ацетилен и оксид кальция (CaO) на первом этапе
двойное разложение (см. уравнение 5).
разложение. При контакте с водой/влагой карбид кальция
разлагается на газообразный ацетилен и оксид кальция (CaO) на первом этапе
двойное разложение (см. уравнение 5).
CaC2 + h3O → CaO + C2h3 Уравнение 5
Поскольку CaO гигроскопичен, он сразу же реагирует с жидкими или газообразными воды с образованием гидроксида кальция. Уравнение 6 показывает второй шаг двойное разложение.
CaO + h3O → Ca(OH)2 Уравнение 6
Поскольку эти две реакции протекают одновременно, обычно представляют разложение CaC2 объединенным уравнением, показанным на Уравнение 1 (см. выше).
Можно предположить, что конверсия первого карбида кальция
молекула находится в кислом или нейтральном диапазоне
образование CaO (см. уравнение 5). Поскольку CaO продолжает реагировать с
воды, присутствующей в реакционной смеси, постепенно образуется Ca(OH)2
(уравнение 6) и сдвиг рН от кислой/нейтральной к щелочной среде
происходит.
Тот факт, что реакция CaC2 и воды не останавливается в присутствие Ca(OH)2 свидетельствует о том, что гидролиз в щелочной среде среда соответствует гидролизу в кислой/нейтральной среде.
Был проведен поиск литературы для предоставления научных доказательств требуется конкретная информация о конечной точке воспламеняемости и гидролиза. Имеющаяся информация была подвергнута экспертной оценке. Находки составляют устоявшиеся учебниковые знания:
Карбид кальция мгновенно гидролитически разлагается при контакте с воды с образованием гидроксида кальция и газообразного ацетилена. Гидролиз период полувыведения при значениях рН 4, 7 и 9 значительно меньше 12 часов. Фактически гидролитическая реакция завершается в течение нескольких секунд. таким образом, периоду полувыведения можно присвоить значение менее одной минуты.
Cac2 And h30 Reaction Dissertation Results
Тип бумаги: Результаты диссертации
Тема: Вода, Химическая реакция, Реакция, Химическая, Кальций, Вещество, Карбид, Элемент
Страницы: 1
Words: 300
Опубликовано: 21. 03.2020
03.2020
Происходит химическая реакция между (Ca3C02)водой). Реакция происходит потому, что при добавлении кусочков карбида в колбу с водой можно наблюдать мутность (мутность). Также можно наблюдать образование пузырьков, поскольку в результате реакции выделяется газообразный ацетилен. Беловатое или мутное вещество, образующееся в ходе реакции, представляет собой гидроксид кальция.
Реакция между реагентами карбидом кальция (CaC2) и водой. Реагенты – это вещества, которые при соединении химически обменивают свои ионы и образуют другие вещества. В реакции участвуют активные ионы дикарбида (C22-) и кальция (Ca2+) с ионами водорода (H+) и гидроксид-ионами (OH-) соответственно. Ионы образуются после распада соединений CaC2 и h3O. Соединение — это вещество, образованное химическим соединением двух или более элементов в заданном соотношении. Соединения существуют как устойчивые вещества, которые распадаются под действием некоторых химических сил.
Реакция имеет следующее сбалансированное уравнение:-
CaC2 + 2 h3O = C2h3 + Ca (OH)2
Расщепление ионов кальция и карбида оставляет кальций реагировать с ионом гидроксида как отдельный элемент. Элемент – это вещество, атомы которого имеют одинаковое число протонов. Таким образом, этот элемент представляет собой простейшее вещество, которое не может быть далее расщеплено никаким химическим методом.
Элемент – это вещество, атомы которого имеют одинаковое число протонов. Таким образом, этот элемент представляет собой простейшее вещество, которое не может быть далее расщеплено никаким химическим методом.
Вышеуказанные реакции очевидны, потому что реагенты производят определенное соединение, которое вызывает изменение цвета воды. Выделение газообразного ацетилена можно проверить, зажигая горлышко колбы, в которой происходит химическая реакция. Светящаяся лучина на горлышке колбы загорается, потому что ацетилен поддерживает горение.
Цитировать эту страницу
Выберите формат цитирования:
- АПА
- ГНД
- Гарвард
- Ванкувер
- Чикаго
- АСА
- IEEE
- АМА
WowEssays. (2020, 21 марта) Результаты диссертации по реакции Cac2 и h30. Получено 2 января 2023 г. с https://www.wowessays.com/free-samples/dissertation-results-on-cac2-and-h30-reaction/
(2020, 21 марта) Результаты диссертации по реакции Cac2 и h30. Получено 2 января 2023 г. с https://www.wowessays.com/free-samples/dissertation-results-on-cac2-and-h30-reaction/
«Результаты диссертации по реакции Cac2 и h30». WowEssays, 21 марта 2020 г., https://www.wowessays.com/free-samples/dissertation-results-on-cac2-and-h30-reaction/. По состоянию на 2 января 2023 г.
WowEssays. 2020. Результаты диссертации о реакции Cac2 и h30 ., просмотрено 02 января 2023 г.,
ВауЭссе. Результаты диссертации по реакции Cac2 и h30. [Интернет]. Март 2020 г. [По состоянию на 2 января 2023 г.]. Доступно по адресу: https://www.wowessays.com/free-samples/dissertation-results-on-cac2-and-h30-reaction/
«Результаты диссертации по реакции Cac2 и h30». WowEssays, 21 марта 2020 г. По состоянию на 2 января 2023 г. https://www.wowessays.com/free-samples/dissertation-results-on-cac2-and-h30-reaction/
WowEssays.

 11.19
11.19 11.19
11.19 Химическая формула — СаС2
Химическая формула — СаС2