Ответы на контрольную работу по теме «Подгруппа углерода» (Габриелян) решебник
Вариант 1.
ЧАСТЬ А. Тестовые задания с выбором ответа
1. Распределение электронов по энергетическим уровням в атоме углерода:
А. 2е, 4е.
2. Из перечисленных химических элементов максимальную электроотрицательность имеет:
Г. Фтор.
3. Из перечисленных химических элементов наименьший радиус атома имеет:
А. Углерод.
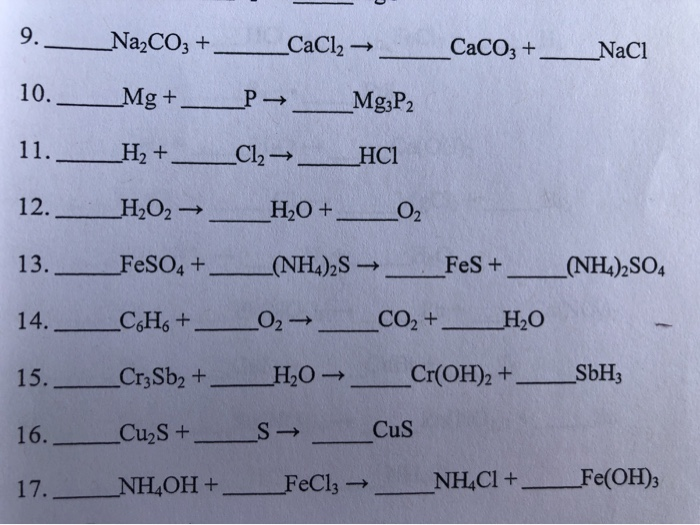
4. Закономерность изменения неметаллических свойств простых веществ, образованных элементами бором, углеродом, азотом, кислородом, с увеличением заряда ядра атома:
В. Усиливаются.
5. Кристаллическая решетка алмаза:
А. Атомная.
6. Степень окисления углерода в ряду СН4—С—СО—С02:
Б. Увеличивается.
7. Ионное уравнение
2Н+ + СО3 2- = C02↑ + Н20
соответствует взаимодействию веществ, формулы которых:
Б. НС1 и Na2C03.
8. Реактивом на углекислый газ является:
Б. Известковая вода.
Известковая вода.
9. Вещество, с которым не взаимодействует оксид углерода (IV):
Г. Оксид серы (IV).
10. Данные превращения
Si → Si02 → Na2Si03
соответствуют общей схеме:
В. Э → Э02 → Na2Э03.
ЧАСТЬ Б. Задания со свободным ответом
11. Определите вещество X в схеме превращений
FeO + CO → X + C02↑.
Расставьте коэффициенты, используя метод электронного баланса, укажите окислитель и восстановитель.
Fe+2O +C+2О → Fe0 + C+4O2
Fe+2 +2е → Fe0 окисл.
C+2 -2е→ C+4 восстан.
12. Напишите молекулярные уравнения реакций, идущих по схеме:
СО → С02 → KHCO3 → К2С03 → С02.
1. 2СО + О2 = 2СО2
2. СО2 + КОН = КНСО3
3. КНСО3 + КОН = К2СО3 + Н2О
4. К2СО3 + 2НCl = 2KCl + h3O + CO2
13. Перечислите вещества, которые служат сырьем для производства стекла.
кварцевый песок, сода и известь.
14. Дополните фразу: «Активированный уголь применяется…»
В противогазах, при производстве сахара, а также в медицине, химической, фармацевтической и пищевой промышленности. Фильтры, содержащие активированный уголь, используются во многих современных моделях устройств для очистки питьевой воды.
Фильтры, содержащие активированный уголь, используются во многих современных моделях устройств для очистки питьевой воды.
15. На 200 г известняка, содержащего 85% СаС03, подействовали избытком соляной кислоты. Вычислите количество вещества, объем (н. у.) и массу выделившегося газа.
2HNO3 + CaCO3 = Ca(NO3)2 + h3O + CO2
m(CaCO3)= 200г*0,85= 170г
n(CaCO3) = 170г/100г/моль = 1,7моль
n(CO2) = n(CaCO3) = 1,7моль
V(CO2) = 1,7 моль*22,4л/моль = 38,08 л
m(CO2) = 1,7моль*44г/моль = 74,8 г.
Вариант 2.
ЧАСТЬ А. Тестовые задания с выбором ответа
1. Распределение электронов по энергетическим уровням в атоме кремния:
Б. 2е, 8е, 4е.
2. Из перечисленных химических элементов минимальную электроотрицательность имеет:
А. Углерод.
3. Из перечисленных химических элементов наибольший радиус атома имеет:
Г. Олово.
4. Закономерность изменения неметаллических свойств простых веществ, образованных элементами кремнием, фосфором, серой, хлором, с увеличением заряда ядра атома:
В. Усиливаются.
Усиливаются.
5. Кристаллическая решетка оксида углерода (IV):
В. Металлическая.
6. Степень окисления кремния в ряду Sih5—Si—Si02:
Б. Увеличивается.
7. Ионное уравнение
2Н+ + SiO3 2- = h3Si03↓
соответствует взаимодействию веществ, формулы которых:
A. Na2Si03 и h3S04.
8. Гидрокарбонат-ион можно обнаружить водным раствором:
Г. Хлороводорода.
9. Оксид углерода (IV) образуется при взаимодействии:
Г. Разложением карбоната кальция.
10. Данные превращения
Sih5 → Si02 → K2Si03
соответствуют общей схеме:
Г. ЭН4 → Э02 → К2ЭО3.
ЧАСТЬ Б. Задания со свободным ответом
11. Определите вещество X в схеме превращений
ZnO + CO > х + СО2↑.
Расставьте коэффициенты, используя метод электронного баланса, укажите окислитель и восстановитель.
Zn+2O +C+2О → Zn0 + C+4O2
Zn+2 +2е → Zn0 окисл.
C+2 -2е→ C+4 восстан.
12. Напишите молекулярные уравнения реакций, идущих по схеме
MgCO3 → С02 → MgCO3 → Mg(HCO3)2 → MgCl2.
1. MgCO3 + 2HCl= MgCl2 + CO2 + h3O
2. MgO + CO2 = MgCO3
3. MgCO3 + h3CO3 = Mg(HCO3)2
4. Mg(HCO3)2 + 2HCl= MgCl2 + 2CO2 + 2h3O
13. Перечислите вещества, которые служат сырьем для производства цемента.
Он образуется путем измельчения клинкера, гипса и специальных добавок. Клинкер – это результат обжига сырьевой смеси, которая включает в себя известняк, глину и прочие материалы (доменный шлак, нефелиновый шлам, мергель).
14. Дополните фразу: «Железобетон — это…»
Соединение бетона и железной (стальной) арматуры, применяемое в строительстве.
15. На 150 г известняка, содержащего 90% СаСО3, подействовали избытком соляной кислоты. Вычислите количество вещества, объем (н. у.) и массу выделившегося газа.
2HCl + CaCO3 = CaCl2 + h3O + CO2
m(CaCO3)= 150г*0,9= 135г
n(CaCO3) = 135г/100г/моль = 1,35 моль
n(CO2) = n(CaCO3) = 1,35моль
V(CO2) = 1,35 моль*22,4л/моль = 30,24 л
m(CO2) = 1,35моль*44г/моль = 59,4 г.
Вариант 3.
ЧАСТЬ А. Тестовые задания с выбором ответа
1. Распределение электронов по энергетическим уровням в атоме кремния:
Б. 2е, 8е, 4е.
2. Из перечисленных химических элементов максимальную электроотрицательность имеет:
А. Углерод.
3. Из перечисленных химических элементов наибольший радиус атома имеет:
А. Углерод.
4. Закономерность изменения неметаллических свойств простых веществ, образованных элементами кремнием, фосфором, азотом и кислородом, с увеличением заряда ядра атома:
В. Усиливаются.
5. Кристаллическая решетка оксида кремния (IV):
А. Атомная.
6. Степень окисления углерода в ряду С02—СО—С—СН4:
В. Уменьшается.
7. Ионное уравнение
С02 + 20Н- = СО3 2- + Н20
соответствует взаимодействию веществ, формулы которых:
В. С02 и NaOH.
8. Силикат-ион можно обнаружить водным раствором:
В. Хлороводорода.
9. Вещество, с которым не взаимодействует оксид углерода (IV):
Г. Оксид серы (VI).
Оксид серы (VI).
10. Данные превращения
СН4 → С02 → К2С03
соответствуют общей схеме:
Г. ЭН4 → Э02 → К2Э03.
ЧАСТЬ Б. Задания со свободным ответом
11. Определите вещество X в схеме превращений
СuО + СО → Cu + X↑.
Расставьте коэффициенты, используя метод электронного баланса, укажите окислитель и восстановитель.
Cu+2O +C+2О → Cu0 + C+4O2
Cu+2 +2е → Cu0 окисл.
C+2 -2е→ C+4 восстан
12. Напишите молекулярные уравнения реакций, идущих по схеме
Са(НС03)2 →СаС03 → С02 → Na2C03 → С02.
1. Ca(HCO3)2 = CaCO3 + h3O + CO2
2. CaCO3 = CaO + CO2
3. CO2 + Na2O = Na2CO3
4. Na2СО3 + 2НCl = 2NaCl + h3O + CO2
13. Перечислите вещества, которые служат сырьем для производства керамики.
Керамика— изделия из неорганических материалов (например, глины) и их смесей с минеральными добавками, изготавливаемые под воздействием высокой температуры с последующим охлаждением.
14. Дополните фразу: «Адсорбция — это…»
Процесс поглощения газов, паров, веществ из раствора или газовой смеси поверхностным слоем жидкости или твердого тела — адсорбентом (активированным углем и др.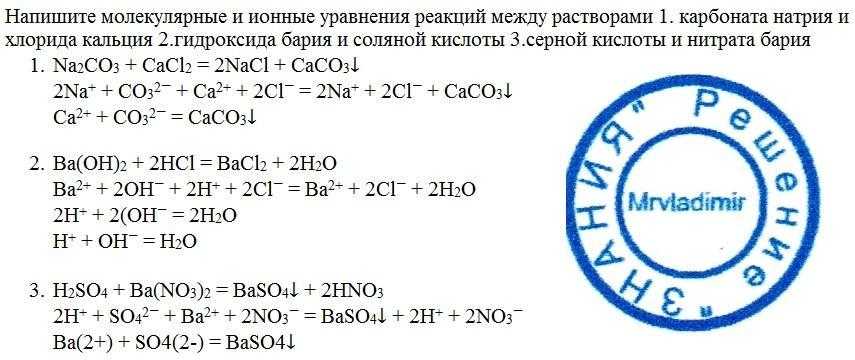 ), используемый в химической технике для разделения и очистки веществ.
), используемый в химической технике для разделения и очистки веществ.
15. На 250 г известняка, содержащего 80% CaCO3, подействовали избытком соляной кислоты. Вычислите количество вещества, объем (н. у.) и массу выделившегося газа.
2HCl + CaCO3 = CaCl2 + h3O + CO2
m(CaCO3)= 250г*0,8= 200г
n(CaCO3) = 200г/100г/моль = 2 моль
n(CO2) = n(CaCO3) = 2 моль
V(CO2) = 2 моль*22,4л/моль = 44,8 л
m(CO2) = 2моль*44г/моль = 88 г.
Вариант 4.
ЧАСТЬ А. Тестовые задания с выбором ответа
1. Распределение электронов по энергетическим уровням в атоме углерода:
А. 2е, 4е.
2. Из перечисленных химических элементов минимальную электроотрицательность имеет:
Г. Олово.
3. Из перечисленных химических элементов наибольший радиус атома имеет:
А. Углерод.
4. Закономерность изменения неметаллических свойств простых веществ, образованных элементами алюминием, кремнием, фосфором, серой, с увеличением заряда ядра атома:
В. Усиливаются.
Усиливаются.
5. Кристаллическая решетка графита:
А. Атомная.
6. Степень окисления кремния в ряду h3Si03—Si—Mg2Si:
В. Уменьшается.
7. Ионное уравнение
Са2+ + СО3 2- = СаС03
соответствует взаимодействию веществ, формулы которых:
Б. Са(ОН)2 и Na2C03.
8. Карбонат-ион можно обнаружить водным раствором:
Г. Хлороводорода.
9. Кремниевая кислота образуется при взаимодействии:
Г. Силиката натрия с соляной кислотой.
10. Данные превращения
С → С02 → Н2С03
соответствуют общей схеме:
Б. Э → Э02 → Н2Э03.
ЧАСТЬ Б. Задания со свободным ответом
11. Определите вещество X в схеме превращений Fe203 + СО → Fe + Х↑.
Расставьте коэффициенты, используя метод электронного баланса, укажите окислитель и восстановитель.
12. Напишите молекулярные уравнения реакций, идущих по схеме:
Ва(НС03)2 → ВаС03 → С02 → K2C03 → CaCO3.
1. Ва(НСО3)2 = ВаСО3 + Н2О + СО2
2. ВаСО3 = Н2О + СО2
ВаСО3 = Н2О + СО2
3. СО2 + 2КОН = К2СО3 + Н2О
4. К2СО3 + СаCl2 = 2KCl + CaCO3
13. Перечислите вещества, которые служат сырьем для производства фарфора.
Фарфор получают высокотемпературным обжигом крупнодисперсной смеси каолина, кварца, полевого шпата и пластичной глины.
14. Дополните фразу: «Бетон — это…»
Строительный материал из смеси цемента с водой, песком и щебнем, твердеющей после укладки.
15. На 300 г известняка, содержащего 75% CaCO3, подействовали избытком соляной кислоты. Вычислите количество вещества, объем (н. у.) и массу выделившегося газа.
2HCl + CaCO3 = CaCl2 + h3O + CO2
m(CaCO3)= 300г*0,75= 225г
n(CaCO3) = 225г/100г/моль = 2.5 моль
n(CO2) = n(CaCO3) = 2.5 моль
V(CO2) = 2.5 моль*22,4л/моль = 56 л
m(CO2) = 2.5моль*44г/моль = 110 г.
Что происходит, когда вы смешиваете хлорид кальция и карбонат натрия?
Что такое хлорид кальция?
Хлорид кальция является одним из неорганических соединений, обозначающих CaCl2. Он растворим и имеет белый цвет при комнатной температуре. Хлорид кальция имеет другое название, такое как дихлорид кальция, хлорид кальция (II) и E509.
Он растворим и имеет белый цвет при комнатной температуре. Хлорид кальция имеет другое название, такое как дихлорид кальция, хлорид кальция (II) и E509.
Кальций хлористый на вид гигроскопичен, имеет 110,98·моль−1. Он имеет пять уровней плотности: безводный (2,15 г/см3), моногидрат (2,24 г/см3), дигидрат (1,85 г/см3), тетрагидрат (1,83 г/см3) и гексагидрат (1,71 г/см3). г/см3). Хлористый кальций кипит при 1,935°С.
Можно ли смешивать хлорид кальция с другими химическими соединениями?
Ответ на вопрос выше абсолютно да. Хлорид кальция можно смешивать с карбонатом натрия. Он имеет несколько названий, таких как стиральная сода, кальцинированная сода и кристаллическая сода.
Что такое карбонат натрия?
Карбонат натрия – одно из химических соединений, которое обозначает Na2CO3. Цвет белый и растворимый. Раньше карбонат натрия извлекали из пепла растений, произрастающих на натриевых почвах.
Карбонат натрия структурирован по молекулярной массе, плотности и температуре плавления.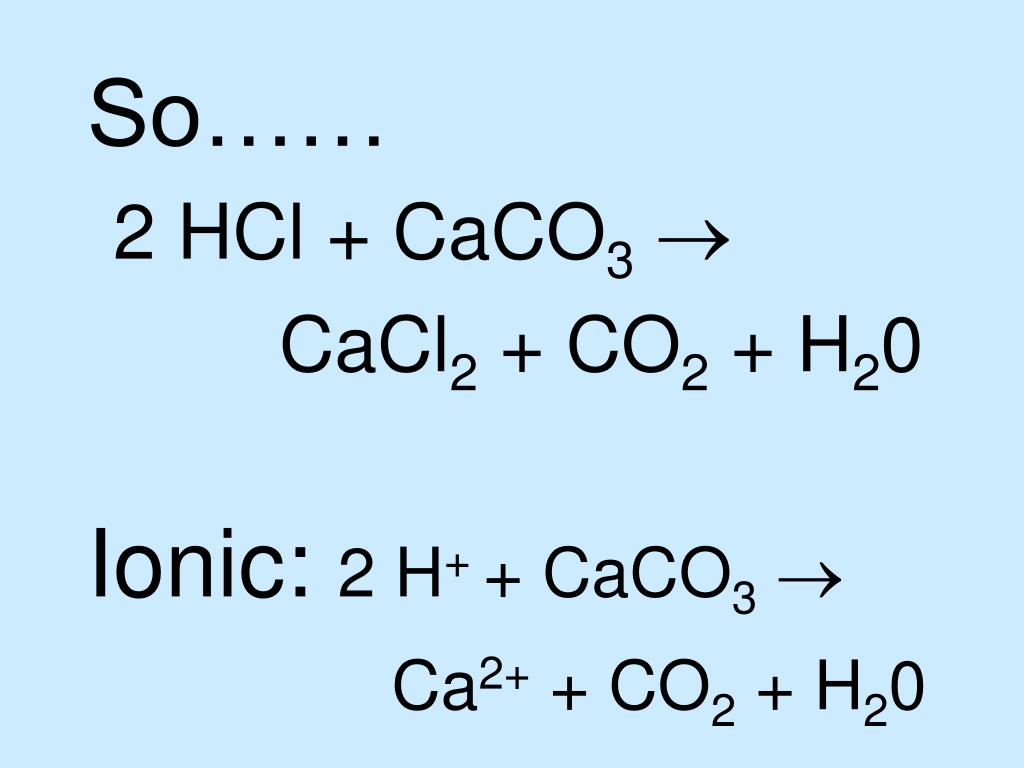 Молярная масса карбоната натрия состоит из безводного (105,9888 г/моль) и декагидрата (286,1416 г/моль).
Молярная масса карбоната натрия состоит из безводного (105,9888 г/моль) и декагидрата (286,1416 г/моль).
Плотность карбоната натрия делится на пять уровней, таких как безводный (2,54 г/см3), 856 °C, моногидрат (2,25 г/см3), гептагидрат (1,51 г/см3) и декагидрат (1,46 г/см3).
Точки плавления карбоната натрия составляют 851 °C, 100 °C, 33,5 °C и 34 °C.
Вы также можете прочитать о:
- Использование оксида кальция в повседневной жизни
- Использование альгината натрия во многих областях
Что произойдет, если смешать хлорид кальция и карбонат натрия?
Существует формула для смешивания хлорида кальция. Основываясь на этой формуле, вы можете уловить реакцию, например:
CaCl2(водн.) + Na2CO3(водн.) → CaCO3(тв.) + 2NaCl(водн.)
Во-первых, вы должны написать формулу этих соединений. Есть CaCl2 для хлорида кальция и Na2CO3 для карбоната натрия. Вы получите твердый карбонат кальция, и он выпадет в осадок. Кроме того, есть водная поваренная соль.
Кроме того, есть водная поваренная соль.
Эту реакцию можно назвать реакцией осаждения, даже если эти соединения являются жидкими. Когда они смешаны, их разделяют в процессе фильтрации.
Вы также можете прочитать о:
- Использование хлорида ртути и потенциальное вредное воздействие
- Свойства кальция и его использование в повседневной жизни
Использование продуктов; карбонат кальция и поваренная соль
Продукты этой реакции могут быть использованы для получения многих преимуществ, а именно:
Карбонат кальция
Карбонат кальция означает CaCO3, который содержится в сельскохозяйственной извести. Есть так много преимуществ карбоната кальция, таких как:
- Карбонат кальция можно использовать в качестве антацида.
- Подходит в качестве вспомогательного средства при лечении остеопороза.
- Процесс очистки для горнодобывающих нужд.
- Бумажная промышленность и потребности в покрытиях.

- Карбонат кальция можно использовать для увеличения процесса усвоения питательных веществ растениями в сельскохозяйственных целях.
Поваренная соль
Поваренная соль или хлорид натрия имеет так много преимуществ для различных медицинских нужд. Лучшие преимущества поваренной соли улучшают содержание в организме таких веществ, как натрий, кальций и калий.
[PDF] Образование частицы и проводимости CACO3 раствора NA2CO3 и CACL2 в магнитном поле в системе динамической жидкости
- DOI: 10,7454/MST.V15I1.862
- CORPUSSPES: 1245151515132
4.114.114.114.114....4..4.4.4. .114.1144.114.1194.........
.114.1144.114.1194.......... .... title={ОБРАЗОВАНИЕ ЧАСТИЦЫ CaCO3 И ПРОВОДИМОСТЬ РАСТВОРОВ Na2CO3 И CaCl2 ПОД ДЕЙСТВИЕМ МАГНИТНОГО ПОЛЯ НА ДИНАМИЧЕСКОЙ ЖИДКОСТНОЙ СИСТЕМЕ}, автор = {Нельсон Саксоно и Сетихо Бисмо и Роэкмиджати Виданингром и Азвар Манаф}, journal={Теория вычислительных систем\/ Теория математических систем}, год = {2011}, объем = {15}, страницы={89-95} }
- Н. Саксоно, С. Бизмо, А. Манаф
- Опубликовано 1 апреля 2011 г.
- Материаловедение, химия
- Теория вычислительных систем / Теория математических систем
стенки труб и теплообменное оборудование в процессах промышленного или бытового водоснабжения. Проведено большое количество экспериментальных исследований по предотвращению процесса осаждения CaCO3 магнитным полем. В этом исследовании растворы Na2CO3 и CaCl2 намагничивались в условиях циркулирующего потока (динамическая жидкостная система). Скорость жидкости и время циркуляции…
Проведено большое количество экспериментальных исследований по предотвращению процесса осаждения CaCO3 магнитным полем. В этом исследовании растворы Na2CO3 и CaCl2 намагничивались в условиях циркулирующего потока (динамическая жидкостная система). Скорость жидкости и время циркуляции…
Просмотр через издателя
Scholarhub.ui.ac.idЭкспериментальное исследование по предотвращению кристаллизации карбоната кальция в дренажной трубе туннельного строительства
- Юаньфу Чжоу, Сюефу Чжан, Лянвэнь Вэй, Ши-юн Лю, Бин Чжан, Чао Чжоу
Материаловедение
Достижения в области гражданского строительства
- 2018
Если дренажные трубы туннеля будут заблокированы, несущие конструкции будут в опасности, поскольку они будут подвергаться большей нагрузке, чем раньше. Чтобы исследовать проблему блокировки, некоторые лаборатории…
Исследование и анализ кристаллизации дренажных труб туннелей в Чунцине
На внутренней стенке дренажных труб туннелей в Чунцине существует множество кристаллизаций.