| 1 | Найти число нейтронов | H | |
| 2 | Найти массу одного моля | H_2O | |
| 3 | Баланс | H_2(SO_4)+K(OH)→K_2(SO_4)+H(OH) | |
| 4 | Найти массу одного моля | H | |
| 5 | Найти число нейтронов | Fe | |
| 6 | Найти число нейтронов | Tc | |
| 7 | Найти конфигурацию электронов | H | |
| 8 | Найти число нейтронов | Ca | |
| 9 | Баланс | CH_4+O_2→H_2O+CO_2 | |
| 10 | Найти число нейтронов | C | |
| 11 | Найти число протонов | H | |
| 12 | Найти число нейтронов | O | |
| 13 | Найти массу одного моля | CO_2 | |
| 14 | Баланс | C_8H_18+O_2→CO_2+H_2O | |
| 15 | Найти атомную массу | H | |
| 16 | Определить, растворима ли смесь в воде | H_2O | |
| 17 | Найти конфигурацию электронов | Na | |
| 18 | Найти массу одного атома | H | |
| 19 | Найти число нейтронов | Nb | |
| 20 | Найти число нейтронов | Au | |
| 21 | Найти число нейтронов | Mn | |
| 22 | Найти число нейтронов | Ru | |
| 23 | Найти конфигурацию электронов | ||
| 24 | Найти массовую долю | H_2O | |
| 25 | Определить, растворима ли смесь в воде | NaCl | |
| 26 | Найти эмпирическую/простейшую формулу | H_2O | |
| 27 | Найти степень окисления | H_2O | |
| 28 | Найти конфигурацию электронов | K | |
| 29 | Найти конфигурацию электронов | Mg | |
| 30 | Найти конфигурацию электронов | Ca | |
| 31 | Найти число нейтронов | Rh | |
| 32 | Найти число нейтронов | Na | |
| 33 | Найти число нейтронов | Pt | |
| 34 | Найти число нейтронов | Be | Be |
| 35 | Найти число нейтронов | Cr | |
| 36 | Найти массу одного моля | H_2SO_4 | |
| 37 | Найти массу одного моля | HCl | |
| 38 | Найти массу одного моля | Fe | |
| 39 | Найти массу одного моля | C | |
| 40 | Найти число нейтронов | Cu | |
| 41 | Найти число нейтронов | S | |
| 42 | Найти степень окисления | H | |
| 43 | Баланс | CH_4+O_2→CO_2+H_2O | |
| 44 | Найти атомную массу | O | |
| 45 | Найти атомное число | H | |
| 46 | Найти число нейтронов | Mo | |
| 47 | Найти число нейтронов | Os | |
| 48 | Найти массу одного моля | NaOH | |
| 49 | Найти массу одного моля | O | |
| 50 | Найти конфигурацию электронов | Fe | |
| 51 | Найти конфигурацию электронов | C | |
| 52 | Найти массовую долю | NaCl | |
| 53 | Найти массу одного моля | ||
| 54 | Найти массу одного атома | Na | |
| 55 | Найти число нейтронов | N | |
| 56 | Найти число нейтронов | Li | |
| 57 | Найти число нейтронов | V | |
| 58 | Найти число протонов | N | |
| 59 | Упростить | H^2O | |
| 60 | Упростить | h*2o | |
| 61 | Определить, растворима ли смесь в воде | H | |
| 62 | Найти плотность при стандартной температуре и давлении | H_2O | |
| 63 | Найти степень окисления | NaCl | |
| 64 | Найти атомную массу | He | He |
| 65 | Найти атомную массу | Mg | |
| 66 | Найти число электронов | H | |
| 67 | Найти число электронов | O | |
| 68 | Найти число электронов | S | |
| 69 | Найти число нейтронов | Pd | |
| 70 | Найти число нейтронов | Hg | |
| 71 | Найти число нейтронов | B | |
| 72 | Найти массу одного атома | Li | |
| 73 | Найти эмпирическую формулу | H=12% , C=54% , N=20 | , , |
| 74 | Найти число протонов | Be | Be |
| 75 | Найти массу одного моля | Na | |
| 76 | Найти конфигурацию электронов | Co | |
| 77 | Найти конфигурацию электронов | S | |
| 78 | Баланс | C_2H_6+O_2→CO_2+H_2O | |
| 79 | Баланс | H_2+O_2→H_2O | |
| 80 | Найти конфигурацию электронов | P | |
| 81 | Найти конфигурацию электронов | Pb | |
| 82 | Найти конфигурацию электронов | Al | |
| 83 | Найти конфигурацию электронов | Ar | |
| 84 | Найти массу одного моля | O_2 | |
| 85 | Найти массу одного моля | H_2 | |
| 86 | Найти число нейтронов | K | |
| 87 | Найти число нейтронов | P | |
| 88 | Найти число нейтронов | Mg | |
| 89 | Найти число нейтронов | W | |
| 90 | Найти массу одного атома | C | |
| 91 | Упростить | na+cl | |
| 92 | Определить, растворима ли смесь в воде | H_2SO_4 | |
| 93 | Найти плотность при стандартной температуре и давлении | NaCl | |
| 94 | Найти степень окисления | C_6H_12O_6 | |
| 95 | Найти степень окисления | Na | |
| 96 | Определить, растворима ли смесь в воде | C_6H_12O_6 | |
| 97 | Найти атомную массу | Cl | |
| 98 | Найти атомную массу | Fe | |
| 99 | Найти эмпирическую/простейшую формулу | CO_2 | |
| 100 | Найти число нейтронов | Mt |
Особенности строения электронных оболочек атомов элементов
На этой странице вы узнаете:- Чем общежития электронов отличаются от студенческих?
- В атомах химических элементов есть свои уровни комфортности?
- Химические элементы делятся на семейства? Это что, биология какая-то?
Сейчас в обществе все больше набирает оборот модный тренд — минималистичный образ жизни. Как в фильме «Сто вещей и ничего лишнего». Главные герои — два закадычных друга — решили на спор отказаться от всех своих вещей (абсолютно всех, включая одежду и телефон). Спустя время и преодолев череду проблем, они поняли, что вещи — это не главное в жизни.
Как в фильме «Сто вещей и ничего лишнего». Главные герои — два закадычных друга — решили на спор отказаться от всех своих вещей (абсолютно всех, включая одежду и телефон). Спустя время и преодолев череду проблем, они поняли, что вещи — это не главное в жизни.
Видимо, по такому принципу «живет» хорошо нам знакомый товарищ — водород. У него всего один электрон, который всегда на своем месте. А как быть, например, с атомом хлора, у которого их аж 17, ведь их надо содержать в порядке? Сейчас мы с вами узнаем, как располагаются электроны в электронной оболочке атома и многое другое.
Строение электронной оболочки атомаПредставим, что электрон — это студент, а электронная оболочка атома — общежитие. Как будет жить наш студент в общежитии?
Разберемся сначала с «планом помещения».
- В нём есть отдельные комнаты, которые называются атомными орбиталями — в них могут проживать максимум 2 электрона.
- Несколько комнат объединяются в блок с общей кухней — их мы назовем энергетическими подуровнями.

- Этажи общежития — энергетические уровни. Определенный этаж содержит определенное количество блоков.
Таким образом, все электроны «живут» на энергетических уровнях-этажах, каждый из которых имеет энергетические подуровни-блоки со своими орбиталями-комнатами.
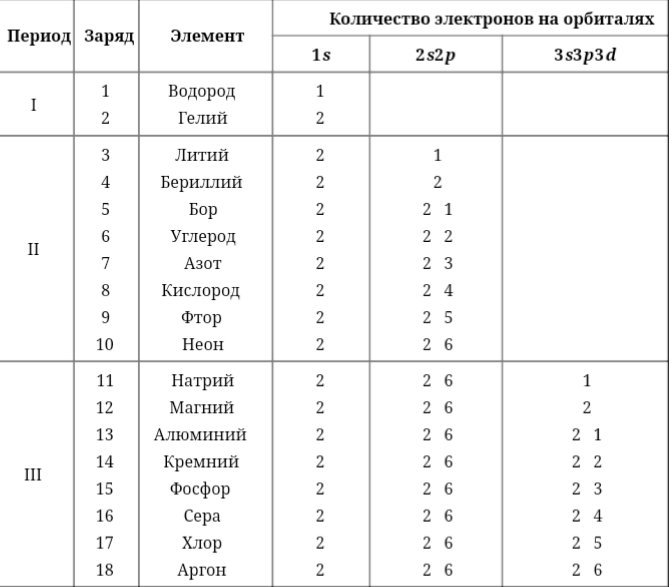
То, что мы видим с вами на рисунке — электронно-графическая формула для отдельных атомов химических элементов — это расположение всех его электронов на орбиталях.
| Чем общежития электронов отличаются от студенческих? 1. Энергетические уровни (этажи) имеют порядковую нумерацию. Причем на первом уровне располагается всего один подуровень (блок), на втором — два, на третьем — три, на четвертом и последующих — по 4. 2. Подуровни (блоки) обозначают в следующем порядке по мере отдаления от ядра: s (имеет одну орбиталь) → p (три орбитали) → d (пять орбиталей)→ f (семь орбиталей). 3. Орбиталь (комната) специального обозначения не имеет. Может содержать максимум 2 электрона (студента). |
Как нам поможет Периодическая таблица химических элементов Д.И. Менделеева при заполнении схемы строения электронных оболочек атомов?
- Число электронов в атоме химического элемента равно его порядковому номеру в Периодической системе Д. И. Менделеева.
- Количество уровней совпадает с номером периода, в котором располагается элемент: 1, 2, 3…
- Количество электронов на внешнем энергетическом уровне для элементов главных (A) подгрупп можно также легко узнать — в какой группе по номеру расположен химический элемент, столько электронов и будет находиться на его внешнем уровне.
- Для элементов побочных подгрупп количество электронов на внешнем энергетическом уровне равно двум.
 Исключениями являются медь, серебро, хром, золото и некоторые другие элементы.
Исключениями являются медь, серебро, хром, золото и некоторые другие элементы. - Количество валентных электронов для элементов главных (A) подгрупп равно номеру группы, для элементов побочных подгрупп — числу электронов на внешнем энергетическом уровне и незаполненном предвнешнем подуровне.
Это можно использовать для проверки своих действий при распределении электронов по уровням.
Уже сейчас, используя полученную информацию, мы можем решить задание №2 ОГЭ по химии.
На приведенном рисунке изображена модель атома химического элемента.
Запишите в таблицу порядковый номер в Периодической системе (Х) химического элемента, модель атома которого изображена на рисунке, и номер группы (Y), в которой этот элемент расположен в Периодической системе.
Решение:
1) Порядковый номер химического элемента в Периодической системе можно определить по числу электронов в атоме. Сосчитав все электроны, получаем, что их 14 штук, следовательно, X — 14.
2) Номер группы Периодической системы, в которой расположен химический, элемент можно узнать по числу электронов на его внешнем электронном уровне. Сосчитав их, получим, что их 4 штуки, следовательно, Y — 4.
Ответ: 144
Электронная конфигурация атомаДля изображения строения электронных слоев атома (электронной конфигурации) пользуются условной записью.
Удобно представлять атомные орбитали в виде ячеек, в которых располагаются два электрона, их обозначаем в виде двух стрелочек, первая направлена вверх, а вторая — вниз. Это называется принципом Паули.
Он гласит, что два электрона не могут иметь одинаковые спины. Спин — характеристика электрона, проще всего его можно представить как вращение электрона по часовой стрелке и против часовой, поэтому в ячейке они расположены в противоположном направлении (то есть +1/2 и -1/2).
При заполнении этих ячеек удобно пользоваться правилом Хунда (или правилом «трамвайного вагона»):
| При наличии свободных орбиталей на подуровне электроны занимают именно их, а не «подсаживаются» к другим электронам: Ты приглядись, решив присесть, |
В нашем с вами примере студентов заселяют по одному в комнату пока это возможно.
| Важное замечание: в комнате не больше двух студентов — атомная орбиталь вмещает максимально два электрона. |
Например, на изображении представлена электронно-графическая формула атома углерода. Стрелочками обозначены электроны, которые занимают атомные орбитали. Несколько атомных орбиталей на одном энергетическом уровне образуют подуровни.
Можно составить общую табличку с информацией о том, как распределяются электроны по энергетическим уровням и подуровням электронно-графической формулы:
| В атомах химических элементов есть свои уровни комфортности? Да, проанализировав таблицу, мы увидим, что на s-подуровне (блоке) может находиться не больше двух электронов, на p-подуровне — не больше шести электронов, на d-подуровне — не больше десяти электронов, на f-подуровне — не больше четырнадцати электронов. Электроны, как и студенты, стремятся занять более комфортные места, так система стремится к минимуму энергии. Порядок заполнения подуровней в атомах химических элементов следующий: 1s → 2s → 2p → 3s → 3p → 4s → 3d → 4p → 5s → 4d → 5p → 6s → … Согласитесь, если студентам заселиться в блок вдвоем, им будет проще найти друг с другом общий язык, чем если бы их было в блоке четырнадцать. |
Схематично порядок заполнения энергетических подуровней электронно-графической формулы представлен на картинке:
После того, как мы расположили все электроны по своим местам, мы можем составить электронную конфигурацию атома, которая будет отражать порядок заполнения электронов по подуровням в текстовом виде.
Потренируемся в написании электронной конфигурации на примере атомов хлора и титана.
Химический элемент титан располагается в IVB группе IV периода, имеет порядковый номер, равный 22. Исходя из этого, мы можем сказать, что в его атоме:
— четыре энергетических уровня (IV период), из которых первый и второй уровни полностью заполнены;
— четыре электрона на внешнем энергетическом уровне и предвнешнем подуровне;
— всего двадцать два электрона (порядковый номер).
В соответствии с порядком заполнения орбиталей распределим электроны:
22Ti 1s22s22p63s23p64s23d2 — как мы видим, сначала заполняется 4s-подуровень, а затем 3d-подуровень, это соответствует порядку заполнения орбиталей, описанному выше.
Проверим себя. В сумме все верхние цифры (обозначающие число электронов на подуровне), должны образовать ровно 22: 2 + 2 + 6 + 2 + 6 + 2 + 2 = 22, следовательно, электронная конфигурация атома хлора составлена верно.
| Химические элементы делятся на семейства? Это что, биология какая-то? К счастью, с биологией у атомов химических элементов мало общего, иначе, представьте, что в качестве домашнего питомца у вас был бы атом хлора, а в зоопарке бы показывали семью атомов золота. Что-то из области фантастики, не так ли? — s-элементы — это элементы IA и IIA групп, в их атомах последний электрон занимает место на s-подуровне внешнего энергетического уровня; |
Таким образом, мы с вами узнали, что электроны располагаются в атомах химических элементов в определенном порядке и выявили связь между положением химического элемента в Периодической системе химических элементов Д. И. Менделеева и строением его атома. Теперь для нас не составит труда описать строение атома любого химического элемента.
Теперь для нас не составит труда описать строение атома любого химического элемента.
- Электроны располагаются на электронных уровнях, причем их число определяется положением элемента в Периодической системе (по номеру периода).
- Энергетические уровни, в свою очередь, состоят из подуровней.
- Энергетические подуровни состоят из атомных орбиталей, которые для удобства обозначаются ячейками.
- По принципу Паули на каждой атомной орбитали могут располагаться максимально два электрона, причем их спины должны быть противонаправлены.
- Электроны располагаются по подуровням так, чтобы энергия системы была минимальна.
- Химические элементы делятся на s-, p-, d- и f-семейства по тому, на какой подуровень пишем последний электрон при составлении электронной конфигурации атома.
Задание 1.
Сколько электронов может максимально располагаться на орбитали?
- 1 электрон
- 2 электрона
- 3 электрона
- 4 электрона
Задание 2.
Как атомные подуровни заполняются электронами?
- в порядке увеличения их энергии
- в порядке уменьшения их энергии
- в периодическом порядке
Задание 3.
Сколько атомных орбиталей содержит d-подуровень?
- 1
- 3
- 5
- 7
Задание 4.
Какую форму имеет s-орбиталь?
- шара
- гантели
- эллипса
- нескольких гантелей
Ответы: 1. — 2; 2. — 1; 3. — 3; 4. — 1.
Электрон | Определение, масса и факты
атомные орбитали
Смотреть все СМИ
- Ключевые люди:
- П.А.М. Дирак Дж.Дж. Томсон Луи де Бройль Иоахим Франк Ричард Хендерсон
- Похожие темы:
- электронная конфигурация дифракция электронов электронный парамагнитный резонанс позитрон рассеяние электронов
Просмотреть весь связанный контент →
Исследуйте внутреннюю часть атома, чтобы узнать расположение его ядра, протонов и электронов
Просмотреть все видео к этой статье электрон , самая легкая из известных стабильных субатомных частиц.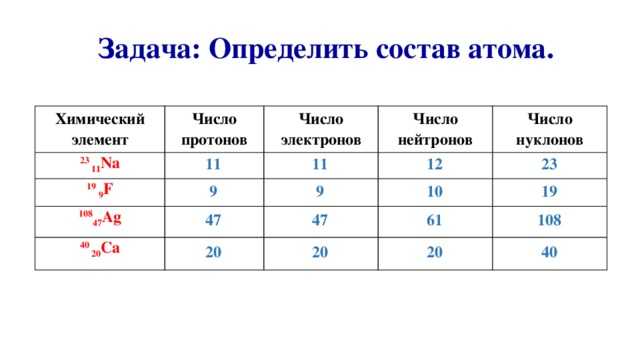 Он несет отрицательный заряд 1,602176634 × 10 −19 кулонов, что считается основной единицей электрического заряда. Масса покоя электрона равна 9,1093837015 × 10 −31 кг, что составляет всего 1 /9.0031 1,836 масса протона. Поэтому электрон считается почти безмассовым по сравнению с протоном или нейтроном, и масса электрона не включается в расчет массового числа атома.
Он несет отрицательный заряд 1,602176634 × 10 −19 кулонов, что считается основной единицей электрического заряда. Масса покоя электрона равна 9,1093837015 × 10 −31 кг, что составляет всего 1 /9.0031 1,836 масса протона. Поэтому электрон считается почти безмассовым по сравнению с протоном или нейтроном, и масса электрона не включается в расчет массового числа атома.
Электрон был открыт в 1897 году английским физиком Дж.Дж. Томсон при исследовании катодных лучей. Его открытие электронов, которые он первоначально назвал корпускулами, сыграло ключевую роль в революционном знании строения атома. В обычных условиях электроны связаны с положительно заряженными ядрами атомов за счет притяжения между противоположными электрическими зарядами. В нейтральном атоме количество электронов равно количеству положительных зарядов ядра. Однако любой атом может иметь больше или меньше электронов, чем положительных зарядов, и, таким образом, в целом быть отрицательно или положительно заряженным; эти заряженные атомы известны как ионы. Не все электроны связаны с атомами; некоторые из них находятся в свободном состоянии с ионами в форме вещества, известного как плазма.
Не все электроны связаны с атомами; некоторые из них находятся в свободном состоянии с ионами в форме вещества, известного как плазма.
Викторина «Британника»
Викторина «Наука»
Внутри любого данного атома электроны движутся вокруг ядра по упорядоченному расположению орбиталей, притяжение между электронами и ядром преодолевает отталкивание между электронами, которое в противном случае заставило бы их разлететься. Эти орбитали организованы в концентрические оболочки, отходящие от ядра наружу с возрастающим числом подоболочек. Электроны на ближайших к ядру орбиталях удерживаются наиболее крепко; те, что находятся на самых внешних орбиталях, защищены промежуточными электронами и наиболее слабо удерживаются ядром. Двигаясь внутри этой структуры, электроны образуют диффузное облако отрицательного заряда, которое занимает почти весь объем атома. Подробное структурное расположение электронов внутри атома называется электронной конфигурацией атома.
В области физики элементарных частиц существует два способа классификации электронов. Электрон — это фермион, тип частицы, названный в честь статистики Ферми-Дирака, описывающей его поведение. Все фермионы характеризуются полуцелыми значениями своего спина, где спин соответствует собственному угловому моменту частицы. Концепция спина воплощена в волновом уравнении для электрона, сформулированном П.А.М. Дирак. Волновое уравнение Дирака также предсказывает существование аналога электрона из антивещества, позитрона. Внутри фермионной группы субатомных частиц электрон можно далее классифицировать как лептон. Лептон — это субатомная частица, реагирующая только электромагнитными, слабыми и гравитационными силами; он не реагирует на короткодействующую сильную силу, действующую между кварками и связывающую протоны и нейтроны в атомном ядре.
Редакторы Британской энциклопедии Эта статья была недавно отредактирована и дополнена Эриком Грегерсеном.
3.4: Атомная масса и атомный номер
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 91936
- Элизабет Гордон
- Университет Фурмана
Результаты обучения
- Определение атомных и массовых чисел.
- Определить количество протонов, нейтронов и электронов в атоме.
- Определите заряд и относительную массу субатомных частиц.
- Обозначьте расположение субатомных частиц в атоме.
- Определите массу атома на основе его субатомных частиц.

- Напишите формат A/Z и символ-масса для атома.
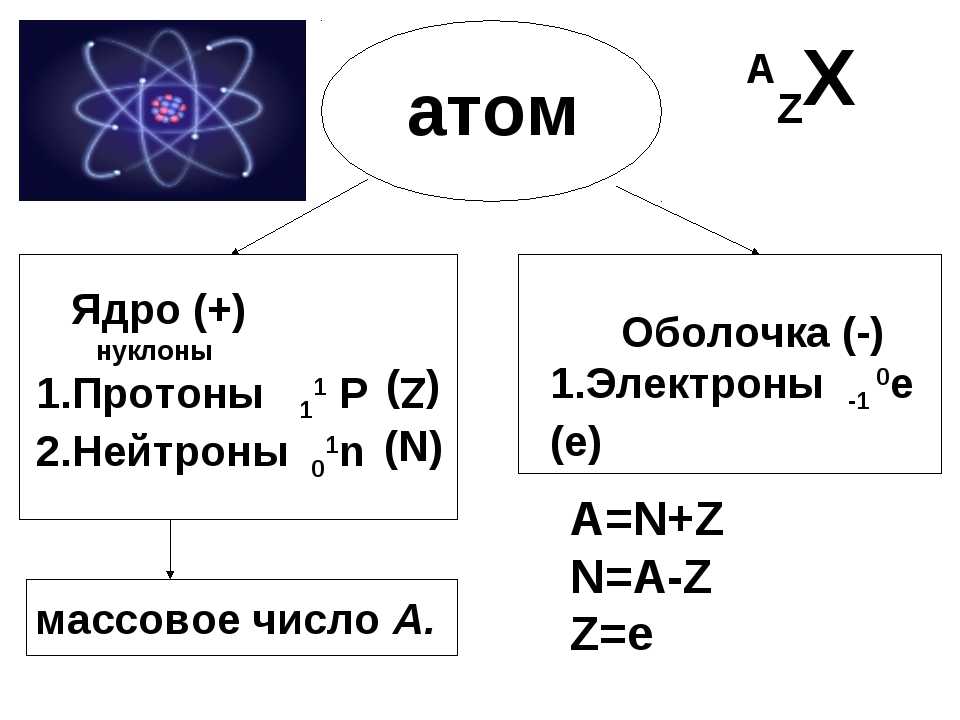
Атомы являются фундаментальными строительными блоками всей материи и состоят из протонов, нейтронов и электронов. Поскольку атомы электрически нейтральны, количество положительно заряженных протонов должно быть равно количеству отрицательно заряженных электронов. Поскольку нейтроны не влияют на заряд, количество нейтронов не зависит от количества протонов и будет различаться даже среди атомов одного и того же элемента.
Атомный номер
Атомный номер (представленный буквой Z) элемента представляет собой число протонов в ядре каждого атома этого элемента . Атом может быть классифицирован как конкретный элемент исключительно на основании его атомного номера. Например, любой атом с атомным номером 8 (его ядро содержит 8 протонов) является атомом кислорода, а любой атом с другим числом протонов будет другим элементом. Периодическая таблица (см. рисунок ниже) отображает все известные элементы и расположена в порядке возрастания атомного номера. В этой таблице атомный номер элемента указан над символом элемента. Водород в верхнем левом углу таблицы имеет атомный номер 1. Каждый атом водорода имеет в своем ядре один протон. Следующим на столе стоит гелий, атомы которого имеют два протона в ядре. Атомы лития имеют три протона, атомы бериллия — четыре и так далее.
В этой таблице атомный номер элемента указан над символом элемента. Водород в верхнем левом углу таблицы имеет атомный номер 1. Каждый атом водорода имеет в своем ядре один протон. Следующим на столе стоит гелий, атомы которого имеют два протона в ядре. Атомы лития имеют три протона, атомы бериллия — четыре и так далее.
Рисунок \(\PageIndex{1}\): Субатомный номер социального страхования — протон.
Поскольку атомы нейтральны, количество электронов в атоме равно количеству протонов. Все атомы водорода имеют один электрон, занимающий пространство вне ядра. Гелий с двумя протонами будет иметь два электрона. В классе химии количество протонов всегда будет эквивалентно атомному номеру. Это значение не изменится, если ядро не распадется или не подвергнется бомбардировке (ядерная физика).
Рисунок \(\PageIndex{3}\): Периодическая таблица элементов. (CC BY-SA 4.0 International; DePiep через Википедию).Массовое число
Экспериментальные данные показали, что подавляющая часть массы атома сосредоточена в его ядре, которое состоит из протонов и нейтронов. Массовое число (обозначенное буквой А) определяется как общее количество протонов и нейтронов в атоме. Рассмотрим приведенную ниже таблицу, в которой показаны данные первых шести элементов периодической таблицы.
Массовое число (обозначенное буквой А) определяется как общее количество протонов и нейтронов в атоме. Рассмотрим приведенную ниже таблицу, в которой показаны данные первых шести элементов периодической таблицы.
| Имя | Символ | Атомный номер (Z) | Протоны | Нейтроны | Электроны | Массовое число (А) (округленное до двух знаков после запятой) |
|---|---|---|---|---|---|---|
| водород | \(\се{Н}\) | 1 | 1 | 0 | 1 | 1,01 |
| гелий | \(\ce{He}\) | 2 | 2 | 2 | 2 | 4,00 |
| литий | \(\ce{Li}\) | 3 | 3 | 4 | 3 | 6,94 |
| бериллий | \(\ce{Be}\) | 4 | 4 | 5 | 4 | 9.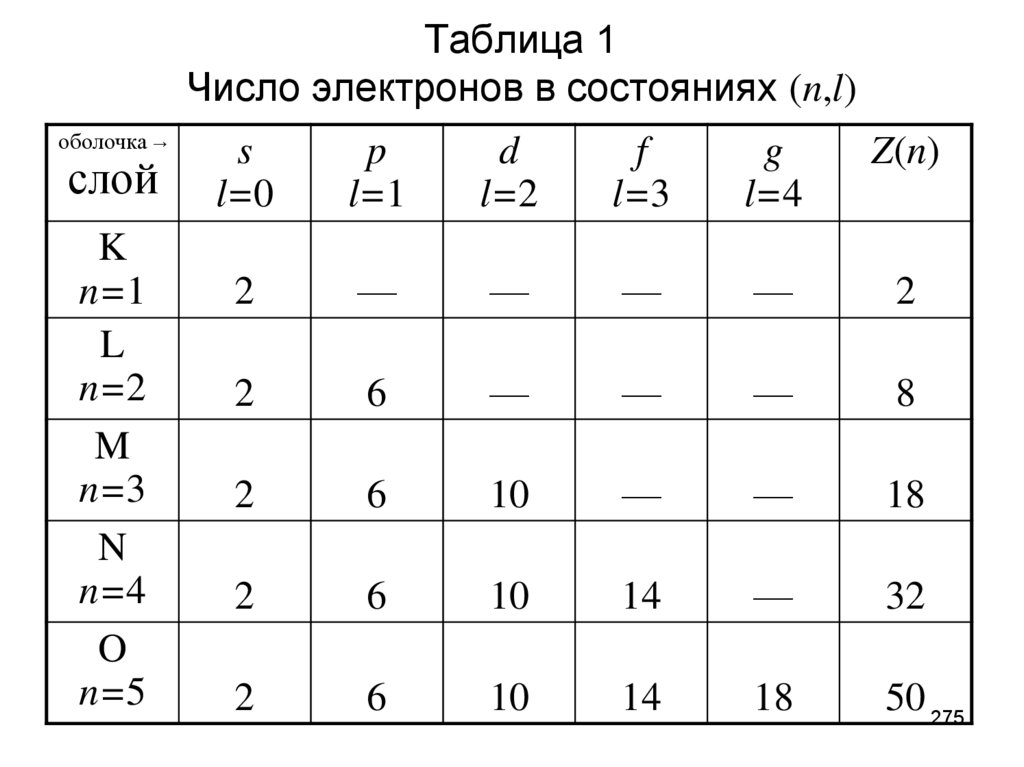 01 01 |
| бор | \(\ce{B}\) | 5 | 5 | 6 | 5 | 10,18 |
| углерод | \(\се{С}\) | 6 | 6 | 6 | 6 | 12.01 |
Рассмотрим элемент гелий. Его атомный номер равен 2, поэтому в его ядре два протона. Его ядро также содержит два нейтрона. Поскольку \(2 + 2 = 4\), мы знаем, что массовое число атома гелия равно 4. Наконец, атом гелия также содержит два электрона, так как число электронов должно равняться числу протонов. Этот пример может привести вас к мысли, что атомы имеют одинаковое количество протонов и нейтронов, но дальнейшее изучение приведенной выше таблицы покажет, что это не так. Литий, например, имеет три протона и четыре нейтрона, что дает ему массовое число 7,9.0003
Этот пример может привести вас к мысли, что атомы имеют одинаковое количество протонов и нейтронов, но дальнейшее изучение приведенной выше таблицы покажет, что это не так. Литий, например, имеет три протона и четыре нейтрона, что дает ему массовое число 7,9.0003
Рисунок \(\PageIndex{4}\): Формат A/Z и поиск субатомов для elementChromium (Авторское право; Элизабет Р. Гордон)
Зная массовое число и атомный номер атома, вы можете определить количество нейтронов, присутствующих в этом атоме, путем вычитания.
\[\text{Число нейтронов} = \text{округленное массовое число} — \text{атомный номер}\]
Атомы элемента хрома \(\left( \ce{Cr} \right)\) имеют атомный номер 24 и массовое число 52. Сколько нейтронов содержится в ядре атома хрома? Чтобы определить это, вы должны вычесть, как показано: 9{52}_{24}Cr}\]
Другим способом обозначения конкретного атома является запись массового числа атома после названия, разделенного дефисом. Формат символа-массы для вышеуказанного атома будет записан как Cr-52. В этом обозначении атомный номер не включен. Вам нужно будет обратиться к периодической таблице для значений протонов.
В этом обозначении атомный номер не включен. Вам нужно будет обратиться к периодической таблице для значений протонов.
Пример \(\PageIndex{1}\)
Рассчитайте каждую из трех субатомных частиц и дайте конкретные названия групп или периодов для каждого атома.
- ртуть
- платина
- бром
Растворы
- Hg (переходный металл) – содержит 80 электронов, 80 протонов и 121 нейтрон
- Pt (переходный металл) — имеет 78 электронов, 78 протонов и 117 нейтронов
- Br (галоген) — имеет 35 электронов, 35 протонов и 45 нейтронов
Пример \(\PageIndex{2}\)
Запишите форматы A/Z и символьная масса для атомов в примере \(\PageIndex{1}\). 9{80}_{35}Бр}\) и Бр-80
Пример \(\PageIndex{3}\)
Определите элементы на основе приведенных ниже утверждений.
- Какой элемент имеет 25 протонов?
- Какой элемент имеет 0 нейтронов?
- Какой элемент имеет 83 электрона?
Растворы
а.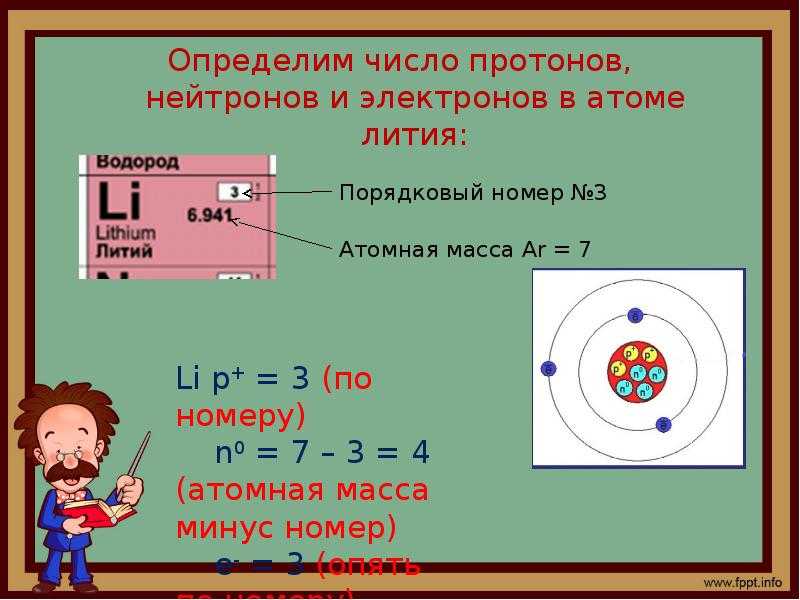


 Исключениями являются медь, серебро, хром, золото и некоторые другие элементы.
Исключениями являются медь, серебро, хром, золото и некоторые другие элементы.
 Таких семейств выделяют четыре:
Таких семейств выделяют четыре: