Окислительно-восстановительные реакции (ОВР) — презентация онлайн
Похожие презентации:
Сложные эфиры. Жиры
Физические, химические свойства предельных и непредельных карбоновых кислот, получение
Газовая хроматография
Хроматографические методы анализа
Искусственные алмазы
Титриметрические методы анализа
Биохимия гормонов
Антисептики и дезинфицирующие средства. (Лекция 6)
Клиническая фармакология антибактериальных препаратов
Биохимия соединительной ткани
Окислительновосстановительные
реакции (ОВР)
Окислительно-восстановительные
реакции
протекают с изменением степеней окисления
атомов элементов, входящих в состав молекул
реагирующих веществ.
Степень окисления – это условный заряд
атома в молекуле, вычисленный на основании
предположения, что молекула состоит только из
ионов.
Следует различать понятия «степень окисления»
и «валентность».
Валентность элемента определяется числом
неспаренных
на
внешнем
энергетическом уровне атома (для s- и pэлементов) или на внешнем и предвнешнем
незавершенном уровне атома (для d-элементов).

Это число электронов атома, участвующих в
образовании валентных связей.
Степень окисления в отличие от валентности
имеет положительное, отрицательное и нулевое
значение. Часто степень окисления атома
численно равна валентности, например, в
молекуле HCl валентность атома хлора равна 1, а
степень окисления – 1, но иногда может и не
совпадать, так, в молекуле Cl2 валентность хлора
равна 1, а степень окисления – нулю.
Для
правильного
составления
уравнений
окислительно-восстановительных
реакций
необходимо правильно определять величину и
знак степени окисления любого атома в молекуле.
Для
этого
следует
руководствоваться
следующими положениями:
а) степень окисления атома элемента в
молекуле простого вещества равна нулю;
б) степень окисления атома водорода во всех
соединениях, кроме гидридов щелочных и
щелочно-земельных металлов, равна +1;
в) степень окисления атома кислорода во
всех соединениях, кроме пероксидных и OF2,
равна -2;
г)
атомы
большинства
металлов,
обладающих значением электроотрицательности,
меньшей 2,1, во всех соединениях проявляют
только положительные степени окисления;
д) сумма степеней окисления всех атомов в
молекуле равна нулю;
Большинство
элементов
могут
проявлять
переменную степень окисления в соединениях.

Например, рассчитать степень окисления азота в
соединениях KNO2 и HNO3
+1 x -2
KNO2 +1+Χ+(-2)*2 = 0 Χ = +3
+1 x -2
HNO3 +1+Χ+(-2)*3 = 0 Χ = +5
Окисление – это процесс отдачи электронов
атомами, молекулами или ионами.
Восстановление – это процесс присоединения
Любая
окислительновосстановительная реакция состоит из процессов
окисления и восстановления. При окислении
степень окисления элемента повышается, при
восстановлении – понижается.
К типичным восстановителям относятся простые
вещества, атомы которых имеют малую
электроотрицательность
(металлы,
водород,
углерод, анионы, находящиеся в низкой или
низшей степени окисления).
К типичным окислителям относятся простые
вещества, атомы которых характеризуются
высокой электроотрицательностью (галогены,
кислород), катионы и анионы, содержащие атомы
в высокой степени окисления (Fe+3, Pb+4, C2O4-1,
MnO4-1, ClO4-1).
Окислительно-восстановительные
реакции
делятся на три группы:
1.
 Межмолекулярные реакции.
Межмолекулярные реакции.В этих реакциях участвуют разные вещества.
Например:
+4 -2
C0 + O20 = CO2
C0 – 4ē → C+4
O20 + 4ē → 2O-2
C0 – Восстановитель
O20 – Окислитель
2. Внутримолекулярные реакции.
В этих реакциях окислитель и восстановитель в
одной и той же молекуле, но разные атомы
выполняют
функции
окислителя
и
восстановителя.
Обычно
это
реакции
разложения. Например:
-4 +1
Ch5 → C0 + h30
C-4 — 4ē → C0
2H+1 + 2ē → h30
C-4 – восстановитель
H+1 – окислитель
3.
Реакции
диспропорционирования
(самоокисления и самовосстановления). В этих
реакциях
происходит
окисление
и
восстановление атомов и ионов одного и того же
элемента. Например:
+6
+7
+4
h3MnO4 → HMnO4 + MnO2 + h3O
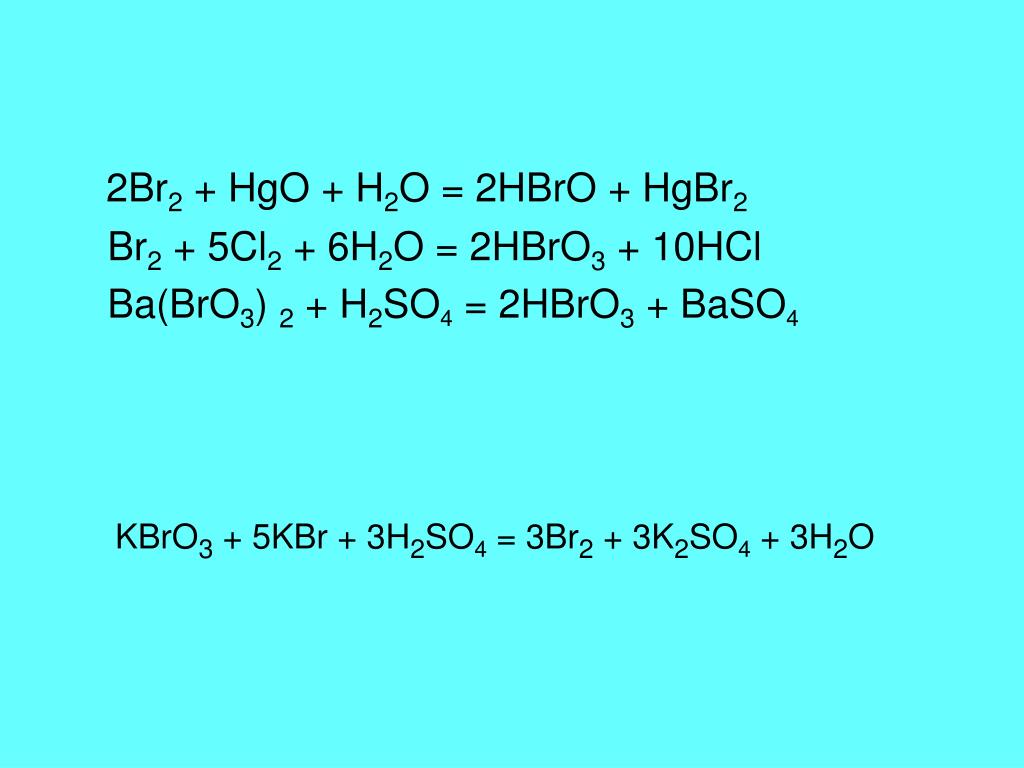
11. Составление уравнений окислительно- восстановительных реакций
Составление уравнений окислительновосстановительных реакцийУстановить формулы
продуктов реакции.

исходных
веществ
Определить степень окисления
веществах и продуктах реакции.
Определить
число
электронов
отданных
восстановителем и принимаемых окислителем и
коэффициенты при восстановителе и окислителе.
Определить коэффициенты при исходных
веществах и продуктах реакции, исходя из
баланса атомов в левой и правой части
уравнений.
в
и
исходных
12. Пример
Взаимодействиесульфата
железа
(2)
с
перманганатом калия в кислой среде (H+ ).
1. Напишем уравнение реакции. Расставим
степени окисления.
+1 +7 -2
+6 -2
+1 +6 -2
+3
+6 -2
KMnO4 + FeSO4 + h3SO4 → K2SO4 + Fe2 (SO4)3 +
+2 +6 -2
MnSO4 + h3O
+7
+2
Mn → Mn – степень окисления понижается
+2
+3
Fe → Fe – степень окисления повышается
2. Определим число электронов отданных
восстановителем и принимаемых окислителем, а
также коэффициенты при восстановителе и
окислителе:
+7
+2
Mn + 5 ē → Mn
+2
+3
Fe – ē → Fe
3.
 Определим коэффициенты при исходных
Определим коэффициенты при исходныхвеществах и продуктах реакции, исходя из
баланса атомов в левой и правой части
уравнений.
KMnO4 + 2FeSO4 → Fe2 (SO4)3 + MnSO4
окислитель восстановитель
+5ē
– 2ē
Число отданных и принятых электронов
должно быть равно. Наименьшее общее кратное 5
и 2 равно 10. Ищем коэффициент:
2KMnO4 + 10FeSO4 → K2SO4 + 5Fe2(SO4)3 +
2MnSO4
+10 ē
-10 ē
Окисление и восстановление — две стороны
единого процесса, и в соответствие с законом
сохранения массы количество электронов,
отданных восстановителем, равно количеству
электронов,
принятых
окислителем.
Для
отражения
окислительно-восстановительного
процесса составляют электронные уравнения.
О том, какими свойствами (окислительными
или восстановительными) обладает данное
вещество, можно судить на основании степени
окисления элемента в данном соединении.
Атомы s- и d-элементов в своей низшей степени
окисления (нулевой) имеют на внешнем
энергетическом уровне 1-2 электрона.

Атомы p-элементов 4-7 групп в своей низшей
степени окисления на внешнем энергетическом
уровне имеют 8 электронов.
И в том и в другом случае атом элемента в своей
низшей степени окисления не может принимать
электроны и является только восстановителем.
Атом элемента в своей высшей степени
окисления не имеет ни одного валентного
электрона (у атомов s- и p-элементов отданы все
электроны внешнего энергетического уровня, у
атомов d-элементов и часть электронов с
предвнешнего слоя недостроенного d-подуровня).
Следовательно, дальнейшая отдача электронов
таким атомом невозможна, и атом элемента в
своей высшей степени окисления может быть
только окислителем.
Если атом элемента находится в своей
промежуточной степени окисления, то возможны
как процесс дальнейшей отдачи электронов, так
и процесс присоединения, т.е. атом обладает
окислительно-восстановительной
двойственностью – возможностью вступать в
реакции как с восстановителями, так и с
окислителями.

Изменение окислительно-восстановительных
свойств выглядит следующим образом
Cl1-
HCl
Cl0
Cl1+
Cl3+
Cl5+
Cl2
HClO
HClO2
HClO3
Cl7+
HClO4
Низшая
степень
окисления – только
восстановительные
свойства
Промежуточная
степень окисления –
окислительные
и
восстановительные
свойства
Высшая
степень
окисления – только
окислительные
свойства
Число групп SO4-2 в правой части стало на 8 больше, чем
в левой части уравнения, поэтому для материального
баланса по группам SO4-2 надо добавить в левую часть
уравнения 8 молекул h3SO4:
2KMnO4 + 10FeSO4 + 8h3SO4 → K2SO4 + 5Fe2(SO4) 3
+ 2MnSO4
Считаем сколько атомов водорода в левой части
уравнения и в правой части. В левой 16 атомов водорода, в
правой части их нет совсем. Для соблюдения
материального баланса по водороду в правую часть
добавляем 8 молекул воды:
2KMnO4 + 10FeSO4 + 8h3SO4→ K2SO4 + 5Fe2(SO4)3 +
2MnSO4 + 8h3O
Это окончательное уравнение.
 Для проверки
Для проверкидостаточно подсчитать число атомов водорода и
кислорода в каждой части уравнения. Если числа
совпадают, то уравнение составлено верно.
Этот многоступенчатый метод составления
уравнений
окислительно-восстановительных
реакций приведен для понимания логики
решения многих задач.
22. Метод электронного баланса
Пример.1) Zn0 + h3+SO4 (разб) → Zn+2SO4 + h30
Zn0 — 2 ē → Zn+2
2H+ + 2 ē → h30
Zn0 + 2H+→ Zn+2 + h30
+2 = +2 – проверка
2) Fe0 + 2H+1Cl(разб) → Fe+2Cl2 + h30↑
Fe0 — 2ē → Fe+2
2H+1 + 2ē → h30
Fe0 + 2H+1 →Fe+2 + h30
+2 = +2
3) 2Fe + 6h3SO4 (конц)→Fe2(SO4)3 + 3SO2 + 6h3O
Fe0 — 3ē → Fe+3
S+6 + 2ē → S+4
2Fe0 + 3S+6 →2Fe+3 + 3S+4
0 + 18
+ 6 + 12
+ 18 = + 18
Для соблюдения электронного баланса ищем
дополнительные множители.
24. Электронно-ионный метод (Метод полуреакций)
Реакции со сложными ионами в различных средах.Взаимодействие перманганата калия с сульфатом
калия в разных средах.

1) Кислая среда (избыток H+)
Написать уравнение в молекулярной форме и
расставить степени окисления
+7
+4
+2
+6
KMnO4 + K2SO3 +h3SO4 → MnSO4 + K2SO4 + h3O
Полное ионное уравнение:
K+ + MnO4-1 + 2K+ + SO3-2 + 2H+ +SO4-2 →
Mn+2 + SO4-2 +2K+ + SO4-2 + h3O
Подчеркнуты ионы, которые изменили свой внешний
вид.
Записать эти частицы претерпевшие изменения,
т.е. незавершенные полуреакции:
MnO4-1 → Mn+2
SO3-2 → SO4-2
Установим материальный баланс:
MnO4-1 + 8H+ → Mn+2 + 4h3O
SO3-2 + h3O → SO4-2 + 2H+
Составим баланс по разделам:
MnO4-1 + 8H+ → Mn+2 + 4h3O
-1+8 → +2+0
+7 → +2
Прибавим в левую часть пять электронов.
SO3-2 + h3O → SO4-2 + 2H+
-2+0 → -2+2
-2 → 0
Следовательно надо отнять два электрона в
левой части.
Составим электронный баланс (число отданных
электронов должно быть равно числу принятых
электронов)
MnO4-1+ 8H+ + 5ē → Mn+2 + 4h3O
2
10
SO3-2 + h3O — 2ē → SO4-2 + 2H+
5
MnO4-1 + 16H+ + 5SO3-2 + 5h3O→
2Mn+2 + 8h3O + 5SO4-2 + 10H+
Сложим левые и правые части полуреакций с
учетом дополнительных множителей.
 Сохраним
Сохранимодинаковые частицы в левой и правой части
уравнения.
2MnO4-1 + 5SO3-2 + 6H+→2Mn+2 + 5SO4-2 + 3h3O
-2+(-10)+6 → +4+(-10)+0
-6 = -6
Заряд левой части равен заряду правой части
(уравнение составлено верно). Полученные
коэффициенты
переносим
в
уравнение,
написанное в молекулярной форме:
2KMnO4 + 5K2SO3 + 3h3SO4→2MnSO4 + 6K2SO4 +
3h3O
Итак, в кислой среде каждая избыточная частица
кислорода взаимодействует с двумя ионами
водорода (2H+) с образованием воды, а каждая
недостающая частица кислорода (O-2) берется из
воды с образованием двух ионов водорода (2H+).
29. 2) Щелочная среда (избыток OH- и h3o)
+7+4
+6
+6
KMnO4 + K2SO3 + KOH → K2MnO4 + K2SO4 + h3O
Окислитель восстановитель
MnO4-1 + ē → MnO4-2
SO3-2 +2OH- — 2ē → SO4-2 + h3O
2MnO4-1 + SO3-2 +2OH- → 2MnO4-2 + SO4-2 + h3O
-2+(-2)+(-2) → 2*(-2)+(-2)+0
-6 = -6 — проверка.
Переносим коэффициенты в молекулярное
уравнение:
2KMnO4 + K2SO3 + KOH → 2K2MnO4 + K2SO4 +
h3 O
Итак, в щелочной среде каждая недостающая
частица кислорода (O-2) берется из двух
гидроксильных групп с образованием молекул
воды, а каждая избыточная частица кислорода
связывается с молекулой воды с образованием
двух гидроксильных групп (2OH-).

Каждая избыточная частица водорода (H+)
связывается с гидроксильной группой с
образованием молекул воды.
31. 3) Нейтральная среда (HOH)
В нейтральной среде каждая избыточная частицакислорода взаимодействует с молекулой воды с
образованием двух гидроксильных групп (2OH-).
Недостающая частица кислорода берется из воды
с образованием двух ионов водорода (2H+).
Пример: KMnO4 + K2SO3 + h3O → MnO2↓ + K2SO4
+…
MnO4-1 → MnO20
SO3-2 → SO4-2
MnO4-1 + 2h3O + 3ē → MnO20 + 4OH SO3-2 + h3O — 2ē → SO4-2 + 2H+
2MnO4-1 + 4h3O + 3SO3-2 +3h3O → 2MnO2 + 8OH+3SO4-2 + 6H+
2MnO4-1 + 3SO3-2 + 7h3O → 2MnO2 + 3SO4-2 + 6h3O +
2OH 2MnO4-1 + 3SO3-2 + h3O → 2MnO2 + 3SO4-2 + 2OH -8 = -8 — проверка
2KMnO4 + 3K2SO3 + h3O → 2MnO2 + 3K2SO4 +
2KOH
Итак, среда влияет на характер протекания
реакции.
33. Реакции внутремолекулярного взаимодействия
KMnO4 → MnO2 + K2MnO4 + O20В одном и том же веществе находятся и
окислитель и восстановитель, но эти функции
выполняют разные атомы.

Уравняем реакцию методом электронного
баланса, так как это реакция разложения
кристаллического вещества:
Mn+7 + 3ē → Mn+4
Mn+7 + 1ē → Mn+6
2O-2 — 4ē → O20
2Mn+7 + 4ē → Mn+4 + Mn+6
2O-2 — 4ē → O20
2Mn+7 + 2O-2 → Mn+4 + Mn+6 + O20
+10 = +10 – проверка
2KMnO4 → MnO2 + K2MnO4 + O20
35. Реакции диспропорционирования
В одном и том же веществе окислитель ивосстановитель,
но
эти
функции
несут
одинаковые атомы с одинаковыми зарядами.
Пример: Cl20 + h3O → HCl-1 + HClO
Реакции идут в растворе, уравняем методом
полуреакций:
Cl0 → Cl-1
Cl0 → ClO-1
Cl0 + ē → Cl-1
Cl20 + h3O — ē → ClO-1 + 2H+
Cl20 + h3O → Cl-1 + ClO-1 + 2H+
0=0
Конечное уравнение:
Cl2 + h3O = HCl + HClO
К окислительно-восстановительным реакциям
относятся реакции разложения нитратов (соли
азотной кислоты).
Соли азотной кислоты
при нагревании
разлагаются, продукты разложения зависят от
солеобразующего металла в ряду стандартных
электронных потенциалов:
Пример: Разложение нитрата кальция
+5 -2
+3
Ca(NO3)2 → Ca(NO2)2 + O20
N+5 + 2ē → N+3
2O-2 — 4ē → O2
2N+5 + 2O-2 → 2N+3 + O2
+6 = +6 – проверка
Конечное уравнение:
Ca(NO3)2 → Ca(NO2)2 + O2
Разложение нитрата цинка:
Zn(NO3)2 → ZnO + N+4O2 + O20
N+5 + ē →N+4
2O-2 — 4ē → O20
4N+5 + 2O-2 → 4N+4 + O20
+16 = +16 – проверка
Разложение нитрата серебра:
+1
+5 -2
→ Ag0
+4
AgNO3
+ NO2 + O20
Ag+1 + ē → Ag0
N+5 + ē → N+4
2O-2 + 4ē → O2
Ag+1 + N+5 + 2ē → Ag0 + N+4
2O-2 + 4ē → O2
2Ag+1 + 2N+5 + 2O-2 → 2Ag0 + 2N+4 + O2
+8 = +8 – проверка
Разложение при нагревании (термолиз) – важное
свойство солей азотной кислоты.

39. Фотосинтез — это единственно важный первичный источник энергии для всего живого 6CO2 + 6h3O → C6h22O6 + 6O2
40. Горение топлива
41. Получение металлов
42. Коррозия металлов
а. Сu + HNO3 → Cu(NO3)2 + NO2 + h3O2 NO3- + 2H+ + e = NO2 + h3O
1 Cu = Cu2+ + 2e
———————————————————2NO3- + 4H+ + Cu = 2NO2 + 2h3O + Cu2+
Сu + 4HNO3 = Cu(NO3)2 + 2NO2 + 2h3O
б. Сu + HNO3 → Cu(NO3)2 + NO + h3O
3 Cu = Cu2+ + 2e
———————————————————2NO3- + 8H+ + 3Cu = 2NO + 4h3O + Cu2+
3Сu + 8HNO3 = 3Cu(NO3)2 + 2NO + 4h3O
в. Zn + HNO3 → Zn(NO3)2 + N2O + h3O
1 2NO3- + 10H+ + 8e = N2O + 5h3O
4 Zn = Zn2+ + 2e
———————————————————2NO3- + 10H+ + 4Zn = N2O + 5h3O + 4Zn2+
4Zn + 10HNO3 = 4Zn(NO3)2 + N2O + 5h3O
г. Zn + HNO3 → Zn(NO3)2 + N2 + h3O
1 2NO3- + 12H+ + 10e = N2 + 6h3O
5 Zn = Zn2+ + 2e
———————————————————2NO3- + 12H+ + 5Zn = N2 + 6h3O + 5Zn2+
5Zn + 12HNO3 = 5Zn(NO3)2 + N2 + 6h3O
д.
 Zn + HNO3 → Zn(NO3)2 + Nh5NO3 + h3O
Zn + HNO3 → Zn(NO3)2 + Nh5NO3 + h3O1 NO3- + 10H+ + 8e = Nh5+ + 3h3O
4 Zn = Zn2+ + 2e
———————————————————NO3- + 10H+ + 4Zn = Nh5+ + 3h3O + 4Zn2+
4Zn + 10HNO3 = 4Zn(NO3)2 + Nh5NO3 + 3h3O
е. S + HNO3 → h3SO4 + NO
2 NO3- + 4H+ + 3e = NO + 2h3O
1 S + 4h3O = SO42- + 8H+ + 6e
———————————————————2NO3- + 8H+ + S + 4h3O = 2NO + 4h3O + SO42- + 8H+
S + 2HNO3 → h3SO4 + 2NO
ж. S + HNO3 → h3SO4 + NO2 + h3O
6 NO3- + 2H+ + e = NO2 + h3O
1 S + 4h3O = SO42- + 8H+ + 6e
———————————————————6NO3- + 12H+ + S + 4h3O = 6NO2 + 6h3O + SO42- + 8H+
S + 6HNO3 = h3SO4 + 6NO2 + 2h3O
з. P + HNO3+ h3O → h4PO4 + NO
5 NO3- + 4H+ + 3e = NO + 2h3O
3 P + 4h3O = PO43- + 8H+ + 5e
———————————————————5NO3- + 20H+ + 3P + 12h3O = 5NO + 10h3O + 3PO43- + 24H+
3P + 5HNO3 + 2h3O = 3h4PO4 + 5NO
и. P + HNO3 → h4PO4 + h3O + NO2
5 NO3- + 2H+ + e = NO2 + h3O
1 P + 4h3O = PO43- + 8H+ + 5e
———————————————————5NO3- + 10H+ + P + 4h3O = 5NO2 + 5h3O + PO43- + 8H+
к.
 FeO + HNO3 → Fe(NO3)3 + NO2 + h3O
FeO + HNO3 → Fe(NO3)3 + NO2 + h3O1 NO3- + 2H+ + e = NO2 + h3O
1 FeO + 2H+ = Fe3+ + h3O + e
———————————————————NO3- + 2H+ + FeO + 2H+ = NO2 + h3O + Fe3+ + h3O
FeO + 4HNO3 = Fe(NO3)3 + NO2 + 2h3O
English Русский Правила
33. Окислительно-восстановительные сис. Степ окисл. Процессы ок и вос. Пр типичных ок и восстанов.
Окислительно-восстановительные системы (ОВРеакции) ОВР – это реакции, которые сопровождаются изменением степ окисления реагентов в результате полн или частичного переноса электронной плотности .
Степень окисления – условный заряд элемента в соединении, вычисленный, исходя из предположения, что все связи ионные, т.е все электронные пары его химических связей смещены в сторону более электроотрицательного атома. Определение степени окисления проводят, используя следующие правила
: 1.Степень
окисления элемента в простом веществе,
например, в металле или H2,
N2,O3 равна нулю.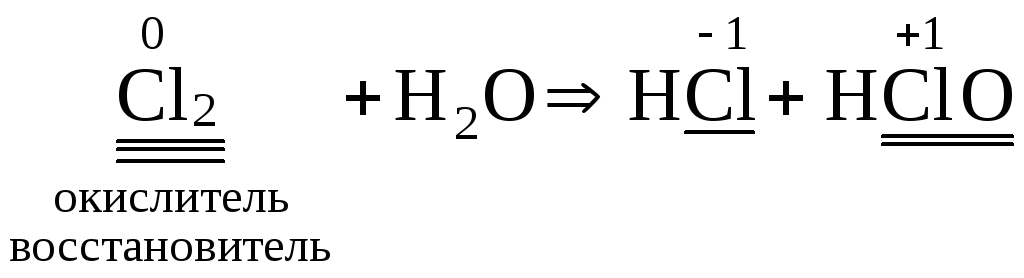
2.Степ окисления эл-та в виде одноатомного иона в соед, имеющим ионное строение, = заряду данного иона.
3.В соединениях с ковалентными полярными связями отрицательный заряд относят к более электроотрицательному элементу, причём принимают следующие степени окисления: а)для фтора -1; б)для кислорода — 2, за исключением пероксидов, где С.О.= -1, надпероксидов (С.О.= -1/2), озонидов (С.О.= -1/3) иOF2 (C.О.=+2 ) в)для водорода С.О.=+1, за исключением солеобразных гидридов, например LiH, где С.О.= -1 г)для щёлочных и щёлочно-земельных металлов С.О.=+1 и +2 соответственно.
4
Процессы
окисления и восстановления. Окисление-
отдача электронов веществом, т.е.
повышение степени окисления элемента. Zn0—
2е→ Zn2+.
С.О. цинка повышается от 0 до +2.
Восстановление- это смещение электронов
к веществу или понижение степени
окисления элемента.
Zn0—
2е→ Zn2+.
С.О. цинка повышается от 0 до +2.
Восстановление- это смещение электронов
к веществу или понижение степени
окисления элемента.
Примеры типичных окислителей и восстановителей Типичные ок: (хар-ся высоким положит окислит-восст потенциалом): а)Простые в-ва, атомы которых обладают большой ЭО. Пример I2, Br2, O2,Cl2,F2. б)Сложные в-ва, в которых атомы имеют наивысшую положит степень окисления.
пример: KMnO4, HNO3. Типичные восст (хар-ся низким часто отрицат окислит-восст потенциалами)
а)Простые в-ва ,атомы которых обладают низкими значениями энергии ионизации и малой ЭО. Li,Na,K,Cu,Al,Zn,H. б)сложные в-ва, содержащие атомы в низшей степени окисления, часто в отрицательной. Пр H2S, Nh4, HCl
ОВР-реакции,
которые сопровождаются изменением
степени окисления реагентов в результате
полного и частичного переноса эл.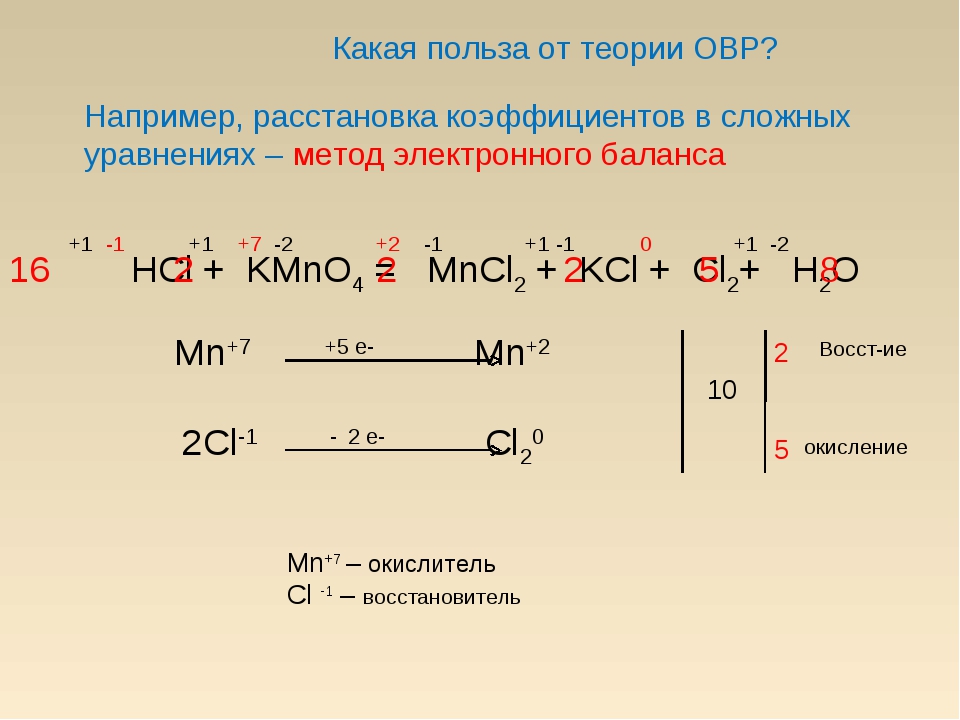 плотности.
плотности.
ОВР делятся на типы: 1. Межмолекулярные р-ции – в которых окисилит и восстанов представляют собой разные вещества. Cu+2FeCl3→CuCl2+2FeCl2
1) определяем окисл. и вос. среди исходных вещей; 2)предполагаем вариант изменения их степени ок. в р-ции ОВР; 3) составляем баланс, записываем электродные потенциалы, определяем возможность протекания р-ции; 4) если р-ция возможна, то записываем ур-ние.
2. Внутримолекулярные реакции – окислит и восстан служат атомы или ионы одной и той же молекулы. (Nh5)2Cr2O7→N2+Cr2O3+4h3O
3. Р-ции диспропорционирования протекают с одновременным ↓и ↑степ окисл-я атомов одного и того же эл-та. Cl2+h3O→HCl+HClO
При
составлении ОВР применяют Метод
электронного баланса:
Ок-е и восстан-е выражают электронными
ур-ми, в которых указывают изменение
степени окисления атома восст-ля и
окислителя, а также число отданных и
принятых электронов. Коэффиц-ты
подбираются так, чтобы соблюдался баланс
отданных и принятых электронов.
Коэффиц-ты
подбираются так, чтобы соблюдался баланс
отданных и принятых электронов.
pH среда создается добавлением в ур-ние р-ции молекул к-ты, воды или оснований.
Среда может ослабить окислит-восст св-ва соединений, а иногда изменить направление процесса. Реакция As2O3+2I2+2h3O→As2O5+4HI в прямом направлении идет только в нейтральной и щелочной средах. Чем меньше кислотность среды, тем, как правило, менее глубоко идет процесс: перманганат восстанавливается до Mn2+ в кислой среде, до MnO2 — в нейтральной и до MnO42- в щелочной среде.
Сопряженное основание HClO(4) слабее основания, чем H(2)O
Рекомендуемые вопросы
9 видеоРЕКЛАМА
Ab Padhai karo bina ads ke
Khareedo DN Pro and dekho sari videos bina kisi ad ki rukaavat ke!
Пошаговое решение от экспертов, которое поможет вам избавиться от сомнений и получить отличные оценки на экзаменах.
Стенограмма
11 Английский вопрос неверное утверждение об услугах в cl4nx cielo Vista найти здесь в первый раз, говоря, что вариант говорит, что центральный атом в обоих hclo4 hclo3 найти там, так что hclo4 даст этот тип структуры тяжелее Атом CL и даст этот тип структуры, в основном он существовал при федеральной структуре, и гидратация будет равна SP3, хорошо, потому что он будет содержать 4 сигма-связи и связь Pi, поэтому из этой комбинации только с одной, поэтому координационное число будет равно будет раньше и была связь между 3, и она будет называться второй как таковой, я буду выглядеть так, я буду CL, и только если я буду содержать на работе и всего одну одинокую пару, чтобы арендовать на Thi одинокую пару и одинокую пару, а также одну
Сигма-пруд всего 24, так что он также гибридизируется с SP3, достиг такой же формы, поэтому первый член находится рядом со вторым hclo4 образуется в реакции между cl2 и h3O. см. здесь, когда h3O + cl2 будет реагировать, это даст HCL вместе с ним даст певцу clo2 офисную форму HCL, но здесь, в форме CL Liu, это утверждение неверно в третьем варианте. C говорит, что сопряженная база hclo4 является более слабой базой, чем h3ocean. здесь у нас есть clo4 hclo4, это даст сопряженное базовое значение h + Ion clo4 -2 между сильной кислотой сильной кислотой по сравнению с h3O и здесь h3O, когда будет настроено Desire kamjor Gate base watch
см. здесь, когда h3O + cl2 будет реагировать, это даст HCL вместе с ним даст певцу clo2 офисную форму HCL, но здесь, в форме CL Liu, это утверждение неверно в третьем варианте. C говорит, что сопряженная база hclo4 является более слабой базой, чем h3ocean. здесь у нас есть clo4 hclo4, это даст сопряженное базовое значение h + Ion clo4 -2 между сильной кислотой сильной кислотой по сравнению с h3O и здесь h3O, когда будет настроено Desire kamjor Gate base watch
сопряженное основание указывает на основание, поэтому здесь это слабая кислота слабая кислота, поэтому слабая кислота даст сильное сопряженное основание, поэтому оно должно быть сильным сопряженным основанием, чтобы быть сильным и слабым, потому что оно будет иметь сильную кислоту, сильную или слабую основание это большой бас-бас и сильное сопряженное основание, поэтому это утверждение говорит о том, что сопряженное основание hclo4 является более слабым основанием, чем заявление HTC Desire 816. Утверждение заявления является единственным заголовком для более кислотного, чем HCL, поскольку из-за права является правильным потому что на кло4 даст шаг сопряженной базы а — 16 ничья структура должна выглядеть как в этом году СПЛ и О — там будет и деструктивный вид вот так и это будет стабилизировано этим негативом установленным этим резонансом это будет
поэтому очень стабильный, но в этом случае он будет содержать только этот кислород, поэтому он не так уж и стабилен, это сопряженное с ауром основание hclo4 hclo3 основание hclo4 хорошо, так что слабая кислота при этом очень стабильна, но это это невозможно, потому что это отсутствие национального, поэтому этот последний термин правильный, поэтому текущее местоположение в правильном сегменте — вариант B Вариант наук, мы благодарим вас (ii) HClO2, (iii) HClO3 и (iv) HClO4, равно (являются)
141188413
Text Solution
Eplain, почему устойчивость оксакислот хлора увеличивается в порядке, указанном ниже? 201236145 Text Solution Объясните, почему устойчивость оксокислот хлора увеличивается в порядке, указанном ниже. 234825854 Неверное утверждение об оксокислотах HClO_(4) и HClO 278664942 (i) hclo, (ii) hclo2, (iii) hclo3 तथा (iv) hclo4 के सन्दर्भ में सही विकल्प/विकल्पों है (हैं) 334959571 hcio4 औ औ के के के के के के के के. 555834801 Объясните, почему устойчивость оксокислот хлора увеличивается в следующем порядке:
HClO 614493521 (A) Кислотность увеличивается от HOCl до HClO_(4) (R ) Степень окисления хлора увеличивается от HClO до HClO_(4) 637871361 Название IUPAC: хлорноватистая кислота, хлорноватистая кислота (I), хлоранол, гидроксидхлор В химии и производстве электролиз — это метод, в котором используется постоянный электрический ток (DC) для запуска химической реакции, которая в противном случае не была бы самопроизвольной. Ключевым процессом электролиза является обмен атомами и ионами путем удаления или добавления электронов из внешней цепи. Электрический потенциал прикладывается к паре электродов, погруженных в электролит. Каждый электрод притягивает ионы противоположного заряда. Положительно заряженные ионы (катионы) движутся к электронному (отрицательному) катоду. Отрицательно заряженные ионы (анионы) движутся к электроноэкстрагирующему (положительному) аноду. Например, первым шагом в производстве хлорноватистой кислоты является электролиз соляного раствора соленой воды с получением водорода и хлора, продукты являются газообразными. Эти газообразные продукты выделяются из электролита и собираются. 2 NaCl(т) + 2 ч30(л) → 2 NaOH(водн.) + h3(г) + Cl2(г) Ионообменная мембрана изготовлена из полимера, пропускающего только положительные ионы. Это означает, что через мембрану могут проходить только ионы натрия из раствора хлорида натрия, а не ионы хлорида. Преимущество этого заключается в том, что раствор гидроксида натрия, образующийся в правом отсеке, никогда не загрязняется каким-либо раствором хлорида натрия. Используемый раствор хлорида натрия должен быть чистым. Если бы он содержал ионы других металлов, они также прошли бы через мембрану и таким образом загрязнили бы раствор гидроксида натрия. На катоде образуется водород: На катоде образуется гидроксид натрия: На аноде образуется хлор: Загрязнен кислородом из-за реакции : Добавление хлора к воде дает как соляную кислоту (HCl), так и хлорноватистую кислоту (HOCl): Значение рН определяет содержание свободного хлора в водных растворах. При pH от 5 до 6 хлорсодержащие соединения почти на 100 % состоят из хлорноватистой кислоты (HOCl). Когда pH падает ниже 5, он начинает превращаться в Cl2 (газообразный хлор). При pH выше 6 он начинает превращаться в ион гипохлорита (OCl-). Хлорноватистая кислота является слабой кислотой (pKa около 7,5), что означает, что она слегка диссоциирует на
ионы водорода и гипохлорита, как указано в уравнении: : HOCl ⇌ H+ + OCl- При pH от 6,5 до 8,5 эта диссоциация неполная, и в некоторой степени присутствуют как HOCl, так и OCl-. Поскольку бактерицидное действие HOCl намного выше, чем у OCl-, предпочтительным является хлорирование при более низком pH. Гермицидная эффективность хлорноватистой кислоты (HOCl) намного выше, чем у иона гипохлорита (OCl-). Распределение соединений хлора между HOCl и OCl- определяется рН, как обсуждалось выше. Поскольку HOCl преобладает при низком pH, хлорирование обеспечивает более эффективную дезинфекцию при низком pH. При высоком рН преобладает OCl-, что вызывает снижение эффективности обеззараживания. Хлор — чрезвычайно эффективное дезинфицирующее средство для инактивации бактерий. В исследовании, проведенном в 1940-х годах, изучались уровни инактивации в зависимости от времени для E. coli, Pseudomonas aeruginosa, Salmonella typhi и Shigella dysenteriae.
(Баттерфилд и др., 1943).
Результаты исследования показали, что HOCl более эффективен, чем OCl-, для инактивации этих бактерий. Эта самая большая проблема заключалась в том, чтобы создать хлорноватистую кислоту с почти нейтральным pH вместо газообразного хлора или гипохлорита и сделать это в стабильной форме. Хлорноватистая кислота является метастабильной молекулой. Он хочет вернуться к соленой воде или преобразовать в гипохлорит. Одним из величайших достижений стала разработка технологии с одной ячейкой, в которой вырабатывается один поток свободного хлора без побочного продукта гидроксида натрия (NaOH). Эта технология привела к разработке более стабильных растворов хлорноватистой кислоты и позволила лучше контролировать рН образующегося свободного хлора.
HClO
HClO Химия хлорноватистой кислоты
Химия
Хлорноватистая кислота
Другие названия: гипохлорит водорода, гидроксид хлора, электролизированная вода, электролизированная окислительная вода, электроактивированная вода
Номер CAS: 7790-92-3
Молярная масса: 52,46 г/моль
Молекулярная формула : HOCl
Внешний вид : Бесцветный водный раствор
Растворимость в воде : Растворим
Кислотность : 7,53 Электролиз
 Электролиз имеет коммерческое значение как этап выделения элементов из природных источников. Электролиз хлорида натрия (NaCl) и воды (h3O) можно использовать для получения хлорноватистой кислоты. Технология электролиза была впервые объяснена Майклом Фаррадеем, когда он разработал законы электролиза в 1830-х годах. Проведение электрического тока через два электрода в соляном растворе может привести к образованию газообразного хлора, гипохлорита натрия (отбеливатель или NaOCl), хлорноватистой кислоты, гидроксида натрия, газообразного водорода, озона и следов других возникающих окислителей.
Электролиз имеет коммерческое значение как этап выделения элементов из природных источников. Электролиз хлорида натрия (NaCl) и воды (h3O) можно использовать для получения хлорноватистой кислоты. Технология электролиза была впервые объяснена Майклом Фаррадеем, когда он разработал законы электролиза в 1830-х годах. Проведение электрического тока через два электрода в соляном растворе может привести к образованию газообразного хлора, гипохлорита натрия (отбеливатель или NaOCl), хлорноватистой кислоты, гидроксида натрия, газообразного водорода, озона и следов других возникающих окислителей. В химии потеря электронов называется окислением, а приобретение электронов называется восстановлением.
В химии потеря электронов называется окислением, а приобретение электронов называется восстановлением. Membrane Cell Technology

2H+(aq) + 2e- → h3(g)
Na+(водн.) + OH-(водн.) → NaOH(водн.)
2Cl-(водн.) — 2e- → Cl2(г)
4OH-(водн.) — 4e- → 2h3O(ж) + O2(г)
Cl2(г) + h3O ⇌ HOCl(водн.) + HCl(водн.)
Cl2(г) + 4 OH- ⇌ 2 ClO-(водн.) + 2 h3O(ж) + 2 e-
Cl2(г) + 2 e- ⇌ 2 Cl-(водн.) 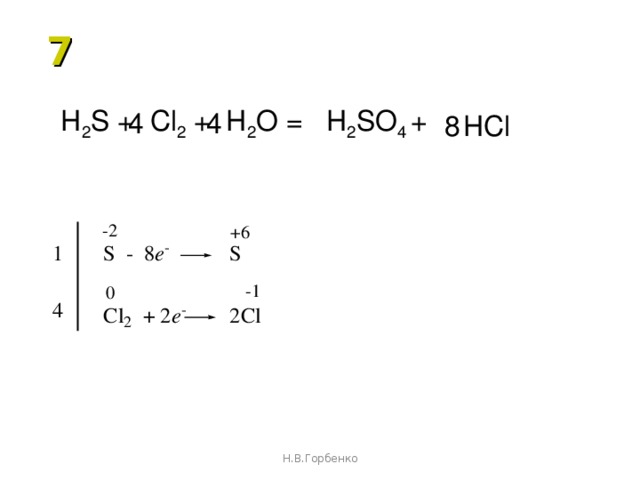 Ниже pH 6,5 диссоциация HOCl не происходит, а выше pH 8,5 происходит полная диссоциация до OCl-.
Ниже pH 6,5 диссоциация HOCl не происходит, а выше pH 8,5 происходит полная диссоциация до OCl-. Инактивация бактерий
 Эти результаты были подтверждены несколькими исследователями, которые пришли к выводу, что HOCl в 70-80 раз более эффективен, чем OCl- для инактивации бактерий.
(Калп/Веснер/Калп, 1986).
С 1986 года появились сотни публикаций, подтверждающих превосходство HOCl над OCl- (см. базу данных исследований ).
Эти результаты были подтверждены несколькими исследователями, которые пришли к выводу, что HOCl в 70-80 раз более эффективен, чем OCl- для инактивации бактерий.
(Калп/Веснер/Калп, 1986).
С 1986 года появились сотни публикаций, подтверждающих превосходство HOCl над OCl- (см. базу данных исследований ). Технология с одной ячейкой

