Лучший ответ по мнению автора | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||
|
|
| |||||||||||||||||||||||||||||||||||||||||||||||||||
Посмотреть всех экспертов из раздела Учеба и наука
| Похожие вопросы |
чему равны индуктивность и энергия магнитного поля соленоида , если при силе тока, равной 4А, магнитный поток через соленоид и равен 0,4 вб
Твір на тему «девіз України яким йому бути»
х^2+x^2 сколько будет
Помогите составить условие задачи: у Иры в коллекции есть 26марок,посвящённые историческим событиям,а так же марки,посвящённые архитектуре и спорту,марок по архитектуре у неё на 15 больше чем по
Решение задач по химии. Закон Рауля
Закон Рауля
Пользуйтесь нашим приложением
Опыт 2. Обменное взаимодействие между CuSo4 и NaOh
НАБЛЮДЕНИЯ: образовался осадок синего цвета
Молекулярное уравнение реакции:
CuSO4 + 2NaOH → Cu(OH)2 ↓+Na2SO4
Среди участников реакции нерастворимыми, трудно- или малорастворимыми веществами являются: Cu(OH)2↓.
При составлении ионно-молекулярного уравнения их формулы следует записать в молекулярной форме.
Среди участников реакции сильными электролитами, растворимыми в воде, являются NaOH ,CuSO4 ,NaSO4
При составлении ионно-молекулярного уравнения их формулы следует записать в ионной форме.
Среди участников
реакции слабыми
электролитами являются…… …………. .
.
…………………………………………………………………………………………
При составлении ионно-молекулярного уравнения их формулы следует записать в … ………………………………………(ионной или молекулярной) форме.
Полное ионно-молекулярное уравнение реакции:
Cu2++SO42- + 2Na+ + 2OH— → Cu(OH)2 ↓+2Na+ + SO42-
Краткое ионно-молекулярное уравнение реакции:
Cu2++2OH— → Cu(OH)2 ↓
В Ы В О Д
(о направленности протекания данной реакции)
Реакция протекает вправо, в сторону трудно растворимого соединения Cu(OH)2 ↓
Опыт 3. Обменное взаимодействие между BaCl2 и K2CrO4
НАБЛЮДЕНИЯ: образуется осадок жёлтого цвета
Молекулярное уравнение реакции:
BaCl2 + K2CrO4→BaCrO4↓ + 2KCl
Среди участников реакции нерастворимыми, трудно- или малорастворимыми веществами являются: BaCrO4↓
При составлении
ионно-молекулярного уравнения их формулы
следует записать в молекулярной форме.
Среди участников реакции сильными электролитами, растворимыми в воде, являются: K2CrO4, BaCl2, KCl
При составлении ионно-молекулярного уравнения их формулы следует записать в ионной форме.
Среди участников реакции слабыми электролитами являются………………..
…………………………………………………………………………………………
При составлении ионно-молекулярного уравнения их формулы следует записать в …………………………………………(ионной или молекулярной) форме.
Полное ионно-молекулярное уравнение реакции:
Ba2+ + 2Cl—+ 2K++CrO42-→BaCrO4↓ + 2K++2Cl—
Краткое ионно-молекулярное уравнение реакции:
Ba2+ + CrO42-→BaCrO4↓
В Ы В О Д
(о направленности протекания данной реакции)
Реакция
идет в сторону связывания ионов Ba2+ и CrO42- в трудно
растворимую соль.
Опыт 4. Обменное взаимодействие между KI и Hg(NO3)2
НАБЛЮДЕНИЯ:
Образование осадка оранжевого цвета.
Молекулярное уравнение реакции:
2KI + Hg(NO3)2 →HgI2↓ + 2KNO3
Среди участников реакции нерастворимыми, трудно- или малорастворимыми веществами являются: HgI2↓
При составлении ионно-молекулярного уравнения их формулы следует записать в молекулярной форме.
Среди участников реакции сильными электролитами, растворимыми в воде, являются KNO3, KI, Hg(NO3)2 .
При составлении ионно-молекулярного уравнения их формулы следует записать в ионной форме.
Среди участников реакции слабыми электролитами являются……
При
составлении ионно-молекулярного
уравнения их формулы следует записать
в ………………………………………. ..(ионной или
молекулярной) форме.
..(ионной или
молекулярной) форме.
Полное ионно-молекулярное уравнение реакции:
2K+ + 2I— + Hg2+ +2NO3—→HgI2↓ + 2K+ + 2NO3—
Краткое ионно-молекулярное уравнение реакции:
2I— + Hg2+ →HgI2↓
В Ы В О Д
(о направленности протекания данной реакции)
Реакция идет в сторону связывания ионов 2I— и Hg2+ в труднорастворимую соль HgI2,Опыт 5. Обменное взаимодействие между KI и Pb(NO3)2
НАБЛЮДЕНИЯ:
Образуется осадок ярко-желтого цвета
Молекулярное уравнение реакции:
2KI + Pb(NO3)2→PbI2↓ + 2KNO3
Среди участников реакции нерастворимыми, трудно- или малорастворимыми веществами являются: PbI2↓
При составлении
ионно-молекулярного уравнения их формулы
следует записать в молекулярной форме.
Среди участников
реакции сильными
электролитами,
растворимыми в воде, являются Pb(NO3)2,
K2NO
При составлении ионно-молекулярного уравнения их формулы следует записать в ионной форме.
Среди участников реакции слабыми электролитами являются………………..
…………………………………………………………………………………………
При составлении ионно-молекулярного уравнения их формулы следует записать в …………………………………………(ионной или молекулярной) форме.
Полное ионно-молекулярное уравнение реакции:
2K+ + 2I— + Pb2+ + 2NO3—→PbI2↓ + 2K++ 2NO3—
Краткое ионно-молекулярное уравнение реакции:
2I— + Pb2+ →PbI2↓
В Ы В О Д
(о направленности протекания данной реакции)
Реакция
идет в сторону связывания ионов 2I— и Pb 2+ в
труднорастворимую соль PbI 2↓.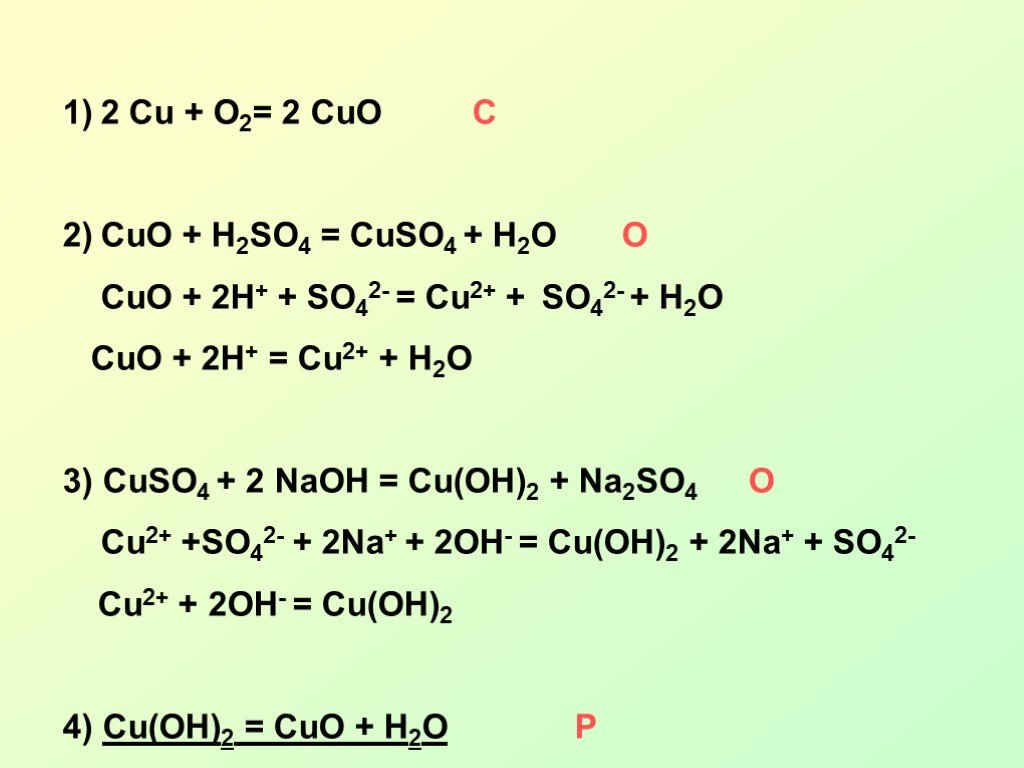
Опыт 6. Обменное взаимодействие между CoCl2 и NaOH
НАБЛЮДЕНИЯ:
при сливание CoCl2 и NaOH образуется осадок темно-синего цвета.
Молекулярное уравнение реакции:
CoCl2 + 2NaOH→Co(OH)2 ↓+ 2NaCl
Среди участников реакции нерастворимыми, трудно- или малорастворимыми веществами являются: Co(OH)2 ↓
При составлении ионно-молекулярного уравнения их формулы следует записать в молекулярной форме.
Среди участников реакции сильными электролитами, растворимыми в воде, являются NaCl, NaOH, CoCl2
При составлении ионно-молекулярного уравнения их формулы следует записать в ионной форме.
Среди участников
реакции слабыми
электролитами являются………………. .
.
…………………………………………………………………………………………
При составлении ионно-молекулярного уравнения их формулы следует записать в …………………………………………(ионной или молекулярной) форме.
Полное ионно-молекулярное уравнение реакции:
Co2+ + 2Cl— + 2Na+ + 2OH—→Co(OH)2 ↓+ 2Na+ + 2Cl—
Краткое ионно-молекулярное уравнение реакции:
Co2+ + 2OH—→Co(OH)2 ↓
В Ы В О Д
(о направленности протекания данной реакции)
Реакция идет в сторону связывания ионов Co2+ и 2OH— в нерастворимое основания Co(OH)2
14
Реакционная способность металлов и полууравнения
Реакционная способность металлов и полууравнения — VCE ChemistryХимия ВКЭ
. РЕАКЦИОННАЯ СПОСОБНОСТЬ МЕТАЛЛОВ
РЕАКЦИОННАЯ СПОСОБНОСТЬ МЕТАЛЛОВ
• Когда магний помещают в раствор сульфата меди, происходит
реакция, в результате которой на магнии образуется металлическая медь, и темно-синий цвет раствора бледнеет.
• Уравнение:
Mg (тв.) + CuSO4 (водн.) → Cu (тв.) + MgSO4 (водн.)
• Если поместить медную полоску в раствор сульфата магния,
не происходит.
•Поэтому можно заключить, что магний более реакционноспособен, чем медь.
•Например, калий
настолько реакционноспособен, что
встречается в природе как соединение, а не как чистый металл.
•
, с другой стороны, очень
нереактивный . Встречается в природе как чистый элемент
Встречается в природе как чистый элемент
Калий и золото противоположны ряду реактивности металлов
(также называемому рядом активности).
•
: Реакция между металлическим магнием и раствором сульфата меди.
•
:
Mg (тв.) + CuSO4 (водн.) → Cu (тв.) + MgSO4 (водн.) Cu 2+ (водн.) → Cu (тв.) + Mg 2+ (водн.)
Ряд реакционной способности металлов
Полууравнения
• Полууравнения полезны для понимания процессов, происходящих в окислительно-восстановительной реакции.
•Хотя
происходят одновременно, две реакции можно записать отдельно .
• Два реагента (окислитель и восстановитель) имеют свои полууравнения.
•
: Реакция между металлическим магнием и раствором сульфата меди. 9Уравнение ионов (s) → Mg 2+ (водн.) + 2e-
• Полууравнение восстановления :
Cu 2+ (водн.) + 2e- → Cu (s)
• Сопряженная окислительно-восстановительная пара состоит из двух компонентов (
), которые отличаются количеством электронов, перешедших от окислителя к восстановителю в ходе химической реакции.
• Сопряженные окислительно-восстановительные пары записываются как:
окислитель / восстановитель
• Например: Mg 2+ / Mg; Cu 2+ / Cu
• Электрохимический ряд металлов ранжирует металлы в порядке их реакционной способности.
• Наиболее активные металлы находятся в нижней части таблицы, так как они легче теряют электроны.
• Наиболее активные металлы являются сильнейшими восстановителями.
•Полууравнения записываются в том направлении, в котором происходит приведение.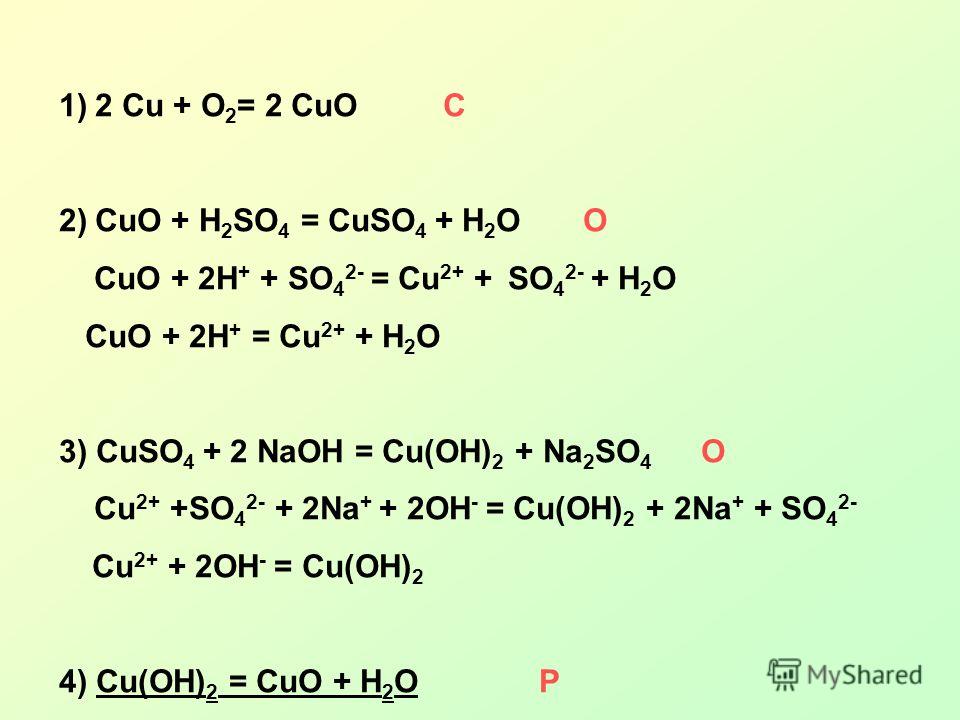
•Двойная стрелка (↔ ) используется для обозначения того, что реакция может протекать в обоих направлениях.
•Окислители слева.
•Восстановители справа.
•Самые сильные окислители указаны вверху слева в таблице.
Схема электрохимического ряда предоставлена Tem5psu (собственная работа) [CC BY-SA 3.0 (http://creativecommons.org/licenses/by-sa/3.0)], через Wikimedia Commons
Использование электрохимических рядов для предсказания окислительно-восстановительных реакций.
•Для окислительно-восстановительной реакции
вам понадобится окислитель
(левая сторона таблицы) и
восстановитель (правая часть таблицы).
•Для самопроизвольной реакции окислитель должен быть выше восстановителя в таблице.
•
: Металлический натрий (Na), добавленный к раствору нитрата свинца (Pb(NO3)2).
1. Посмотрите на Электрохимическую серию.
2.Pb 2+ – окислитель, Na – восстановитель.
3.Pb 2+ в таблице выше Na.
4. Произойдет спонтанная окислительно-восстановительная реакция.
5. Ионное уравнение:
2Na (тв.) + Pb 2+ (водн.) → Pb (тв.) + 2Na + (водн.)
восстановитель окислитель восстановитель окислитель
• Пример 2 : Металлическое олово (Sn), добавленное к раствору нитрата алюминия (Al(NO3)3).
1. Посмотрите на Электрохимическую серию.
2.Al 3+ – окислитель, Sn – восстановитель.
3.Al 3+ ниже Sn по таблице.
4. Самопроизвольной окислительно-восстановительной реакции не произойдет (нет реакции).
Подробнее о спонтанных окислительно-восстановительных реакциях | Викторина о окислительно-восстановительных реакциях |
Kahoot quiz — серия реактивности и окислительно-восстановительный потенциал
youtube.com/embed/UqxIsiN8do0″ frameborder=»0″ allowfullscreen=»»>Вопрос Видео: Написание уравнения реакции на аноде при электролизе раствора сульфата меди с использованием инертных электродов
Стенограмма видео
Какое уравнение описывает реакцию при анод при электролизе раствора сульфата меди с использованием инертных электроды?
В этом вопросе нам нужно предсказать продукты электролиза раствора соли сульфата меди. Электролиз – это химический процесс в котором электрический ток пропускают через жидкость или раствор, содержащий ионы, вызывают разложение веществ. Жидкость или раствор, который содержит подвижные ионы и подвергается электролизу, называется электролитом. В этой задаче электролит раствор сульфата меди (II), который имеет химическую формулу CuSO4 водный.
Теперь давайте рассмотрим основные
электролитическая ячейка, чтобы узнать, какие реакции происходят внутри. Здесь мы видим блок питания и
два электрода, которые будут использоваться для пропускания электрического тока через соль
решение. В электролизере анод
положительно заряженный электрод, а катод отрицательно заряженный
электрод. Эти электроды изготовлены из
инертное вещество, такое как платина или углерод. Они помогают пропускать электроны через
растворе, но не вступают в химические реакции.
Здесь мы видим блок питания и
два электрода, которые будут использоваться для пропускания электрического тока через соль
решение. В электролизере анод
положительно заряженный электрод, а катод отрицательно заряженный
электрод. Эти электроды изготовлены из
инертное вещество, такое как платина или углерод. Они помогают пропускать электроны через
растворе, но не вступают в химические реакции.
Чтобы ответить на этот вопрос, мы
необходимо определить, какая реакция протекает на аноде. Ионы, присутствующие в соли
раствором являются катион меди(II) и сульфат-анион. При электролизе электроны движутся
от анода к катоду. Положительно заряженные ионы меди
будет притягиваться к отрицательно заряженному катоду. Но нельзя забывать, что
водный раствор соли также содержит воду, и молекулы воды могут диссоциировать на
ионы H+ и OH–. Итак, положительно заряженный водород
ионы также притягиваются к катоду. На катоде происходит восстановление
место, которое относится к приросту электронов.
Итак, положительно заряженный водород
ионы также притягиваются к катоду. На катоде происходит восстановление
место, которое относится к приросту электронов.
Чтобы определить, являются ли ионы H+ или ионы Cu2+ будут восстановлены, нам нужно будет использовать ряд реактивности. Мы видим в сериале, что медь менее активна, чем водород. Когда металлический элемент меньше реактивен, чем водород, это означает, что он является лучшим окислителем, чем водород. Итак, на катоде каждый ион меди будет восстановлен за счет принятия двух электронов с образованием атомов металлической меди.
На аноде происходит окисление,
то есть потеря электронов. Однако нам нужно определить, является ли
гидроксид-ионы или сульфат-ионы будут окисляться на аноде. Чем более реакционноспособным будет анион.
окисляется на аноде. Мы знаем, что галогенид-ионы довольно
реактивный.

 10.17
10.17