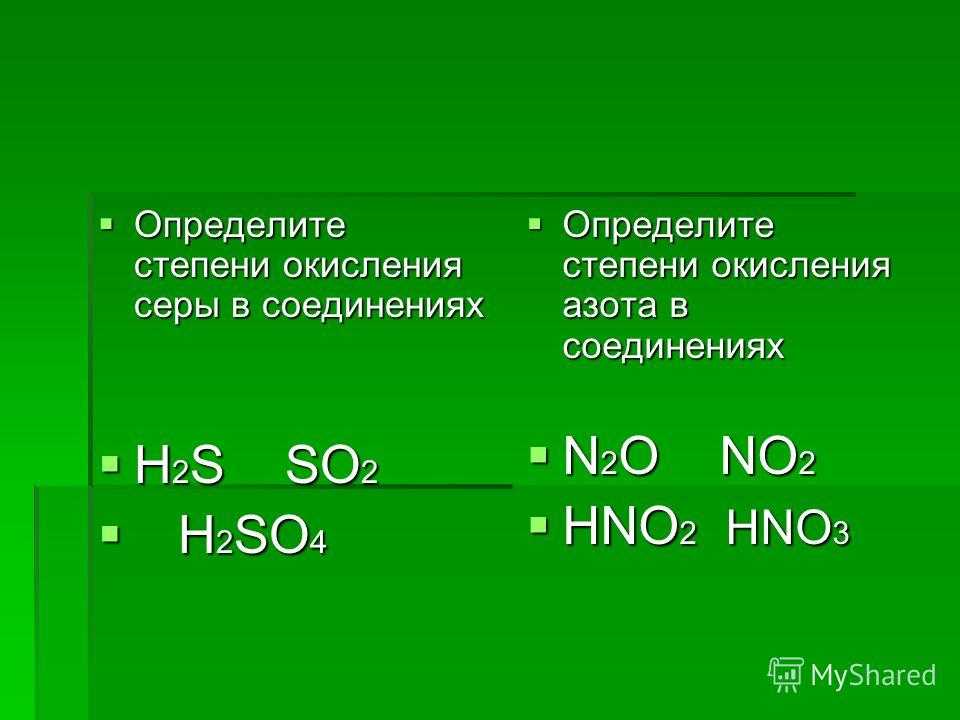
оксид меди(I), закись меди, Cu2O, оксид меди (II) CuO
Известны соединения, в которых медь имеет степень окисления один, два и три. Их можно рассматривать как производные соответствующих оксидов: Cu2O, СuО и Си2O3.Соединения меди(I), в общем, менее устойчивы, чем соединения меди(II). Оксид Сu2O3 и его производные весьма нестойки.
Соединения меди(I). Cu2O оксид меди(I) (cuprum oxydulatum,cuprous oxide, закись меди) Сu2O(молек. масса 143.08) встречается в природе в виде минерала куприта.
Cu2O представляет собой карминово-красный кристаллический порошок. Получаемый иногда аморфный препарат Cu2O имеет желтую или оранжевую окраску. Плотн.6,0г/см3, Т плавл.1235 0С, нерастворим в воде, растворяется в NH4OH. Соляная кислота в отсутствие воздуха превращает Cu2O в белый кристаллический порошок CuCl.
Искусственно Cu2O может быть получен путем нагревания раствора соли меди(II) со щелочью и каким-нибудь сильным восстановителем, например формалином или глюкозой:
2CuSO4+4NaOH+C6H12O6→Cu2O+2Na2SO4+C6H12O7+2H2O
Так же Cu2O можно получить сухим путем при нагревании до 10000С смеси металлической меди и оксида меди (I):
Cu+CuO→Cu2O
При нагревании в атмосфере кислорода медь окисляется в закись меди Cu2O, а затем в оксид меди(II):
2Cu+O2→Cu2O+O2→2CuO
При действии на Cu2O соляной кислоты получается бесцветный раствор хлорида меди(I) CuCl. Если разбавить этот раствор водой, то хлорид меди(I) выпадает в виде белого творожистого осадка, нерастворимого в воде. Он может быть получен также кипячением раствора хлорида меди(II) СuСl2
с металлической медью в солянокислой среде:CuCl2+Cu→2CuCl
Оксид меди(II)( окись меди, монооксид меди, cuprum oxydatum, copper oxide, молекулярная масса 79. 545; регистрационный номер CAS 1317-38-0, разлагается при 1026 0С не плавясь на Cu2O и O2; плотн.6.4-6.45г/см3)
545; регистрационный номер CAS 1317-38-0, разлагается при 1026 0С не плавясь на Cu2O и O2; плотн.6.4-6.45г/см3)
СuО — черные кристаллы или порошок, встречающиеся в природе (например, в виде минерала тенорита). Оксид меди почти нерастворим в воде, несколько растворим в NH4OH. При нагревании в струе водорода , монооксида углерода (CO) CuO легко восстанавливается до металлической меди:
CuO+H2→Cu+H2O
CuO+CO→Cu+CO2
В лаборатории CuO можно получить путем осаждения ионов Cu2+ действием NaOH или NH4OH с последующим прокаливанием Cu(OH)
CuSO4+2NaOH→CuO+Na2SO4+H2O
Оксид меди (II) CuO можно так же легко получить прокаливанием гидроксида меди:
Cu(OH)2→CuO+H2O
или карбоната гидроксомеди(II) Сu2(ОН)2СО3 :
Cu2(OH)2CO3→2CuO+CO2+H2O
или нитрата меди: 2Cu(NO3)2→2CuO+4NO2+O2
Оксид меди(II) проявляет окислительные свойства. При нагревании с различными органическими веществами СuО окисляет их, превращая углерод в диоксид углерода, а водород — в воду и восстанавливаясь при этом в металлическую медь. Этой реакцией пользуются при элементарном анализе органических веществ для определения содержания в них углерода и водорода.
При нагревании с различными органическими веществами СuО окисляет их, превращая углерод в диоксид углерода, а водород — в воду и восстанавливаясь при этом в металлическую медь. Этой реакцией пользуются при элементарном анализе органических веществ для определения содержания в них углерода и водорода.
CuO хорошо растворяется в кислотах, образуя соответствующие соли:
CuO+2HCl→ CuCl2+H2O
CuO+H2SO4→CuSO4+H2O
CuO+2HNO3→Cu(NO3)2+H2O
Оксид меди(II) применяется в производстве стекла и эмалей, получения других соединений меди.
ГОСТ16539-79 Реактивы. Меди(II) оксид. Технические условия.
1. Опишите классификацию и номенклатуру оксидов, приведите примеры соединений
КЛАССИФИКАЦИЯ
Несолеобразующие : CO, N2O, NO
Солеобразующие :
—Основные— это оксиды металлов, в которых последние проявляют
небольшую степень окисления +1, +2: Na2O; MgO; CuO
—Амфотерные— обычно оксиды металлов со степенью окисления +3, +4: Cr2O3; SnO2; + ZnO; Al2O3
—Кислотные-это оксиды неметаллов и металлов со степенью
окисления от +5 до +7: SO2; SO3; P2O5; Mn2O7; CrO3
Основным оксидам соответствуют основания, кислотным – кислоты,
амфотерным
– и те и другие.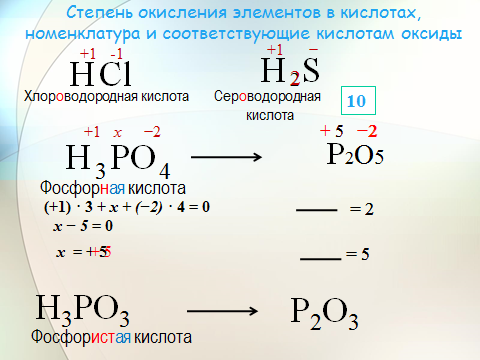
НОМЕНКЛАТУРА
ОКСИД + Э(русское название, род. падеж) + (валентность Э)
Примеры:
MgO – оксид магния
NiO – оксид никеля
Сu2О – оксид меди (I)
Fe2O3 – оксид железа (III)
SO2 – оксид серы (IV)
SO3 – оксид серы (VI)
Cl2O7 – оксид хлора (VII)
P2O5 – оксид фосфора (V)
2.Опишите способы получения оксидов, приведите примеры химических реакций .
Получение оксидов
1. Взаимодействие простых и сложных веществ с кислородом:
Ch5 + 2O2 = CO2 + 2h3O
2Mg + O2= 2MgO
4P + 5O2 = 2P2O5
S + O2 = SO2
2CO + O2 = 2CO2
2CuS + 3O2 = 2CuO + 2SO2
4Nh4 + 5O2 = 4NO + 6h3O ( в присутствии катализатора)
2. Разложение
некоторых кислородсодержащих веществ
(оснований,
Разложение
некоторых кислородсодержащих веществ
(оснований,
кислот, солей) при нагревании:
Cu(OH)2 t= Cu2O↓ + h3O
(CuOH)2CO3 = 2CuO + CO2 + h3O
2Pb(NO3)2 = 2PbO + 4NO2 + O2
2HMnO4 = Mn2O7 + h3O ( в присутствии h3SO4(конц.))
3. Опишите химические свойства оксидов
1. Взаимодействие с водой:
-Основные оксиды— образуется основание:
CaO + h3O = Ca(OH)2
-Кислотные оксиды— образуется кислота:
SO3 + h3O = h3SO4
P2O5 + 3h3O = 2h4PO4
Исключение SiO2, который с водой не
реагирует
2. Взаимодействие с кислотой или основанием:
-Основные оксиды— при реакции с кислотой образуется соль и вода:
MgO + h3SO4 t= MgSO4 + h3O
CuO + 2HCl t= CuCl2 + h3O
-Кислотные оксиды— при реакции с основанием образуется соль и вода:
CO2 + Ba(OH)2 =BaCO3 + h3O
SO2 + 2NaOH = Na2SO3 + h3O
Амфотерные оксиды взаимодействуют с кислотами как основные:
ZnO + h3SO4 = ZnSO4 + h3O
с основаниями как кислотные:
ZnO + 2NaOH + h3O = Na2[Zn(OH)4])
3. Взаимодействие основных и кислотных
оксидов между собой приводит к солям.
Взаимодействие основных и кислотных
оксидов между собой приводит к солям.
Na2O + CO2 = Na2CO3
4. Восстановление до простых веществ:
3CuO + 2Nh4 = 3Cu + N2 + 3h3O
P2O5 + 5C = 2P + 5CO
4.Опишите классификацию и номенклатуру основания, приведите примеры
Основания классифицируются по растворимости и по кислотности
— растворимые в воде (щелочи)
М – IА и IIА, кроме Be и Mg
NaOH, Ca(OH)2 ;
— нерастворимые в воде
Ni(OH)2, Cr(OH)3
-oднокислотные: NaOH, KOH — двухкислотные: Ca(OH)2
-трёхкислотные: Fe(OH)3
НОМЕНКЛАТУРА ОСНОВАНИЙ
ГИДРОКСИД
+ Э(русское название, род. падеж) +
(валентность Э)
падеж) +
(валентность Э)
NaOH – гидроксид натрия
Cr(OH)3 – гидроксид хрома (III)
Ba(OH)2 – гидроксид бария
Нанокубы Cu2O со смешанными гранями степеней окисления для (фото)каталитического гидрирования диоксида углерода
- Артикул
- Опубликовано:
- Лили Ван 1,2 ,
- Цисин Чжоу ORCID: orcid.org/0000-0003-4864-1715 1 ,
- Синь Ван ORCID: orcid.org/0000-0002-3522-5627 1 ,
- Томас Э. Вуд 2 ,
- Лу Ван ORCID: orcid.org/0000-0002-4165-4022 2 ,
- Paul N.
 Duchesne 2 ,
Duchesne 2 , - Jiuli Guo 2 ,
- Xiaoliang Yan 2,3 ,
- Meikun Xia 2 ,
- Young Feng Li 2 ,
- Abdinoor A. Jelle 2 ,
- Ulrich Ulmer 2 ,
- Jia Jia 2 ,
- Tian li0012 1 ,
- Вэй Сун 4 и
- …
- Джеффри А. Озин ORCID: orcid.org/0000-0002-6315-0925 2
9567 Доступ
140 цитирований
19 Альтметрический
Сведения о показателях
Субъекты
- Гетерогенный катализ
- Наночастицы
- Фотокатализ
Abstract
Закись меди (Cu 2 O), широко распространенный в земле недорогой полупроводник на основе оксида металла, привлек огромное внимание благодаря своей способности восстанавливать CO 2 в водной среде с помощью фотохимических, фотоэлектрохимических и электрохимических методов. Однако нерешенной проблемой всех этих подходов является нестабильность Cu 2 O, вызванная его тенденцией к необратимой реакции окислительно-восстановительного диспропорционирования. Здесь мы сообщаем о способе обойти это неприятное поведение Cu 2 O путем восстановления CO 2 в газовой фазе посредством гетерогенного фотокаталитического гидрирования. С этой целью были синтезированы нанокубы Cu 2 O с поверхностями, содержащими медные центры Cu(0,I,II) со смешанными степенями окисления, кислородные вакансии [O] и гидроксильные группы OH. Эти поверхности обеспечивают гетеролиз H 2 и адсорбцию CO 2 в мягких условиях; они облегчают обратную реакцию конверсии вода-газ, делая обратимой реакцию окислительно-восстановительного диспропорционирования. Этот синергизм обеспечивает Cu 2 O нанокубы с высокой фотокаталитической активностью и стабильностью.
Однако нерешенной проблемой всех этих подходов является нестабильность Cu 2 O, вызванная его тенденцией к необратимой реакции окислительно-восстановительного диспропорционирования. Здесь мы сообщаем о способе обойти это неприятное поведение Cu 2 O путем восстановления CO 2 в газовой фазе посредством гетерогенного фотокаталитического гидрирования. С этой целью были синтезированы нанокубы Cu 2 O с поверхностями, содержащими медные центры Cu(0,I,II) со смешанными степенями окисления, кислородные вакансии [O] и гидроксильные группы OH. Эти поверхности обеспечивают гетеролиз H 2 и адсорбцию CO 2 в мягких условиях; они облегчают обратную реакцию конверсии вода-газ, делая обратимой реакцию окислительно-восстановительного диспропорционирования. Этот синергизм обеспечивает Cu 2 O нанокубы с высокой фотокаталитической активностью и стабильностью.
Это предварительный просмотр содержимого подписки, доступ через ваше учреждение
Соответствующие статьи
Статьи открытого доступа со ссылками на эту статью.
Полная переработка никеля из сточных вод гальванопокрытий в фототермический катализ CO2
- Шэнхуа Ван
- , Дэйк Чжан
- … Джеффри А. Озин
Связь с природой Открытый доступ 09 сентября 2022 г.
Бром- и йод-мостиковые структурные элементы в металлоорганических каркасах для улучшенного транспорта носителя и фотовосстановления СО2 водяным паром
- Синфэн Чен
- , Чэндун Пэн
- … Хунхан Фэй
Связь с природой Открытый доступ 06 августа 2022 г.

Активные центры Cu–ZnO-катализаторов реакций конверсии водяного газа и гидрирования СО
- Чжэньхуа Чжан
- , Сюанье Чен
- … Вейсинь Хуан
Связь с природой Открытый доступ 15 июля 2021 г.
Варианты доступа
Подписаться на журнал
Получить полный доступ к журналу на 1 год
118,99 €
всего 9,92 € за выпуск
Подписаться
Расчет налога будет завершен во время оформления заказа.
Купить статью
Получите ограниченный по времени или полный доступ к статье на ReadCube.
32,00 $
Купить
Все цены указаны без учета стоимости.
Рис. 1: Механизм роста CF-Cu 2 O. Рис. 2: Структура CF-Cu 2 O. Рис. 3: Фотокаталитические характеристики CF-Cu 2 O. Рис. 4: Результаты in situ DRIFTS для CF-Cu 2 O при 25 °С. Рис. 5: Результаты DRIFTS in situ для CF-Cu 2 O под световым облучением. Рис. 6: Предлагаемые пути реакции для фотокаталитического гидрирования CO 2 .Доступность данных
Данные, подтверждающие графики в этой статье и другие результаты этого исследования, можно получить у соответствующего автора по обоснованному запросу.
Ссылки
МГЭИК. Изменение климата, 2013 г.: Физическая научная основа: Вклад рабочей группы I в Пятый оценочный отчет Межправительственной группы экспертов по изменению климата (ред. Стокер, Т. Ф. и др.) (Cambridge Univ. Press, 2013).
Schreier, M. et al. Ковалентная иммобилизация молекулярного катализатора на фотокатодах Cu 2 O для восстановления CO 2 . Дж. Ам. хим. соц. 138 , 1938–1946 (2016).
Артикул КАС Google ученый
Ту, В., Чжоу, Ю. и Цзоу, З. Фотокаталитическая конверсия CO 2 в возобновляемое углеводородное топливо: современные достижения, проблемы и перспективы. Доп. Матер. 26 , 4607–4626 (2014).
Артикул КАС Google ученый
«>Wang, J.C. et al. Повышенная активность фотовосстановления CO 2 на гетероструктурах прямой Z-схемы α-Fe 2 O 3 /Cu 2 O при облучении видимым светом. Приложение ACS Матер. Интерфейсы 7 , 8631–8639 (2015 г.).
Артикул КАС Google ученый
Li, H., Zhang, X. & MacFarlane, D. R. Углеродные квантовые точки/Cu 2 O гетероструктуры для преобразования CO 2 в метанол под действием солнечного света. Доп. Энергия Матер. 5 , 1401077 (2015).
Артикул Google ученый
«>Грейс А. Н. и др. Электрохимическое восстановление диоксида углерода при низком перенапряжении на электроде на основе нанокомпозита полианилин/Cu 2 O. Заяв. Энергия 120 , 85–94 (2014).
Артикул КАС Google ученый
Чанг, X. и др. Настройка интерфейсов Cu/Cu 2 O для восстановления диоксида углерода до метанола в водных растворах. Анжю. хим. Междунар. Эд. 57 , 15415–15419 (2018).
Артикул КАС Google ученый
Tran, P.D., Wong, L.
 H., Barber, J. & Loo, J.S. Последние достижения в области гибридных фотокатализаторов для производства солнечного топлива. Энергетическая среда. науч. 5 , 5902–5918 (2012).
H., Barber, J. & Loo, J.S. Последние достижения в области гибридных фотокатализаторов для производства солнечного топлива. Энергетическая среда. науч. 5 , 5902–5918 (2012).Артикул КАС Google ученый
Гадимхани Г., де Таккони Н. Р., Чанмани В., Джанаки К. и Раджешвар К. К. Эффективный солнечный фотоэлектросинтез метанола из диоксида углерода с использованием гибридных массивов полупроводниковых наностержней CuO–Cu 2 O. Хим. коммун. 49 , 1297–1299 (2013).
Артикул КАС Google ученый
Сюй Х. и др. Материал наноперехода Cu 2 O/TiO 2 с пористой структурой для эффективного фотовосстановления CO 2 . Нанотехнологии 25 , 165402 (2014).
Артикул Google ученый
«>Гоу Л. и Мерфи С. Дж. Синтез нанокубов Cu 2 O в фазе раствора. Нано Летт. 3 , 231–234 (2003).
Артикул КАС Google ученый
Куо, С. Х., Чен, С. Х. и Хуанг, М. Х. Опосредованный затравкой синтез монодисперсного Cu 2 O нанокубы с пятью различными диапазонами размеров от 40 до 420 нм. Доп. Функц. Матер. 17 , 3773–3780 (2007).
Артикул КАС Google ученый
Парк, Дж. К., Ким, Дж.
 , Квон, Х. и Сонг, Х. Синтез нанокубов Cu 2 O в масштабе грамма и последующее окисление до полых наноструктур CuO для анодных материалов литий-ионных аккумуляторов. Доп. Матер. 21 , 803–807 (2009 г.)).
, Квон, Х. и Сонг, Х. Синтез нанокубов Cu 2 O в масштабе грамма и последующее окисление до полых наноструктур CuO для анодных материалов литий-ионных аккумуляторов. Доп. Матер. 21 , 803–807 (2009 г.)).Артикул КАС Google ученый
Tsai, YH, Chanda, K., Chu, Y.T., Chiu, C.Y. & Huang, MH. Прямое образование малых Cu 2 O нанокубов, октаэдров и октаподов для эффективного синтеза триазолов. Nanoscale 6 , 8704–8870 (2014).
Артикул КАС Google ученый
Huang, W.C., Lyu, L.M., Yang, Y.C. & Huang, M.H. Синтез Cu 2 Нанокристаллы O от кубической до ромбододекаэдрической структуры и их сравнительная фотокаталитическая активность. Дж. Ам. хим. соц. 134 , 1261–1267 (2011).
Артикул Google ученый
«>Страндберг, Х. Реакции соединений медной патины — II. Влияние хлорида натрия на некоторые загрязнители воздуха. Атмос. Окружающая среда. 32 , 3521–3526 (1998).
Артикул КАС Google ученый
Лин, Х. и Франкель, Г. Атмосферная коррозия меди под действием УФ, озона и NaCl. Коррос. англ. науч. Технол. 48 , 461–468 (2013).
Артикул КАС Google ученый
Сун, С., Ян, К., Лян, С. и Ян, З. Полая медь x O (x = 2, 1) микро/наноструктуры: синтез, фундаментальные свойства и приложения.
 CrystEngComm 19 , 6225–6251 (2017).
CrystEngComm 19 , 6225–6251 (2017).Артикул КАС Google ученый
Liu, X.D., Hagihala, M., Zheng, X.G. и Guo, Q.X. Колебательные спектроскопические свойства основных галогенидов меди со структурой боталлакита. Виб. Спектроск. 56 , 177–183 (2011).
Артикул КАС Google ученый
Ван Ю. и др. Синтез пористых каркасов Cu 2 O/CuO с использованием металлоорганических каркасов на основе Cu в качестве шаблонов и их газочувствительных свойств. Дж. Матер. хим. А. 3 , 12796–12803 (2015).
Артикул КАС Google ученый
Колин, С., Беш, Э., Бержоан, Р., Жолибуа, Х. и Шамбоде, А. Исследование свободной коррозии сплавов на основе меди, никеля и цинка в синтетических пот. Коррос.
 науч. 41 , 1051–1065 (1999).
науч. 41 , 1051–1065 (1999).Артикул КАС Google ученый
Jiang, P. et al. Экспериментальное и теоретическое исследование электронной структуры Cu 2 Тонкие пленки O и CuO на Cu (110) с использованием рентгеновской фотоэлектронной и абсорбционной спектроскопии. J. Chem. физ. 138 , 024704 (2013).
Артикул Google ученый
Азими Х. и др. Эффективная лигандная пассивация наночастиц Cu 2 O посредством твердофазной обработки меркаптопропионовой кислотой. Дж. Ам. хим. соц. 136 , 7233–7236 (2014).
Артикул КАС Google ученый
Каттель, С., Ян, Б., Ян, Ю., Чен, Дж. Г. и Лю, П. Оптимизация энергии связи ключевых промежуточных соединений для гидрирования CO 2 в метанол по сравнению с медью, нанесенной на оксид.
 Дж. Ам. хим. соц. 138 , 12440–12450 (2016).
Дж. Ам. хим. соц. 138 , 12440–12450 (2016).Артикул КАС Google ученый
Толедо-Антонио, Дж. А. и др. Низкотемпературное FTIR-исследование адсорбции CO на нанотрубках из диоксида титана. J. Phys. хим. С. 111 , 10799–10805 (2007 г.).
Артикул КАС Google ученый
Зекчина А., Скарано Д., Бордига С., Спото Г. и Ламберти С. Поверхностные структуры оксидов и галогенидов и их связь с каталитическими свойствами. Доп. Катал. 46 , 265–397 (2001).
КАС Google ученый
Лю Л., Гао Ф., Чжао Х. и Ли Ю. Адаптация валентности меди и вакансии кислорода в Cu/TiO 2 катализаторы для повышения эффективности фотовосстановления CO 2 . Заяв. Катал. Б. 134 , 349–358 (2013).

Артикул Google ученый
Лю Л. и др. Инженеры совместно экспонировали грани {001} и {101} в нанокристаллах TiO 2 с дефицитом кислорода для улучшенного фотовосстановления CO 2 в видимом свете. ACS Катал. 6 , 1097–1108 (2016).
Артикул КАС Google ученый
Коржавый П.А., Сорока И.Л., Исаев Э.И., Лиля С. и Йоханссон Б. Изучение соединений одновалентной меди с кислородом и водородом. Проц. Натл акад. науч. США 109 , 686–689 (2012).
Артикул КАС Google ученый
Bennett, E. et al. Как структура поверхности определяет свойства CuH. Неорг. хим. 54 , 2213–2220 (2015).
Артикул КАС Google ученый
«>Хара, М. и др. Cu 2 O в качестве фотокатализатора общего расщепления воды под действием видимого света. Хим. коммун. 3 , 357–358 (1998).
Артикул Google ученый
Рой, С. К., Варгезе, О. К., Паулоуз, М. и Граймс, К. А. К солнечному топливу: фотокаталитическое преобразование углекислого газа в углеводороды. ACS Nano 4 , 1259–1278 (2010).
Артикул КАС Google ученый
Хандоко А.Д. и Танг Дж. Управляемое фотовосстановление протона и CO 2 на Cu 2 O с различной морфологией. Междунар. Дж. Гидрог. Энергия 38 , 13017–13022 (2013).
Артикул КАС Google ученый
Ли, Ф. и др. Фотокаталитическое превращение CO 2 в метанол с помощью гетероструктурного катализатора Cu 2 O/графен/ТНК в двухкамерном реакторе, работающем под действием видимого света. Nano Energy 27 , 320–329 (2016).
Артикул КАС Google ученый
Лю, Х. и др. Масштабируемый синтез полых нанокубов Cu 2 O с уникальными оптическими свойствами с помощью простого подхода, основанного на гидролизе. Дж. Матер. хим. А. 1 , 302–307 (2013).
Артикул КАС Google ученый
Сун, Б. З., Чен, В. К., Чжэн, Дж. Д. и Лу, С. Х. Роль кислородной вакансии в адсорбционных свойствах СО и NO на поверхности меди 2 O (1 1 1): результаты первых принципов изучение. Заяв. Серф. науч. 255 , 3141–3148 (2008).
Артикул КАС Google ученый
Ссылки на скачивание
Благодарности
Q.Z. выражает благодарность NSFC (грант № 21677080) за частичную поддержку этого исследования. G.A.O. признает финансовую поддержку следующих агентств: Министерство исследований и инноваций Онтарио; Министерство экономического развития, занятости и инфраструктуры; Министерство окружающей среды и изменения климата; Лучший в науке; Министерство исследований, инноваций и науки Фонд низкоуглеродных инноваций; Фонд задач Центра передового опыта Онтарио на 2030 год; Фонд Александра фон Гумбольдта; Империал Ойл; Инновационный фонд Коннота Университета Торонто; Connaught Global Challenge Fund и Канадский совет по естественным наукам и инженерным исследованиям. Л.Ван признателен за финансовую поддержку Китайского стипендиального совета. В.С. признает программу 100 талантов Чжэцзянского университета и Фонда молодых ученых Национального фонда естественных наук Китая (грант № 517). Помощь А. Тонтаса в оценке ASPEN признается всеми авторами.
Л.Ван признателен за финансовую поддержку Китайского стипендиального совета. В.С. признает программу 100 талантов Чжэцзянского университета и Фонда молодых ученых Национального фонда естественных наук Китая (грант № 517). Помощь А. Тонтаса в оценке ASPEN признается всеми авторами.
Информация об авторе
Авторы и организации
Ключевая лаборатория MOE процессов загрязнения и экологических критериев/Тяньцзиньская ключевая лаборатория восстановления окружающей среды и контроля загрязнения, Колледж экологических наук и инженерии, Нанкайский университет, Тяньцзинь, Китай
Lili Wan , Qixing Zhou, Xin Wang & Tian Li
Исследовательская группа по химии материалов и нанохимии, кластер солнечного топлива, химический факультет, Университет Торонто, Торонто, Онтарио, Канада
Лили Ван, Томас Э. Вуд, Лу Ван, Пол Н. Дюшен, Цзюли Го, Сяолян Янь, Мейкунь Ся, Янг Фэн Ли, Абдинор А. Джелле, Ульрих Ульмер, Цзя Цзя и Джеффри А. Озин
Колледж химии и химического машиностроения Тайюаньского технологического университета, Тайюань, Шаньси, Китай
Сяолян Янь
Государственная ключевая лаборатория кремниевых материалов и Школа материаловедения и инженерии Чжэцзянского университета, Ханчжоу, Чжэцзян, Китай
Wei Sun
Авторы
- Lili Wan
Посмотреть публикации автора
Вы также можете искать этого автора в PubMed Google Scholar
- Qixing Zhou
Просмотр публикаций автора
Вы также можете искать этого автора в PubMed Google Scholar
- Xin Wang
Просмотр публикаций автора
Вы также можете искать этого автора в PubMed Google Академия
- Thomas E.
 Wood
WoodПосмотреть публикации автора
Вы также можете искать этого автора в PubMed Google Scholar
- Lu Wang
Посмотреть публикации автора
Вы также можете искать этого автора в PubMed Google Scholar
- Paul N. Duchesne
Посмотреть публикации автора
Вы также можете искать этого автора в PubMed Google Scholar
- Jiuli Guo
Посмотреть публикации автора
Вы также можете искать этого автора в PubMed Google Scholar
- Xiaoliang Yan
Просмотр публикаций автора
Вы также можете искать этого автора в PubMed Google Scholar
- Meikun Xia
Просмотр публикаций автора
Вы также можете искать этого автора в PubMed Google Scholar
- Янг Фэн Ли
Посмотреть публикации автора
Вы также можете искать этого автора в PubMed Google Scholar
- Abdinoor A.
 Jelle
JelleПросмотр публикаций автора
Вы также можете искать этого автора в PubMed Google Scholar
- Ulrich Ulmer
Посмотреть публикации автора
Вы также можете искать этого автора в PubMed Google Scholar
- Jia Jia
Посмотреть публикации автора
Вы также можете искать этого автора в PubMed Google Scholar
- Tian Li
Просмотр публикаций автора
Вы также можете искать этого автора в PubMed Google Scholar
- Wei Sun
Посмотреть публикации автора
Вы также можете искать этого автора в PubMed Google Scholar
- Джеффри А. Озин
Просмотр публикаций автора
Вы также можете искать этого автора в PubMed Google Академия
Пожертвования
Л.Ван, В.С., К.З. и Г.А.О. придумали и разработали эксперименты. Л.Ван, В.С. и Т.Л. подготовили материалы и выполнили SEM, XRD и FTIR при поддержке X.W. Л.Ван и В.С. провела серию экспериментов со светом высокой интенсивности при поддержке T.E.W. и Дж.Дж. В.С. и Т.Э.В. провел испытание на долговременную стабильность в светодиодном реакторе. Л.Ван, В.С., Дж.Г., X.Y. и Ю.Ф.Л. провел исследование DRIFTS in situ при поддержке P.N.D. М.Х. и L.Wang выполнили характеристики XPS. А.А.Дж. выполнили ТЭМ-характеристики. У.У. выполнили обнаружение ICP-OES. Л.Ван, В.С. и Г.А.О. соавтором рукописи. Все авторы обсудили результаты и прокомментировали рукопись.
Л.Ван, В.С. и Т.Л. подготовили материалы и выполнили SEM, XRD и FTIR при поддержке X.W. Л.Ван и В.С. провела серию экспериментов со светом высокой интенсивности при поддержке T.E.W. и Дж.Дж. В.С. и Т.Э.В. провел испытание на долговременную стабильность в светодиодном реакторе. Л.Ван, В.С., Дж.Г., X.Y. и Ю.Ф.Л. провел исследование DRIFTS in situ при поддержке P.N.D. М.Х. и L.Wang выполнили характеристики XPS. А.А.Дж. выполнили ТЭМ-характеристики. У.У. выполнили обнаружение ICP-OES. Л.Ван, В.С. и Г.А.О. соавтором рукописи. Все авторы обсудили результаты и прокомментировали рукопись.
Авторы переписки
Переписка с Цисин Чжоу, Вэй Сун или Джеффри А. Озин.
Заявление об этике
Конкурирующие интересы
Авторы не заявляют об отсутствии конкурирующих интересов.
Дополнительная информация
Примечание издателя: Springer Nature остается нейтральной в отношении юрисдикционных претензий в опубликованных картах и институциональной принадлежности.
Дополнительная информация
Дополнительная информация
Дополнительные примечания 1 и 2, рис. 1–18, таблицы 1–3 и ссылки.
Права и разрешения
Перепечатка и разрешения
Об этой статье
Эта статья цитируется
Бром- и йод-мостиковые структурные элементы в металлоорганических каркасах для улучшенного транспорта носителя и фотовосстановления СО2 водяным паром
- Синьфэн Чен
- Чэндун Пэн
- Хунхан Фей
Nature Communications (2022)
Улучшение использования CO2 в процессе сухого риформинга метана, достигаемое за счет перелива водорода в кристаллах цеолита, опосредованного никелем.

- Цюян Чжу
- Ханг Чжоу
- Фэн-Шоу Сяо
Природный катализ (2022)
Полная переработка никеля из сточных вод гальванопокрытий в фототермический катализ CO2
- Шенхуа Ван
- Дейк Чжан
- Джеффри А. Озин
Nature Communications (2022)
ЭКСПЕРИМЕНТАЛЬНЫЕ И ТЕОРЕТИЧЕСКИЕ ИССЛЕДОВАНИЯ НАНОЧАСТИЦ Cu2O, синтезированных в зеленом цвете, с использованием Datura Metel L
- Каруппая Чинная
- Вивек Майк
- К.
 Гурушанкар
Гурушанкар
Журнал флуоресценции (2022)
Перенос электронов в Cu/Cu2O, вызванный диспропорционированием, способствует эффективному фотовосстановлению CO2
- Цянь Чжу
- Кайнан Чжу
- Шоухуа Фэн
Нано Исследования (2022)
Разница между оксидом меди и оксидом меди
Ключевое различие между оксидом меди и оксидом меди заключается в том, что оксид меди имеет темно-красный цвет, тогда как оксид меди имеет черный цвет.
Как оксид меди, так и оксид меди являются соединениями химического элемента меди. Эти оксиды содержат различные степени окисления меди. При этом у закиси меди степень окисления +1, а у закиси меди степень окисления +2.
СОДЕРЖАНИЕ
1. Обзор и основные отличия
2. Что такое оксид меди
3. Что такое оксид меди
4. Сравнение бок о бок – оксид меди и оксид меди в табличной форме
5. Резюме
Что такое оксид меди?
Закись меди представляет собой оксид меди, химический элемент, который имеет степень окисления меди +1. Поэтому название оксида меди по ИЮПАК — оксид меди (I). Это неорганическое соединение, имеющее химическую формулу Cu 2 O. Кроме того, если мы посмотрим на его структуру, то увидим, что два атома меди связаны с одним атомом кислорода. Кроме того, это соединение имеет красный цвет. Естественно, мы можем найти его как красноватый минерал, куприт.
Рисунок 01: Окись меди
Кроме того, наиболее распространенным способом получения этого соединения является окисление металлической меди.
4 Cu + O 2 → 2 Cu 2 O
Кроме того, он образуется на посеребренных медных деталях, если они подвергаются воздействию влаги после повреждения слоя серебра. Мы называем это коррозией или красной чумой.
При рассмотрении свойств закись меди существует в твердом состоянии и является диамагнитной. Может растворяться в концентрированных растворах аммиака и образовывать комплекс; [CuNH 3 ) 2 ] + . Кроме того, этот комплекс легко окисляется и образует комплекс синего цвета, который представляет собой [Cu(NH 3 ) 4 (H 2 O) 2 ] 2+ .
Что такое оксид меди?
Оксид меди — это оксид химического элемента меди, имеющий химическую формулу CuO. Здесь одному атому меди соответствует один атом кислорода. Оксид меди (II) — это его название IUPAC. Он встречается в виде черного твердого вещества и очень стабилен. Кроме того, это соединение встречается в природе в виде минерала тенорита. Кроме того, он является предшественником многих соединений, содержащих медь.
Кроме того, он является предшественником многих соединений, содержащих медь.
Рисунок 02: Оксид меди
Кроме того, мы можем производить это соединение с помощью пирометаллургии в больших масштабах. Это происходит в моноклинной кристаллической системе. Здесь атом меди связан с четырьмя атомами кислорода в плоскоквадратной конфигурации. Примечательно, что это полупроводник р-типа.
В чем разница между оксидом меди и оксидом меди?
Закись меди — это Cu 2 O, а закись меди — CuO. Основное различие между оксидом меди и оксидом меди заключается в том, что оксид меди имеет темно-красный цвет, тогда как оксид меди имеет черный цвет. Название оксида меди по ИЮПАК — оксид меди (I), а название оксида меди по ИЮПАК — оксид меди (II).
Кроме того, у закиси меди степень окисления +1, а у закиси меди — степень окисления +2. Еще одно различие между оксидом меди и оксидом меди заключается в том, что оксид меди встречается в природе в виде красноватого минерала куприта, где оксид меди встречается в виде минерала тенорита.

 Duchesne 2 ,
Duchesne 2 ,
 H., Barber, J. & Loo, J.S. Последние достижения в области гибридных фотокатализаторов для производства солнечного топлива. Энергетическая среда. науч. 5 , 5902–5918 (2012).
H., Barber, J. & Loo, J.S. Последние достижения в области гибридных фотокатализаторов для производства солнечного топлива. Энергетическая среда. науч. 5 , 5902–5918 (2012). , Квон, Х. и Сонг, Х. Синтез нанокубов Cu 2 O в масштабе грамма и последующее окисление до полых наноструктур CuO для анодных материалов литий-ионных аккумуляторов. Доп. Матер. 21 , 803–807 (2009 г.)).
, Квон, Х. и Сонг, Х. Синтез нанокубов Cu 2 O в масштабе грамма и последующее окисление до полых наноструктур CuO для анодных материалов литий-ионных аккумуляторов. Доп. Матер. 21 , 803–807 (2009 г.)). CrystEngComm 19 , 6225–6251 (2017).
CrystEngComm 19 , 6225–6251 (2017). науч. 41 , 1051–1065 (1999).
науч. 41 , 1051–1065 (1999). Дж. Ам. хим. соц. 138 , 12440–12450 (2016).
Дж. Ам. хим. соц. 138 , 12440–12450 (2016).
 Wood
Wood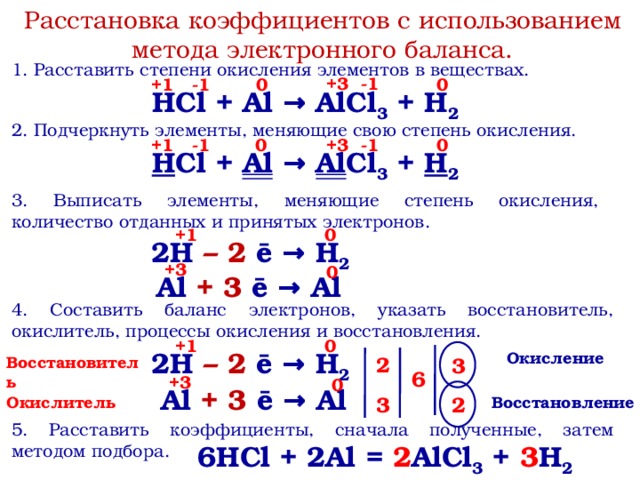 Jelle
Jelle
 Гурушанкар
Гурушанкар