Свойства хлорида железа (FeCl3) (25 фактов, которые вы должны знать) —
Хлорное железо, также известное как трихлорид железа, является неорганическое соединение. Он умеренно растворим в воде. Давайте узнаем некоторые факты, связанные с хлоридом железа.
Хлорид железа имеет множество фармацевтических, промышленных и лабораторных применений. В промышленности хлорное железо синтезируют взаимодействием железного лома и сухого хлора при 500-700°С. oC. Используется в служении сточные воды, травление меди во время окислительно-восстановительной реакции, изготовление ПХБ и обнаружение фенольных соединений.
В этой статье мы обсудим различные свойства хлорида железа, такие как химическая классификация, электронная конфигурация, степень окисления и реакция с кислотой, основанием, оксидами, металлами и т. д.
FeCl
3 Название IUPACКомпания IUPAC (Международный союз теоретической и прикладной химии) название FeCl3 представляет собой хлорид железа (III).
FeCl
3 Химическая формулаFeCl3 это химическая формула хлорида железа.
FeCl
3 Номер по CASКомпания Номер по CAS (аутентичный числовой идентификатор до 10 цифр) FeCl3 7705-08-0.
FeCl
3 Идентификатор ChemSpiderКомпания Идентификатор ChemSpider (ChemSpider — бесплатная база данных химической структуры) FeCl3 это 22792.
FeCl
3 Химическая классификацияFeCl3 классифицируется как коррозионное твердое вещество класса 8. Это очень реактивный материал, и с ним следует обращаться осторожно.
FeCl
3 Молярная массаКомпания молярная масса безводного FeCl3 составляет 162.204 г/моль, тогда как молярная масса гексагидрата FeCl3 составляет 270.295 г/моль.
FeCl
3 ЦветЦвет FeCl.3 представляет собой соединение от оранжевого до коричнево-черного цвета.
FeCl
3 ВязкостьВязкость FeCl3 составляет 12 сП (40% раствор).
FeCl
3 Молярная плотностьМолярная плотность FeCl3 составляет 1.1 г/мл.
FeCl
3 Температура плавленияТемпература плавления FeCl3 составляет 306 ° C.
FeCl
3 Точка кипенияТемпература кипения FeCl3 составляет 315 ° C.
FeCl
3 Состояние при комнатной температуреFeCl3 представляет собой кристаллическое твердое вещество при комнатной температуре.
FeCl
3 Ионная связьFeCl3 образует ионные связи. Он обладает мельчайшим FeCl3 повторяющееся звено в структуре кристаллической решетки хлорида железа.
FeCl
3 Ионный радиусМы не можем определить ионный радиус FeCl3 поскольку мы можем вычислить только радиус одного атома. Кроме того, ионный радиус иона трехвалентного железа составляет 63 пм.
Кроме того, ионный радиус иона трехвалентного железа составляет 63 пм.
FeCl
3 Электронные конфигурацииКомпания электронная конфигурация относится к распределению электронов молекулы или атома на молекулярных или атомных орбиталях. Обсудим электронную конфигурацию FeCl.3.
Электронная конфигурация трехвалентного железа в FeCl3 составляет 1 с2 2s2 2p6 3s2 3p6 4s2 3d6. Напротив, электронная конфигурация хлора равна 1s.2 2s2 2p6 3s2 3p5.
FeCl
3 Состояние окисления- Атом Fe в FeCl3 находится в +3 степень окисления.
- Атом Cl имеет степень окисления -1 в FeCl.3.
FeCl
3 кислотностьFeCl3 имеет кислую природу, так как представляет собой соль сильной кислоты и слабого основания. Его значение pH меньше 7, и он вызывает коррозию большинства металлов и тканей.
FeCl
3 непахнущийFeCl3 не без запаха. Обладает слабым запахом соляной кислоты.
FeCl
3 парамагнитныйНаличие неспаренных электронов свидетельствует о парамагнитный характеристики элемента. Посмотрим, будет ли FeCl3 содержит неспаренный электрон.
FeCl3 имеет парамагнитную природу, поскольку содержит неспаренные электроны в своей самой внешней валентной оболочке, а при приложении любого внешнего магнитного поля притягивает друг друга и проявляет парамагнитные характеристики.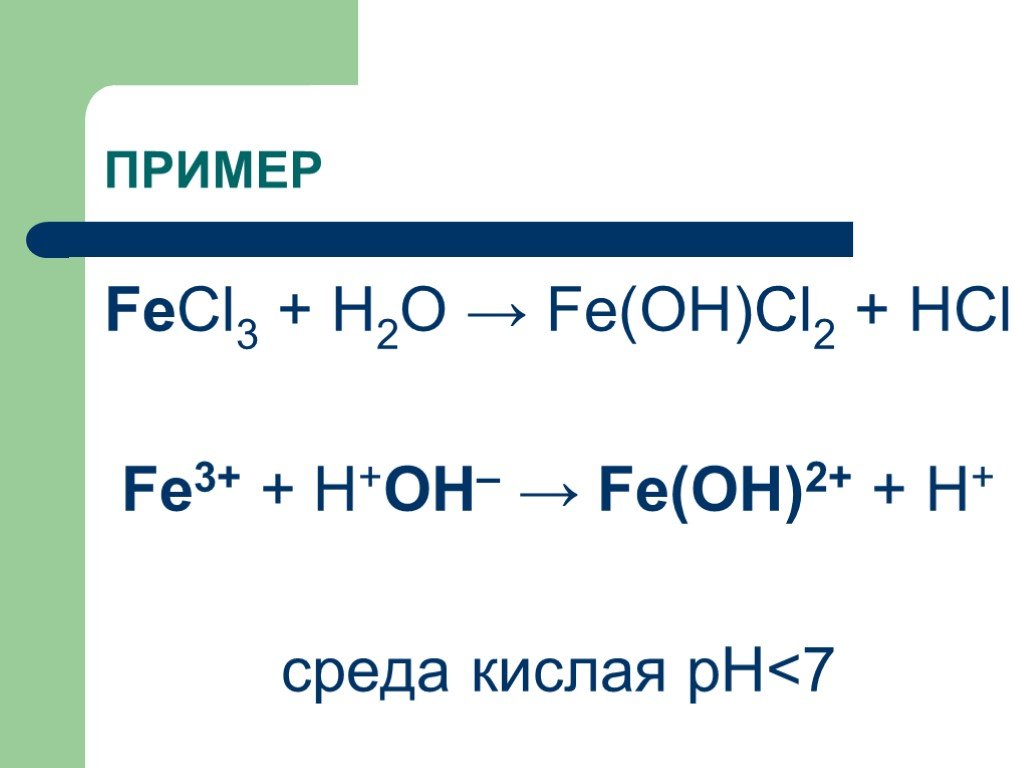
FeCl
3 гидратыСуществует четыре гидрата FeCl.3 а именно- FeCl3.2H2О, FeCl3.2.5H2О, FeCl3.3.5H2О и FeCl3.6H2O. Эти гидраты являются сильными обезвоживающими агентами. Различные гидраты FeCl3 объясняются в таблице ниже.
| Тип | Молекулярная формула | Структурная формула |
|---|---|---|
| дигидрат | FeCl3.2H2O | транс-[FeCl2(H2O)4][FeCl4] |
| Неназванный | FeCl3.2.5H2O | цис-[FeCl2(H2O)4][FeCl4]·ЧАС2O |
| Неназванный | FeCl3. 3.5H2O 3.5H2O | цис-[FeCl2(H2O)4][FeCl4]·3ч2O |
| гексагидрат | FeCl3.6H2O | транс-[FeCl2(H2O)4]Cl·2H2O |
FeCl
3 Кристальная структураFeCl3 существует в кристаллической гексагональной твердой структуре hR24.
FeCl
3 Полярность и проводимость- FeCl3 представляет собой полярную молекулу. Он проявляет полярность из-за дипольного момента, который возникает из-за большой разницы в электроотрицательности между атомами трехвалентного железа и хлора, что делает FeCl3 полярный.
- FeCl3 является проводящим, идущим по параболическому пути. Значение проводимости зависит от концентрации.

FeCl
3 Реакция с кислотойПри низких температурах FeCl3 реагирует с кислотой с образованием красного осадка.
3CH3СООН + FeCl3 → (СН3главный операционный директор)3Fe + 3HCl
FeCl
3 Реакция с основаниемFeCl3 реагирует с основанием с образованием хлопьев гидроксида железа, т.е. Fe(OH)3, также пишется как ферригидрит, т.е. FeO(OH), который используется для удаления взвешенных примесей.
3NaOH + FeCl3 → Fe (OH)3 + 3NaCl
FeCl
3 Реакция с оксидомFeCl3 реагирует с оксидами с образованием оксидов железа и соответствующих солей. Например, FeCl3 реагирует с оксидом магния с образованием оксидов железа и соответствующего хлорида магния.
Например, FeCl3 реагирует с оксидом магния с образованием оксидов железа и соответствующего хлорида магния.
2FeCl3 + 3MgO → Fe2O3 + 3MgCl2
FeCl
3 Реакция с металломFeCl3 реагирует с металлом с образованием соли металла и хлорида железа. Он вызывает коррозию большинства металлов и широко используется для травления в области химического травления, в первую очередь для травления нержавеющей стали и стали; но он также умеет травить медь.
FeCl3 + Cu → CuCl + FeCl2
Заключение
FeCl3, также называемый хлоридом железа (III) или хлоридом железа, представляет собой соединение от оранжевого до коричнево-черного цвета. Это кристаллическое твердое вещество при комнатной температуре со слабым запахом соляной кислоты. Это гексагональная парамагнитная полярная молекула, которая существует в виде четырех гидратов.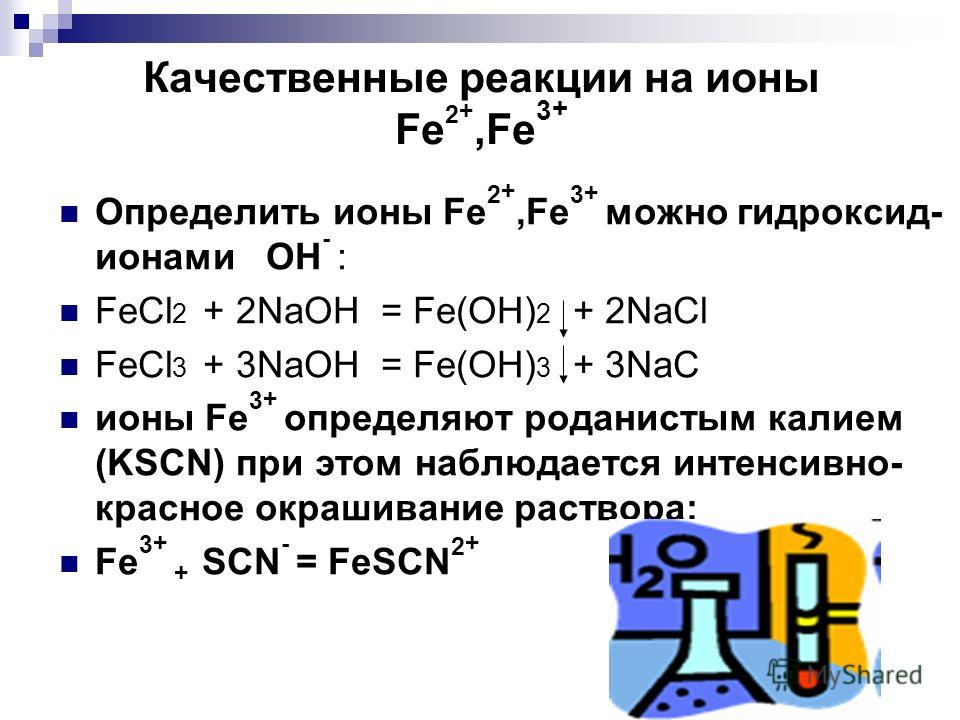
Железо (III) хлорное безводное. «ХИМПЭК»
Применение: — в качестве коагулянта, предназначенного для обработки воды; для очистки промышленных и городских сточных вод и обезвреживания выделяющихся из них осадков; Цена: уточняйте у менеджера Узнать цену |
Физико-химические показатели
Области применения
| Наименование показателя | Спецификация импортного продукта |
| Внешний вид | Кристаллический порошок фиолетового цвета с коричневым или темно-зеленым оттенком |
| Массовая доля хлорного железа (FeCl3), %, не менее | 95,0 |
| Массовая доля железа (II) хлорида (FeCl2), %, не более | 2,0 |
| Массовая доля нерастворимых в воде примесей, %, не более | 4,4 |
| Класс опасности по степени воздействия на организм человека | 3 |
| Виды опасности | |
| Взрыво- и пожароопасность хлорид железа | Не относится к горючим веществам, пожаро- взрывобезопасно.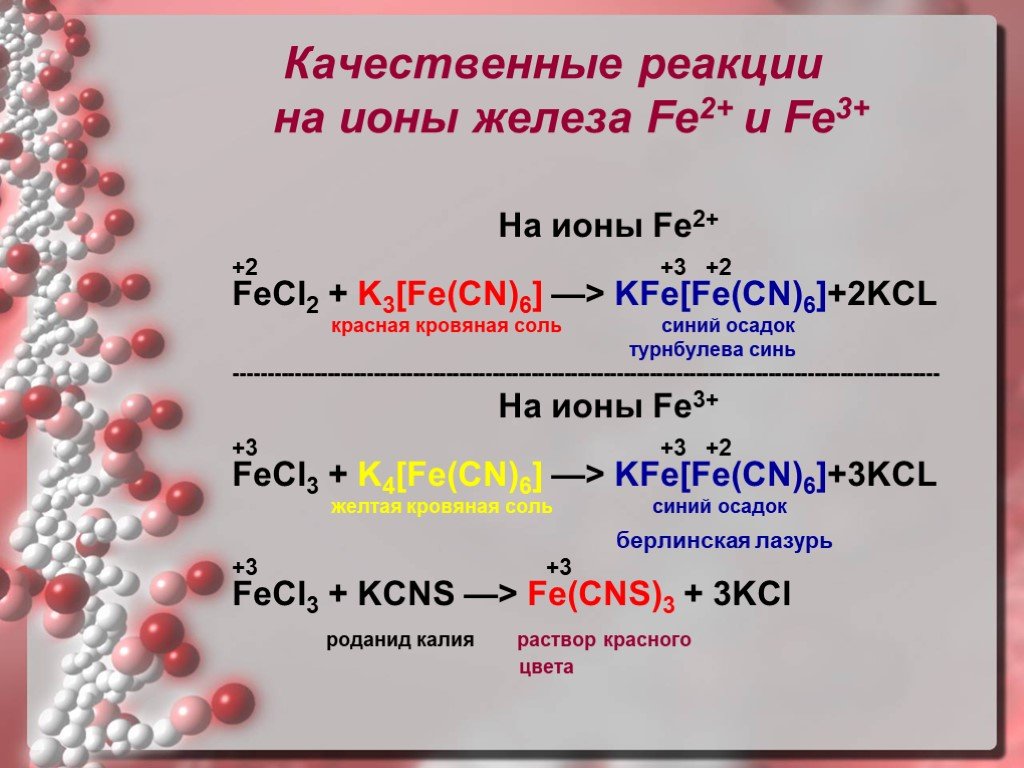 |
| Опасность для человека | Пыль обладает выраженным раздражающим действием на кожу, слизистые оболочки верхних дыхательных путей, глаз. При попадании на кожу вызывает химические ожоги. Вредно при проглатывании. |
| Средства индивидуальной защиты | Использовать средства индивидуальной защиты: фильтрующий противогаз БКФ, респиратор РУ-60, защитные очки, перчатки, резиновые сапоги, костюм суконный. |
Гарантийный срок хранения продукта — 3 года с даты изготовления.
— в качестве коагулянта, предназначенного для обработки воды, очистки промышленных и городских сточных вод и обезвреживания выделяющихся из них осадков;
— хлорное железо применяется в качестве катализатора в процессах органического синтеза;
— для травления печатных плат в радиотехнической промышленности, авиационной промышленности и приборостроении, а также в других отраслях промышленности.
Склад
В Московской области
Адрес: Истринский район, сельское поселение Ивановское, поселок станция Манихино, 50 км
Посмотреть на карте
Скачать схему проезда
Здесь возможно:
оплатить наличными;
купить от 1 мешка (канистры/мкр/куба/барабана) продукции.
С этим продуктом часто покупают:
| Продукция | Синонимы | CAS № | ГОСТ | Марка/сорт | Упаковка/вес |
| Кальция гипохлорит технический | хлорноватистокислый кальций | 12394-14-8 | импорт | Барабан 50 кг | |
| Натрия гидрокарбонат E500 (ii) | бикарбонат натрия, натрий двууглекислый, сода пищевая, питьевая сода, гидрокарбонат натрия | 144-55-8 | 32802-2014, импорт | первый, второй | Мешок 25 кг, 50 кг, пачки 500 г |
| Натрия полифосфат технический | гексаметафосфат натрия | 68915-31-1, 10124-56-8 | импорт | Мешок 25 кг | |
| Аммония хлорид технический (аммоний хлористый) | хлорид аммония, нашатырь | 12125-02-9 | 2210-73, импорт | Мешок 25 кг, 35 кг | |
| Бура безводная | натрий тетраборнокислый, тетраборат динатрия, бура кальцинированная, обезвоженная бура | 1330-43-4 | импорт | «Этибор-68» (Etibor-68) | МКР 1000 кг, Мешок 25 кг |
| Бура пятиводная | динатрий тетраборат пентагидрат, тетраборат натрия пентагидрат, боракс пентагидрат | 12179-04-3 | импорт | МКР 1000 кг, Мешок 25 кг | |
| Известь строительная воздушная гашеная | известь строительная воздушная гидратная, гидроокись кальция, пушонка | 1305-62-0 | 9179-77 | Мешок 25 кг | |
| Известь хлорная | кальция гипохлорита смесь сухая, хлорная известь, хлорка, известь белильная | 22464-76-2 | 1692-85 | марка А, 3 сорт | Мешок 19-23 кг |
| Канифоль сосновая живичная | канифоль сосновая, канифоль живичная, колофонская смола, гарпиус | 8050-09-07 | 19113-84, импорт | Барабан 91 кг, бочка 225 кг | |
| Сода кальцинированная техническая | натрий углекислый, карбонат натрия, динатрий карбонат | 497-19-8 | 5100-85 | А, Б | Мешок 25 кг, 50 кг, МКР 600 кг, 800 кг, 1250 кг |
| Сульфаминовая кислота | амидосульфоновая кислота, моноамид серной кислоты, амидосерная кислота | 5329-14-6 | импорт | Мешок 25 кг | |
| Уголь древесный активированный дробленый БАУ-А | активный уголь, активированный уголь, древесный активный уголь | 7440-44-0 | 6217-74 | БАУ-А | Мешок 10 кг |
| Уротропин технический | гексаметилентетрамин, гексамин, уризол, метенамин | 100-97-0 | 1381-73, 2478-037-00203803-2012 | марка С, высший сорт, первый сорт | Мешок 25 кг |
| Сульфат алюминия (алюминий сернокислый) | алюминий сернокислый кусковой (коагулянт), алюминий сернокислый гранулированный, глинозем сернокислый | 10043-01-3 | 12966-85 | высший, первый, второй | Мешок 25 кг МКР 700-1000 кг |
Хлорид железа – свойства и вредное воздействие
Что такое хлорид железа? С химической формулой FeCl 3 хлорид железа представляет собой неорганическое вещество с широким спектром применения в промышленности, медицине и лабораториях. Хлорид железа — это термин, данный хлориду железа. Это химическое вещество с молекулярной формулой FeCl 3 . Так, соединение FeCl 3 состоит из железа (III) и хлора.
Хлорид железа — это термин, данный хлориду железа. Это химическое вещество с молекулярной формулой FeCl 3 . Так, соединение FeCl 3 состоит из железа (III) и хлора.
Железо имеет потенциал окисления +3 в структуре хлорида железа, частая комбинация железа и хлора. Хлорид железа (III) или трихлорид железа — это название соединения FeCl 3 .
Помимо хлорида железа, другими названиями соединений FeCl 3 являются молизит и флорес мартис. Он имеет множество оттенков, в том числе темно-зеленый или фиолетовый в аморфном состоянии и чисто желтый в водном состоянии.
В этой статье будут рассмотрены структура хлорида железа, его физические и химические характеристики, а также тест хлорида железа на фенолы и применение во многих секторах.
Свойства хлорида железа
Основные физические и химические свойства хлорида железа следующие:
Физические свойства
- Хлорид железа имеет химическую формулу FeCl 3 .

- В обезвоженном состоянии его молярная масса составляет 162,2 г/моль.
- Он имеет сравнительно низкую температуру плавления по сравнению с температурой кипения, которая составляет около 315 градусов Цельсия. Хлорид железа растворяется в воде с выделением энергии в этой экзотермической реакции.
- Производится на промышленных предприятиях при реакции безводного хлора и железной руды при температуре от 500 до 700 градусов Цельсия.
- Угол наблюдения в первую очередь влияет на его оттенок. Кристаллиты, кажется, имеют черновато-зеленый оттенок, когда свет отражается от поверхности. Однако кристаллы выглядят фиолетовыми, когда свет проходит через среду.
- Полученный водный раствор имеет бледно-желтый цвет при растворении хлорида железа в воде. Он также сильно пахнет соляной или соляной кислотой.
- Хлорное железо очень слабо растворяется в растворах без дипольных моментов, таких как бензол и гексан. Тем не менее, он хорошо диспергируется в жидкостях с отдающими свойствами, включая сложные эфиры, ацетон, спирты, амины и нитрилы.

Химические свойства
Хлорид железа опасен, чрезвычайно коррозионно-активен и имеет естественную кислотность. Взамен безводное вещество является мощным стимулятором обезвоживания. Несмотря на редкость токсичности для человека, потребление хлорида железа может вызвать серьезное заболевание и повысить уровень смертности.
FeCl 3 + Fe 2 O 3 🡪 3FeOCl
FeCl 3 + CuCl 🡪 FeCl 2 + CuCl 2
2FeCl 3 + C 6 H 5 CL 🡪 2FECL 2 + C 6 H 4 CL 2 + HCL
2FECL 3 + LICH 3 🡪 FECL 2 + LIFECL 4 + CH 3 9009 9009 9009 9009 9009 9009 9009 9009 9009 9009 9009 9009 9009 9009 9009 9009 9009 9009 9009 9009 9009 9009 9009 9009 9009 9009 9009 9009 9009 9009 9009 9009 9009 9009 9009 9009 9009 9009 9009 + хлорида железа
Железо и хлор могут соединяться с образованием безводного хлорида железа. Ответ приведен ниже:
Ответ приведен ниже:
2FE (S) + 3CL 2 (G) 🡪 2FECL 3 (S)
Разбалтный хлорид железа:. 3 O 4 (S) + 8HCl (AQ) 🡪 FECL 2 (AQ) + 2FECL 3 (AQ) + 4H 2 O (L)
2FECL 2 (AQ AQ ) + Cl 2(г) 🡪 2FeCl 3(водн.)
4FeCl 2(водн.) + O 2 + 4HCl 🡪 4FeCl 3(aq) + 2H 2 O (l)
Тест на хлорид железа
Тест на хлорид железа используется для определения наличия или присутствия хлорида железа в образце нет. Это типичный тест хроматограммы фенола. Он включает в себя следующие действия:
- Возьмите 1% раствор хлорида железа, нейтрализованный гидроксидом натрия, и перемешивайте его до образования слабого осадка FeO(OH). Фильтр применяется перед использованием.
- В пробирке химический материал или образец разбавляют водой, метанолом или спиртом.

- Теперь к тестовому раствору добавляется предварительно взятый нейтрализованный раствор хлорида железа.
- Если наблюдается кратковременная или стойкая фиолетовая, зеленоватая или индиговая окраска, в растворе присутствует фенольная или енольная группа.
Применение хлорида железа
Во многих отраслях промышленности используется хлорид железа. Ниже приведены некоторые из его применений:
Управление сточными водами
Хлорное железо используется для очистки сточных вод и удаления загрязняющих веществ из воды, что является его основным применением. Хлорид железа является одним из немногих используемых в настоящее время средств для обработки воды, позволяющих контролировать запах. Он особенно уменьшает запахи, связанные с серой.
Вода поступает в ранее существовавшие резервуары для осаждения после флокуляции. Хлорид делает частицы воды более проводящими электричество, делая воду более агрессивной. Хлорид соединяется с катионами металлов в трубопроводах с образованием различных растворимых солей. В результате увеличивается количество металлов в питьевой воде. Хотя на свинцовых трубах образуется защитная оксидная пленка, хлорид постоянно ускоряет процесс коррозии. Бытовые кондиционеры воды часто вызывают попадание соли в городские сточные воды.
В результате увеличивается количество металлов в питьевой воде. Хотя на свинцовых трубах образуется защитная оксидная пленка, хлорид постоянно ускоряет процесс коррозии. Бытовые кондиционеры воды часто вызывают попадание соли в городские сточные воды.
Производство печатных плат
Печатная плата (PCB) представляет собой пустую печатную плату без электронных частей. Печатная плата еще не работает. Они используются в устройствах наблюдения, диагностики и терапии, а также в приборах. Использование ПХД в сфере здравоохранения быстро расширяется благодаря научным достижениям, открывающим новые возможности.
В качестве катализатора
Используется для проведения катализирующих процессов в исследовательских установках, включая реакции ацилирования и алкилирования Фриделя-Крафтса и процесс хлорирования органических углеводородов. Хлорид железа часто используется в качестве кислоты Льюиса.
Промышленное использование
Применение в промышленности включает множество процессов производства пигментов, гальванопокрытий, стабилизаторов процессов и агентов, разделяющих твердые частицы. Промышленное производство хлорида железа включает процедуру, известную как прямое хлорирование. В этом процессе сухой хлор реагирует с железным ломом при температуре от 500 до 700 градусов Цельсия.
Промышленное производство хлорида железа включает процедуру, известную как прямое хлорирование. В этом процессе сухой хлор реагирует с железным ломом при температуре от 500 до 700 градусов Цельсия.
Тест на хлорид железа
Тест на хлорид железа проводится для определения того, присутствуют ли фенолы в растительном экстракте или присутствуют в образце или химическом веществе. Кроме того, енолы, гидроксиламин и его производные, азотсодержащие органические соединения и серные кислоты также дают благоприятные результаты.
В растворенной форме
Чаще всего используется растворенный тип хлорида железа. Он распадается на бледно-коричневый водянистый раствор с сильным запахом раствора HCl. Большинство предметов, включая металлы, сильно разъедаются им, а ткани тела, предположительно, тоже разъедаются. Он широко используется в различных процедурах очистки сточных вод и фильтрации воды и является негорючим.
Для травления сложных медицинских устройств
Может травить медь, но чаще используется для травления изделий из железа и нержавеющей стали. Его адаптивность является одним из факторов, способствующих его популярности. Он позволяет пополнить травитель и продлить время до его истечения. Следовательно, это свойство позволяет художникам и другим ремесленникам использовать его для сварки рисунков.
Его адаптивность является одним из факторов, способствующих его популярности. Он позволяет пополнить травитель и продлить время до его истечения. Следовательно, это свойство позволяет художникам и другим ремесленникам использовать его для сварки рисунков.
Для удаления алюминия с зеркал
Самые популярные покрытия для зеркал изготавливаются из металлов. Светоотражающие свойства слоев алюминия и серебра делают их популярными. Серебро отражает 95% света, что делает его наиболее отражающим материалом в видимом диапазоне. Однако алюминий по-прежнему может отражать 90% света, что немного меньше, чем у стали. Алюминиевые покрытия зеркал удаляются с сохранением финишного покрытия с помощью FeCl 3 .
В других реакциях
Гамма-гидроксимасляная кислота и гамма-бутиролактон потенциально могут быть протестированы с ним. В многочисленных реакциях он служит дегидратирующим агентом. Он служит окислителем в процессе изготовления красителя индиго-синего.
Вредное воздействие хлорида железа
- Солеобразное кристаллическое или порошкообразное вещество со светлым зеленоватым оттенком представляет собой хлорид железа.
 Он используется в нескольких процедурах для производства тканей, плавки, производства лекарственных средств и утилизации отходов.
Он используется в нескольких процедурах для производства тканей, плавки, производства лекарственных средств и утилизации отходов. - Поскольку хлорид железа является едким веществом, контакт с ним может привести к жжению и повреждению кожи и глаз. FeCl 3 может раздражать горло и носовые проходы при вдыхании. Увеличение времени контакта может привести к повреждению роговицы и вызвать изменение ее цвета на коричневый.
- Хлор может быть токсичным для растений и рыб в чрезмерных количествах. Однако более быстрого или менее дорогого способа удаления хлоридов из сточных вод не существует. Потребуется обратный осмос, дорогостоящая и узкоспециализированная процедура, используемая для создания пресной воды для научных целей.
- Нетоксичные жидкие квасцы используются в озерах для уменьшения количества фосфатов в воде.
Во многих отраслях промышленности используется хлорид железа. Ниже приведены лишь некоторые из его применений.
Ниже приведены лишь некоторые из его применений.
- Печатные платы изготавливаются с его использованием.

- Его также можно использовать для тестирования гамма-гидроксимасляной кислоты и гамма-бутиролактона.
- Гамма-гидроксимасляная кислота и гамма-бутиролактон также могут быть протестированы с ним.
 Этим методом удаляются алюминиевые покрытия зеркал
Этим методом удаляются алюминиевые покрытия зеркал - .
- Используется для травления сложных медицинских устройств.

- Обычно используется в лабораториях.
- Во многих реакциях он служит осушителем.
Заключение
Поскольку железо в структуре FeCl 3 находится в степени окисления +3, хлорид железа представляет собой кристаллы темно-зеленого оттенка. Название соединения FeCl 3 — хлорид железа (III). Хлорное железо имеет химическую формулу FeCl 3 .
Название соединения FeCl 3 — хлорид железа (III). Хлорное железо имеет химическую формулу FeCl 3 .
Водный раствор имеет цвет от прозрачного до бледно-коричневого. Слабо пахнет HCl. Он разъедает многие минералы и ткани организма. Он часто используется в управлении сточными водами и фильтрации воды, поскольку он не воспламеняется.
В обезвоженном состоянии гигроскопичен. Кроме того, гидролиз происходит по мере того, как влага из воздуха поглощается, высвобождая HCl, создавая туман во влажном воздухе. Имеет высокую кислотность по Льюису.
Часто задаваемые вопросы
1. Какие меры безопасности необходимо соблюдать при обращении с хлорным железом?Вы должны проявлять необходимую осторожность, чтобы безопасно использовать хлорид железа:
- При использовании вещества держите его подальше от тепла, яркого света и искусственного света.
- Никогда не смешивайте воду с химикатами.
- При работе с химическим веществом надевайте рукавицы, защитные очки и защитный фартук.

- Во избежание химического воздействия используйте средства защиты органов дыхания.
Химически ядовитый хлорид железа представляет собой материал. Он может раздражать кожу и вреден для здоровья человека. Кроме того, это вредит глазам. Это может привести к ожогу горла, удушью, потере сознания и даже смерти при употреблении.
3. Что произойдет, если сжечь хлорное железо?Оксихлорид железа получают нагреванием хлорида железа с оксидом железа (III). Во время нагревания должна быть достигнута температура 350°C.
Хлорид железа — 3V Tech
Хлорид железа или хлорид железа (III) (FeCl3) используется в качестве флокулянта при очистке сточных вод и производстве питьевой воды. При добавлении в сырую воду небольших количеств хлорида железа гидроксид железа(III) выпадает в осадок и адсорбирует мелкодисперсные твердые вещества и коллоиды.
Обычно производится и продается в виде концентрированного раствора с минимальной концентрацией 40% по весу. Из этого раствора также можно получить твердый кристаллический хлорид железа с температурой плавления 37°C.
Из этого раствора также можно получить твердый кристаллический хлорид железа с температурой плавления 37°C.
Компания Consito разработала ноу-хау и технологии для заводов по производству 40-процентного раствора хлорида железа как для очистки сточных вод, так и для питьевой воды.
Мы можем предоставить несколько различных процессов для производства хлорида железа в зависимости от исходного сырья:
- Металлолом и газообразный хлор путем переработки хлорида железа
- Мягкое железо и газообразный хлор путем переработки хлорида железа
- Оксид железа и соляная кислота
- Смешанные оксиды, соляная кислота и газообразный хлор
- Травильные растворы и газообразный хлор с конечной концентрацией
Сырье также дешевое и легкодоступное, поэтому производство хлорида железа часто является привлекательной добавкой для производителей хлора и щелочи.
Процесс производства
Раствор хлорида железа 40% по весу может производиться различными способами в зависимости от исходного сырья.
Металлолом
Хлорное железо получают при контакте хлорного железа с железом в сосуде для растворения по следующей реакции:
Fe + 2 FeCl 3 = 3 FeCl 2
Раствор хлорида железа, полученный в результате растворения железа, затем фильтруется и окисляется до хлорида железа в секции хлорирования газообразным хлором в соответствии со следующей реакцией:
3 FeCl 2 + 1,5 Cl 2 = 3 FeCl 3
Две трети раствора хлорида железа рециркулируют обратно в сосуд для растворения, а одна треть выгружается как продукт.
Мягкое железо
Это сырье представляет собой порошок мягкого железа, полученный прокатным способом. Производственный процесс аналогичен описанному выше с использованием лома железа в качестве сырья.
Оксид железа
Исходя из оксида железа, побочного продукта сталелитейных заводов или гематита, можно получить хлорид железа простой реакцией с 32% HCl:
Fe 2 O 3 + 6 HCl = 2 FeCl 3 + 3 H 2 O
Смешанные оксиды
Это сырье представляет собой смесь оксида железа и оксида железа, полученную в виде окалины в процессе прокатки.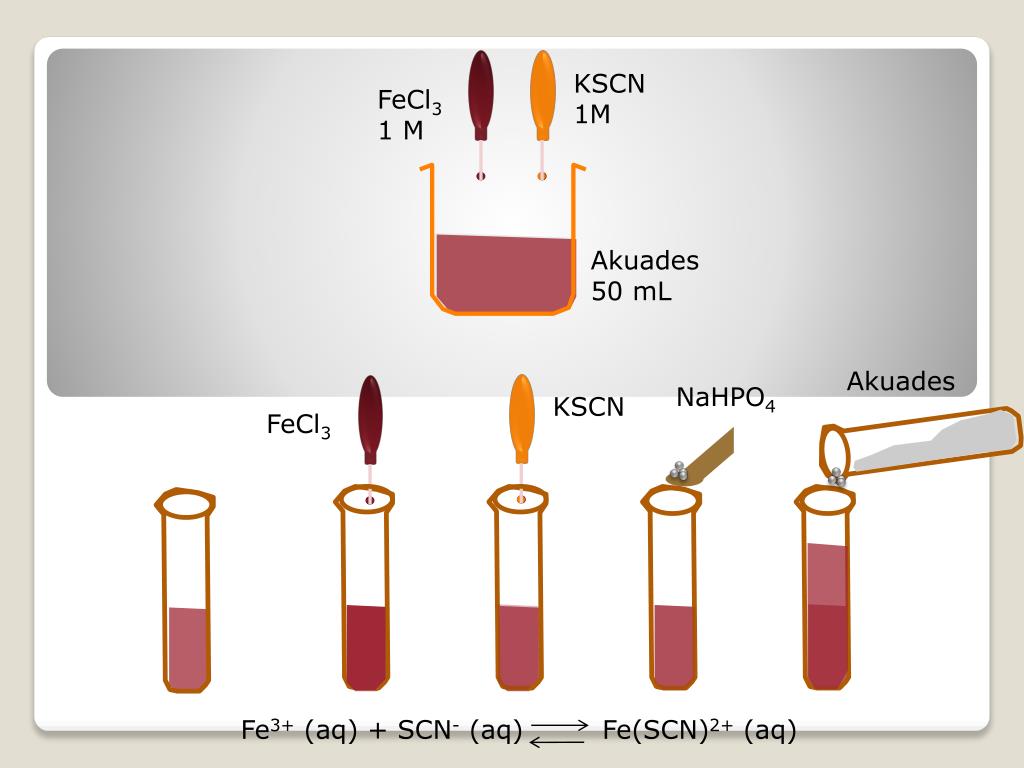 Предварительная обработка 32% HCl с последующим хлорированием приводит к полному превращению в хлорид железа по следующим реакциям:
Предварительная обработка 32% HCl с последующим хлорированием приводит к полному превращению в хлорид железа по следующим реакциям:
Fe 2 O 3 + 6 HCl = 2 FECL 3 + 3 H 2 O
Feo + 2 HCl = FECL 2 + H3O
FECL 2 + 0,5 Cl 2 = FeCl 3
Травильные растворы
При определенном способе можно также использовать в качестве сырья шлам травления стали с HCl. Также достигается снижение потребления хлора. Окончательная концентрация путем выпаривания обычно требуется для достижения 40%-ного раствора по массе.
Эксплуатационные данные
| Типичное качество конечного продукта | |
|---|---|
| Чистота на сухую основу | % 99 |
| Внешний вид | темно-коричневый раствор |
| Плотность | 1,43 г/мл при 20°C |
| Растворимость в воде | 1% |
| Температура плавления | -12 °С |
| Вязкость | 10 мПа при 20°C |
| Химические свойства | кислотные и сильно коррозионные |
| Минимальная концентрация активного вещества FeCl3 | % 40 +/- 3 |
| Минимальная концентрация активного вещества Fe(III) | % 13,7 +/- 3 |
| Марганец | % макс. 2 2 |
| Железо (II) | % макс. 2,5 |
| Нерастворимый | % макс. 0,2 |
Открытый стол
Типовой расход основного сырья для каждого процесса:
Относится к 1 метрической тонне раствора FeCl3 40% по весу:
| Процесс | и | б | в | д | и | |
|---|---|---|---|---|---|---|
| Металлолом | кг | 140 | 140 | |||
| Мягкое железо | кг | |||||
| Оксид железа | кг | 200 | ||||
| Смешанные оксиды | кг | 200 | ||||
| Рассолы | кг | 1 400 | ||||
| Мягкое железо | кг | |||||
| Хлор | кг | 270 | 220 | 20 | 50 | |
| HCl 32% | кг | 750 | 800 | 300 | ||
| Выпаренный | кг | 720 |
Открытый стол
Применение хлорида железа
Хлорид железа или хлорид железа (III) (FeCl3) используется в качестве флокулянта при очистке сточных вод и производстве питьевой воды. При добавлении в сырую воду небольших количеств хлорида железа гидроксид железа(III) выпадает в осадок и адсорбирует мелкодисперсные твердые вещества и коллоиды.
При добавлении в сырую воду небольших количеств хлорида железа гидроксид железа(III) выпадает в осадок и адсорбирует мелкодисперсные твердые вещества и коллоиды.
В Европе химическое использование хлорида железа для питьевой воды четко определено в Регламенте UNI EN 888:2005.
Применяется к хлориду железа (III) (a), гексагидрату хлорида железа (III) (b) и раствору хлорида железа (III) (c) для обработки воды, предназначенной для потребления человеком. Он охватывает характеристики и определяет требования и соответствующие процедуры испытаний для хлоридов железа (III) (a), (b) и (c), а также информацию об их использовании при очистке воды.
Примеси и основные побочные продукты: ограничение по массовой доле содержания Fe(III) в %
Ссылка: Таблица 3 – Примеси
Fe (II) имеет более низкую коагулянтную эффективность по сравнению с Fe(III). Также гидролиз Fe(II) начинается при pH 8, поэтому Fe(II) может оставаться в воде при более низких значениях pH.
Избыток нерастворимых веществ указывает на присутствие посторонних веществ Железо, являющееся компонентом продукта, обычно удаляется в процессе обработки.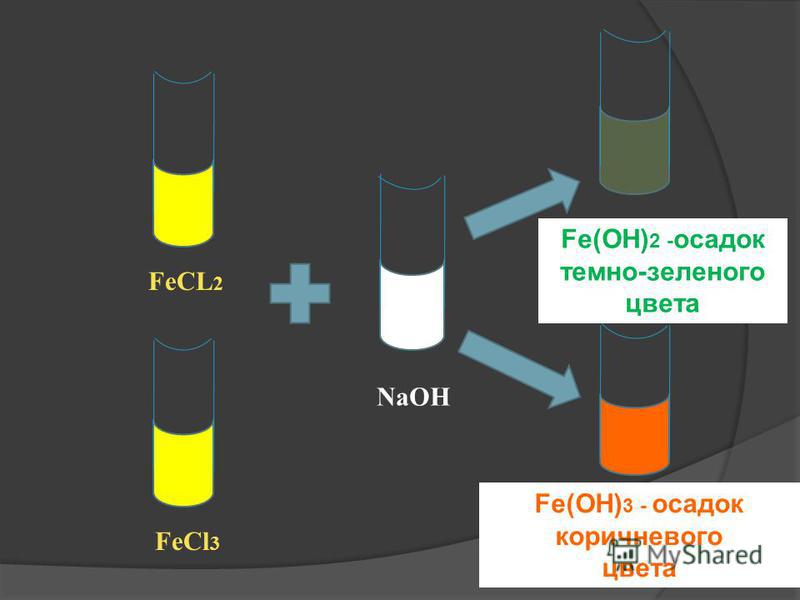





 Он используется в нескольких процедурах для производства тканей, плавки, производства лекарственных средств и утилизации отходов.
Он используется в нескольких процедурах для производства тканей, плавки, производства лекарственных средств и утилизации отходов.


