доклады советской делегации. — 1955 — Электронная библиотека «История Росатома»
Реакторостроение и теория реакторов: доклады советской делегации. — 1955 — Электронная библиотека «История Росатома»Главная → Указатель произведений
ЭлектроннаябиблиотекаИстория Росатома
Ничего не найдено.
Загрузка результатов…
Закладки
Обложка12 пустая34567891010 вкл. 1111212 вкл. 1131415161718192021222324252627282930313233343536373838 вкл. 13940414243444546474849505152535455565758596061626364656667686970717273747576777879808182838485868788899091929394959696 вкл. 196 вкл. 296 вкл. 3979898 вкл. 199100101102103104105106106 вкл. 1107108109110111112113114115116117118119120121122123124125126127128129130131132133134135136137138139140141142143144145146147148149150151152153154155156157158159160161162163164165166167168169170171172173174175176177178179180181182183184185186187188189190191192193194195196197198199200201202203204205206207208209210211212213214215216217218219220221222223224225226227228229230231232233234235236237238239240241242243244245246247248249250251252253254255256257258259260261262263264265266267268269270271272273274275276277278279280281282283284285286287288289290291292293294295296297298299300301302303304305306307308
Увеличить/уменьшить масштаб
По ширине страницы
По высоте страницы
Постранично/Разворот
Поворот страницы
Навигация по документу
Закладки
Поиск в издании
Структура документа
Скопировать текст страницы
(работает в Chrome 42+,
Microsoft Internet Explorer и Mozilla FireFox
c установленным Adobe Flash Player)
Добавить в закладки
Текущие страницы выделены рамкой.
Содержание
ОбложкаОбложка
1Титульный лист
3Блохинцев Д. И., Николаев Н. А.
Первая атомная электростанция СССР и пути развития атомной энергетики 49Кружилин Г. Н.
Реактор для физических и технических исследований 91Николаев Ю. Г.
Экспериментальный ядерный реактор на обыкновенной воде и обогащенном уране 105Алиханов А. И., Владимирский В. В., Никитин С. Я., Галанин А. Д., Гаврилов С. А., Бургов Н. А.
Опытный физический реактор с тяжелой водой 119Николаев Ю. Г.
Ядерный реактор для исследовательских целей мощностью 2000 квт по теплу 127Алиханов А. И., Завойский В. К., Сердюк Р. Л., Эршлер Б. В., Суворов Л. Я.
Кипящий энергетический гомогенный ядерный котел 139Михеев М. А., Баум В. А., Воскресенский К. Д., Федынский О. С.
Теплоотдача расплавленных металлов 152Фейнберг С. М.
Гетерогенные методы расчета реакторов. Обзор результатов и сравнение с экспериментом 191Галанин А. Д.
Критический размер гетерогенного реактора с малым числом блоков 199 А.Расчеты гетерогенных реакторов с небольшим числом блоков 206
А.Расчеты гетерогенных реакторов с небольшим числом блоков 206Галанин А. Д.
Использование метода эффективных граничных условий для расчета критических размеров реактора 213Галанин А. Д.
Поглощение и размножение нейтронов при замедлении в теории двух групп 220Гуревич И. И., Померанчук И. Я.
Теория резонансного поглощения в гетерогенных системах 236Галанин А. Д.
Вычисление коэффициента теплового использования в гетерогенном реакторе 251Усачев Л. Н.
Уравнение для ценности нейтронов, кинетика реактора и теория возмущений 269Галанин А. Д.
Эффективность регуляторов в реакторе на тепловых нейтронах 279Зарецкий Д. Ф., Одинцов Д. Д.
Эффективные граничные условия для «серых» тел 294Бать Г. А., Зарецкий Д. Ф.
Решение обобщенной задачи Милна307Содержание
308Концевая страница
308Опечатки
Обращаясь к сайту «История Росатома — Электронная библиотека»,
я соглашаюсь с условиями использования представленных там материалов.
Правила сайта (далее – Правила)
- Общие положения
- Настоящие правила определяют порядок и условия использования материалов, размещенных на сайте www.biblioatom.ru (далее именуется Сайт), а также правила использования материалов Сайтом и порядок взаимодействия с Администрацией Сайта.
- Любые материалы, размещенные на Сайте, являются объектами интеллектуальной собственности (объектами авторского права или смежных прав, а также прав на средства индивидуализации). Права Администрации Сайта на указанные материалы охраняются законодательством о правах на результаты интеллектуальной деятельности.
- Использование материалов, размещенных на Сайте, допускается только с письменного согласия Администрации Сайта или иного правообладателя, прямо указанного на конкретном материале, размещенном на Сайте, или в непосредственной близости от указанного материала.
- Права на использование и разрешение использования материалов, размещенных на Сайте, принадлежащих иным правообладателям, нежели Администрация Сайта, допускается с разрешения таких правообладателей
или в соответствии с условиями, установленными такими правообладателями.
 Никакое из положений настоящих Правил не дает прав третьим лицам на использование материалов правообладателей, прямо указанных на
конкретном материале, размещенном на Сайте, или в непосредственной близости от указанного материала.
Никакое из положений настоящих Правил не дает прав третьим лицам на использование материалов правообладателей, прямо указанных на
конкретном материале, размещенном на Сайте, или в непосредственной близости от указанного материала.
- Настоящие Правила распространяют свое действие на следующих пользователей: информационные агентства, электронные и печатные средства массовой информации, любые физические и юридические лица, а также индивидуальные предприниматели (далее — «Пользователи»).
- Использование материалов. Виды использования
- Под использованием материалов Сайта понимается воспроизведение, распространение, публичный показ, сообщение в эфир, сообщение по кабелю, перевод, переработка, доведение до всеобщего сведения и иные способы использования, предусмотренные действующим законодательством Российской Федерации.
- Использование материалов Сайта без получения разрешения от Администрации Сайта не допустимо.

- Внесение каких-либо изменений и/или дополнений в материалы Сайта запрещено.
- Использование материалов Сайта осуществляется на основании договоров с Администрацией Сайта, заключенных в письменной форме, или на основании письменного разрешения, выданного Администрацией Сайта.
- Запрещается любое использование (бездоговорное/без разрешения) фото-, графических, видео-, аудио- и иных материалов, размещенных на Сайте, принадлежащих Администрации Сайта и иным правообладателям (третьим лицам).
- Стоимость использования каждого конкретного материала или выдача разрешения на его использование согласуется Пользователем и Администрацией Сайта в каждом конкретном случае.
- В случае необходимости использования материалов Сайта, права на которые принадлежат третьим лицам (иным правообладателям, нежели Администрация Сайта, о чем прямо указано на таких материалах либо в
непосредственной близости от них), Пользователи обязаны обращаться к правообладателям таких материалов для получения разрешения на использование материалов.

- Обязанности Пользователей при использовании материалов Сайта
- 3.1. При использовании материалов Сайта в любых целях при наличии разрешения Администрации Сайта, ссылка на Сайт обязательна и осуществляется в следующем виде:
- в печатных изданиях или в иных формах на материальных носителях Пользователи обязаны в каждом случае использования материалов указать источник – электронная библиотека «История Росатома» (www.biblioatom.ru)
- в интернете или иных формах использования в электронном виде не на материальных носителях, Пользователи в каждом случае использования материалов обязаны разместить гиперссылку на Сайт —
электронная
библиотека «История Росатома» (www.biblioatom.ru), гиперссылка должна являться активной и прямой, при нажатии на которую Пользователь переходит на конкретную страницу Сайта, с которой заимствован
материал.

- Ссылка на источник или гиперссылка, указанные в пп. 3.1.1 и 3.1.2. настоящих Правил, должны быть помещены Пользователем в начале используемого текстового материала, а также непосредственно под используемым аудио-, видео-, фотоматериалом, графическим материалом Администрации Сайта.
- Размеры шрифта ссылки на источник или гиперссылки не должны быть меньше размера шрифта текста, в котором используются материалы Сайта, либо размера шрифта текста Пользователя, сопровождающего аудио-, видео-, фотоматериалы и графические материалы Сайта, а также цвет ссылки должен быть идентичен цветам ссылок на Сайте и должен быть видимым Пользователю.
- Использование материалов с Сайта, полученных из вторичных источников (от иных правообладателей, нежели Администрация Сайта, о чем прямо указано на таких материалах либо в непосредственной близости от
них), возможно только со ссылкой на эти источники и, в случае необходимости, установленной такими источниками (правообладателями), — с их разрешения.

- Не допускается переработка оригинального материала (произведения), взятого с Сайта, в том числе сокращение материала, иная его переработка, в том числе приводящая к искажению его смысла.
- 3.1. При использовании материалов Сайта в любых целях при наличии разрешения Администрации Сайта, ссылка на Сайт обязательна и осуществляется в следующем виде:
- Права на материалы третьих лиц, урегулирование претензий
- Материалы, права на которые принадлежат третьим лицам, размещенные на Сайте, размещены либо с разрешения правообладателя, полученного Администрацией Сайта, либо, в случае, если таковое использование прямо не запрещено правообладателем, в соответствии с Законодательством РФ в информационных целях с обязательным указанием имени автора, материал которого используется, и источника заимствования.
- В случае, если в обозначении авторства материалов в соответствии с п. 4.1. настоящих Правил содержится ошибка, или в случае использования материала с предполагаемым или реальным нарушением прав
третьих лиц, или в иных спорных случаях использования объектов интеллектуальной собственности, размещенных на Сайте, в том числе в случае, когда права третьего лица тем или иным образом нарушаются с
использованием Сайта, применяется следующая схема урегулирования претензий третьих лиц к Администрации Сайта:
- в адрес Администрации Сайта по электронной почте на адрес info@biblioatom.
 ru направляется претензия, содержащая информацию об объекте интеллектуальной собственности, права на который
принадлежат
заявителю и который используется незаконно посредством Сайта или с нарушением правил использования, или иным образом права заявителя как обладателя исключительного права на объект интеллектуальной
собственности, размещенный на Сайте, нарушены посредством Сайта, с приложением документов, подтверждающих правомочия заявителя, данные о правообладателе и копия доверенности на действия от лица
правообладателя, если лицо, направляющее претензию, не является руководителем компании правообладателя или непосредственно физическим лицом — правообладателем. В претензии также указывается адрес
страницы
Сайта, которая содержит данные, нарушающие права, и излагается полное описание сути нарушения прав;
ru направляется претензия, содержащая информацию об объекте интеллектуальной собственности, права на который
принадлежат
заявителю и который используется незаконно посредством Сайта или с нарушением правил использования, или иным образом права заявителя как обладателя исключительного права на объект интеллектуальной
собственности, размещенный на Сайте, нарушены посредством Сайта, с приложением документов, подтверждающих правомочия заявителя, данные о правообладателе и копия доверенности на действия от лица
правообладателя, если лицо, направляющее претензию, не является руководителем компании правообладателя или непосредственно физическим лицом — правообладателем. В претензии также указывается адрес
страницы
Сайта, которая содержит данные, нарушающие права, и излагается полное описание сути нарушения прав;
- Администрация Сайта обязуется рассмотреть надлежаще оформленную претензию в срок не менее 5 (пяти) рабочих дней с даты ее получения по электронной почте.

- Администрация Сайта в любом случае предпринимает все возможные меры к скорейшему удовлетворению обоснованных претензий третьих лиц и стремиться к максимально скорому урегулированию всех
спорных
вопросов.

- в адрес Администрации Сайта по электронной почте на адрес info@biblioatom.
- Прочие условия
- Администрация Сайта оставляет за собой право изменять настоящие Правила в одностороннем порядке в любое время без уведомления Пользователей. Любые изменения будут размещены на Сайте. Изменения вступают в силу с момента их опубликования на Сайте.
- По всем вопросам использования материалов Сайта Пользователи могут обращаться к Администрации Сайта по следующим координатам: [email protected]
- Во всем, что не урегулировано настоящими Правилами в отношении вопросов использования материалов на Сайте, стороны руководствуются положениями Законодательства РФ.
СогласенНе согласен
Урок 2. Изотопы элементов – HIMI4KA
Архив уроков › Основные законы химии
В уроке 2 «Изотопы элементов» из курса «Химия для чайников» рассмотрим что такое изотопы элементов и как правильно их обозначают; кроме того мы научимся определять массовое число, дефект массы и энергию связи ядра. Данный урок полностью опирается на основы химии, изложенные в первом уроке, в котором мы рассмотрели строение атома и атомного ядра, поэтому настоятельно вам рекомендую его изучить от корки до корки.
Данный урок полностью опирается на основы химии, изложенные в первом уроке, в котором мы рассмотрели строение атома и атомного ядра, поэтому настоятельно вам рекомендую его изучить от корки до корки.
Что такое изотоп?
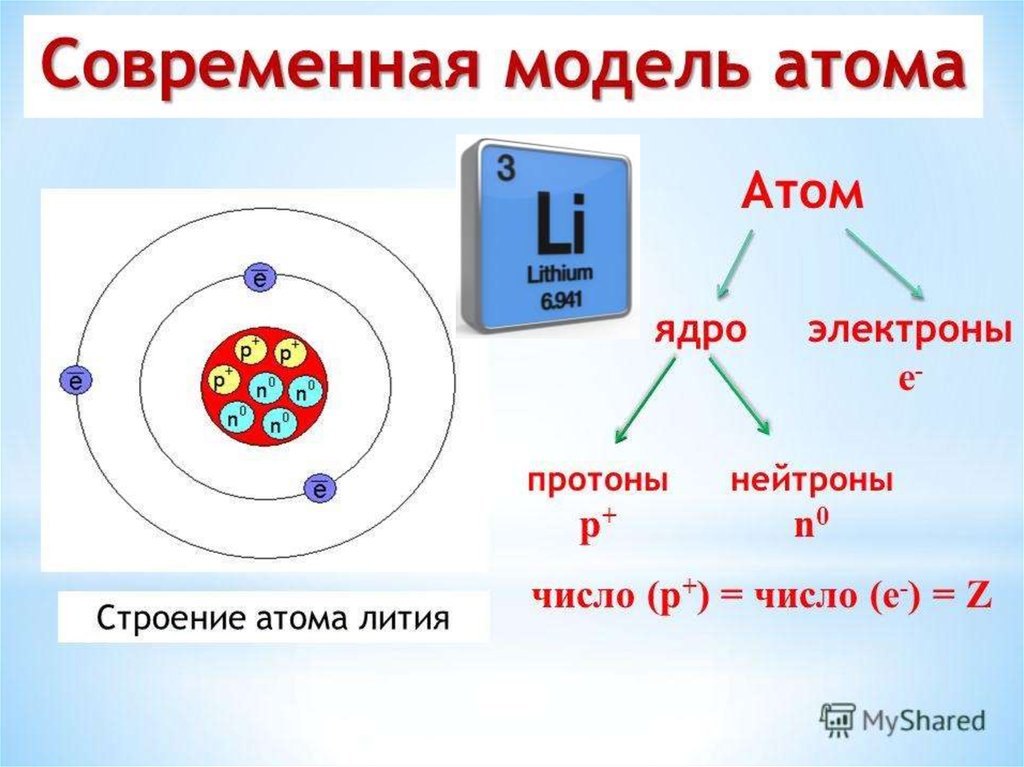
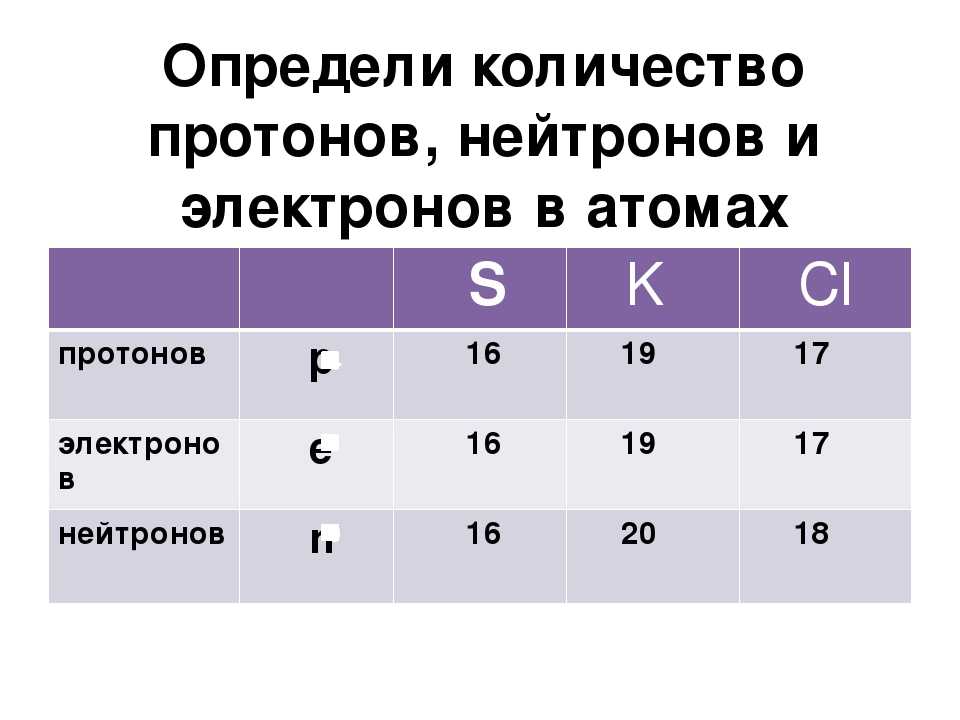
Хотя все атомы одного элемента имеют одинаковое число протонов, эти атомы могут отличаться числом имеющихся у них нейтронов. Такие различные атомы одного и того же элемента называются изотопами. Количество протонов, а также количество электронов у изотопа и исходного элемента совпадает. По этой причине в природе существует гораздо больше химических элементов, чем указано в таблице Менделеева, которая систематизирует элементы по числу протонов (порядковый номер).
Например, все атомы Li имеют 3 протона, но в природе существуют изотопы, содержащие от 3 до 5 нейтронов. Для обозначения изотопа, слева от символа элемента подписывают нижним индексом его порядковый номер, а верхним — массовое число. Массовое число — это суммарное число нуклонов (протонов и нейтронов) в атомном ядре, численно близкое к атомной массе элемента.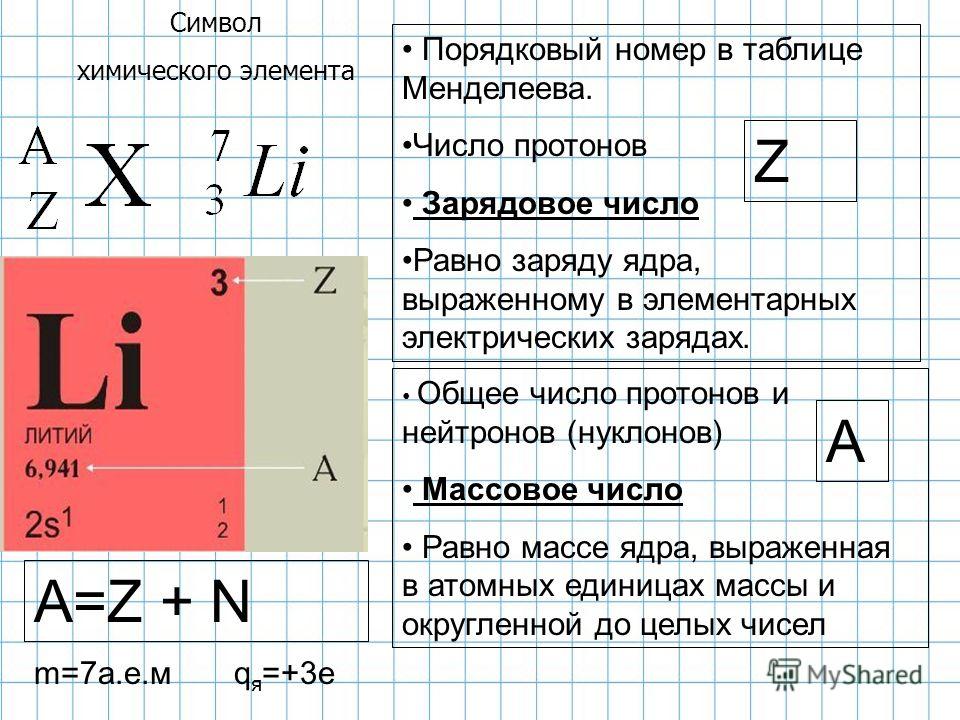 Нижний индекс, обозначающий порядковый номер элемента, указывать не обязательно, так как все атомы лития имеют в своем ядре по 3 протона. Также, обсуждая эти изотопы, можно пользоваться записью «литий-6» и «литий-8».
Нижний индекс, обозначающий порядковый номер элемента, указывать не обязательно, так как все атомы лития имеют в своем ядре по 3 протона. Также, обсуждая эти изотопы, можно пользоваться записью «литий-6» и «литий-8».
На рисунке выше изображен состав четырех изотопов гелия (Не). Все атомы гелия содержат два протона (и, следовательно, два электрона), но число нейтронов у них может быть разным. В природе большинство атомов гелия имеет два нейтрона (гелий-4) и реже одного раза на миллион встречаются атомы гелия с одним нейтроном (гелий-3). Другие изотопы гелия — гелий-5 , гелий-6 и гелий-8 (не показанный на рисунке) — неустойчивы и обнаруживаются лишь на очень непродолжительное время в ядерных реакциях (подробнее об этом будем говорить еще не скоро). Размеры ядер на рисунке очень сильно увеличены. Если бы они были такими, как это показано на рисунке, диаметр атома должен был достигать примерно 0,5 км.
Пример 1. Сколько протонов, нейтронов и электронов содержится в атоме урана-238? Запишите символ этого изотопа.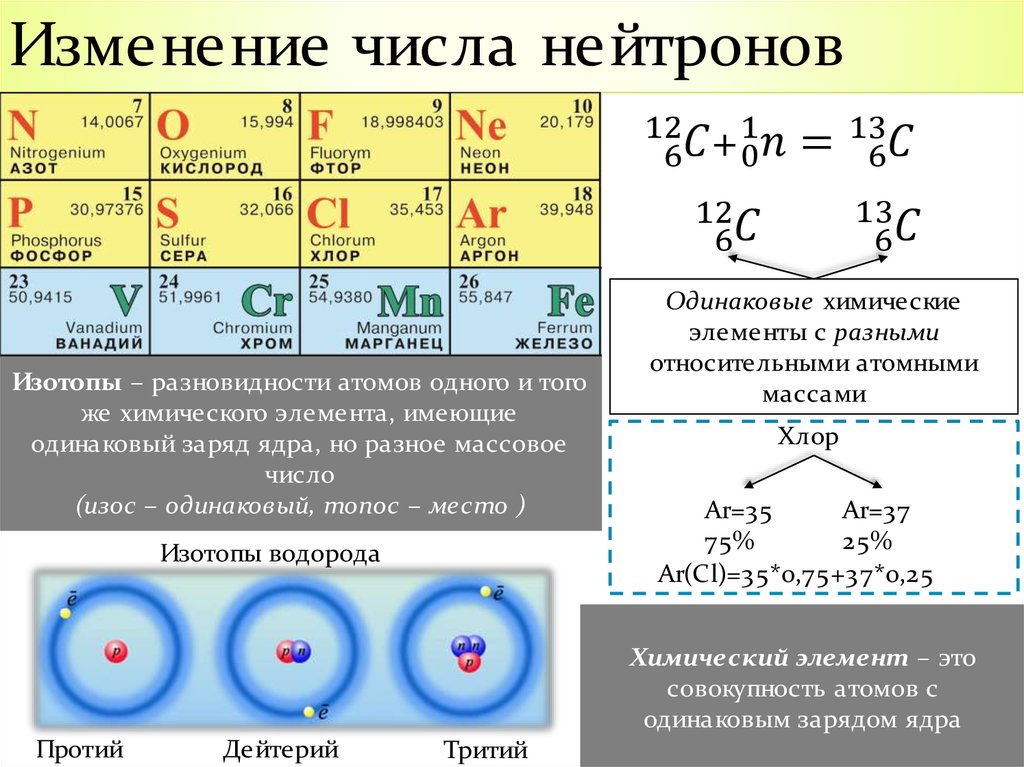
Решение: Порядковый номер урана (см. таблицу Менделеева) равен 92, а массовое число изотопа равно 238 (по условию). Следовательно, он содержит 92 протона, 92 электрона и 238 — 92 = 146 нейтронов. Его символ 238U.
Дефект массы и энергия связи ядра
Затронув тему изотопов, нельзя пройти мимо феномена дефект массы ядра. Когда из отдельных нуклонов образуется атомное ядро, часть их массы превращается в энергию. Другими словами, вот взяли вы щепотку протонов и нейтронов, хорошенько их смяли вместе, и получили ядро, но его масса будет меньше массы исходных компонентов. Это и есть дефект масс. Формула для расчета дефекта массы ядра:
- ∆m=(Zmp+Nmn)-Mя
где Mя – масса ядра, Z – число протонов в ядре, N – число нейтронов в ядре, mp – масса протона, mn – масса нейтрона.
Если к атому подвести энергию (которая эквивалентна дефекту масс), то можно разделить его ядро обратно на нуклоны. Эта энергия носит название энергия связи ядра. Формула для расчета энергии связи ядра:
Эта энергия носит название энергия связи ядра. Формула для расчета энергии связи ядра:
- ∆Eсв=∆mc2
где с — скорость света, ∆m — дефект массы ядра
Проверьте себя, как вы усвоили понятия дефект массы и энергия связи ядра, самостоятельно решив задачу пользуясь формулами выше.
Пример 2. Если образовать атом углерода-12 из субатомных частиц, какое значение будет иметь дефект масс?
Показать
Ответ: 0,0990 а.е.м.
[свернуть]
Теперь нам известно, что каждый изотоп элемента характеризуется порядковым номером (суммарным числом протонов), массовым числом (суммарным числом протонов и нейтронов) и атомной массой (массой атома, выраженной в атомных единицах массы). Поскольку дефект массы при образовании атома очень мал, массовое число обычно совпадает с атомной массой изотопа, округленной до ближайшего целого числа. (Например, атомная масса хлора-37 равна 36,966, что после округления дает 37. ) Если в природе встречается несколько изотопов одного элемента, то экспериментально наблюдаемая атомная масса (естественная атомная масса) равна средневзвешенному значению атомных масс отдельных изотопов. Это средневзвешенное значение определяется соответственно относительному содержанию изотопов в природе. Хлор существует в природе в виде смеси из 75,53% хлора-35 (атомная масса 34,97 а.е.м.) и 24,47% хлора-37 (36,97 а.е.м.), поэтому средневзвешенное значение масс этих изотопов равно
) Если в природе встречается несколько изотопов одного элемента, то экспериментально наблюдаемая атомная масса (естественная атомная масса) равна средневзвешенному значению атомных масс отдельных изотопов. Это средневзвешенное значение определяется соответственно относительному содержанию изотопов в природе. Хлор существует в природе в виде смеси из 75,53% хлора-35 (атомная масса 34,97 а.е.м.) и 24,47% хлора-37 (36,97 а.е.м.), поэтому средневзвешенное значение масс этих изотопов равно
- (0,7553·34,97 а.е.м.) + (0,2447·36,97 а.е.м.) = 35,46 а.е.м.
Атомные массы, указанные в таблице Менделеева представляют собой во всех случаях средневзвешенные значения атомных масс изотопов, встречающихся в природе, и именно этими значениями мы будем пользоваться в дальнейшем, за исключением тех случаев, когда будет обсуждаться какой-нибудь конкретный изотоп. Все изотопы одного элемента в химическом отношении ведут себя практически одинаково. На рисунке ниже изображены состав и свойства некоторые атомов, ионов и изотопов элементов.
Пример 3. Магний (Mg) в основном состоит из трех естественных изотопов: 78,70% всех атомов магния имеют атомную массу 23,985 а.е.м., 10,13% — 24,986 а.е.м. и 11,17% — 25,983 а.е.м. Сколько протонов и нейтронов содержится в каждом из этих трех изотопов? Чему равно средневзвешенное значение их атомных масс?
Решение: Все изотопы магния содержат по 12 протонов. Изотоп с атомной массой 23,985 а.е.м. имеет массовое число 24 (суммарное число протонов и нейтронов), следовательно, он имеет 24 — 12 = 12 нейтронов. Символ этого изотопа 24Mg. Аналогично находим, что изотоп с атомным весом 24,986 а.е.м. имеет массовое число 25, содержит 13 нейтронов и имеет символ 25Mg. Третий изотоп (25,983 а.е.м.) имеет массовое число 26, содержит 14 нейтронов и имеет символ 26Mg. Средняя атомная масса магния находится следующим образом:
- (0,7870·23,985 а.е.м.) + (0,1013·24,986 а.е.м.) + (0,1117·25,983 а.е.м.) = 24,31 а.
 е.м.
е.м.
Надеюсь урок 2 «Изотопы элементов» помог вам понять что из себя представляют изотопы. Если у вас возникли вопросы, пишите их в комментарии.
Урок 3. Схема образования молекул →
← Урок 1. Схема строения атомов
| 1 | Найдите количество нейтронов | Х | |
| 2 | Найдите массу 1 моля | Н_2О | |
| 3 | Баланс | H_2(SO_4)+K(OH)→K_2(SO_4)+H(OH) | |
| 4 | Найдите массу 1 моля | Х | |
| 5 | Найдите количество нейтронов | Фе | |
| 6 | Найдите количество нейтронов | ТК | |
| 7 | Найдите электронную конфигурацию | Х | |
| 8 | Найдите количество нейтронов | Са | |
| 9 | Баланс | CH_4+O_2→H_2O+CO_2 | |
| 10 | Найдите число нейтронов | С | |
| 11 | Найдите число протонов | Х | |
| 12 | Найдите количество нейтронов | О | |
| 13 | Найдите массу 1 моля | СО_2 | |
| 14 | Баланс | C_8H_18+O_2→CO_2+H_2O | |
| 15 | Найдите атомную массу | Х | |
| 16 | Определить, растворимо ли соединение в воде | Н_2О | |
| 17 | Найдите электронную конфигурацию | Нет | |
| 18 | Найдите массу отдельного атома | Х | |
| 19 | Найдите количество нейтронов | № | |
| 20 | Найдите количество нейтронов | Золото | |
| 21 | Найдите количество нейтронов | Мн | |
| 22 | Найдите количество нейтронов | Ру | |
| 23 | Найдите электронную конфигурацию | О | |
| 24 | Найдите массовые проценты | Н_2О | |
| 25 | Определить, растворимо ли соединение в воде | NaCl | |
| 26 | Найдите эмпирическую/простейшую формулу | Н_2О | |
| 27 | Найти степени окисления | Н_2О | |
| 28 | Найдите электронную конфигурацию | К | |
| 29 | Найдите электронную конфигурацию | Мг | |
| 30 | Найдите электронную конфигурацию | Са | |
| 31 | Найдите количество нейтронов | Рх | |
| 32 | Найдите количество нейтронов | Нет | |
| 33 | Найдите количество нейтронов | Пт | |
| 34 | Найдите количество нейтронов | Быть | Быть |
| 35 | Найдите количество нейтронов | Кр | |
| 36 | Найдите массу 1 моля | Н_2SO_4 | |
| 37 | Найдите массу 1 моля | HCl | |
| 38 | Найдите массу 1 моля | Фе | |
| 39 | Найдите массу 1 моля | С | |
| 40 | Найдите количество нейтронов | Медь | |
| 41 | Найдите количество нейтронов | С | |
| 42 | Найдите степени окисления | Х | |
| 43 | Баланс | CH_4+O_2→CO_2+H_2O | |
| 44 | Найдите атомную массу | О | |
| 45 | Найдите атомный номер | Х | |
| 46 | Найдите количество нейтронов | Пн | |
| 47 | Найдите количество нейтронов | ОС | |
| 48 | Найдите массу 1 моля | NaOH | |
| 49 | Найдите массу 1 моля | О | |
| 50 | Найдите электронную конфигурацию | Фе | |
| 51 | Найдите электронную конфигурацию | С | |
| 52 | Найдите массовые проценты | NaCl | |
| 53 | Найдите массу 1 моля | К | |
| 54 | Найдите массу отдельного атома | Нет | |
| 55 | Найдите число нейтронов | Н | |
| 56 | Найдите количество нейтронов | Ли | |
| 57 | Найдите количество нейтронов | В | |
| 58 | Найдите число протонов | № 92О | |
| 60 | Упростить | ч*2р | |
| 61 | Определить, растворимо ли соединение в воде | Х | |
| 62 | Найдите плотность на STP | Н_2О | |
| 63 | Найти степени окисления | NaCl | |
| 64 | Найдите атомную массу | Он | Он |
| 65 | Найдите атомную массу | Мг | |
| 66 | Найдите количество электронов | Х | |
| 67 | Найдите число электронов | О | |
| 68 | Найдите число электронов | С | |
| 69 | Найдите число нейтронов | Пд | |
| 70 | Найдите количество нейтронов | рт. ст. ст. | |
| 71 | Найдите количество нейтронов | Б | |
| 72 | Найдите массу отдельного атома | Ли | |
| 73 | Найдите эмпирическую формулу | Н=12%, С=54%, N=20 | , , |
| 74 | Найдите число протонов | Быть | Быть |
| 75 | Найдите массу 1 моля | На | |
| 76 | Найдите электронную конфигурацию | Со | |
| 77 | Найдите электронную конфигурацию | С | |
| 78 | Баланс | C_2H_6+O_2→CO_2+H_2O | |
| 79 | Баланс | Н_2+О_2→Н_2О | |
| 80 | Найдите электронную конфигурацию | Р | |
| 81 | Найдите электронную конфигурацию | Пб | |
| 82 | Найдите электронную конфигурацию | Ал | |
| 83 | Найдите электронную конфигурацию | Ар | |
| 84 | Найдите массу 1 моля | О_2 | |
| 85 | Найдите массу 1 моля | Н_2 | |
| 86 | Найдите количество нейтронов | К | |
| 87 | Найдите количество нейтронов | Р | |
| 88 | Найдите число нейтронов | Мг | |
| 89 | Найдите количество нейтронов | Вт | |
| 90 | Найдите массу отдельного атома | С | |
| 91 | Упростить | н/д+кл | |
| 92 | Определить, растворимо ли соединение в воде | Н_2SO_4 | |
| 93 | Найдите плотность на STP | NaCl | |
| 94 | Найти степени окисления | C_6H_12O_6 | |
| 95 | Найти степени окисления | Нет | |
| 96 | Определить, растворимо ли соединение в воде | C_6H_12O_6 | |
| 97 | Найдите атомную массу | Кл | |
| 98 | Найдите атомную массу | Фе | |
| 99 | Найдите эмпирическую/самую простую формулу | СО_2 | |
| 100 | Найдите количество нейтронов | Мт |
Определение и формула для расчета
- Определение
- Как рассчитать молярную массу
- Подробнее о расчете
- Расчет молярной массы элемента
- Расчет молярной массы соединения
- История крота
- Забавные факты о кротах мира
- Давайте позаботимся о вашем академическом уровне прямо сейчас!
Что ж, вы только что хорошо провели выходные, а теперь вам нужно вернуться в мир науки, в частности, к молекулярной массе. Да, вам обязательно нужно знать, как найти молярную массу.
Да, вам обязательно нужно знать, как найти молярную массу.
Определение
Молярная масса может быть определена как масса одного моля любого вещества. Что касается моля, то это всего лишь общее количество атомов в двенадцати граммах изотопа углерода-12. Это всегда фиксированное число, часто называемое числом Авогадро. Как следует из этого, молярную массу любого вещества можно объяснить как массу числа молекул Авогадро данного вещества. Молярная масса используется, когда речь идет о расчете концентрации определенного вещества.
Кстати, атомы обычно состоят из двух или даже трех типов частиц. Вспомним их. Это нейтрон, протон и, наконец, электрон. Грубо говоря, протон эквивалентен нейтрону по массе. Электрон — чрезвычайно легкая частица, поэтому при расчете молярной массы мы можем позволить себе не учитывать электрон. (итак: как найти молярную массу?)
Моль является важной формой измерения в химии. Понятно, что для поддержания стабильности элементам требуется наличие равных элементов электронов и протонов. С другой стороны, они различаются по количеству нейтронов. Атомный номер обозначается общим количеством протонов.
С другой стороны, они различаются по количеству нейтронов. Атомный номер обозначается общим количеством протонов.
Общее количество нейтронов и протонов вместе образуют так называемое массовое число. Это, конечно, без электронов, как мы только что сказали выше, их масса совершенно незначительна. Любой элемент сначала обозначается атомным номером. Любой элемент начинен одними и теми же атомами, хотя они сильно различаются по изотопам и массам.
В атоме углерода может быть до шести протонов. Между тем, атом этого элемента с шестью нейтронами известен как изотоп углерода-12, а изотоп углерода-14 — с восемью нейтронами.
Ученые выбрали изотоп углерода-12 в качестве основы для своих измерений молей. В двенадцати граммах этого вещества мы можем найти до 6,022 х 1023 атомов. Это число Авогадро, упомянутое выше.
Масса одного моля любого вещества обычно относится к индивидуальному массовому числу атомов в веществе. Например, моль кислорода имеет массу 16 граммов, потому что самый распространенный тип атома кислорода имеет 8 протонов, 8 электронов, 8 нейтронов и, соответственно, его массовое число равно 16.
Измерение с помощью молекулярной массы также реально, если используется молекула соединения. Скорее всего, вы уже знаете, что молекула воды состоит из одного атома кислорода и двух слипшихся атомов водорода. Просто объединив все массовые числа вместе, мы получим общую массу одной молекулы воды. Кроме того, это число является точным эквивалентом массы, представленной в граммах одного моля воды.
Химики используют моль как форму измерения массы и концентрации данного вещества. Принимая во внимание, что моль начинен буквально триллионами атомов, а количество граммов одного вещества не обязательно равно силе того же количества граммов другого вещества, это чрезвычайно полезный и простой метод измерения химических веществ. Молярная масса вещества дополнительно равна массовому числу данного вещества. Химики обычно используют это свойство, когда дело доходит до взвешивания того, сколько химиката им нужно использовать.
Как рассчитать молярную массу
Пришло время приблизиться к науке. Если вам поручили вычислить молярную массу определенного соединения, вы можете использовать таблицу Менделеева, а также количество данного соединения. Напомним, что молярная масса данного соединения – это масса одного моля вещества в граммах.
Если вам поручили вычислить молярную массу определенного соединения, вы можете использовать таблицу Менделеева, а также количество данного соединения. Напомним, что молярная масса данного соединения – это масса одного моля вещества в граммах.
Для этого вам потребуется:
- Формула химического соединения
- Таблица Менделеева
- Молярные массы элементов
Во-первых, вам нужно найти молярную массу данного элемента. Молярная масса в граммах равна атомному весу элемента, выраженному в атомных единицах массы. Вы можете найти их в периодической таблице.
Во-вторых, вам нужно рассчитать двухатомные элементы. Имейте в виду, что азот, водород, фтор, кислород, йод и бром являются двухатомными элементами. Это чистые элементы, и они образуют молекулы с двумя атомами. Чтобы найти молярную массу двухатомного элемента, нужно умножить его атомную массу на два.
В-третьих, необходимо рассматривать химические соединения без индексов. Ну, на самом деле вы работаете с химическим соединением, представляющим собой комбинацию определенных элементов, и в их формуле нет индексов. Просто добавьте молярные массы каждого из доступных элементов.
Ну, на самом деле вы работаете с химическим соединением, представляющим собой комбинацию определенных элементов, и в их формуле нет индексов. Просто добавьте молярные массы каждого из доступных элементов.
В-четвертых, вы только что рассмотрели соединения без индексов, теперь следует сделать то же самое, но с индексами. Предположим, у вашего соединения есть индексы. Вы должны умножить количество атомов в химической группе или элементе с нижним индексом на значение нижнего индекса.
Тогда вам нужно рассмотреть соединения с более сложными формулами. Итак, если вы работаете с соединением, имеющим более сложные индексы, вам необходимо учитывать общее количество атомов в этом соединении.
Наконец, следует перейти к расчетам. Используйте молярную массу в различных химических приложениях. Например, вы можете использовать его, чтобы найти молекулярную формулу нужного вещества.
Подробнее о расчете
Итак, вы только что познакомились с методом в целом, а теперь пора перейти к существенным деталям.
Атомы — это очень маленькие частицы, поэтому их измерение не имеет смысла. Таким образом, чтобы работать со значительным количеством веществ, необходимо сгруппировать их в единицы, называемые молями. Как упоминалось выше, моль — это количество атомов углерода в двенадцати граммах изотопа углерода-12, что составляет примерно 6,022 х 1023 атома — число Авогадро. Он используется как число атомов буквально для любого вещества. Кстати, масса одного моля данного вещества и есть его молярная масса.
Расчет молярной массы элемента
Просто используя атомную массу данного элемента, а затем умножая ее на коэффициент пересчета в граммах на моль, вы можете легко вычислить молярную массу любого элемента.
Необходимо найти относительную атомную массу данного элемента. Этот тип атомной массы представляет собой среднюю массу образца всех его изотопов. Эта информация ждет вас в таблице Менделеева. Вам нужно найти элемент там и найти нужное число под символом элемента. Это будет не целое число, оно будет состоять из десятичных дробей.
Вы должны умножить вновь полученную атомную массу на постоянную молярной массы. Это один грамм на моль.
Некоторые элементы можно обнаружить только в молекулах из двух атомов и даже больше. Из этого следует, что если вы хотите найти молярную массу элементов, состоящих из двух атомов, включая кислород, водород и хлор, вам необходимо найти их относительные атомные массы. Поэтому вам нужно умножить их на постоянную молярной массы. Готовый результат следует умножить на два.
Расчет молярной массы соединения
Здесь вы должны выяснить химическую формулу соединения. Это количество атомов в каждом элементе, из которого состоит соединение. Например, предположим, что вы имеете дело с C6h22O6 (глюкоза). В этом случае у нас есть шесть атомов углерода, двенадцать атомов водорода, а также шесть атомов кислорода.
Определите относительную атомную массу каждого элемента в соединении. С помощью периодической таблицы вам нужно найти относительную атомную массу каждого элемента. Как сказано выше, это число под символом элемента. Как и в предыдущем случае, вы должны умножить эти массы на один грамм/моль.
Как сказано выше, это число под символом элемента. Как и в предыдущем случае, вы должны умножить эти массы на один грамм/моль.
Что касается глюкозы, то относительные атомные массы ее элементов составляют водород -1,007 г/моль, углерод -12,0107 г/моль и кислород -15,9994 г/моль.
Найдите молярную массу каждого элемента в соединении. Вам нужно умножить атомную массу элемента на количество атомов данного элемента в соединении. Таким образом, вы получите относительное количество, которое каждый элемент вносит в это конкретное соединение. Что касается глюкозы, молярная масса каждого элемента:
- кислород: 15,9994 х 6 = 95,9964 г/моль
- водород: 1,007 х 12 = 12,084 г/моль
- углерод: 12,0107 x 6 = 72,0642 г/моль
Наконец, вам нужно добавить молярные массы каждого элемента в соединении. Он определяет молярную массу всего соединения. Здесь вы должны взять продукты, полученные на предыдущем шаге, а затем сложить их все вместе, чтобы рассчитать молярную массу данного соединения.
Что касается глюкозы, то ее молярная масса будет: 72,0642 + 12,084 + 95,9964 = 180,1446 г/моль – масса одного моля этого вещества.
История крота
Известный научный термин «число Авогадро» появился благодаря выдающемуся итальянскому ученому Афмедео Авогадро. Он оказался первым, кто понял, что объем газа строго пропорционален количеству молекул или атомов. В 1930-х годах в американских учебниках по химии появился термин «число Авогадро».
Примерно в 1900 году Оствальд впервые ввел единицу измерения «моль». Он также определил его в граммах. Грамм можно определить как единицу массы. Позже ученый связал понятие моля с идеальным газом.
Забавные факты о кротах мира
Что ж, мы только что закончили обучение и теперь вы уже точно знаете, как рассчитать молярную массу. Ваш мозг полностью истощен, поэтому имеет смысл расслабиться. Пожалуй, лучший способ сделать это — просмотреть несколько забавных фактов о кротах мира.
Наше человеческое тело состоит примерно из ста триллионов клеток. Итак, общее количество человеческих клеток на Земле составляет примерно 100×1012*6×109=6×1023. Это соответствует одному молю.
Итак, общее количество человеческих клеток на Земле составляет примерно 100×1012*6×109=6×1023. Это соответствует одному молю.
Предположим, что объем одной песчинки составляет около 10-12 м3, а площадь США занимает 1013 м2. Как следует из этого, в одном сантиметре песка Америку покрыл бы моль песчинок.
Если бы у вас была моль пенни, вы могли бы произвести достаточно денег для каждого человека, чтобы они могли выкладывать по миллиону баксов каждый час, с утра до вечера и до последних дней.
Учитывая, что Земля имеет радиус около 6400 км, ее объем составляет 1021 м3. 936 различных попыток. Это около 1028, а это более 17 000 молей.
Учитывая, что примерно 500 крупных грейпфрутов легко поместятся в кубическом метре, соответственно, моль грейпфрута будет иметь такие же размеры, как и наша планета.
Если бы у вас был всего один моль листов бумаги, можно было бы сделать миллион одинаковых стопок с уровня печати на планете, которая прошла бы мимо Солнца.

 Никакое из положений настоящих Правил не дает прав третьим лицам на использование материалов правообладателей, прямо указанных на
конкретном материале, размещенном на Сайте, или в непосредственной близости от указанного материала.
Никакое из положений настоящих Правил не дает прав третьим лицам на использование материалов правообладателей, прямо указанных на
конкретном материале, размещенном на Сайте, или в непосредственной близости от указанного материала.




 ru направляется претензия, содержащая информацию об объекте интеллектуальной собственности, права на который
принадлежат
заявителю и который используется незаконно посредством Сайта или с нарушением правил использования, или иным образом права заявителя как обладателя исключительного права на объект интеллектуальной
собственности, размещенный на Сайте, нарушены посредством Сайта, с приложением документов, подтверждающих правомочия заявителя, данные о правообладателе и копия доверенности на действия от лица
правообладателя, если лицо, направляющее претензию, не является руководителем компании правообладателя или непосредственно физическим лицом — правообладателем. В претензии также указывается адрес
страницы
Сайта, которая содержит данные, нарушающие права, и излагается полное описание сути нарушения прав;
ru направляется претензия, содержащая информацию об объекте интеллектуальной собственности, права на который
принадлежат
заявителю и который используется незаконно посредством Сайта или с нарушением правил использования, или иным образом права заявителя как обладателя исключительного права на объект интеллектуальной
собственности, размещенный на Сайте, нарушены посредством Сайта, с приложением документов, подтверждающих правомочия заявителя, данные о правообладателе и копия доверенности на действия от лица
правообладателя, если лицо, направляющее претензию, не является руководителем компании правообладателя или непосредственно физическим лицом — правообладателем. В претензии также указывается адрес
страницы
Сайта, которая содержит данные, нарушающие права, и излагается полное описание сути нарушения прав;


 е.м.
е.м.