Задания №14 с решениями
Главная \ Подготовка к ОГЭ \ Химия \ Задания №14 с решениями
Разберем задания №14 из вариантов ОГЭ за 2016 год.
Перед решением заданий рекомендуем повторить тему «Окислительно-восстановительные реакции. Окислители. Восстановители».
Задания с решением.
Задание №1.
Окислительные свойства водород проявляет в реакции, уравнение которой
1. CuO + h3 = Cu + h3O
2. h3 + Cl2 = 2HCl
3. Ca + h3 = Cah3
4. 2h3 + O2 = 2h3O
Объяснение: запишем изменение степеней окисления водорода в данных реакциях
1. 0 → +1
2. 0 → +1
3. 0 → -1
4. 0 → +1
Водород принимает электроны только в реакции №3. Правильный ответ — 3.
Задание №2.
Сера является окислителем в реакции, уравнение которой:
1. 2SO2 + O2 = 2SO3
2. 2h3S + 3O2 = 2h3O + 2SO2
2h3S + 3O2 = 2h3O + 2SO2
3. h3S + Br2 = 2HBr + S
4. 2Al + 3S = Al2S3
Объяснение: запишем изменения степеней окисления серы
1. +4 → +6
2. -2 → +4
3. -2 → 0
4. 0 → -3
Сера принимает электроны только в реакции 4.
Правильный ответ — 4.
Задание №3.
В химической реакции, уравнение которой
CO + CuO = Cu + CO2
Восстановителем является
1. Cu +2 в оксиде меди (II)
2. С+2 в оксиде углерода (II)
3. О-2 в оксиде углерода (II)
4. О-2 в оксиде меди (II)
Объяснение: запишем атомы каких элементов меняют степени окисления:
С(+2) -2ē → С(+4)
Сu(+2) +2ē→ Cu(0)
Восстановитель отдает электроны, следовательно, С(+2) — восстановитель.
Правильный ответ — 2.
Задание №4.
В уравнении окислительно-восстановительной реакции
NO2 + Mg = MgO + N2
коэффициент перед формулой окислителя равен
1.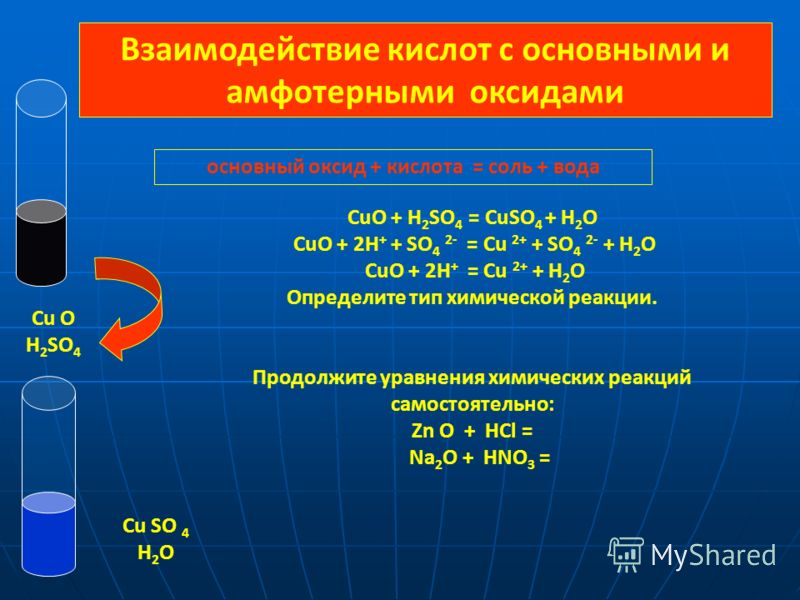 4
4
2. 3
3. 2
4. 1
Объяснение: запишем баланс
2N(+4) +8ē→ N2(0) окислитель
Mg(0) -2ē→ Mg(+2) восстановитель
Азот в составе оксида является окислителем. Перед его формулой будет коэффициент 2:
2NO2 + 4Mg = 4MgO + N2
Правильный ответ — 3.
Задание №5.
В химической реакции, уравнение которой
2KI + SO3 = K2SO3 + I2
окислителем является
1. I‾ в иодиде калия
2. О²‾ в оксиде серы (VI)
3. K+1 в иодиде калия
4. S+6 в оксиде серы (VI)
Объяснение: запишем баланс
2I(-1) -2ē→ I2(0) восстановитель
S(+6) +2ē→ S(+4) окислитель
Окислитель принимает электроны, поэтому S(+6) в оксиде серы (IV) является окислителем.
Правильный ответ — 4.
Задание №6.
Сера является окислителем в реакции:
1. C + 2h3SO4(конц) = CO2 + 2SO2 + 2h3O
C + 2h3SO4(конц) = CO2 + 2SO2 + 2h3O
2. 2KOH + h3S = K2S + 2h3O
3. 2h3SO3 + O2 = 2h3SO4
4. S + O2 = SO2
Объяснение: запишем изменение степеней окисления серы в приведенных реакциях:
1. +6 → +4
2. -2 → -2
3. +4 → +6
4. 0 → +4
Окислитель принимает электроны, с серой это происходит только в первой реакции. Правильный ответ — 1.
Задание №7.
Хлор является восстановителем в реакции
1. Cl2 + 2KBr = 2KCl + Br2
2. 3S + 2KClO3 = 3SO2 + 2KCl
3. 2HClO(конц) = 2HCl + O2
4. Cl2 + F2 = 2ClF
Объяснение: запишем изменение степеней окисления хлора в приведенных реакциях:
1. 0 +2ē→ -1
2. +5 +6ē→ -1
3. +1 +2ē→ -1
4. 0 -2ē→ +1
Восстановитель в реакциях отдает электроны, хлор отдает электроны только в четвертой реакции. Правильный ответ — 4.
Задание №8.
Фосфор является окислителем в реакции:
1. 4P + 5O2 = 2P2O5
2. 2P + 5Cl2 = 2PCl5
3. 2P + 3Ca = Ca3P2
4. Ph4 + 2O2 = h4PO4
Объяснение: запишем изменение степеней окисления фосфора в приведенных реакциях:
1. 0 -5ē→ +5
2. 0 -5ē→ +5
3. 0 +3ē→ -3
4. -3 -8ē→ +5
Окислитель принимает электроны, фосфор принимает электроны только в третьей реакции.
Правильный ответ — 3.
Задание №9.
В уравнении окислительно-восстановительной реакции
Nh4 + O2 = h3O + NO
коэффициент перед формулой окислителя равен
1. 6
2. 5
3. 4
4. 3
Объяснение: запишем электронно-ионный баланс данной реакции:
N(-3) -5ē→ N(+2) || 4 — восстановитель
O2(0) +4ē→ 2O(-2) ||5 — окислитель
4Nh4 + 5O2 = 6h3O + 4NO
Окислителем является кислород в виде простого вещества. Коэффициент перед его формулой — 5. Правильный ответ — 2.
Коэффициент перед его формулой — 5. Правильный ответ — 2.
Задание №10.
Кислород является окислителем в реакции:
1. 2Cl2 + 2h3O = 4HCl + O2
2. 2KClO3 = 2KCl + 3O2
3. 2h3S + 3O2 = 2SO2 + 2h3O
4. SiO2 + 2F2 = SiF4 + O2
Объяснение: запишем изменение степеней окисления кислорода для каждой реакции:
1. -2 -4ē→ 0
2. -2 -4ē→ 0
3. 0 +4ē→ -2
4. -2 -4ē→ 0
Правильный ответ — 3.
Кислород принимает электроны (как окислитель) только в третьей реакции. Есть другой способ решения этого задания: нужно внимательно посмотреть на реакции, три из них похожи (1, 2, 4) в них всех в качестве продукта есть кислород в виде простого вещества, а в левых частях этих реакций и в веществах кислород стоит «на последнем месте», то есть имеет отрицательную степень окисления, а значит меняет степень окисления с -х на 0, то есть отдает электроны. А в третьей реакции кислород наоборот в виде простого вещества стоит в левой части, а значит, скорее всего, будет принимать электроны.
А в третьей реакции кислород наоборот в виде простого вещества стоит в левой части, а значит, скорее всего, будет принимать электроны.
Автор решения: Лунькова Е.Ю.
Задания для самостоятельного решения.
1. Водород является окислителем в реакции:
1. CuO + h3 = Cu + h3O
2. 2h3 + O2 = 2h3O
3. 2K + 2h3O = 2KOH + h3
4. Ch5 + 2O2 = CO2 + 2h3O
2. Сера является восстановителем в реакции:
1. 4Mg + 5h3SO4 = 4MgSO4 + h3S + 2h3O
2. h3S + Cl2 = 2HCl + S
3. 2Al + 3S = Al2S3
4. 2KI + SO3 = K2SO3 + I2
3. Азот является окислителем в реакции:
1. 4Nh4 + 3O2 = 2N2 + 6h3O
2. 2Pb(NO3)2 = 2PbO + 4NO2 + O2
3. 4NO2 + O2 + 2h3O = 4HNO3
4. 2Nh4 + 3CuO = 3Cu + N2 + 3h3O
4. Фосфор является окислителем в реакции:
1. 2Ph4 + 4O2 = P2O5 + 3h3O
2. 3P + 5HNO3 + 2h3O = 3h4PO4 + 5NO
3. PCl5 = PCl3 + Cl2
4. 4P + 5O2 = 2P2O5
5. Сульфат-ионы нельзя обнаружить а растворе с помощью:
1. Хлорида бария
Хлорида бария
2. Карбоната бария
3. Гидроксида бария
4. Нитрата бария
6. Карбонат-ионы обнаруживают в растворе с помощью ионов:
1. Водорода
2. Натрия
3. Лития
4. Калия
7. Образование газа при добавлении к исследуемому раствору кислоты является признаком качественной реакции:
1. На силикат-ион
2. На фосфат-ион
3. На сульфат-ион
4. На карбонат-ион
8. Окраска раствора фенолфталеина изменяется при пропускании через него:
1. Аммиака
2. Сероводорода
3. Хлороводорода
4. Углекислого газа
9. С помощью раствора серной кислоты можно распознать растворы:
1. Карбоната натрия и карбоната калия
2. Нитрата бария и хлорида бария
3. Силиката калия и хлорида калия
4. Сульфита калия и сульфита натрия
10. Растворы фторида и фосфата натрия можно распознать с помощью раствора:
1. Нитрата серебра
2. Нитрата бария
3. Соляной кислоты
Соляной кислоты
4. Гидроксида бария
Предоставленные задания были взяты из сборника для подготовки к ОГЭ по химии авторов: Корощенко А.С. и Купцовой А.А.
Используя термохимическое уравнение реакции: CuO + h3… -reshimne.ru
Новые вопросы
Ответы
Похожие вопросы
Помогите пожалуйста очень прошу!!!
Назовите элемент если известно что он находится в четвёртой группе ПСХЭ И значение относительной молекулярной массы его высшего оксида равна 60…
Помогите с химией!!Прошу!…
Что такое [ М ] в химии, и как его определить.
Например, определите M ( Cu(OH)2 )….
Назовите элемент если известно что он находится в четвёртой группе ПСХЭ И значение Относительной молекулярной его Летучего водородного соединение равна 16.
Назовите элемент если известно что он находится в пятой группе ПСХЭ И значение относительной молекулярной массы его Летучего водородного соединение равна 17…
Дайте характеристику химической реакции 1) Fe+h3SO4=FeSO4+h3-Q 2) 2FeCl2+Cl2=2FeCl3+Q…
Математика
Литература
Алгебра
Русский язык
Геометрия
Английский язык
Химия
Физика
Биология
Другие предметы
История
Окружающий мир
География
Українська мова
Українська література
Қазақ тiлi
Беларуская мова
ИнформатикаЭкономика
Музыка
Право
Французский язык
Немецкий язык
МХК
ОБЖ
Психология
Видео с вопросом: определение диаграммы, которая правильно обозначает окислители и восстановители в химическом уравнении
Уравнение CuO (т) + H₂ (г) ⟶ Cu (т) + H₂O (ж) показывает, как оксид меди может реагировать с водородом с образованием меди и воды. Какое из следующих изображений правильно определяет окислитель и восстановитель в этом химическом уравнении? [A] Изображение A [B] Изображение B [C] Изображение C [D] Изображение D [E] Изображение E
Какое из следующих изображений правильно определяет окислитель и восстановитель в этом химическом уравнении? [A] Изображение A [B] Изображение B [C] Изображение C [D] Изображение D [E] Изображение E
Стенограмма видео
Уравнение CuO в твердом состоянии плюс h3 в газообразном состоянии реагирует с образованием твердого вещества Cu плюс жидкая вода H3O показывает, как оксид меди может реагировать с водорода для получения меди и воды. Какое из следующих изображений правильно определяет окислители и восстановители в этом химическом веществе уравнение?
В этом вопросе нам дается
подборка химических уравнений, показывающих реакцию между оксидом меди(II) и
водородный газ. В каждом из разных ответов
вариантов, мы видим, что один из продуктов или реагентов помечен как окислитель
агент, а второй продукт или реагент помечен как восстановитель. Освободим место для обсуждения
процессы окисления и восстановления.
Освободим место для обсуждения
процессы окисления и восстановления.
Можно объяснить окисление и восстановление в химических реакциях различными способами. Например, мы могли бы описать окисление как присоединение кислорода или потеря водорода веществом. Мы могли бы описать сокращение как потеря кислорода или приобретение водорода веществом. У нас также возможно описывают окисление и восстановление с точки зрения приобретения или потери электронов. Однако по уравнению реакции при условии, что нам будет легче использовать прирост или потерю кислорода, чтобы ответить на этот вопрос. вопрос.
При определении того, какое вещество в
реакция является окислителем, а которая является восстановителем, мы имеем в виду
реагенты. Реагент, окисляющий другой
реагент известен как окислитель. С другой стороны, реагент, который
восстанавливает, другой реагент является восстановителем. Если мы посмотрим на реакцию между
оксид меди (II) и газообразный водород, мы можем видеть, что оксид меди (II) теряет кислород до
образуют элементарную медь и поэтому восстанавливаются. Это означает, что газообразный водород или
h3, должно быть восстановителем.
Если мы посмотрим на реакцию между
оксид меди (II) и газообразный водород, мы можем видеть, что оксид меди (II) теряет кислород до
образуют элементарную медь и поэтому восстанавливаются. Это означает, что газообразный водород или
h3, должно быть восстановителем.
Если бы мы посмотрели на это с С другой точки зрения, можно сказать, что водород присоединяет кислород и окисляется до стать водой. Поскольку водород окисляется, оксид меди(II) должен быть окислителем. Окисление и восстановление не могут происходить независимо. И так всегда бывает, что когда произойдет одно, произойдет и другое.
Вернем варианты ответов
на экране, чтобы определить правильный ответ. Теперь, когда мы знаем, что окислительные и
восстановители являются реагентами, мы можем исключить варианты ответов (B), (C) и (D),
потому что в этих вариантах ответа есть один или несколько продуктов, помеченных как окисляющие или
восстановители.
Мы видим в выборе ответа (А) что оксид меди (II) помечен как окислитель, а водород помечен как восстановитель. Следовательно, правильный ответ выбор ответа (А).
В реакции CuO + h3 до Cu + h3O какое вещество 11 класс химии CBSE
Ответ
Проверено
160.7k+ просмотров
Подсказка: Данная реакция является окислительно-восстановительной реакцией или реакцией окисления-восстановления. В окислительно-восстановительной реакции восстановитель или восстановитель окисляются, а окислитель или окислитель восстанавливаются.
Полный пошаговый ответ:
— В окислительно-восстановительных реакциях реагенты изменяют свои степени окисления.
— С другой стороны, водород в состоянии 0 в атоме водорода теряет 2 электрона и окисляется до состояния +1 в воде.
Таким образом, водород окисляется, а медь восстанавливается.
— Еще одним примером окислительно-восстановительной реакции является реакция между сульфидом свинца и перекисью водорода. Сульфид свинца, имеющий химическую формулу ${\text{PbS}}$, реагирует с перекисью водорода, ${{\text{H}}_{\text{2}}}{{\text{O}}_{\text {2}}}$ с получением в качестве продуктов сульфата свинца, имеющего химическую формулу ${\text{PbS}}{{\text{O}}_{\text{4}}}$, и воды. Сбалансированное химическое уравнение реакции между сульфидом свинца и перекисью водорода показано ниже.
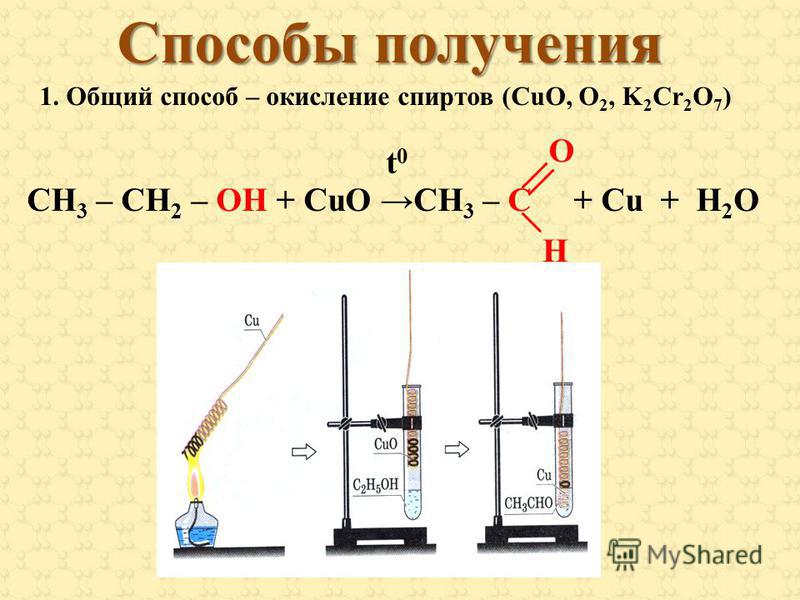
${\text{PbS + 4}}{{\text{H}}_{\text{2}}}{{\text{O}}_{\text{2}}} \to {\text {PbS}}{{\text{O}}_4} + {\text{4}}{{\text{H}}_{\text{2}}}{\text{O}}$
Сульфид свинца представляет собой черный осадок, а сульфат свинца — белый осадок.
— Это окислительно-восстановительная реакция, в которой перекись водорода окисляет сульфид свинца, в котором сера находится в степени окисления -2, до сульфата свинца, в котором сера находится в степени окисления +6. С другой стороны, кислород перекиси водорода в состоянии -1 восстанавливается в воде до состояния -2. Таким образом, в этой окислительно-восстановительной реакции перекись водорода действует как окислитель, а сульфид свинца — как восстановитель.
Примечание:
Окислительно-восстановительные реакции имеют множество применений в электрохимии. Окислительно-восстановительная реакция используется батареей, используемой для генерирования постоянного тока для производства электрической энергии. Аккумуляторы
, используемые в транспортных средствах для обеспечения всех электрических потребностей транспортных средств, также основаны на окислительно-восстановительных реакциях.
