Как это сбалансировать?$C+{{H}_{2}}S{{O}_{4}}\\to C{{O}_{2}}+{{H}_{2}} O+S{{O}_{2}}$
Подсказка: Добавление стехиометрических коэффициентов к реагенту и продуктам требует балансировки химических уравнений. Закону сохранения должны следовать химические уравнения, а закон постоянных пропорций очень важен для балансировки химических уравнений. Традиционный метод балансировки и метод алгебраической балансировки — это два простых и быстрых метода балансировки химического уравнения.
Полное пошаговое решение:
Данная реакция,
$C+{{H}_{2}}S{{O}_{4}}\to C{{O}_{2}}+{ {H}_{2}}O+S{{O}_{2}}$
Вещество, которое подвергается химическому превращению в приведенной выше реакции, углерод и серная кислота являются реагентами, а углекислый газ, вода и сера диоксид являются новыми продуктами.
Словесное уравнение показывает превращение реагентов в продукты через расположенную между ними стрелку. Реагенты написаны слева, а продукты написаны справа со знаком плюс (+) между ними.
Стрелки показывают направление продуктов реакции.
Химическое уравнение представляет собой химическую реакцию, когда вместо слов используются химические формулы.
Уравновешивание данного химического уравнения с использованием традиционного метода уравновешивания:
Шаг-1: данное несбалансированное уравнение
$C+{{H}_{2}}S{{O}_{4}}\to C{{O}_ {2}}+{{H}_{2}}O+S{{O}_{2}}$
Шаг 2:
Подсчитайте и сравните количество атомов каждого элемента в левой и правой частях стрелки . Убедитесь, что число атомов каждого элемента одинаково по обеим сторонам реакции, тогда говорят, что уравнение несбалансировано. Потому что обе стороны химического уравнения, масса не то же самое.
| Химическое уравнение: $C+{{H}_{2}}S{{O}_{4}}\to C{{O}_{2}}+{{H}_{ 2}}O+S{{O}_{2}}$ | |
| Сторона реагентов | Сторона продукта |
| Один атом углерода из C | Один атом углерода | Два атома водорода из ${ {H}_{2}}S{{O}_{4}}$ | Два атома водорода из ${{H}_{2}}O$ |
| Один атом серы из ${{H} _{2}}S{{O}_{4}}$ | Один атом серы из $S{{O}_{2}}$ |
| 4 атома кислорода из ${{H}_{2}}S{{O}_{4}}$ | 5 атомов кислорода, 2 из $C{{O}_{2}}$ , один из ${{H}_{2}}O$ , 2 из $S{{O}_{2}}$ |
Шаг: 3
Вспомните однажды, закон сохранения массы утверждает, что масса не может быть ни создана, ни уничтожена в химической реакции, что означает, что общая масса элементов, присутствующих в продуктах химической реакции, должна быть равна общей массе элементов, присутствующих в реагентах.
| Химическое уравнение: $C+2{{H}_{2}}S{{O}_{4}}\to C{{O}_{2}}+2{{H} _{2}}O+2S{{O}_{2}}$ | |
| Сторона реагентов | Сторона продукта |
| Один атом углерода из C | Один атом углерода | 4 атома водорода из ${{H}_{2}}S{{O}_{4}}$ | 4 атома водорода из ${{H}_{2}}O$ |
| 2 атома серы из ${{ H}_{2}}S{{O}_{4}}$ | 2 атома серы из $S{{O}_{2}}$ |
| 8 атомов кислорода из ${{H}_{2}}S{{O}_{4}}$ | 8 атомов кислорода, 2 из $C{{O}_{2}}$ , 2 из ${{H}_{2}}O$ , 4 из $S{{O}_{2}}$ |
Следовательно, сбалансированная химическая реакция будет
$C+2 {{H}_{2}}S{{O}_{4}}\to C{{O}_{2}}+2{{H}_{2}}O+2S{{O}_ {2}}$.
Примечание: Например, когда молоко оставляют при комнатной температуре, или пища готовится, или пища переваривается в нашем организме. В этих ситуациях природа и идентичность исходного вещества изменились.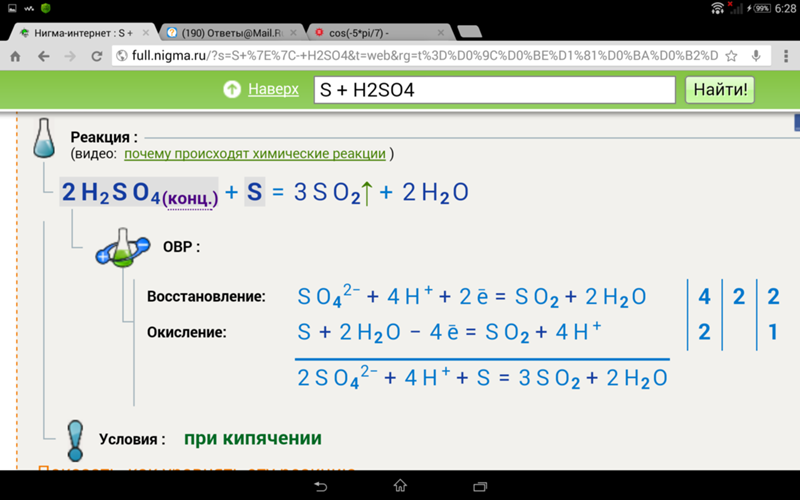 Всякий раз, когда происходит химическое изменение, эта химическая реакция представляет собой изменение реакции.
Всякий раз, когда происходит химическое изменение, эта химическая реакция представляет собой изменение реакции.
Сбалансируйте следующие реакции методом степени окисления: (a) h3SO4(водн.) + C(т) → CO2(г) + SO2(г) + h3O(л) (кислая) — Sarthaks eConnect
(a ) H 2 SO 4(водн.) + C (т) → CO 2(г) + SO 2(г) + H 2 O (л) 90 120 (кислая)
Шаг 1:
Напишите уравнение скелета и сбалансируйте элементы, кроме O и H.
H 2 SO 4(водн.) + C (s) → CO 2(g) + SO 2(g) + H 2 O (l)
Этап 2 : 901 33
Присвойте степени окисления S и C.
Рассчитайте увеличение и уменьшение степени окисления и приравняйте их.
Чтобы общее увеличение и уменьшение были одинаковыми, мы должны взять 2 атома S.
H 2 SO 4(aq) + C (s) → CO 2(g) 9 0120 + СО 2(г) + H 2 O (l)
Шаг 3:
Сбалансируйте атомы O, добавив H 2 O в правую часть.
H 2 SO 4(aq) + C (s) → CO 2(g) + SO 2(g) + H 2 O 9 0119 (л) + Н 2 O (l)
Этап 4:
Среда кислая.
Плата не взимается с обеих сторон.
Атомы водорода равны с обеих сторон. 9O (л)
Шаг 5:
Проверьте две стороны на баланс атомов и зарядов.
Отсюда сбалансированное уравнение:
H 2 SO 4(aq) + C (s) → CO 2(g) + 2SO 9011 9 2(г) + Н 2 O (л)
(б) Bi(OH) 3(г) + Sn(OH) 3 Θ (водн.) → Bi (тв) + Sn(OH) 6 2Θ (водн.) (основной)
Би(ОН) 3(г) + Sn(OH) 3 — (водн.) → Bi (т) + Sn(OH) 6 2- (водный) (базовый)
Шаг 1:
Напишите уравнение скелета и сбалансируйте элементы, кроме O и H.
Bi(OH) 3(g) + Sn(OH) 3 — (водн.) → Bi (тв.) + Sn(OH) 6 2- (водн.)
90 006 Шаг 2 :Присвойте степени окисления Bi и Сн.
Рассчитайте увеличение и уменьшение степени окисления и приравняйте их.
Чтобы общее увеличение и уменьшение были равными, мы должны взять 3 атома Sn и 2 атома Bi.
Этап 4 :
Среда является основной.
Чтобы сделать атомы водорода с двух сторон равными, добавьте 3W с правой стороны.
Bi(OH) 3(т)
Добавьте ионы OH — , равное количеству ионов H+ в обеих частях уравнения.
2Bi(OH) 3(s) + 3Sn(OH) — 3(aq) + 3H 2 O (л) + 3OH — (водн.
