Калькулятор pH — Sensorex
Перейти к содержимому
+1 (714) 895-4344
Рассчитайте pH, используя метод концентрации, веса или объема.
Concentration Method
Select ChemicalAcetic AcidAnilineAmmoniaArsenic AcidArsenious AcidBenzoic AcidBoric AcidCarbonic AcidChlorous AcidCitric AcidFormic AcidHydrocyanic AcidHydrofluoric AcidHydrosulfuric AcidHydrochloric AcidHypochlorous AcidNitric AcidNitrous AcidPerchloric AcidPhenolPhenol AcidPhosphoric AcidPhosphorous AcidSodium HydroxideSulfuric AcidSulfurous Acid
Концентрация раствора (молярность):
Рассчитать
Непосредственно введите концентрацию вашего приложения.
Weight Method (Solid Chemicals)
Select ChemicalAcetic AcidAnilineAmmoniaArsenic AcidArsenious AcidBenzoic AcidBoric AcidCarbonic AcidChlorous AcidCitric AcidFormic AcidHydrocyanic AcidHydrofluoric AcidHydrosulfuric AcidHydrochloric AcidHypochlorous AcidNitric AcidNitrous AcidPerchloric AcidPhenolPhenol AcidPhosphoric AcidPhosphorous AcidSodium HydroxideSulfuric AcidSulfurous Acid
Масса кислоты или основания (граммы):
Общий объем раствора (литры):
Рассчитать
Введите вес и общий объем вашего приложения выше, если химическое вещество является твердым.
Датчики pH для магазина
О pH
pH, обычно используемый для измерения воды, является мерой кислотности и щелочности, или щелочи и основания, присутствующих в данном растворе. Обычно он выражается числовой шкалой от 0 до 14. Значение 7 представляет нейтральность. Цифры на шкале увеличиваются с увеличением щелочности, а числа на шкале уменьшаются с увеличением кислотности.
Каждая единица изменения соответствует десятикратному изменению кислотности или щелочности. Значение рН также равно отрицательному логарифму концентрации ионов водорода или активности ионов водорода.
Комбинированные датчики pH
Наиболее распространенным методом измерения pH является использование электрохимического датчика pH. Комбинированные датчики pH представляют собой тип электрохимического датчика pH, в котором есть как измерительный электрод, так и электрод сравнения. Измерительный электрод обнаруживает изменения значения pH, в то время как эталон обеспечивает стабильный сигнал для сравнения.
Устройство с высоким импедансом, известное как рН-метр, используется для отображения милливольтового сигнала в единицах рН. Технология комбинированных датчиков pH может использоваться для создания различных продуктов, включая лабораторные датчики pH и промышленные или технологические датчики pH.
Дифференциальные датчики pH
По сравнению с обычным комбинированным датчиком pH дифференциальные датчики pH работают немного иначе. В то время как комбинированные датчики pH имеют 2 электрода, измерительный и электрод сравнения, дифференциальные датчики pH имеют 3 электрода. В дифференциальной конструкции два электрода измеряют pH по-разному относительно третьего металлического заземляющего электрода. Преимущество этой конструкции состоит в том, что она предотвращает загрязнение эталона, что делает ее идеальной для промышленного применения, например, для мокрых скрубберов.
Лабораторные датчики pH
Комбинированные датчики pH в стеклянных и пластиковых корпусах диаметром 12 мм обычно называют датчиками лабораторного типа. Эти датчики хорошо работают в легких приложениях, таких как образование и исследования, отбор проб окружающей среды и мониторинг бассейнов. Хотя базовая конструкция остается неизменной, такие функции, как заполнение сенсора, соединения и кабели, могут быть изменены в соответствии с потребностями различных приложений.
Эти датчики хорошо работают в легких приложениях, таких как образование и исследования, отбор проб окружающей среды и мониторинг бассейнов. Хотя базовая конструкция остается неизменной, такие функции, как заполнение сенсора, соединения и кабели, могут быть изменены в соответствии с потребностями различных приложений.
Технологические датчики pH
Комбинированные датчики pH также могут быть встроены в более крупные и прочные корпуса со встроенными технологическими соединениями (например, с резьбой NPT). Эти датчики обычно называют датчиками pH технологического процесса, и они хорошо подходят для непрерывного мониторинга рН. Технологические датчики pH обычно монтируются в трубу, погружаются в резервуар или используются как часть вставного узла.
У вас есть собственный проект?
Мы готовы работать с вами над этим.
Давай поговорим
ДАТЧИКИ КАЧЕСТВА ВОДЫ И ДРУГИЕПросмотр нашей продукции
Ознакомьтесь с нашей полной линейкой датчиков и сопутствующих товаров, которые ежедневно решают проблемы профессионалов в области водоснабжения.
Купить сейчас
ЕСТЬ ВОПРОС? Свяжитесь с нами
Если вам нужна помощь в выборе датчика, подходящего для вашего приложения, напишите нам.
Свяжитесь с нами
Ларутан Асам, Баса дан Гарам – Кимиа Фармаси |
PengertianPengertian Asam, Basa, Garam, Ciri, Sifat, Indikator, Gambar dan Contoh: Asam adalah senyawa kimia yang bila dilarutkan dalam air akan menghasilkan larutan dengan pH lebih menapyada kecil dari 7. гидрониум кетика диларуткан далам эйр. Basa memiliki pH lebih besar dari 7. Гарам атау «Natrium Klorida» (Nacl) adalah senyawa ionik yang terdiri dari ion positif (kation) dan ion negatif (anion)
Pengertian Asam Basa dan Garam Asam dan basa sudah dikenal sejak zaman dulu. Istilah asam (кислота) berasal дари bahasa латинский acetum янь berarti cuka. Istilah basa (щелочной) berasal дари bahasa арабский янь berarti абу. Basa digunakan dalam pembuatan sabun. Juga sudah лама diketahui bahwa asam dan basa saling menetralkan. Di alam, asam ditemukan dalam buah-buahan, misalnya asam sitrat dalam buah jeruk berfungsi untuk memberi rasa limun yang tajam.
Juga sudah лама diketahui bahwa asam dan basa saling menetralkan. Di alam, asam ditemukan dalam buah-buahan, misalnya asam sitrat dalam buah jeruk berfungsi untuk memberi rasa limun yang tajam.
Cuka mengandung asam asetat, dan asam tanak dari kulit pohon digunakan untuk menyamak kulit. Асам минерал ян lebih kuat telah dibuat sejak абад pertengahan, salah satunya adalah aqua forti (асам нитрат) ян digunakan oleh para peneliti untuk memisahkan emas dan perak.
Pengertian AsamPengertian Asam adalah Asam dalam ilmu kimia ialah senyawa kimia yang jika dilarutkan dalam air akan menghasilkan sebuah larutan dengan pH lebih kecil dari 7. Dalam pro definsi sua kepada zat lain (ян disebut basa), atau bisa menerima pasangan elektron bebas dari suatu basa
Pengertian Basa
Basa ialah zat (senyawa) yang bisa beraksi dengan asam, menghasilkan senyawa yang disebut garam. Sedangkan basa yaitu suatu zat-zat yang bisa menetralkan asam. Secara kimia, asam dan basa saling berlawanan. Sifat basa pada umumnya ditunjukkan дари раса pahit дан licin.
Sifat basa pada umumnya ditunjukkan дари раса pahit дан licin.
Pengertian Garam
Dalam ilmu kimia, garam ialah senyawa ionik yang terdiri dari ion positif (kation) dan ion negatif (anion), sehingga akan membentuk senyawa netral (tanpa bermuatan). Garam terbentuk дари hasil sebuah reaksi asam дан basa.
Teori Asam dan basa Menurut Arrhenius
Pada tahun 1884, Svante Arrhenius (1859-1897) seorang ilmuwan Swedia yang memenangkan hadiah nobel atas karyanya di bidang ionisasi, memperkenalkan pemikiran tentang senyawa yang terpisah atau terurai menjadi bagian ion-ion dalam larutan. Dia menjelaskan bagaimana kekuatan asam dalam larutan aqua (воздух) tergantung pada konsentrai ион-ион водорода ди dalamnya.
Menurut Arrhenius, asam adalah zat yang dalam air melepakan ion H+, sedangkan basa adalah zat yang dalam air melepakan ion OH–. Jadi pembawa sifat asam adalah ion H+, sedangkan pembawa sifat basa adalah ion OH–. Asam Arrhenius dirumuskan sebagai HxZ, yang dalam air mengalami ionisasi sebagai berikut.
HxZ ⎯⎯→ x H+ + Zx–
Джумла ион H+ ян дапат дихасилкан оле 1 молекула асам дисебут валенси асам, седангкан ион отрицательный ян тербентук дари асам сетелах мелепаскан ион Н+ дисэбут ион сиса асам. Beberapa contoh asam dapat dilihat pada tabel
Tabel 5.1 Berbagai Jenis Asam
| Rumus Asam | Nama Asam | Valensi Asam |
| HF | Aasm Fluorida | 1 |
| HCl | Asam klorida | 1 |
| HBr | Asam bromida | 1 |
| HCN | Asam sianida | 1 |
| h3S | Asam sulfida | 2 |
| HNO3 | Asam nitrat | 1 |
| h3SO4 | Asam sulfat | 2 |
| h3SO3 | Asam sulfit | 2 |
| h4PO4 | Asam fosfat | 3 |
| h4PO3 | Asam fosfit | 3 |
| Ch4COOH | Asam asetat | 1 |
| h3C2O4 | Asam oksalat | 2 |
| C5H5COOH | Асам бензоат | 1 |
M(OH)x ⎯⎯→ Mx+ + x OH–
Jumlah ion OH– yang dapat dilepaskan oleh satu molekul basa disebut valensi basa. Beberapa contoh basa diberikan pada tabel
Beberapa contoh basa diberikan pada tabel
Таблица 5.2 Berbagai Jenis Basa
| Rumus Basa | Nama Basa | Valensi Basa |
| NaOH | Natrium hidroksida | 1 |
| KOH | Kalium hidroksida | 1 |
| Mg (OH) 2 | Magnesium hidroksida | 2 |
| Ca (OH) 2 | Kalsium hidroksida | 2 |
| Ba(OH) 2 | Barium hidroksida | 2 |
| Fe(OH) 3 | Besi(III) hidroksida | 3 |
| Fe (OH) 2 | Besi (II) hidroksida | 2 |
| Al (OH) 3 | Aluminium hidroksida | 3 |
| Sr (OH) 2 | стронция гидроксида | 2 |
h3SO4 ––→ 2 H+ + SO42–
Mg(OH)2 ⎯⎯→ Mg+ + 2 OH–
Persamaan ionisasi air dapat ditulis sebagai:
h3O(l) ←–⎯⎯⎯→ H+(водн. ) + OH–(водн.)
) + OH–(водн.)
Harga air adalah:
· Harga tetapan air
· Konsentrasi h3O yang terionisasi menjadi H+ dan OH– sangat kecil dibandingkan dengan konsentrasi h3O mula-mula, sehingga konsentrasi h3O dapat dianggap tetap, maka harga K[h3O] juga tetap, yang disebut tetapan kesetimbangan air atau ditulisKw.
· Пада суху 25 °C, Кв янг дидапат дари перкобаан адалах 1,0 × 10–14.
· Parga Kw ini tergantung pada suhu, tetapi untuk percobaan yang suhunya tidak terlalu menyimpang jauh dari 25 °C, harga Kw itu dapat dianggap tetap.
· Harga Kw pada berbagai suhu dapat dilihat pada tabel berikut.
Tabel Harga Kw pada berbagai suhu
| Suhu ( o C) | Kw |
| 0 | 0,114 x 10 -14 |
| 10 | 0,295 x 10 -14 |
| 20 | 0,676 x 10 -14 |
| 25 | 1,00 x 10 -14 |
| 60 | 9,55 x 10 -14 |
| 100 | 55,0 x 10 -14 |
Kekuatan Asam Dan Basa
Kekuatan Asam
Kekaatan AsamAn -hAlhan -halhan -halhan -halhan -halhan -halhan -halhan -halhan -halhan -halhih halhan -halhan halhan. Berdasarkan banyak sedikitnya ion H+ yang dihasilkan, larutan asam dibedakan menjadi dua macam sebagai berikut.
Berdasarkan banyak sedikitnya ion H+ yang dihasilkan, larutan asam dibedakan menjadi dua macam sebagai berikut.
1. Асам Куат
Асам куат яиту сенява асам янг далам ларутання терион селурухня менжади ион-ионня. Reaksi ionisasi asam kuat merupakan reaksi berkesudahan. Secara умум, ionisasi asam kuat dirumuskan sebagai berikut.
HA(водн.) ––→ H+(водн.) + A–(водн.)
[H+] = X . [HA]
Atau
[H+] = valensi asam . M
Dengan : x = valensi asam
M = Konsentrasi asam
2. Asam Lemah
Asam lemah yaitu senyawa asam yang dalam larutannyja mendiionikion isedion sedion. Reaksi ionisasi asam lemah merupakan reaksi kesetimbangan. Secara umum, ionisasi asam lemah valensi satu dapat dirumuskan sebagai berikut.
HA(aq) ←⎯⎯⎯⎯→ H+(aq) + A–(aq)
Makin kuat asam maka reaksi kesetimbangan asam makin condong ke kanan, akibatnya Ka bertambah besar. Олег карена иту, harga Ka merupakan ukuran kekuatan asam, makin besar Ka makin kuat asam. Berdasarkan persamaan di atas, karena pada asam lemah [H+] = [A–], maka persamaan di atas dapat diubah menjadi:
Berdasarkan persamaan di atas, karena pada asam lemah [H+] = [A–], maka persamaan di atas dapat diubah menjadi:
[H+] = √ Ka . [HA]
Dengan Ka = tetapan ionisasi asam
[H+] = [HA].α
Kekuatan Basa
Kekuatan base dipengaruhi oleh banyaknya ion – ion OH– yang dallarutanny basa oleh senyamawa .
Berdasarkan banyak sedikitnya ion OH yang dihasilkan, larutan basa juga dibedakan menjadi dua macam sebagai berikut.
1. Баса Куат
· Баса куат яиту сенява баса ян далам ларутання терион селурухня менжади ион-ионня. Reaksi ionisasi basa kuat merupakan reaksi berkesudahan.
· Secara umum, ionisasi basa kuat dirumuskan sebagai berikut.
M(OH)x(водн.) ––→ Mx+(водн.) + x OH–(водн.)
2. Basa Lemah
· Basa lemah yaitu senyawa basa yang dalam larutannya hanya sedikit-terionisasi menjadi.
· Reaksi ionisasi basa lemah juga merupakan reaksi kesetimbangan.
· Secara umum, ionisasi basa lemah valensi satu dapat dirumuskan sebagai berikut.
M(OH)(водн.) ←⎯⎯⎯⎯→ M+(водн.) + OH–(водн.)
· Makin kuat basa maka reaksi kesetimbangan basa makin condong ke kanan, akibatnya Kb bertambah besar.
· Олех карена иту, харга Кб мерупакан укуран кекуатан баса, макин бесар Кб макин куат баса.
· Berdasarkan persamaan di atas, karena pada basa lemah [M+] = [OH–], maka persamaan di atas dapat diubah menjadi:
Kb = [OH]2
[M(OH)]
[OH-]2 = Kb . [M(OH)]
[OH-] = √Kb. [M(OH)]
Dengan Kb = тетапан ionisasi
[OH-] = [M(OH)] . α
Derajat Keasamaan (pH)
Konsep pH
Untuk menyatakan tingkat atau derajat keasaman suatu larutan, pada tahun 1910, seorang ahli dari Дания, Soren Lautiz Sorensen memperkenalkan suatu bilangtu. Bilangan ini diperoleh dari hasil logaritma konsentrasi H+.
· Bilangan ini kita kenal dengan skala pH. Harga pH berkisar antara 1–14 dan ditulis:
· Dari uraian di atas dapat kita simpulkan bahwa:
a. Ларутан берсифат нетрал джика [H+] = [OH–] атау pH = pOH = 7,
Ларутан берсифат нетрал джика [H+] = [OH–] атау pH = pOH = 7,
б. Ларутан берсифат асам джика [H+] > [OH–] атау pH < 7,
c. Larutan bersifat basa jika [H+] < [OH–] atau pH >
7.· karena pH dan konsentrasi ion H+ dihubungkan dengan tanda negatif, maka makin besar konsentrasi ion H+ makin kecil pH, dan karena bilangan dasar logaritma adalah 10, maka larutan yang nilai pH-nya berbeda sebesar n mempunyai perbedaan ion H+ sebesar 10n.
· Perhatikan contoh di bawah ini.
· Концентрация Jika H+ = 0,01 M, maka pH = – log 0,01 = 2 Satuan)
Jadi Dapat Disimpulkan:
· Makin Besar Konsentrasi Ion H+ Makin Kecil PH
· Larutan Dengan PH = 1 Adalah 10 Kali Lebih Asam Dari Pada Larutan Dengan Ph = 2
Pencur 3
Pencur 3 9008
Pencan PHINKAN
PNCAN 9008
PNCURAN DARAN DENGAN
9008
Пенг. dapat dilakukan dengan beberapa cara, antara lain sebagai berikut.
Menggunakan Beberapa Indikator
· Indikator adalah asam organik lemah atau basa organik lemah yang dapat berubah warna pada rentang harga pH tertentu (James E.
· Harga pH suatu larutan dapat diperkirakan dengan menggunakan trackek Индикатор pH.
· Индикатор мемилики трайек перубахан варна ян бербеда-беда.
· Dengan demikian dari uji larutan dengan beberapa indikator akan diperoleh daerah irisan pH larutan.
· Contoh, suatu larutan dengan brom timol biru (6,0–7,6) berwarna biru dan dengan fenolftalein (8,3–10,0) tidak berwarna, maka pH larutan itu adalah 7,6–8,3.
· Hal ini disebabkan jika brom timol biru berwarna biru, berarti pH larutan lebih besar dari 7,6 dan jika dengan fenolftalein tidak berwarna, bearti pH larutan kurang dari 8,3.
Ciri-ciri Asam
1. kata asam (кислота) berasal dari bahasa Latin acidus yang berarti mempunyai rasa asam. Salah satu Definisi asam adalah zat yang jika dilarutkan di dalam air akan menghasilkan ион водорода (H+). Secara umum asam memiliki ciri-ciri sebagai berikut:
2. Rasa Masam Jika Dicicipi (Jangan Menguji Asam Kuat Dengan Mencicipinya)
3. Derajat Keasaman Lebih Kecil Dari 7 (PH <7)
Derajat Keasaman Lebih Kecil Dari 7 (PH <7)
Terasa Menyengat Jika Dementuh, Terrutama Asam -ASAMAMIIFIRIIFIRIIFARIFARIMAR 8. CORAMAMAN 9000. 7000. 7000. 7000. 7000. 7000. 7000. 7000. 7000. 7000. 7000. 7000. 7000. 7000. 7000. 70003. (мениебабкан карат, дапат пула мерусак джаринган кулит/иритаси дан мелубанги бенда ян тербуат дари каю атау кертас джика консентрасинья тингги)
5. Мерупакан ларутан электролит сехингга дапат менгантаркан арус листрик
Сифат Асам
1.мемпуньяи раса асам
2 менгубах лакмус биру менджади мерах
3.берсифат коросиф, дапат меларуткан бербагай логам
4.дапат менкароккабату менкароккано менкаруткан
Ciri-ciri Basa
Basa (щелочной) berasal дари бахаса араб янг берарти абу. Salah satu definisi basa adalah zat yang jika dilarutkan di dalam air akan menghasilkan ion hidroksida (OH–). Secara umum basa memiliki ciri-ciri sebagai berikut:
1. Раса Пахит Джика Дикиципи
2. Далам Кидан Мурни Умумня Берупа Кристал Падат
3.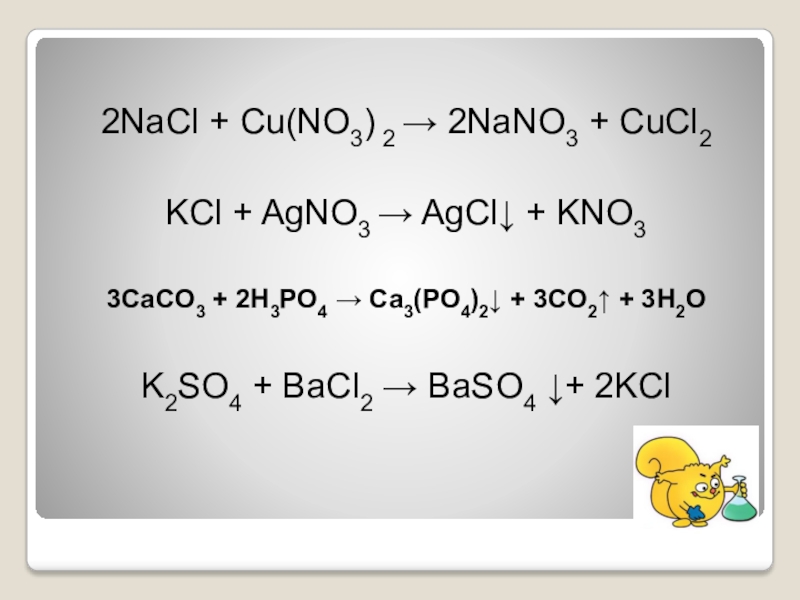 Тинкат Киасаман Лебих Бесар Дари 7 (PH> 7)
Тинкат Киасаман Лебих Бесар Дари 7 (PH> 7)
4. Terasa LicerIt -Mengu -Mengu -Mengu -Menguent) (Jangan Mengu -Menguent (Jangan Mengu -Menguent (Jangan Mengu -Menguent (PH> 7)
4.
5. Memiliki Sifat Kaustik Yaitu Merusak Kulit Jika Kadar Basanya Tinggi
6. Dapat Mengemuls Minyak
7. Merupakan Elektrolit, Larutannanna Dapat Menghantarkan Listrik
Se.sabatgatbagabag.0003
1. Расанья пахит
2. Менгубах лакмус мерах менджади биру
3. Береакси денган лемак мембентук сабун.
4.Menetralkan sifat asam
5. Bersifat korosif, khususnya basa kuat
Indikator
Cara untuk mengetahui apakah suatu zat tergolong asam atau basa adalahik menggunator.
Индикатор adalah merupakan zat yang dapat berupah warna bila dimasukkan kedalam senyawa asam atau basa. Индикатар дапат берупа кертас атау ларутан, индикатор берупа кертас адалах кертас лакмус.
Ада дуа макам кертас лакмус, яиту лакмус берварна мерах дан лакмус берварна биру. Cara pemakaiannya adalah kertas lakmus dimasukkan kedalam senyawa, kemudian dilihat perubahan warnanya.
Cara pemakaiannya adalah kertas lakmus dimasukkan kedalam senyawa, kemudian dilihat perubahan warnanya.
Suatu senyawa tergolong asam bila kertas lakmus biru berubah warna menjadi merah, tetapi kertas lakmus merah tidak berubah warna.. sementara kalau senyawa golongan basa bila kertas lakmus merah berubah warna menjadi biru, tetapi kertas lakmus wartas lakmus berubah warna menjadi biru. Bila senyawa tidak mengubah warna kertas lakmus digolongkan bukan senyawa asam atau basa atau senyawa netral.
Ciri-ciri Garam
Apabila larutan asam dengan larutan basa direaksikan, maka ion H+ (dari asam) akan bereaksi dengan ion OH– (dari basa) membentuk air. Reaksi antara asam dan basa ini disebut reaksi penetralan (netralisasi) jika jumlah zat asam sama dengan jumlah zat basa. Disebut demikian karena selain air, dihasilkan pula suatu zat yang bersifat netral yaitu garam, jika jumlah asam dan jumlah basanya mempunyai perbandingan yang sama. Reaksi ини juga ди kenal dengan reaksi penggaraman karena menghasilkan garam.
Garam terdapat dalam bentuk garam netral, garam basa dan garam asam. Умумня гарам мудах ларут далам эйр, мерупакан падатан пада суху камар (25 или C), мерупакан электролит сехингга дапат менгантаркан арус листрик, мемилики титик дидих дан титик лелех янг тингги.
Sifat Garam
Garam dapat dibuat dengan mereaksikan suatu logam dengan asam kuat yang encer atau mereaksikan antara asam dengan basa., reaksi asam dengan basa disebut reaksi netralisasi.
Contoh Reaksi Netralisasi:
ASAM Klorida + Natrium Hidroksida Natrium Klorida + Air
ASAM SULFAT + Kalium Klorid
Reaksi netralisasi menghasilkan senyawa янь disebut garam. Contoh garam dapur (NaCL) yang terbentuk дари реакси антара гидроксида натрия dengan asam klorida.
Contoh garam yang ada pada kehidupan kita sehari-hari :
Natrium klorida (NaCL) yang disebut garam dapur
сульфат магния (MgSO4) yang disebut garam inggris sebagai abat pencuci perut.
Калсий карбонат (CaCO3) мерупакан сенява далам бату капур, мармер атау бату пуалам.
Карбонат натрия (Na2CO3) yang disebut soda pencuci
Сольфаф алюминия ( Al2(SO4) ), untuk penjernihan air
Стеарат натрия (NaC17h45COO ), bahan sabun mandi
Indikator Asam, Basa dan Garam
Banyak sekali larutan di sekitar kita, baik yang bersifat asam, basa, maupun netral. Tahukah kamu bagaimana cara menentukan sifat asam dan basa larutan secara tepat? Индикатор янь dapat digunakan adalah индикатор asam basa.
Индикатор adalah zat-zat yang menunjukkan indikasi berbeda dalam larutan asam, basa, dan garam. Cara menentukan senyawa bersifat asam, basa, atau netral dapat menggunakan kertas lakmus dan larutan indikator atau indikator alami.
Berikut adalah beberapa cara menguji sifat larutan.
1. Indikator dengan Kertas Lakmus
Warna kertas lakmus dalam larutan asam, larutan basa dan larutan bersifat netral berbeda. Ada dua macam kertas lakmus, yaitu lakmus merah dan lakmus biru. Sifat дари masing-masing kertas lakmus tersebut adalah sebagai berikut.
а. Lakmus merah dalam larutan asam berwarna merah dan dalam larutan basa berwarna biru.
б. Lakmus biru dalam larutan asam berwarna merah dan dalam larutan basa berwarna biru.
в. Lakmus merah maupun biru dalam larutan netral tidak berubah warna.
2. Indikator Larutan Asam dan Basa Menggunakan Indikator Alami
Percobaan yang telah kamu lakukan adalah mengidentifikasi suatu larutan bersifat asam, basa atau netral dengan menggunakan kertas lakmus. Adakah cara lain untuk mengidentifikasi suatu larutan? Ада beberapa чара янь dapat kamu lakukan sendiri ди rumah, yaitu dengan menggunakan индикатор alami.
Berbagai bunga yang berwarna atau tumbuhan, seperti daun, mahkota bunga, kunyit, kulit manggis, dan kubis ungu dapat digunakan sebagai indikator asam basa. Экстрак атау сари дари бахан-бахан ини дапат менунджуккан варна янг бербеда далам ларутан асам баса
Sebagai contoh, ambillah kulit manggis, tumbuklah sampai halus dan campur dengan sedikit air. Warna kulit manggis adalah ungu (dalam keadaan netral). Jika ekstrak kulit manggis dibagi dua dan masing-masing diteteskan larutan asam dan basa, maka dalam larutan asam terjadi perubahan warna дари унгу menjadi cokelat kemerahan. Larutan basa янь diteteskan акан mengubah warna дари ungu menjadi biru kehitaman.
Warna kulit manggis adalah ungu (dalam keadaan netral). Jika ekstrak kulit manggis dibagi dua dan masing-masing diteteskan larutan asam dan basa, maka dalam larutan asam terjadi perubahan warna дари унгу menjadi cokelat kemerahan. Larutan basa янь diteteskan акан mengubah warna дари ungu menjadi biru kehitaman.
Конто Асам, Баса дан Гарам
Конто Асам
Асам дапат денган муда кита темуи далам кехидупан сехари-хари. Dalam makanan, minuman, buah-buahan, air hujan bahkan di dalam tubuh kita. Berdasarkan asalnya, asam dikelompokan menjadi 2 kelompo, yaitu asam organik dan asam minjadi.
Асам органик берасал дари сумбер алами (тумбухан дан хэван), умумня берсифат асам лемах. Contoh asam organik adalah asam sitrat terdapat Dalam buah jeruk, формат asam terdapat Dalam gigitan/sengatan semut dan sengatan lebah dan asam asetat yang terdapat Dalam cuka makan.
Асам минерал adalah senyawa asam seperti asam klorida (asam lambung) terdapat dalam sistem pencernaan manusia dan hewan.
Асам минерал banyak juga dimanfaatkan oleh manusia untuk menuhi kebutuhan sehari-hari дан umumnya bersifat asam kuat. Contoh asam минерал adalah asam klorida yang digunakan secara luas dalam industri, asam sulfat untuk aki mobil dan asam fluorida yangbianya digunakan pada pabrik kaca.
Berdasarkan kekuatannya asam dibagi menjadi dua jenis, yaitu asam kuat dan asam lemah. Kekuatan suatu asam dapat ditentukan дари kemampuannya melepaskan ион водорода yang bermuatan positif (ion H+) ketika dilarutkan dalam воздуха. Семакин баняк ион Н+ ян дилепаскан, семакин куат сифат асамня.
· ASAM ASETAT, Terdapat Pada Larutan Cuka
· ASAM Askorbat, Terdapat Pada Jeruk, Tomat, Sayuran
· Asam Sitrat, Terdapat Pada Jeruk
· ASAM BorAt, Terdapat Pada Jeruk
· ASAM BoranA, TerdaPat Pada Pada Jeruk
· Asam BoranAcat Pada Pan0003
· Asam karbonat, terdapat pada minuman berkarbonasi
· Asam klorida, terdapat pada asam lambung, obat tetes mata
· Asam nitrat, terdapat pada pupuk, bahan peledak (TNT)
· Asam fosfat, terdapat pada deterjent, pupuk
· ASAM Sulfat, Terdapat Pada Baterai Mobil, Pupuk
· ASAM TATRAT, Terdapat Pada Anggur
· Asam Malat, Terdapat Pada Apel
· Асам Формиат, Тердапат Падат Сенгат Сенгат Сенгат Сенгат Лейбэ
· Асам, Тердапат Падат Сенгат. 0003
0003
· Asam laktat, terdapat pada keju
· Asam benzoat, terdapat pada bahan pengawet makanan
Contoh Basa
Sama halnya dengan zat asam, zat basa juga dapat dengan mudah kita temui dalam kehidupan sehari-hari. Sifat licin дан rasanya ян pahit merupakan чара мудах untuk mengenali zat basa. Beberapa contoh zat basa yang sering digunakan adalah:
1. гидроксида натрия / апи соды / кальцинированная сода и гидроксида калия, sebagai bahan baku pembersih dalam rumah tangga, misalnya sabun mandi, sabun cuci, detergen, pembersih dan pembersih dan pembersih0003
2 базовый лемах. Kekuatan suatu basa dapat ditentukan dari kemampuannya melepaskan ion hidroksida yang bermuatan negatif (ion OH–) ketika dilarutkan dalam air. Семакин баняк ион ОН – ян дилепаскан, семакин куат сифат басанья. Semua rumus kimia basa umumnya mengandung gugus OH–.
Jika diketahui rumus kimia suatu basa, maka untuk memberi nama basa, cukup dengan menyebut nama logam dan diikuti kata hidroksida.
1. Алюминиевый хитроксида, Terdapat Pada Sebuah Deodoran, Antasid
2. Kalsium hidroksida, Terdapat Pada Sebuah Minktar Dan Dan Plester
3. Magnesium Hidroksid пада sebuah bahan sabun mandi
Contoh Garam
Салах сату чара memperoleh senyawa garam adalah dengan чара mereaksikan zat asam dengan zat basa. Reaksi ini dikenal dengan reaksi penggaraman atau disebut juga reaksi netralisasi. Dalam kehidupan sehari-hari garam yang sering digunakan antara lain: garam dapur (NaCl), garam inggris (MgSO4) sebagai obat pencahar, сода куэ (NaHCO3) sebagai pengembang roti, глутамат натрия (MSG) sebagai penyedap rasa.
Sifat garam tergantung pada asam dan basa pembentuknya. Гарам янг берасал дари реакси антара асам дан баса дапат берсифат асам, баса атау нетрал.
Garam yang bersifat asam, memiliki pH < 7, berasal dari reaksi antara asam kuat dan basa lemah. Contoh: Nh5Cl (хлорид аммония / лосось), dan Nh5NO3 (нитрат аммония).
Garam yang bersifat basa, memiliki pH > 7, berasal dari reaksi antara asam lemah dan basa kuat. Contoh: KNO2 (нитрит калия), NaHCO3 (бикарбонат натрия/сода), NaCh4COO (ацетат натрия), KCN (цианида калия/калий), dan KF (фосфат калия).
Contoh: KNO2 (нитрит калия), NaHCO3 (бикарбонат натрия/сода), NaCh4COO (ацетат натрия), KCN (цианида калия/калий), dan KF (фосфат калия).
Garam yang bersifat netral, memiliki pH = 7, berasal dari asam kuat dan basa kuat.
Contoh: NaCl (хлорид натрия), KI (йодид калия), dan KNO3 (нитрат калия).
○garam dapur, NaCl → Na+ + Cl-
○besi sulfat, Fe2(SO4)3 → 2Fe3+ + 3SO3-4
Reaksi penggaraman (netralisasi) sangat berguna bagi kehidupan manusia. Dalam kehidupan sehari-hari banyak dijumpai pemanfaatan reaksi netralisasi, misalnya:
1.Untuk mengurangi rasa sakit dan iritasi akibat sengatan lebah yang mengandung asam digunakan soda kue (бикарбонат натрия)
2.Nyeri lambung akibat kadar asam klorida dalam lambung yang berlebihan dinetralisir dengan obat yang mengandung basa magnesium hidroksida atau aluminium hidroksida
3. Limbah cair hasil industri yang dibuang ke sungai mengandung zat asam yang dapat menyebabkan kematian ikan oleh karenanya ditambahkan aluminium hidroksida untuk menetralkannya
4.
