Контрольная работа. Разбор. 9 класс
Похожие презентации:
Сложные эфиры. Жиры
Физические, химические свойства предельных и непредельных карбоновых кислот, получение
Газовая хроматография
Хроматографические методы анализа
Искусственные алмазы
Титриметрические методы анализа
Биохимия гормонов
Антисептики и дезинфицирующие средства. (Лекция 6)
Клиническая фармакология антибактериальных препаратов
Биохимия соединительной ткани
Урок 9 класса.
Разбор контрольная работа
К/Р
1. Cu2S + O2 -> Cu2O + SO2
2. Cu2S + O2 -> CuO + SO2
3. Cu2S + O2 -> CuO + S
К/Р
h3SO4 (конц) + Cu -> CuSO4 + SO2 + h3
К/Р
h3SO4 (конц) + C -> h3O + CO2 + SO2
К/Р
SCl2O + Br2 + h3O -> h3SO4 + HCl + HBr
Тионилхлорид/
оксидихлорид серы
К/Р
KBr + KBrO3 (конц) + HCl-> Br2 + KCl + h3O
К/Р
KBr + KMnO4 + h3SO4 -> Br2 + MnSO4 + h3O + K2SO4
К/Р
Ce(SO4)2 + h3O2 -> Ce(SO4)3 + O2 + h3SO4
KMnO4 + KHSO3 -> K2SO4 + KHSO4 + MnO2 + h3O
6я группа элементов
28.
 11.2016
11.20163е занятие 2го триместра
Распространенность
6я группа главная подгруппа содержит элементы:
О
S
Se
Te
На долю кислорода приходится около 50% массы земной коры и
90% массы мирового океана.
Сера встречается в природных условиях в виде залежей
самородной серы и входит в состав сульфидных руд. Земная кора
содержит около 0,03%; морская вода 0.1%
Химические свойства кислорода
О – второй по электроотрицательности элемент.
С большинством металлов О реагирует при комнатной
температуре, образую основные оксиды.
2Mg + O2 = 2MgO
2Cu + O2 = 2CuO
C неметаллами (за исключением инертных газов) О реагирует при
нагревании.
Р + О2 (60оС) -> Р2О5
S + O2 (250оС) -> SO2
C + O2 (700оС) -> CO2
Реагирует со сложными веществами:
2h3S + O2 -> 2S + 2h3O
2h3S + O2 -> 2SО2 + 2h3O
Озон
Более сильным окислителем, чем кислород является озон.
Его получают пропусканием электрического заряда через кислород
(выход реакции около 5%):
3O2 -> 2O3 – 284кДж
Качественная реакция на I- или озон:
2KI + O3 + h3O -> I2 +2KOH + O2,
но озон не окисляет ионы брома и хлора
Получение
В промышленности получают:
1) Фракционной перегонкой жидкого воздуха (разность
температур конденсации)
2) Электролизом воды
В лаборатории:
2KMnO4 -> K2MnO4 + MnO2 + O2
4K2Cr2O7 -> 4K2CrO4 + 2Cr2O3 + 3O2
2h3O ->2h3O + O2 (самый простой способ)
Сера
При комнатной температуре сера реагирует со фтором, хлором и
концентрированными кислотами-окислителями (HNO3, h3SO4):
S + 3F2 -> SF6
S + Cl2 = SCl2
S + 6HNO3 (конц) = h3SO4 + 6 NO2 + 2h3O
S + 2h3SO4 (конц) = 3SO2 + 2h3O
Также при комнатной температуре протекает реакция со ртутью:
Hg + S = HgS
При нагревании:
h3 + S <-> h3S + 20.
 6 кДж
6 кДжFe + S -> FeS
C щелочами:
2S + 6KOH -> K2SO4 + 2K2S + 3h3O
Сероводород
Сероводород – бесцветный и очень токсичный газ с запахом тухлых
яиц.
Получение в лаборатории:
FeS + 2HCl -> FeCl2 + h3S
Al2S3 + 6h3O -> 2Al(OH)3 + 3h3S
h3S – типичный восстановитель:
h3S + Br2 -> S + 2HBr
А так же, слабая кислота
Pb(OH)2 + h3S -> PbS + 2h3O
Сернистый газ. Сернистая кислота
SO2 + h3O <-> h3SO3
Сернистый газ можно получить при взаимодействии:
Me + 2h3SO4 (конц) -> CuSO4 + SO2 + 2h3O
h3S + O2 -> SO2 + h3O
Характерные реакции:
• Реакции, протекающие без изменения степени окисления:
Ca(OH)2 + SO2 -> CaSO3 + h3O
• Реакции с повышением степени окисления до +6
Na2SO3 + Cl2 + h3O -> Na2SO4 + 2HCl
• Реакции протекающие с понижением степени окисления
2h3S + h3SO3 -> 3S + 3h3O
• Реакции самооксиления-самовосстановления
• NaSO3 + S -> Na2S2O3
Ангидрид серной кислоты.
 Серная кислота.
Серная кислота.Получение ангидрида серной кислоты (SO3) при катализаторе Pt
или V2O5
2SO2 + O2 -> 2SO3 + Q
SO3 + h3O = h3SO4
Олеум – раствор SO3 в 100%-ной серной кислоте.
Разбавленная серная кислота окисляет только металлы, стоящие в
ряду напряжений до водорода:
Zn + h3SO4 (разб) = ZnSO4 + h3
При прокаливании:
ZnSO4 = ZnO + SO3
4FeSO4 = 2Fe2O3 + 4SO2 + O2
Ag2SO4 = 2Ag + SО2 + O2
Концентрированная кислота реагирует:
Zn + 2h3SO4 (конц) = ZnSO4 + SO2 + 2h3O
Пассируются: алюминий, хром и железо.
English Русский Правила
Химиялық байланыс типін анықтаңдар. N2, h3O, Ph4, F2, KCL, I2, h3S. ALF3, SIO2, Ca
Сайтты қолдану үшін FAQ танысып шығыңыз!
leeХимиясұрақ қойды | 58.6k қаралды
Химиялық байланыс типін анықтаңдар. N2, h3O, Ph4, F2, KCL, I2, h3S. ALF3, SIO2, Ca
ALF3, SIO2, Ca
- химиялық байланыс
- химия
2 жауап
AIDANA_MJSжауап берді
Қателеспесем осылай болатын сияқты (,тексеріп алыңыз)): ковалентті полюссіз-N2,F2, I2; Ковалентті полюсті- Ph4, h3S, SiO2, h3O: иондық-KCl, AlF3,Ca
Белгісіз жауап берді
NaCl-> 2Na⁰+Cl2=2Na+Cl. Иондык байланыс, ковалентты полюсті, ЭТ(электртерістілік) айырмашылық бар.
Ғ2 — Ковалентты полюссіз, ЭТ бірдей.
Al- иондык байланыс
Ұқсас сұрақтар
1 жауап
Химиялық байланыстардың типі байланыс еселілігін CI2, O2, N2, h3S, KCI, HBr
Белгісіз
Химия
23. 09.2020
сұрақ қойды
|
1.6k қаралды
09.2020
сұрақ қойды
|
1.6k қаралды
- химиялық байланыс
- химия
1 жауап
Байланыстың типин анықта h3O, Ph4, h3S, AlF3, SiO2, Sh5, Sih5
Aitolkin_IssataevaХимия 12.01.2014 сұрақ қойды | 4.0k қаралды
- химиядан
- есеп
1 жауап
Химиялық байланыс түріне диктует және кристалл торларын анықтаңыз.
Белгісіз Химия 5.03.2021 сұрақ қойды | 266 қаралды
- химиялық байланыс
- кристалл
- аммиак
1 жауап
Төмендегі химиялық реакция теңдеулерін теңестіріп, типін анықтаңдар?
Dias_2009Химия 27.10.2015 сұрақ қойды | 2.8k қаралды
- химия
- есеп
- химиялық реакция
1 жауап
Төмендегі химиялық реакция теңдеулерін теңестіріп, типін анықтаңдар?
АсылгулХимия 31.10.2012 сұрақ қойды | 1.9k қаралды
- химия
- есеп
- қазақша сұрақ
- Санаттар
- Мектеп сұрақтары
29.
 3k
3k- Мектеп 9.0k
- Қазақ тілі 5.7k
- Математика 3.1k
- Химия 2.5k
- Информатика 627
- Аспан әлемі, Ғарыш 191
- Геометрия 1.4k
- Физика 2.6k
- Биология 903
- Психология 197
- География 823
- ҰБТ жайлы 988
- Үй тапсырмасы 1.1k
- Серпін-2050 жобасы 73
- Университет, колледж 4.1k
- Тарих сұрақтары 2.0k
- Компьютер, Интернет 16.5k
- Авто 1.1k
- Қаржы, Бизнес 2.1k
- Саясат, Мемлекет 1.7k
- Заң 2.0k
- Өмір, Тіршілік 4.9k
- Тағам, Аспаздық 990
- Жұмыс 1.4k
- Экология, Табиғат 1.4k
- Денсаулық 6.5k
- Спорт 3.1k
- Танысу, Махаббат 2.7k
- Көңіл-көтеру 1.7k
- Өнер 1.5k
- Қыдыру, Демалыс 453
- Кітап, Әдебиет 3.4k
- Құрылыс, Жобалау 391
- Музыка, Ән 5.8k
- Ұялы телефон 5.3k
- Әлеуметтік желі
1.
 6k
6k - Кино, Теледидар 3.1k
- Сурет, Видео 1.4k
- Тұлға, Адам 3.0k
- Салт-дәстүр 1.0k
- Логикалық сұрақтар 3.3k
- Жалпы сұрақ 14.0k
- Онлайн конференция 16
h3so4+hbr → br2+h3o+so2Tất cả phương trình điều chế từ h3so4+hbr ra br2+h3o+so2
- Транг чо
Тим Ким Пхонг Трин Хоа Хок |
| Тим Ким | Нхом Хок Мьен Пхи Онлайн Facebook | |||
| Lưu ý: mỗi chất cách nhau 1 khoảng trắng, ví dụ: h3 O2 | ||||
Tổng hợp đầy đủ và chi tiết nhất can bằng phương trình điều chế từ h3so4+hbr ra br2+h3o+so2.
 Đầy đủ trạng thai, máu sắc chất và tính số mol trong phản ứng hóa học.
Đầy đủ trạng thai, máu sắc chất và tính số mol trong phản ứng hóa học. Đề Cương Ôn Thi & Bài Tập Trắc nghiệm
(для версии 1.204.214, скачать бесплатно)
Những Điều Thú Vị Chỉ 5% Ngời Biet
Реклама
H
2 SO 4 + 2HBr → Br 2 + 2H 2 О + SO 2Ньет До: Ньет До.
Xem trạng thái chất và chi tiết của phương trình h3SO4 + HBr =>
Br2 + h3O + SO2 Có 1 kết quả được tìm thấy
— Hiển thị kết quả từ 1 đến 1
Trang 1
Thong tin thêm về phương trình hóa học
Phương trình để tạo ra chất h3SO4 (axit sulfuric) (sulfuric acid)
2H 2 O + 2KMnO 4 + 5SO 2 → 2H 2 SO 4 + 2MnSO 4 + K 2 SO 4 24HNO 3 + FeCuS 2 → Cu(NO 3 ) 2 + 10H 2 O + 2H 2 SO 4 + 18NO 2 + FE (№ 3 ) 3 2H 2 O + 2ZNSO 4 → 2H 2 SO 4 + O 2 + 2ZN 9007G7 9007G7.
BR 2 + H 2 O + (NH 4 ) 2 SO 3 → (NH 4 ) 2 SO 40055 400565 2 SO 400565 2 2 SO 4. 400565 2 2 . + 2HBr Br 2 + C 6 H 6 → C 6 H 5 Br + HBr 3Br 2 + C 6 H 5 OH → 3HBr + (Br) 3 C 6 H 2 OH
Phong tწnh CHấT BR2 (BROM) (Bromine)
8H 2 SO 4 + 2KMNO 4 + 10NABR → 5BR 2 + 8H 2 O + 2MNSO 4 + 5NA 2NA 95659565 2NA 9565 2NA 4. 2NA 2NA 2NA 2NA 2NA 2956. + K 2 SO 4 Cl 2 + 2NaBr → Br 2 + 2NaCl 2AgBr → 2Ag + Br 2
Пхонгчринг chất h3O (nước) (вода)
2NH 3 + 3PbO → 3H 2 O + N 2 + 3Pb 10FeO + 18H 2 SO 4 + 2KMnO 4 → 5Fe 2 (SO 4 ) 3 + 18H 2 O + 2MNSO 4 + K 2 SO 4 NAOH + C 6 H 5 BR → C 6 H 5 ONA + H 2 ON + NAB H 5 ONA + H 2 6 H 5 5 ONA + H 2 6 5 .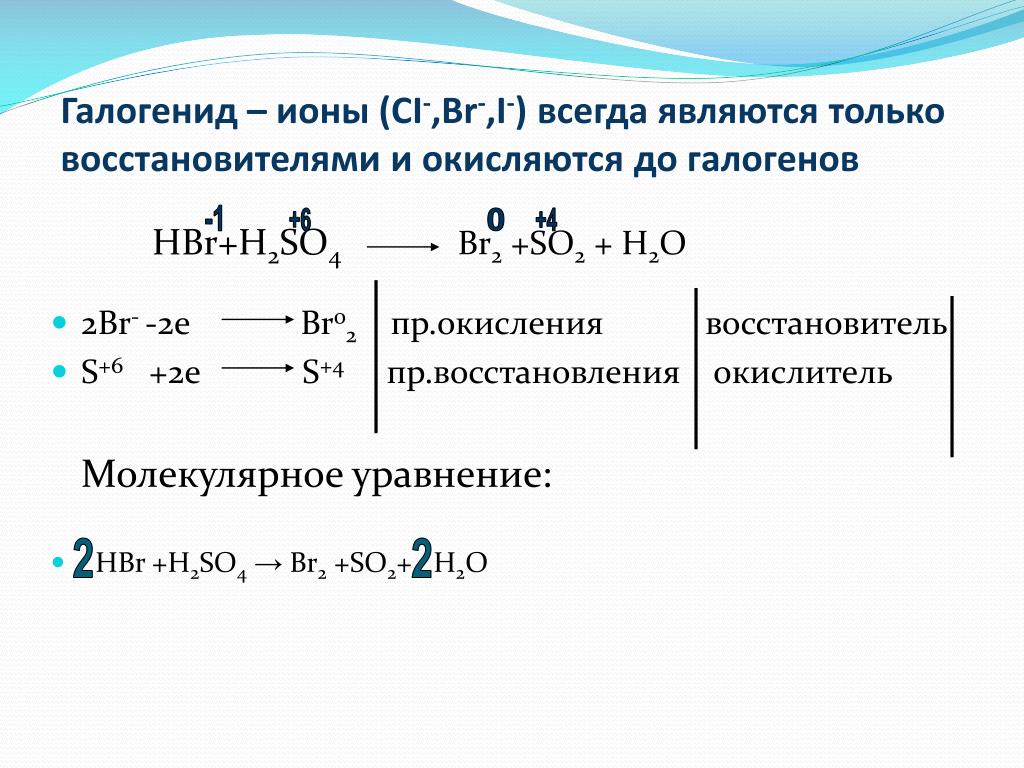
Phương trình để tạo ra chất SO2 (lưu hùynh dioxit) (двуокись серы)
2H 2 S + 3O 2 → 2H 2 O + 2SO 2 H 2 SO 4 + NA 2 SO 3 → H 2 O + NA 2 → H 2 O + NA 2 → H 2 O + NA 2 2 2 2 . + SO 2 CU + 2H 2 SO 4 → 2H 2 O + SO 2 + CUSO 4
NHà TRợ
TVB MộT THờI nhà nhà trợ
TVB MộT THờI nhà TRợ
TVB MộTIA nhà Trợ
Kham Phá Tin Tức Thú Vị Chỉ 5% Người Biet
Cập Nhật 2023-02-17 07:57:12
Doanh thu từ quảng cáo giúp chúng minh duy trì nội dung chất lượng cho веб-сайт — Vì sao chúng minh phải đặt quảng cáo? 😀
Cách tắt chặn quảng cáo
Toi không muốn hỗ trợ Từ Điển (Đóng) — 🙁
= | Сбалансированное уравнение химической реакции
| Поиск |
Результаты поиска по химическому уравнению
Новости Только 5% НАСЕЛЕНИЯ знают
Реклама
1 результатов найдено
Отображение уравнения от 1 до 1 Страница 1 — Пожалуйста, прокрутите до конца, чтобы увидеть больше результатов
Уравнение Результат #1
Нажмите, чтобы увидеть более подробную информацию и рассчитать вес/моль >>
Окислительно-восстановительная реакция
| png» substance-weight=»98.0785″> H 2 SO 4 | + | ) | (không màu) | (không màu, mùi hắc) | ||||||
| 1 | 2 | 1 | 2 | 1 | Hệ số | |||||
| Nguyên — Phân tử khối (g/mol) | ||||||||||
| Số mol | ||||||||||
| Хой лунг (г) 9 5384 | 0013 Реклама Дополнительная информация об уравнении H2 SO 4 + 2HBr → Br 2 + 2H 2 O + SO 2Реакция реакции h3SO4 ) ?Температура: температура Объяснение: идеальные условия окружающей среды для реакции, такие как температура, давление, катализаторы и растворитель. Как могут происходить реакции с образованием Br2 (бром), h3O (вода) и SO2 (диоксид серы)?Реакция серной кислоты с HBr Явление после реакции h3SO4 (серная кислота) с HBr (бромистоводородная кислота)Нажмите, чтобы увидеть явление уравнения Какую другую важную информацию вы должны знать о реакцииУ нас нет дополнительной информации об этой химической реакции. Категории уравненийНажмите, чтобы увидеть более подробную информацию и рассчитать вес/моль >> Другие вопросы, связанные с химическими реакциями H2 SO 4 + 2HBr → Br 2 + 2H 2 O + SO 2 0 Вопросы, связанные с 90серной кислотой h3SO4 () химические и физические характеристики h3SO4 (серная кислота)? В каких химических реакциях используется h3SO4 (серная кислота) в качестве реагента?Вопросы, связанные с реагентом HBr (бромистоводородная кислота)Каковы химические и физические характеристики HBr (бромистоводородной кислоты)? В каких химических реакциях используется HBr (бромистоводородная кислота) в качестве реагента? Вопросы, связанные с продуктом Br2 (бром)Каковы химические и физические характеристики Br2 (бромистоводородной кислоты)? В каких химических реакциях образуется Br2 (бром)? Вопросы, связанные с продуктом h3O (вода)Каковы химические и физические характеристики h3O (бромистоводородной кислоты)? В каких химических реакциях образуется h3O (вода)? Вопросы, связанные с продуктом SO2 (диоксид серы)Каковы химические и физические характеристики SO2 (бромистоводородной кислоты)? Каковы химические реакции, в которых SO2 (диоксид серы) является продуктом? 1 результатов найдено Дополнительная информация о веществах, которые используют уравнение Реакция h3SO4 (аксит серная) реакция с HBr (гидробром) дает Br2 (бром) и SO2 (lưu hùynh dioxit) , температурный режим Nhiệt độ. Реакция, в результате которой образуется вещество h3SO4 (аксит серная) (серная кислота)24HNO 3 + FECUS 2 → CU (№ 3 ) 2 + 10H 2 O + 2H 2 SO 4 + 18NO 2 + FE ). 3 2H 2 O + 2KMnO 4 + 5SO 2 → 2H 2 SO 4 + 2MnSO 4 + K 2 SO 4 2H 2 O + 2ZnSO 4 → 2H 2 SO 4 + O 2 + 2Zn Реакция с образованием вещества HBr (гидробром) (бромистоводородная кислота) BR 2 + H 2 O + (NH 4 ) 2 SO 3 → (NH 4 ) 2 SO 4 + 2HBR BR 2 6 6 6 6 6 6 6 6 6 6 6 2 2 2 2 2 2 2 2 2 2 2 2 2 2 2 2 2 . Реакция с образованием вещества Br2 (бром) (бром)8H 2 SO 4 + 2KMnO 4 + 10NaBr → 5Br 2 + 8H 2 O + 9 2MnSO0055 4 + 5NA 2 SO 4 + K 2 SO 4 CL 2 + 2NABR → BR 2 + 2NACL 2AGBR → 2AG + BR 2 . H3O (NướC) (вода)3NH 4 NO 3 + CH 2 → 7H 2 O + 3N 2 + CO 2 NH 4 NO 2 2H 4 NO 2 2 2H956 2 2 2 . O + N 2 H 2 SO 4 + Na 2 SO 3 → H 2 O + Na 2 SO 4 + SO 2 Реакция с образованием вещества SO2 (lưu hùynh dioxit) (диоксид серы) 2H 2 S + 3O 2 → 2H 2 O + 2SO 2 H 2 SO 4 + NA 2 SO 4 + NA 2 2 SO 4 + NA 2 2 2 2 2 2 2 2 2 2 2 2 2 . |

 3k
3k 6k
6k Катализаторы — это вещества, которые ускоряют темп (скорость) химической реакции, не потребляясь и не становясь частью конечного продукта.
Катализаторы не влияют на равновесные ситуации.
Катализаторы — это вещества, которые ускоряют темп (скорость) химической реакции, не потребляясь и не становясь частью конечного продукта.
Катализаторы не влияют на равновесные ситуации.
 H 6 → C 6 H 5 Br + HBr Br 2 + H 2 → 2HBr
H 6 → C 6 H 5 Br + HBr Br 2 + H 2 → 2HBr