Химические реакции h3 cl2. Получение HCl. Реакция протекает по схеме
Хлороводород в промышленности получают либо прямым синтезом из хлора и водорода, либо из побочных продуктов при хлорировании алканов (метана). Мы будем рассматривать прямой синтез из элементов.
HCl – бесцветный газ с резким, характерным запахом
t° пл = –114,8°C, t° кип = –84°C, t° крист = +57°C, т.е. хлороводород можно получать при комнатной температуре в жидком виде, увеличивая давление до 50 – 60 атм. В газовой и жидкой фазе находится в виде отдельных молекул (отсутствие водородных связей). Прочное соединение Е св = 420 кДж/моль. Начинает разлагаться на элементы при t>1500°C.
2HCl Cl 2 + H 2
Эффективный радиус HCl = 1,28 , диполь – 1,22 .
R Cl — = 1,81 , т.е. протон внедряется в электронное облако иона хлора на треть эффективного радиуса и при этом происходит упрочнение самого соединения, вследствие повышения положительного заряда вблизи ядра иона хлора и уравновешивания отталкивающего действия электронов. Все галогеноводороды образованы аналогично и являются прочными соединениями.
Все галогеноводороды образованы аналогично и являются прочными соединениями.
Хлороводород хорошо растворим в воде в любых соотношениях (в одном объеме H 2 O расторяется до 450 объемов HCl), с водой образует несколько гидратов и дает азеотропную смесь – 20,2% HCl и t° кип = 108,6°C.
Образование хлороводорода из элементов:
Cl 2 + H 2 = 2HCl
Смесь водорода и хлора при освещении взрывается, что указывает на цепной характер реакции.
В начале века Баденштейн предложил следующий механизм реакции:
Инициирование: Cl 2 + hν → ē + Cl 2 +
Цепь: Cl 2 + + H 2 → HCl + H + Cl +
H + Cl 2 → HCl + Cl
Обрыв цепи: Cl + + ē → Cl
Cl + Cl → Cl 2
Но ē в сосуде обнаружен не был.
В 1918 г. Нернст предложил другой механизм:
Инициирование: Cl 2 + hν → Cl + Cl
Цепь: Cl + H 2 → HCl + H
H + Cl 2 → HCl + Cl
Обрыв цепи: H + Cl → HCl
В дальнейшем этот механизм получил дальнейшее развитие и дополнение.
1 стадия – инициирование
реакция Cl 2 + hν → Cl + Cl
Инициируется фотохимическим путем, т.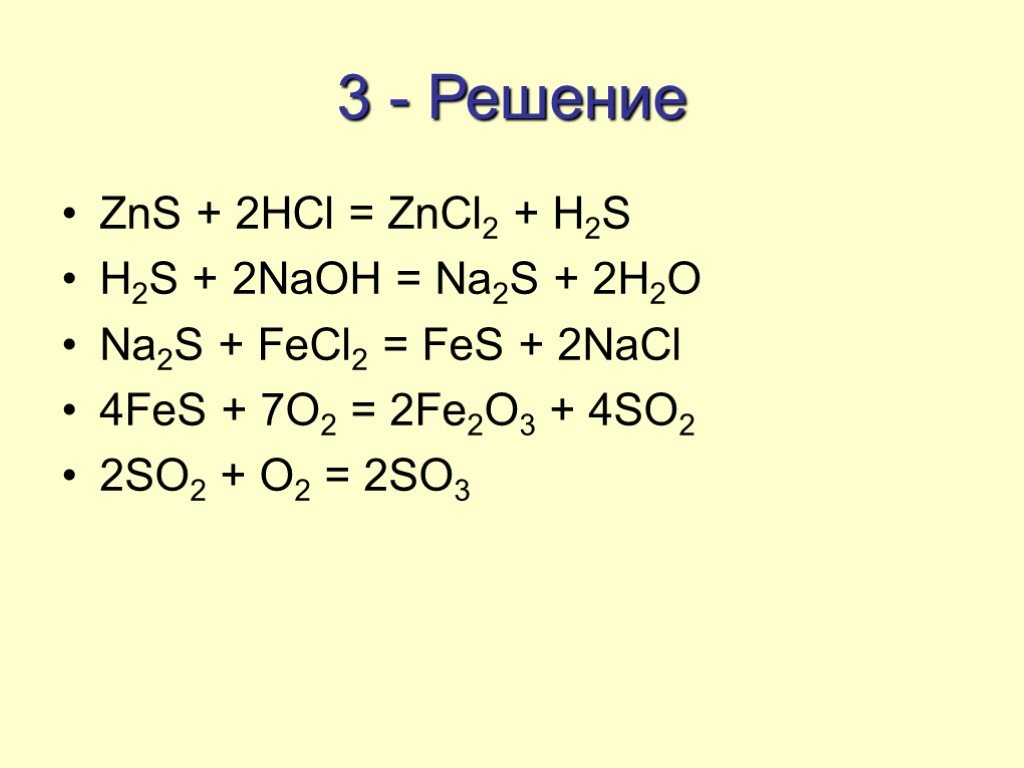 е. путем поглощения кванта света hν. Согласно принципу эквивалентности Эйнштейна каждый квант света может вызвать превращение только одной молекулы. Количественной характеристикой принципа эквивалентности является квантовый выход реакции:
е. путем поглощения кванта света hν. Согласно принципу эквивалентности Эйнштейна каждый квант света может вызвать превращение только одной молекулы. Количественной характеристикой принципа эквивалентности является квантовый выход реакции:
– количество прореагировавших молекул приходящихся на 1 квант света.
γ в обычных фотохимических реакциях ≤1. Однако в случае цепных реакций γ>>1. Например, в случае синтеза HCl γ=10 5 , при распаде H 2 O 2 γ=4.
Если молекула Cl 2 поглотила квант света, то она находится в возбужденном состоянии
10 -8 -10 -3 сек и, если полученной с квантом света энергии хватило для превращения, то происходит реакция, если нет, то молекула снова перейдет в основное состояние, либо с испусканием кванта света (флуоресценция или фосфоресценция), либо электронное возбуждение конверсируется в энергию колебания или вращения.
Посмотрим, что происходит в нашем случае:
Е дис Н 2 = 426,4 кДж/моль
Е дис Cl 2 = 239,67 кДж/моль
Е обр HCl = 432,82 кДж/моль – без облучения реакция не идет.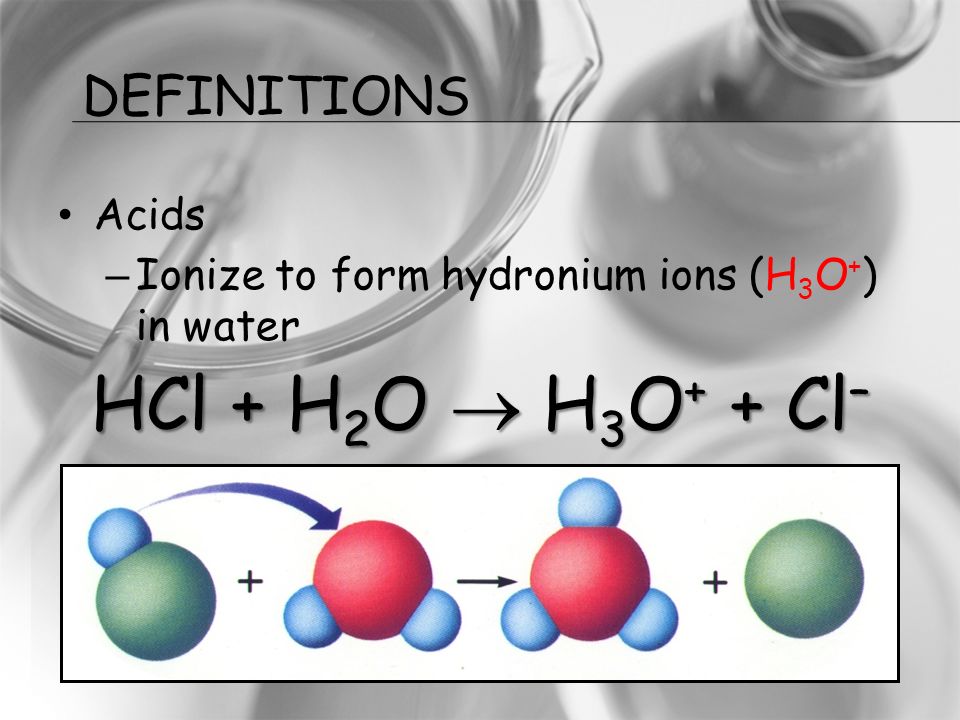
Квант света имеет энергию Е кв = 41,1*10 -20 Дж. Энергия, необходимая для начала реакции (энергия активации) ровна энергии, затраченной диссоциацию молекулы Cl 2:
т.е. Е Cl2
В отличие от катализа, при котором потенциальный барьер снижается, в случае фотохимических реакций он просто преодолевается за счет энергии кванта света.
Еще одна возможность инициирования реакции – добавление паров Na в смесь H 2 +Cl 2 . Реакция идет при 100°C в темноте:
Na + Cl 2 → NaCl + Cl
Cl + H 2 → HCl + H ………
и образуется до 1000 HCl на 1 атом Na.
2 стадия – продолжение цепи
Реакции продолжения цепи при получении HCl бывают следующих типов:
1. Cl + H 2 → HCl + H E a =2,0 кДж/моль
2. H + Cl 2 → HCl + Cl E a =0,8 кДж/моль
Это звенья цепи.
Скорость данных реакций можно представить следующим образом:
W 1 = K 1 [ H 2 ]
W 2 = K 2 [ Cl 2 ]
Т.к. энергии активации этих реакций малы, то их скорости велики. Цепи в данном случае неразветвленные, а по теории неразветвленных цепей:
W развитие цепи = W ициируется фотохимическим путем, т. е. путем поглощения кванта светаобрыва,
е. путем поглощения кванта светаобрыва,
Cl + Cl +М → Cl 2 + М,
то W обр = К 2
От реакций 1 и 2 зависит скорость получения HCl
в данном случае W 1 =W 2 , т.к.цепи достаточно длинные (из теории цепных реакций)
Данное кинетическое уравнение справедливо в отсутствие примесей в смеси H 2 + Cl 2 . Если в систему попадет воздух, то кинетическое уравнение будет иное. В частности
W обр = K, т.е. не квадратичный обрыв и ход процесса полностью меняется.
Т.к. есть вещества, являющиеся ингибиторами цепных реакций. Ингибитором реакции образования HCl является кислород:
O 2 + H → O 2 H
Этот радикал малоактивен и может реагировать только с таким же радикалом, регенерируя кислород
O 2 H + O 2 H = O 2 + H 2 O 2
Расчеты показывают, что в присутствии 1% O 2 реакция замедляется в 1000 раз. Еще более сильно замедляет скорость процесса присутствие NCl 3 , который замедляет реакцию в 10 5 раз сильнее, чем кислород. Т.к. хлорид азота может присутствовать в хлоре в процессе его получения в промышленности, необходима тщательная очистка исходного хлора перед синтезом HCl.
При составлении уравнений окислительно-восстановительных реакций этим методом рекомендуется придерживаться следующего порядка:
1. Запишите схему реакции с указанием исходных и образующихся веществ, определите элементы, которые изменяют в результате реакции степень окисления, найдите окислитель и восстановитель.
2. Составьте электронные уравнения исходя из того, что окислитель принимает электроны , а восстановитель их отдает.
3. Подберите множители (основные коэффициенты) для электронных уравнений так, чтобы число электронов, отданных при окислении, было равно числу электронов, полученных при восстановлении.
4. Расставьте коэффициенты в уравнении реакции.
ПРИМЕР 3: Составить уравнение реакции восстановления оксида железа (III) углеродом . Реакция протекает по схеме:
Fe 2 O 3 + C → Fe + CO
Решение : Железо восстанавливается, понижая степень окисления от +3 до 0; углерод окисляется, его степень окисления повышается от 0 до +2.
Составим схемы этих процессов.
восстановитель 1| 2Fe +3 + 6e = 2Fe 0 , процесс окисления
окислитель 3| C 0 -2e = C +2 , процесс восстановления
Общее число электронов, отданных восстановителем, должно быть равно общему числу электронов, принятых окислителем. Найдя наименьшее общее кратное между числами 2 и 6, определяем, что молекул восстановителя должно быть три, а молекул окислителя — две, т.е. находим соответствующие коэффициенты в уравнении реакции перед восстановителем, окислителем и продуктами окисления и восстановления.
Уравнение будет иметь вид:
Fe 2 O 3 + 3C = 2Fe + 3CO
Метод электронно-ионных уравнений (полуреакций).При составлении электронно-ионных уравнений учитывают форму существования веществ в растворе (простой или сложный ион, атом или молекула нерастворимого или труднодиссоциирующего в воде вещества).
Чтобы составить уравнения окислительно-восстановительных реакций данным методом, рекомендуется придерживаться следующего порядка:
1.
2. Составьте схемы полуреакций окисления и восстановления с указанием исходных и образующихся в условиях реакции ионов или молекул.
3. Уравняйте число атомов каждого элемента в левой и правой частях полуреакций; при этом следует помнить, что в водных растворах в реакциях могут участвовать молекулы воды, ионы Н + или ОН — .
Следует помнить, что в водных растворах связывание избыточного кислорода и присоединение кислорода восстановителем происходят по- разному, в зависимости от рН среды. В кислых растворах избыток кислорода связывается ионами водорода с образованием молекул воды, а в нейтральных и щелочных — молекулами воды с образованием гидроксид-ионов. Например,
MnO 4 — + 8H + + 5e = Mn 2+ + 4H 2 O (кислая среда)
NO 3 — + 6H 2 O + 8e = NH 3 + 9OH — (нейтральная или щелочная среда).
Присоединение кислорода восстановителем осуществляется в кислой и нейтральной средах за счет молекул воды с образованием ионов водорода, а в щелочной среде — за счет гидроксид ионов с образованием молекул воды. Например,
I 2 + 6H 2 O — 10e = 2IO 3 — + 12H + (кислая или нейтральная среда)
CrO 2 — + 4OH — — 3e = CrO 4 2- + 2H 2 O (щелочная среда)
4. Уравняйте суммарное число зарядов в обеих частях каждой полуреакции; для этого прибавьте к левой и правой частям полуреакции необходимое число электронов.
5. Подберите множители (основные коэффициенты) для полуреакций так, чтобы число электронов, отдаваемых при окислении, было равно числу электронов, принимаемых при восстановлении.
6. Сложите уравнения полуреакций с учетом найденных основных коэффициентов.
7. Расставьте коэффициенты в уравнении реакции.
ПРИМЕР 4: Составить уравнение окисления сероводорода хлорной водой.
Реакция протекает по схеме:
H 2 S + Cl 2 + H 2 O → H 2 SO 4 + HCl
Решение.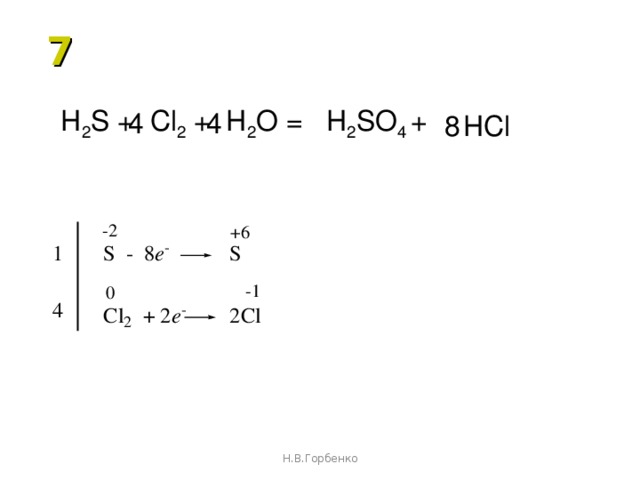 Восстановлению хлора соответствует следующее уравнение полуреакции: Cl 2 + 2e = 2Cl — .
Восстановлению хлора соответствует следующее уравнение полуреакции: Cl 2 + 2e = 2Cl — .
При составлении уравнения полуреакции окисления серы исходим из схемы: H 2 S → SO 4 2- . В ходе этого процесса атом серы связывается с четырьмя атомами кислорода, источником которых служат молекулы воды. При этом образуются восемь ионов Н + ; кроме того, два иона Н + высвобождаются из молекулы Н 2 S.
Всего образуются 10 ионов водорода:
Левая часть схемы содержит только незаряженные частицы, а суммарный заряд ионов в правой части схемы равен +8. Следовательно, в результате окисления высвобождаются восемь электронов:
H 2 S + 4H 2 O → SO 4 2- + 10 H +
Поскольку отношение чисел электронов, принятых при восстановлении хлора и отданных при окислении серы, равно 8?2 или 4?1, то, складывая уравнения полуреакций восстановления и окисления, надо первое из них умножить на 4, а второе — на 1.
Получаем:
Cl 2 + 2e = 2Cl — | 4
H 2 S + 4H 2 O = SO 4 2- + 10H + +8e — | 1
4Cl 2 + H 2 S + 4H 2 O = 8Cl — + SO 4 2- +10H +
В молекулярной форме полученное уравнение имеет следующий вид:
4Cl 2 + H 2 S + 4H 2 O = 8HCl + H 2 SO 4
Одно и то же вещество в различных условиях может окисляться или восстанавливаться до разных степеней окисления соответствующего элемента, поэтому величина эквивалента окислителя и восстановителя также может иметь различные значения.
Эквивалентная масса окислителя равна его молярной массе деленной на число электронов n, которые присоединяет одна молекула окислителя в данной реакции.
Например, в реакции восстановления Cl 2 + 2e = 2Cl — . n = 2 Следовательно, эквивалентная масса Сl 2 равна М/2, т.е. 71/2 = 35,5г/моль.
Эквивалентная масса восстановителя равна его молярной массе деленной на число электронов n, которые отдает одна молекула восстановителя в данной реакции.
Например, в реакции окисления H 2 S + 4H 2 O — 8е = SO 4 2- + 10 H +
n = 8. Следовательно, эквивалентная масса H 2 S равна М/8, т.е. 34,08/8 = 4,26г/моль.
Даны вещества: водные растворы тетрагидроксоалюмината калия К[Аl(ОН)4], хлорида алюминия, карбоната калия, хлор. Напишите уравнения четырёх возможных реакций между этими веществами
(*ответ*) 3K + AlCl3 = 4Al(OH)3 + 3KCl
(*ответ*) 3K2CO3 + 2AlCl3 + 3h3O = 2Al(OH)3 + 3CO2 + 6KCl
(*ответ*) K + CO2 = KHCO3 + Al(OH)3
(*ответ*) 3K2CO3 + 3Cl2 = 5KCl + KClO3 + 3CO2
2AlCl3 + 2CO2 + 3h3O = Al(OH)3 + 2h3CO3 + 2HCl
Даны вещества: водные растворы тетрагидроксоцинката калия K2, пероксид натрия, уголь, углекислый газ. Напишем уравнения четырёх возможных реакций между этими веществами
Напишем уравнения четырёх возможных реакций между этими веществами
(*ответ*) K2 + CO2 = K2CO3 + Zn(OH)2 + h3O
(*ответ*) 2Na2O2 + 2CO2 = 2Na2CO3 + O2
(*ответ*) CO2 + C 2CO
(*ответ*) 2Na2O2 + C Na2CO3 + Na2O
2Na2O2 + 2CO = 2Na2CO3 + 2СO2
Даны вещества: водный раствор гексагидроксохромата калия К3[Сr(ОН)6], твёрдый гипохлорит калия, оксид марганца(IV), концентрированная соляная кислота. Напишем уравнения четырёх возможных реакций между этими веществами: _
(*ответ*) 2K3 + 3KClO = 2K2CrO4 + 3KCl + 2KOH + 5h3O
(*ответ*) K3 + 6HCl = 3KCl + CrCl3 + 6h3O
(*ответ*) 4HCl + MnO2 = Cl2 + MnCl2 + 2h3O
(*ответ*) 2HCl + KClO = Cl2 + KCl + h3O
MnO2 + KClO = MnCl4 + KO
Даны вещества: карбонат натрия, концентрированный раствор гидроксида натрия, оксид алюминия, фторид фосфора(V), вода. Напишем уравнения четырёх возможных реакций между этими веществами:
(*ответ*) PF5 + 4h3O = h4PO4 + 5HF
(*ответ*) PF5 + 8NaOH = Na3PO4 + 5NaF + 4h3O
(*ответ*) Na2CO3 + Al2O3 2NaAlO2 + CO2
(*ответ*) Al2O3 + 2NaOH + 3h3O = 2Na
PF5 + 2Na2CO3 = Na3PO4 + 2CO2 + NaF
Даны вещества: концентрированная азотная кислота, фосфор, сернистый газ, концентрированный раствор сульфита аммония. Напишем уравнения четырёх возможных реакций между этими веществами. В итоге получим: _
Напишем уравнения четырёх возможных реакций между этими веществами. В итоге получим: _
(*ответ*) P + 5HNO3 = h4PO4 + 5NO2 + h3O
(*ответ*) 2HNO3 + SO2 = h3SO4 + 2NO2
(*ответ*) (Nh5)2SO3 + SO2 + h3O = 2Nh5HSO3
(*ответ*) 2HNO3 + (Nh5)2SO3 = (Nh5)2SO4 + 2NO2 + h3O
P + SO2 = PS + O2
Даны вещества: концентрированная серная кислота, сера, серебро, хлорид натрия. Напишем уравнения четырёх возможных реакций между этими веществами. В итоге получим: _
(*ответ*) 2h3SO4 + S = 3SO2 + 2h3O
(*ответ*) h3SO4 + 2NaCl = Na2SO4 + 2HCl (или NaHSO4 + HCl)
(*ответ*) 2Ag + 2h3SO4 =Ag2SO4 + SO2 + 2h3O
(*ответ*) 2Ag+S = Ag2S
3h3SO4 + 2NaCl = 2Na + 2HCl + 3SO2 + 2h3O+ O2
Даны вещества: концентрированная хлорноватая кислота, растворы хлорида хрома(III), гидроксида натрия. Напишем уравнения четырёх возможных реакций между этими веществами. В итоге получим: _
(*ответ*) HClO3 + 2CrCl3 + 4h3O = h3Cr2O7 + 7HCl
(*ответ*) HClO3 + NaOH = NaClO3 + h3O
(*ответ*) CrCl3 + 3NaOH = Cr(OH)3 + 3NaCl
(*ответ*) CrCl3 + 6NaOH = Na3 + 3NaCl
CrCl3 + 8NaOH = Na4 + 4NaCl
Даны вещества: хлор, концентрированная азотная кислота, растворы хлорида железа(II), сульфида натрия. Напишем уравнения четырёх возможных реакций между этими веществами. В итоге получим: _
Напишем уравнения четырёх возможных реакций между этими веществами. В итоге получим: _
(*ответ*) 2FeCl2 + Cl2 = 2FeCl3
(*ответ*) Na2S + FeCl2 = FeS + 2NaCl
(*ответ*) Na2S + 4HNO3 = S + 2NO2 + 2NaNO3 + 2h3O
(*ответ*) FeCl2 + 4HNO3 = Fe(NO3)3 + NO2 + 2HCl + h3O
2HNO3 + Cl2 = 2HCl +2NO2 +h3O
Даны вещества: хлорид фосфора(III), концентрированный раствор гидроксида натрия, хлор. Напишем уравнения четырёх возможных реакций между этими веществами. В итоге получим: _
(*ответ*) PCl3 + 5NaOH = Na2PHO3 + 3NaCl + 2h3O
(*ответ*) PCl3 + Cl2 = PCl5
(*ответ*) 2NaOH + Cl2 = NaCl + NaClO + h3O
(*ответ*) 6NaOH (горячий) + 3Cl2 = 5NaCl + NaClO3 + 3h3O
4NaOH + 2Cl2 = 4NaCl + h3O + O3
Используя метод электронного баланса, составим уравнение реакции: Cl2 + NaI + h3O ® NaIO3 + … и определим окислитель и восстановитель. В итоге получим: _
(*ответ*) уравнение реакции 3Cl2 + NaI + 3h3O = NaIO3 + 6HCl
(*ответ*) окислитель — хлор
(*ответ*) восстановитель — йод
уравнение реакции 2Cl2 + NaI + 2h3O = NaIO3 + 4HCl
восстановитель — хлор
окислитель — йод
Цепные реакции включают в свой механизм множество последовательно повторяющихся
однотипных элементарных актов (цепь).
Рассмотрим реакцию:
H 2 + Cl 2 = 2HCl
Она состоит из следующих стадий, общих для всех цепных реакций:
1) Инициирование , или зарождение цепи
Cl 2 = 2Cl·
Распад молекулы хлора на атомы (радикалы) происходит при УФ-облучении или при нагревании. Сущность стадии инициирования — образование активных, реакционноспособных частиц.
2) Развитие цепи
Cl· + H 2 = HCl + H·
H· + Cl 2 = HCl + Cl·
В результате каждого элементарного акта развития цепи образуется новый радикал хлора, и эта стадия повторяется вновь и вновь, теоретически — до полного расходования реагентов.
3) Рекомбинация , или обрыв цепи
2Cl· = Cl 2
2H· = H 2
H· + Cl· = HCl
Радикалы, оказавшиеся рядом, могут рекомбинировать, образуя устойчивую частицу (молекулу). Избыток энергии они отдают «третьей частице» — например, стенкам сосуда или молекулам примесей.
Рассматриваемая цепная реакция является неразветвленной , поскольку в элементарном акте
развития цепи количество радикалов не возрастает . Цепная реакция взаимодействия водорода с
кислородом является разветвленной , т.к. число радикалов в элементарном
акте развития цепи увеличивается :
Цепная реакция взаимодействия водорода с
кислородом является разветвленной , т.к. число радикалов в элементарном
акте развития цепи увеличивается :
H· + O 2 = OH· + O·
O· + H 2 = OH· + H·
OH· + H 2 = H 2 O + H·
К разветвленным цепным реакциям относятся многие реакции горения.Неконтролируемый рост числа свободных радикалов (как в результате разветвления цепи, так и для неразветвленных реакций в случае слишком быстрого инициирования) может привести к сильному ускорению реакции и взрыву.
Казалось бы, чем больше давление, тем выше концентрация радикалов и вероятнее взрыв.
Но на самом деле для реакции водорода с кислородом взрыв возможен лишь в определенных
областях давления: от 1 до 100 мм рт.ст. и выше 1000 мм рт.ст. Это следует из механизма реакции.
При малом давлении большая часть образующихся радикалов рекомбинирует на стенках сосуда, и
реакция идет медленно. При повышении давления до 1 мм рт.ст. радикалы реже достигают стенок,
т.к. чаще вступают в реакции с молекулами. В этих реакциях радикалы размножаются, и происходит
взрыв. Однако при давлении выше 100 мм рт.ст. концентрации веществ настолько возрастают, что
начинается рекомбинация радикалов в результате тройных соударений (например, с молекулой воды),
и реакция протекает спокойно, без взрыва (стационарное течение). Выше 1000 мм рт.ст. концентрации
становятся очень велики, и даже тройных соударений оказывается недостаточно,
чтобы предотвратить размножение радикалов.
В этих реакциях радикалы размножаются, и происходит
взрыв. Однако при давлении выше 100 мм рт.ст. концентрации веществ настолько возрастают, что
начинается рекомбинация радикалов в результате тройных соударений (например, с молекулой воды),
и реакция протекает спокойно, без взрыва (стационарное течение). Выше 1000 мм рт.ст. концентрации
становятся очень велики, и даже тройных соударений оказывается недостаточно,
чтобы предотвратить размножение радикалов.
Вам известна цепная разветвленная реакция деления урана-235, в каждом элементарном акте которой захватывается 1 нейтрон (играющий роль радикала) и испускается до 3 нейтронов. В зависимости от условий (например, от концентрации поглотителей нейтронов) для нее также возможно стационарное течение или взрыв. Это еще один пример корреляции кинетики химических и ядерных процессов.
Приложения
Ответы | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||
|
|
| |||||||||||||||||||||||||||||||||||||||||||||||||||
Посмотреть всех экспертов из раздела Учеба и наука > Химия
| Похожие вопросы |
электронный баланс Nh4+O2=NO+h3O
CaC2->C2h3->C6H6->C6H6-NO2->C6H6-Nh3
Гидролиз NA3PO4
Напишите изомеры пентановой кислоты изомеры пентаналя
10 класс тема «Фенол» пожалуйстаааа!
Пользуйтесь нашим приложением
Хлористый водород (HCl) | IVHHN
Свойства
Эффекты воздействия
Существующие рекомендации
Вулканические примеры и инциденты
Ссылки
Свойства
Хлористый водород (HCl) представляет собой бесцветный газ с раздражающим резким запахом, обнаруживаемым при ~0,8 ppm. Он очень хорошо растворим в воде (673 г л-1 при 30°C) (Gangolli, 1999) и реагирует во влажном воздухе с образованием тумана. Он не воспламеняется на воздухе и имеет плотность 1,49 г л-1 при 25°C и 1 атм (Lide, 2003), что в 1,2 раза больше, чем у окружающего воздуха. Типичные диапазоны концентраций HCl в разбавленных вулканических шлейфах составляют 0,1–3 ppm по сравнению с тропосферным фоном 0,000001–0,001 ppm, а время пребывания газа в нижних слоях атмосферы составляет примерно 4 дня (Brimblecombe, 19).96; Оппенгеймер и др., 1998).
Он очень хорошо растворим в воде (673 г л-1 при 30°C) (Gangolli, 1999) и реагирует во влажном воздухе с образованием тумана. Он не воспламеняется на воздухе и имеет плотность 1,49 г л-1 при 25°C и 1 атм (Lide, 2003), что в 1,2 раза больше, чем у окружающего воздуха. Типичные диапазоны концентраций HCl в разбавленных вулканических шлейфах составляют 0,1–3 ppm по сравнению с тропосферным фоном 0,000001–0,001 ppm, а время пребывания газа в нижних слоях атмосферы составляет примерно 4 дня (Brimblecombe, 19).96; Оппенгеймер и др., 1998).
Эффекты воздействия
Высокая растворимость HCl означает, что воздействие обычно происходит в смеси газа и аэрозоля. HCl сильно раздражает глаза и слизистые оболочки. При контакте с кожей он может вызвать воспаление кожи или ожоги (NIOSH, 1981). Длительное, повышенное воздействие тумана HCl может вызвать эрозию зубов и изъязвление внутренней части носа. Вдыхание может вызвать удушье, кашель и отек дыхательной системы в зависимости от тяжести воздействия. Пороговые значения концентрации для воздействия на здоровье приведены в таблице.
Пороговые значения концентрации для воздействия на здоровье приведены в таблице.
Влияние на здоровье дыхательных путей хлористого водорода
(Baxter, 2000; Faivre-Pierret and Le Guern, 1983 и ссылки в них; NIOSH, 1981; Sax and Lewis, 1989).
| Пределы воздействия (частей на миллион) | Влияние на здоровье |
|---|---|
| 5< | Кашель |
| 35 | Раздражение горла возникает через короткое время |
| 35< | Серьезные затруднения дыхания и воспаление кожи или ожоги |
| 10-50 | Максимальный уровень, который может поддерживаться в течение нескольких часов |
| 100< | Отек легких и часто спазм горла |
| 50-1000 | Максимально возможное воздействие = 1 час |
| 1000-2000 | Очень опасно даже при очень коротком воздействии |
Существующие инструкции
Для газообразного HCl существуют только профессиональные инструкции, которые приведены в таблице.
Руководство по работе с HCl
| Страна/учреждение | Уровень (частей на миллион) | Уровень мкг·м -3 | Период усреднения | Руководство Тип | Дата реализации | Соответствующий закон | Примечания | Арт. |
|---|---|---|---|---|---|---|---|---|
| ЕС | 5 | 8000 | 8-часовая средняя средневзвешенная стоимость | ОЭЛ | Директива Комиссии 96/94 | и | ||
| 10 | 15000 | СТЭЛ | ОЭЛ | Директива Комиссии 96/94 | и | |||
| Великобритания | 5 | 8000 | 15 мин | МЭЛ | РКН | б | ||
| 1 | 2000 | 8-часовая средняя средневзвешенная стоимость | МЭЛ | РКН | б | |||
| США | 5 | 7000 | 8-часовая средняя средневзвешенная стоимость | ПЭЛ | Правила OSHA (стандарты — 29 CFR) | 1 | в | |
| 5 | 7000 | потолок | РЕЛ | 2003 | НИОСХ | д | ||
| 3 | 1 час | ЭРПГ-1 | 1998 | Руководство по планированию аварийного реагирования | и | |||
| 20 | 1 час | ЭРПГ-2 | 1998 | Руководство по планированию аварийного реагирования | е | |||
| 150 | 1 час | ЭРПГ-3 | 1998 | Руководство по планированию аварийного реагирования | и |
- частей на миллион по объему при 25ºC и 760 торр.

- http://europa.eu.int/comm/employment_social/health_safety/docs/oels_en.pdf
- HSE, 2002. Пределы воздействия на рабочем месте, 2002. HSE Books, Sudbury .
- Веб-сайт стандартов OSHA
- Карманный справочник NIOSH по химическим опасностям (NPG) http://www.cdc.gov/niosh/npg/npg.html
- Комитет АМСЗ по планированию действий в чрезвычайных ситуациях, 2002 г. Руководство по планированию действий в чрезвычайных ситуациях, 2002 г., полный набор, Американская ассоциация промышленной гигиены, Фэрфакс.
Вулканические примеры и инциденты
Измерения потоков HCl гораздо более распространены, чем концентрации, и нет никаких известных инцидентов, связанных с высокими концентрациями HCl. Однако концентрации HCl вблизи вентиляционных отверстий могут превышать профессиональные нормы:
- Ясур, Вануату: Пробы газа, отобранные на краю кратера в сентябре 1988 г., содержали HCl в концентрации от 3 до 9 частей на миллион (SEAN 13:12).

- Килауэа, Гавайи: Концентрация газа в жерле Пуу О’о варьировалась от 0,10 до 19,15 частей на миллион в июле 2003 г. (неопубликованные данные C. Witham). Уровни HCl в плотных шлейфах LAZE, образовавшихся там, где лава из Килауэа достигла моря в марте 1990 года, составляли в среднем 7,1 частей на миллион. (Kullman et al., 1994), превышающих профессиональные уровни. Эти концентрации быстро уменьшались по мере удаления от источника. (Примечание: основным источником хлора для LAZE является морская вода, а не вулканогенные газы). Измерения, проведенные в 2004 году, показали концентрации HCl в диапазоне 3-20 частей на миллион чуть выше Пуу-О’о в восточной рифтовой зоне и 1,5-4,5 частей на миллион вблизи источника шлейфа, входящего в океан. Скорее всего, это минимальные значения. (ХВО, неопубликованные данные).
- Попокатепетль, Мексика: Концентрация HCl вблизи жерла в феврале 1997 г. составляла ~1 ppm (2000 мкг м-3) (Goff et al., 1998), что соответствует среднему 8-часовому пределу для работников Великобритании.

- Вильяррика, Чили: Концентрации HCl в лавовом озере Вильяррика иногда превышают профессиональные нормы США в 5 частей на миллион (Witter and Delmelle, 2004).
- Масая, Никарагуа: В марте 1999 г. максимальные средние концентрации шлейфа над кратером Масая составляли >23 ppm (Horrocks et al., 19).99), значительно превосходя почти все рекомендации. Измерения, проведенные в 14 км по ветру от жерла в марте 1998 г., составили 0,3 ppm (Horrocks, 2001). Максимальные концентрации HCl на краю кратера в мае 2001 г. составляли 0,902 промилле (1300 мкг м-3) (Allen et al., 2002), что чуть ниже 8-часового рабочего норматива Великобритании.
Ссылки
Аллен, А.Г., Оппенгеймер, К., Ферм, М., Бакстер, П.Дж., Хоррокс, Л.А., Галле, Б., МакГонигл, А.Дж.С. и Даффелл, Х.Дж., 2002. Первичный сульфатный аэрозоль и связанные с ним выбросы вулкана Масая, Никарагуа. Журнал геофизических исследований, 107 (D23).
Baxter, P.J., 2000. Газы. В: П.Дж.Бакстер, П.Х. Адамс, Т.-К. О, А. Кокрофт и Дж. М. Харрингтон (редакторы), «Профессиональные болезни охотника». Арнольд, Лондон, стр. 123–178.
В: П.Дж.Бакстер, П.Х. Адамс, Т.-К. О, А. Кокрофт и Дж. М. Харрингтон (редакторы), «Профессиональные болезни охотника». Арнольд, Лондон, стр. 123–178.
Brimblecombe, P., 1996. Состав воздуха и химия. Издательство Кембриджского университета, Кембридж.
Faive-Pierret, R. и Le Guern, F., 1983. Риски для здоровья, связанные с вдыханием вулканических газов и аэрозолей. В: H. Tazieff и JC Sabroux (редакторы), Forecasting Volcanic Events. Elsevier Science Publishers B.V., Амстердам, стр. 69.-81.
Gangolli, S. (Ed.), 1999. Словарь веществ и их эффектов, 2-е изд. Королевское химическое общество. Кембридж.
Гофф, Ф., Яник, С.Дж., Дельгадо, Х., Вернер, К., Каунс, Д., Стимак, Дж.А., Сибе, К., Лав, С.П., Уильямс, С.Н., Фишер, Т. и Джонсон, L., 1998. Геохимические наблюдения за магматическими летучими на вулкане Попокатпетль, Мексика. Бюллетень Геологического общества Америки, 110 (6): 695-710.
Куллман, Г.Дж., Джонс, В.Г., Корнуэлл, Р.Дж. и Паркер, Дж. Э., 19 лет. 94. Характеристика загрязнителей воздуха, образующихся при взаимодействии лавы и морской воды. Перспективы гигиены окружающей среды, 102(5):478–482.
94. Характеристика загрязнителей воздуха, образующихся при взаимодействии лавы и морской воды. Перспективы гигиены окружающей среды, 102(5):478–482.
Лиде, Д.Р. (Ред.), 2003. Справочник CRC по химии и физике, 84-е изд. КПР Пресс. Бока-Ратон, Флорида.
Национальный институт безопасности и гигиены труда (NIOSH), 1981 г. Руководство по гигиене труда при химических опасностях, DHHS (NIOSH), публикация № 81-123. http://www.cdc.gov/niosh/81-123.html.
Оппенгеймер К., Фрэнсис П., Бертон М., Мацеевски А.Дж.Х. и Бордман, Л., 19 лет98. Дистанционное измерение вулканических газов с помощью инфракрасной спектроскопии с преобразованием Фурье. Прикладная физика Б, 67: 505-515.
Сакс, Н.И. и Льюис, Р.Дж., старший, 1989. Опасные свойства промышленных материалов, 7-е изд. Ван Ностранд Рейнхольд. Нью-Йорк.
Смитсоновский институт, 1988. Ясур. Бюллетень сети оповещения о научных событиях (SEAN), т. 13, вып. 12.
Witter, J.B. and Delmelle, P., 2004. Кислотные газы в кратере вулкана Вильяррика (Чили). Revista Geologica de Chile, 31(2): 273-277.
Revista Geologica de Chile, 31(2): 273-277.
Детектор хлористого водорода | Газоанализатор HCL
Детекторы хлористого водорода от International Gas Detectors Ltd.
Детекторы хлороводородного газа от International Gas Detectors – Мы можем предоставить ряд стационарных датчиков и портативных газоанализаторов для обнаружения HCL.
Для многих отраслей промышленности важно иметь точное и быстрое обнаружение хлороводорода, чтобы избежать опасного уровня токсичности газа.
Ознакомьтесь с нашим ассортиментом детекторов хлороводорода и сопутствующих приборов. Разработан специально для обнаружения HCL. Наш диапазон детекторов газа хлорида водорода включает в себя:
Уровни профессионального воздействияSTEL:
5PPM (Краткосрочный лимит воздействия — 15mins) 70007977918959292929292929292929292929135576 (Краткосрочный экспозиция — 15mins) 7777917918918929292929292929292929135576. PPPS. Рекомендации по аварийным сигналам
PPPS. Рекомендации по аварийным сигналам
Optional
Hydrogen Chloride(HCL) Properties:Hydrogen Chloride (HCL) is бесцветный высокотоксичный газ с резким запахом. HCL также обладает высокой коррозионной активностью. Хлороводород легко растворяется в воде с образованием соляной кислоты. Во влажных условиях газообразный хлористый водород реагирует с водой в воздухе, образуя облака соляной кислоты.
Мы можем предоставить ряд решений для обнаружения газообразного хлористого водорода в зависимости от требований вашего объекта. Будь то полностью стационарная система, использующая нашу лучшую в отрасли адресную систему, или автономный преобразователь ATEX, подключенный к системе стойки на всей площадке, у нас есть решение. Ниже обсуждаются опасности хлористого водорода и типичные области применения. Кроме того, мы также обсудим некоторые из наших решений для обнаружения газообразного хлороводорода. Если вы сомневаетесь, позвоните нашей команде, и мы обсудим ваши требования и предложим решение.
Ниже обсуждаются опасности хлористого водорода и типичные области применения. Кроме того, мы также обсудим некоторые из наших решений для обнаружения газообразного хлороводорода. Если вы сомневаетесь, позвоните нашей команде, и мы обсудим ваши требования и предложим решение.
TOC-903-X5 Автономный адресный передатчик газового детектора
Где используется HCL?
Хлористый водород используется в производстве:
- удобрений
- красители
- ряд промышленных химикатов.
- Используется для отделения хлопка от шерсти и пуха в текстильной промышленности.
- в электронной промышленности для травления полупроводниковых кристаллов.
- HCL также используется для обработки синтетического каучука и обработки металлов.
Примеры серьезной утечки:
На виниловом заводе в Чешире в 2000 г. Из контейнера для хранения произошла утечка хлороводорода на территорию, что привело к взрыву и утечке 18 тонн хлороводорода на территорию.

 ) = Pb(HSO4)2 + SO2 + h3O 3) Pb +… — вопрос №1351513 — Учеба и наука
) = Pb(HSO4)2 + SO2 + h3O 3) Pb +… — вопрос №1351513 — Учеба и наука 01.15
01.15

