Конспект урока «Типы химических реакций»
Тема урока: «Типы химических реакций»
Цель : учащиеся должны изучить классификацию химических реакций по составу исходных веществ и продуктов реакций, знать сущность реакций разложения, соединения, замещения, обмена; научиться определять тип реакций.
Дидактические задачи:
Обучающие:
— сформировать представление о понятии «классификация химических реакций»;
— усвоить признак классификации реакций соединения, разложения, замещения, обмена;
Развивающие:
— сформировать умение классифицировать химические реакции;
— закрепить знания, умения и навыки учащихся по составлению уравнений реакций;
— развивать у учащихся навыки наблюдения, логического мышления, умения
обобщать, делать выводы, проводить самопроверку.
Воспитатывающие:
— воспитывать умение работать самостоятельно и в группе, в атмосфере поиска, прививать чувство ответственности за выполненную работу.
Тип урока: изучение нового материала.
Метод: словестно-наглядный.
Средства обучения: презентация, химический эксперимент, химические реактивы.
Оборудование: компьютер, проектор, экран, штатив, пробирки, пробка с газоотводной трубкой; реактивы: медная проволока, пробирка с раствором хлорида меди, железный гвоздь, спиртовка, спички, малахит (порошок), известковая вода, раствор хлорида меди, оксид меди, раствор серной кислоты.
Ход урока:
1. Организационный момент-приветствие
2.Изучение нового материала.
«Понятие химической реакции»
— Что такое химическое уравнение?
(условная запись химической реакции с помощью химических формул)
— Что показывает в формуле индекс, коэффициент?
(Индекс показывает количество атомов элемента в молекуле, коэффициент-количество молекул)
-Все ли химические реакции одинаковы по количеству веществ, вступающих в реакцию и образующихся продуктов?
2.Типы химических реакций.
Проведем опыт
А) Реакции разложения.
Показывает ДО «Разложение малахита»
Для реакции возьмем порошок малахита и нагреем его. Какие признаки химической реакции Вы наблюдаете? (изменение окраски, появление капелек воды и помутнение известковой воды, что свидетельствует о выделении углекислого газа).
На доске записана реакция: (CuOH)2CO3=2CuO+CO2+h3O
Учитель задает вопросы:
Какие вещества образуются в качестве продуктов реакции?
(сложные)
Записывает на доске реакцию разложения воды
Н2О=Н2+О2
А какие вещества образуются здесь в качестве продуктов?
(простые)
Посмотрите внимательно на обе эти реакции и скажите, что общего в исходных веществах этих реакций? ( и в первой и во второй реакции оба вещества являются сложными)
Учитель записывает общую схему реакции вместе с классом (АВ → А+В, АВ2С →АВ+ВС).
Учитель: сформулируйте определение реакции разложения.
Вывод: реакции разложения -реакции, при которых из одного сложного вещества получается 2 или более простых или сложных веществ.
*Текущий контроль: из предложенного списка реакций выбрать реакции разложения (назвать номера этих реакций). Работа в паре (2,4,5)
1) C + O2 = CO2
2) MgCO3 = MgO + CO2
3) CuSO4 + Fe = Cu + FeSO4
4) 2H 2O = 2h3 + O2
5)2Fe(OH)3 = Fe2O3 + 3h3O
Б) Реакции соединения.
Учитель: в природе протекают не только реакции разложения, иначе сложных веществ не осталось бы, потому существуют и реакции соединения.
ДО прокаливание медной проволки
На доске записано уравнение реакции : Сu+O2=CuO
Учитель: какие вещества вступили в реакцию и какой продукт образовался в ходе реакции?(в реакцию вступили простые вещества, а образовавшийся продукт-сложное вещество)
Записывает с классом общую схему реакции А+В=С
Записывает уравнение CaO+CO2=CaCO3
Учитель: какие вещества вступили в реакцию и какой продукт образовался в ходе реакции?(в реакцию вступили сложные вещества, а в качестве продукта образовалось другое сложное вещество)
Составьте также общую схему реакции для данного уравнения
(АВ+СВ=АВ2С)
Учитель: сформулируйте определение реакции соединения.
Вывод: реакции соединения-реакции, при которых из двух или более простых или сложных веществ образуется одно новое сложное вещество.
Текущий контроль*: из предложенного списка выбрать реакции соединения (назвать их номера) (1,5)
1)Al + O2 → Al2O3
2)CaO + HCl → CaCl2 + h3O
3)NaHCO3 → Na2CO3 + h3O + CO2↑
4)Mg + h3SO4 → MgSO4 + h3↑
5)Na2O+CO2=Na2CO3
В) Реакции замещения.
ДО — Взаимодействие раствора хлорида меди (II) с железным гвоздем.
CuCl2+Fe=FeCl2+Cu
(наблюдаем выделение меди красного цвета на гвозде)
— Что вы наблюдаете? Что же произошло в результате реакции?
(наблюдаем выделение меди красного цвета на гвозде в результате реакции )
Учитель записывает на доске уравнение реакции
CuCl2+Fe=FeCl2+Cu
Запишите реакцию замещения в общем виде
AB+C=A+CB
Учитель приводит на доске еще несколько примеров реакции замещения, учащиеся в это время записывают реакцию в общем виде.
Cформулируйте определение реакции замещения
Вывод: реакции замещения-реакции между простым и сложным веществами, при которых атомы простого вещества замещают атомы одного из элементов сложного вещества.
Текущий контроль*: из предложенного выбрать реакции замещения (назвать их номера). (3,4)
1)СО + О2 =СО2
2)NaNO3= NaNO2 + O2,
3)CuO + Al =Al2O3 + Cu,
4)AgNO3 + Cu =Cu(NO3)2 + Ag,
5)KNO3 =KNO2 + O2.
Г) Реакции обмена .
ДО взаимодействие оксида меди с серной кислотой
CuO+h3SO4=CuSO4+h3O
Что вы наблюдаете?
(наблюдаем растворение черного порошка оксида меди и появление раствора сулфата меди голубого цвета)
Запишем уравнение реакции обмена в общем виде:
AB+CD=AC+BD
Учитель: исходя из уравнения в общем виде, сформулируйте определение реакции обмена.
Вывод: реакции между сложными веществами, в ходе которых сложные вещества обмениваются своими составными частями
3.Закрепление изученного материала.
Задание 1 (выполняется в парах):
Расставить коэффициенты и определить тип химической реакции.
(разложение-4,7; соединение 1,2,3,9; замещение 5,8; обмен 6,10)
1) СaO + CO2 = CaCO3 6) AgNO3+HCl−→−AgCl↓+HNO3 .
2) 2Mg + O2 = 2MgO 7) Cu(OH)2 = CuO + h3O
3) 2Al + 3S = Al2S3 8) Mg +2HCl = MgCl2 + h3
4) 2h3O = 2h3 + O2 9) 2SO2 + O2 = 2SO3
5) CuO + h3 = h3O + Cu 10) 2NaOH+CuSO4→Cu(OH)2+Na2SO4
Задание 2 (каждый выполняет у себя в тетради)
Учитель зачитывает описание химической реакции, а учащиеся записывает в тетради 4 типа реакций и напротив каждого ставят соответствующую цифру.
В результате нагревания известняка идет выделение углекислого газа. (разложение)
2) При реакции металлов с кислотами выделяется водород. (замещение)
3) Кислоты взаимодействуют со щелочами с образованием соли и воды. (обмен)
4) Все простые вещества при взаимодействии с кислородом образуют оксиды. (соединение)
5) При нагревании оксида ртути образовалась металлическая ртуть. (разложение)
Учитель:
— Что мы сегодня изучали на уроке? (типы химических реакций)
— Какие типы химических реакций выделяют? (соединение, разложение, замещение, обмен)
— Какие реакции называют реакциями соединения, разложения, замещения, обмена? (реакции разложения -реакции, при которых из одного сложного вещества получается 2 или более простых или сложных веществ.
реакции соединения-реакции, при которых из двух или более простых или сложных веществ образуется одно новое сложное вещество.
реакции замещения-реакции между простым и сложным веществами, при которых атомы простого вещества замещают атомы одного из элементов сложного вещества.
реакции между сложными веществами, в ходе которых сложные вещества обмениваются своими составными частями)
4.Домашнее задание
параграф 22, задачник 2.18, 2.30
Кислоты, их состав и названия презентация, доклад
Тема: «Кислоты, их состав и названия»
8 класс
Запомните!
Каждому кислотному оксиду соответствует определенная кислота. Например:
СО2 → Н2СО3
SО2 → h3SО3
SО3 → Н2SО4
N2О5 → HNO3
P2О5 → h4PO4
Запомните!
Каждому основному оксиду соответствует определенное основание. Например:
Например:
Na2O → NaOH
CaO → Ca(OH)2
Al2O3 → Al(OH)3
FeO → Fe(OH)2
Fe2O3 → Fe(OH)3
СаО + Н2O → Ca(OH)2
(Осн. оксид + вода = основание)
СаО + h3SO4 → CaSO4 + h3O
(Осн. оксид + кислота = соль + вода)
SO3 + h3O → h3SO4
(Кисл. оксид + вода = кислота)
SO3 + Са(ОН)2 → CaSO4 + Н2O
СаО + SO3 → CaSO4
(Осн. оксид + кисл. оксид = соль)
Самостоятельная работа
Напишите уравнения реакций химических свойств следующих оксидов:
Домашнее задание:
Выучить схему.
Составить уравнения реакций химических свойств следующих оксидов: N2O5 и Al2O3.
Содержание
Тема урока №1: «Кислоты, их состав и названия»
Состав кислот
Что такое кислоты
Классификация кислот по количеству атомов водорода
Классификация кислот по строению кислотного остатка
Нахождение кислот в природе
Физические свойства
Правила техники безопасности при работе с кислотами
Действие кислот на индикаторы
Тема урока №2: «Свойства кислот»
Кислоты – электролиты
Классификация кислот по степени электролитической диссоциации
Взаимодействие кислот с металлами
Взаимодействие кислот с основаниями
Взаимодействие кислот с основными и амфотерными оксидами
Взаимодействие кислот с растворами солей
Разложение кислот
Способы получения
Проверьте свои знания (№1)
Проверьте свои знания (№2)
Список литературы
Состав кислот
HCl h3SO4 h4PO4
1. Кислоты – это простые или сложные вещества?
Кислоты – это простые или сложные вещества?
2. Что общего в составе кислот?
3. Сформулируйте определение данного класса.
H Cl = H+ + Cl –
h3 SO 4 = 2 H+ + SO42-
Кислоты – это электролиты,
которые при диссоциации образуют катионы водорода
Что такое кислоты?
Кислотами называют сложные вещества, молекулы которых состоят из атомов водорода, способных замещаться на
атомы металлов, и кислотных остатков.
Классификация кислот по количеству атомов водорода
Одноосновные
HF, H Cl, H Br, HI
HNO3, HNO2
кислоты
Двухосновные
h3SO4 , h3SO3
h3CO3 , h3SiO3
h3S
многоосновные
h4PO4
Классификация кислот по строению кислотного остатка
кислоты
Бескислородные
HF, H Cl, H Br, HI
h3S
Кислородсодержащие
HNO3, HNO2
h3SO4 , h3SO3
h3CO3, h3SiO3
h4PO4
Нахождение кислот в природе
Лимонная кислота содержится в лимонах, яблочная кислота — в яблоках, щавелевая кислота — в листьях щавеля.
В пчелином яде, в волосках крапивы, в иголках сосны и ели содержится муравьиная кислота. Муравьи, защищаясь от врагов, разбрызгивают капельки муравьиной кислоты.
При скисании виноградного сока и молока, при квашении капусты образуется молочная кислота.
Физические свойства
Жидкости, неограниченно смешивающиеся с водой:
h3SO4, HNO3, HCI и др.
Твёрдые вещества, растворимые в воде:
h4PO4, HPO3
Нерастворимая в воде h3SiO3
Правила техники безопасности при работе с кислотами
При растворении серной кислоты нужно вливать ее тонкой струей в воду и перемешивать !!!
h3SO4
Н2О
С растворами кислот надо обращаться
осторожно, при попадании на кожу или одежду данных веществ — промыть большим количеством воды
Действие кислот на растворы индикаторов
фиолетовый
красный
оранжевый
розовый
лакмус
метилоранж
обусловлено наличием в них ионов Н +
Взаимодействие кислот с металлами
Zn + 2 HCI = ZnCI2 + h3 + Q
Zn +2H+ + 2Cl — = Zn 2+ + 2Cl — + h3
Zn + 2H+ = Zn 2+ + h3
Определите тип химической реакции.
металл + кислота = соль + водород
Продолжите уравнения химических реакций самостоятельно:
h3SO4 + Fe =
Zn
HCl
H 2
Na OH +H CI = Na CI + h3O
Na+ + OH — + H + + CI- = Na+ + CI — + h3O
Н+ + OH — = h3O
Определите тип химической реакции.
Продолжите уравнения химических реакций самостоятельно:
KOH + h3SO4 =
Cu(OH)2+ HNO3 =
NaOH
Фенол-
фталеин
HCl
+
NaCl
h3O
Взаимодействие кислот с основаниями
Основание + кислота = соль + вода
основный оксид + кислота = соль + вода
CuO + h3SO4 = CuSO4 + h3O
CuO + 2H+ + SO4 2- = Cu 2+ + SO4 2- + h3O
CuO + 2H+ = Cu 2+ + h3O
Определите тип химической реакции.
Продолжите уравнения химических реакций самостоятельно:
Zn O + HCl =
Na2O + HNO3 =
Взаимодействие кислот с основными и амфотерными оксидами
Cu O
Cu SO 4
h3O
Взаимодействие кислот с растворами солей
BaCI2+h3SO4 = BaSO4 + 2HCI
Ba2+ + 2CI- + 2Н+ + SО42- = BaSO4 + 2H + + 2CI-
B a2+ + SО42 — = B a SО4
Определите тип химической реакции.
Продолжите уравнения химических реакций самостоятельно:
HCl + CaCO3 =
HNO3 + Na2SO3 =
+
BaCI 2
H 2SO 4
Ba SO 4
HCI
соль + кислота = новая соль + новая кислота
h3CO3 = h3O + CO2
h3SO3 = h3O + SO2
h3SiO3 = h3O + SiO2
CO2
H 2CO 3
Разложение кислот
Некоторые кислоты
разлагаются при н.у. или при нагревании:
Способы получения кислот
1. Взаимодействие кислотных оксидов с водой:
P2O5+ 3h3O = 2h4PO4
SO3 + h3O = …
SO2 + h3O = …
СO2 + h3O = …
2. Взаимодействие водорода с соответствующим неметаллом:
h3+ CI2 = 2HCI
h3 + S = …
h3 + I2 = …
3. Взаимодействие концентрированных кислот с кристаллическими солями:
2NaCI + h3SO4 = Na2SO4 + 2HCI
КCI + h3SO4 = …
Проверьте свои знания (№1)
1. С какими из перечисленных веществ реагирует
С какими из перечисленных веществ реагирует
соляная кислота:
Ba(OH)2, AgNO3, Na Cl, Hg, Na2O, Fe, ZnO, CO2?
ZnSO4
ZnSO4 h3SO4 BaSO4
ZnSO4
2. Выполните цепочку превращений
(получите сульфат цинка разными способами).
Пора отправится в гости .Однако, чтобы попасть в дом, необходимо вспомнить адрес хозяев, их имена и фамилии.
1.Что общего у всех кислот:
h3SO4, HCL, h3CO3, HNO3, h4PO4, h3S ?
2.Чем различаются следующие кислоты?
h3CO3 и HCL, h3SO4 и h3S, h4PO4 и НF?
3. По какому ещё признаку можно разделить кислоты на группы?
Мы попали в комнату, где много гостей. Необходимо найти хозяев и выделить их
( выписать формулы кислот).
MgCL2, h3SO4, Ca(OH)2, CuSO4, h3O, HCL, Fe2O3, NaOH, HF, ZnCL2, h3CO3, MgO, O2, h4PO4, KOH, h3, h3SiO4.
Кислоты – большие затейники и решили поиграть с вами в игру «третий лишний»:
А) BaO, HNO3, HCL; B) Na2SO4,h3S,h3SO4;
Б) h3CO3, HF, h3O; Г) h4PO4, h3, h3SiO3.
Чтобы вы не скучали, кислоты придумали игру «Угадай».
Назовите номера практически возможных реакций.
1) AL+ HCL=
2) Cu + h3SO4=
3) CuO + h3SO4=
4) Ag + h4PO4=
5) KOH + HCL=
6) SO3 + h3SO4=
А теперь игра «Мои друзья».
могут ли одновременно находиться в растворе:
А) NaOH и KOH; в) Ca(OH)2 и HCL;
Б) NaOH и HNO3; г) Ba(OH)2 и LiOH.
Один рассеянный человек писал уравнения реакций и потерял свои записи, остались в памяти только продукты реакции. Помогите восстановить записи:
А) ? + ? = Na2SO4 + ? ;
Б) ? + ? =ZnCL2 + h3 ;
B) MgO + ? = MgSO4 + ? ;
Г) K2CO3 +? = KCL +? + ?
. С какой «тройкой» этих металлов может реагировать соляная кислота?
С какой «тройкой» этих металлов может реагировать соляная кислота?
a) Na, Ba, Ag;
б) K, Ca, Au;
в) Mg, AL, Zn;
г) Pb, Cr, Cu.
3. Закончите молекулярные уравнения возможных реакций
и запишите соответствующие им ионные уравнения:
Al2О3 + H Cl = H Cl + Cu S =
Mg + h3SO4 = FeCl 3 + KOH =
HNO3 + Zn SO4 = Ca CO3 + HNO3 =
4 Выполните цепочку превращений:
S SO2 SO3 h3SO4 CuSO4
CuSO4
CuSO4
Проверьте свои знания (№2)
Список литературы
1. Габриелян О.С. Химия 8.- М.: Дрофа, 2007.
2. Габриелян О.С., Решетов П.В., Остроумов И.Г., Никитюк А.М. Готовимся к единому государственному экзамену. — М.: Дрофа, 2003.
— М.: Дрофа, 2003.
3. Зеленин К.Н., Сергутина В.П., Солод О.В. Сдаем экзамен по химии. – ЭЛБИ-СПБ, 2005.
Автор проекта желает
всем успеха
в изучении данной темы !
Город на Волге — Сызрань
Скачать презентацию
Простые и сложные вещества
Простые вещества: молекулы состоят из атомов одного вида (атомов одного элемента).
Пример: h3, O2,Cl2, P4, Na, Cu, Au.
Сложные вещества (или химические соединения): молекулы состоят из атомов разного вида (атомов различных химических элементов).
Пример: h3O, Nh4, OF2, h3SO4, MgCl2, K2SO4.
Аллотропия — способность одного химического элемента образовывать несколько простых веществ, различающихся по строению и свойствам.
Пример:
- С — алмаз, графит, карбин, фуллерен.
- O — кислород, озон.
- S — ромбическая, моноклинная, пластическая.
- P — белый, красный, чёрный.

Явление аллотропии вызывается двумя причинами:
- Различным числом атомов в молекуле, например кислород O2 и озон O3.
- Образованием различных кристаллических форм, например алмаз, графит, карбин и фуллерен (смотри рисунок выше).
Основные классы неорганических веществ
Бинарные соединения
Вещества, состоящие из двух химических элементов называются бинарными (от лат. би – два) или двухэлементными.
Названия бинарных соединений образуют из двух слов – названий входящих в их состав химических элементов.
Первое слово обозначает электроотрицательную часть соединения – неметалл, его латинское название с суффиксом –ид стоит всегда в именительном падеже.
Второе слово обозначает электроположительную часть – металл или менее электроотрицательный элемент, его название стоит в родительном падеже, затем указывается степень окисления (только в том случае, если она переменная):
Запомни!
Bh4 — боран
B2H6 — диборан
Ch5 — метан
Sih5 — силан
Nh4 — аммиак
Ph4 — фосфин
Ash4 — арсин
Оксиды
Оксиды — сложные вещества, состоящие из двух химических элементов, один из которых кислород в степени окисления -2.
Общая формула оксидов: ЭхОу
Основные оксиды
Основные оксиды — оксиды, которым соответствуют основания.
Основные оксиды образованы металлом со степенью окисления +1, +2.
Пример
Соответствие основных оксидов и оснований
- Na2O — Na2(+1)O(-2) — NaOH
- MgO — Mg(+2)O(-2) — Mg(OH)2
- FeO — Fe(+2)O(-2) — Fe(OH)2
- MnO — Mn(+2)O(-2) — Mn(OH)2
Амфотерные оксиды
Амфотерные оксиды — оксиды, которые в зависимости от условий проявляют либо основные, либо кислотные свойства.
Амфотерные оксиды образованы металлом со степенью окисления +3, +4, а также некоторыми металлами (Zn, Be) со степенью окисления +2.
Пример
Al2(+3)O3(-2), Fe2(+3)O3(-2), Mn(+4)O2(-2), Zn(+2)O(-2), Be(+2)O(-2)
Кислотные оксиды
Кислотные оксиды — оксиды, которым соответствуют кислоты.
Кислотные оксиды образованы неметаллом, а также металлом со степенью окисления +5, +6, +7.
Пример
Соответствие кислотных оксидов и кислот
- SO3 — S(+6)O3(-2) — h3SO4
- N2O5 — N2(+5)O5(-2) — HNO3
- CrO3 — Cr(+6)O3(-2) — h3CrO4
- Mn2O7 — Mn2(+7)O7(-2) — HMnO4
Гидроксиды
Гидроксиды — сложные вещества, состоящие из трех элементов, два из которых водород со степенью окисления +1 и кислород со степенью окисления -2.
Общая формула гидроксидов: ЭхОуНz
Основания
Основания — сложные вещества, состоящие из ионов металла и одной или нескольких гидроксо-групп (ОН-).
В основаниях металл имеет степень окисления +1, +2 или вместо металла стоит ион аммония Nh5+
Пример
NaOH, Nh5OH, Ca(OH)2
Амфотерные гидроксиды
Амфотерные гидроксиды — сложные вещества, которые в зависимости от условий проявляют свойства оснований или кислот.
Амфотерные гидроксиды имеют металл со степенью окисления +3, +4, а также некоторые металлы (Zn, Be) со степенью окисления +2.
Пример
Zn(OH)2, Be(OH)2, Al(OH)3, Cr(OH)3
Кислоты
Кислоты — сложные вещества, состоящие из атомов водорода и кислотных остатков.
В состав кислот входит неметалл или металл со степенью окисления +5, +6, +7.
Пример
h3SO4, HNO3, h3Cr2O7, HMnO4
Соли
Соли- соединения, состоящие из катионов металлов (или Nh5+) и кислотных остатков.
Общая формула солей: MexAcy
- Me — металл
- Ac — кислотный остаток
Пример
KNO3 — нитрат калия
(Nh5)2SO4 — сульфат аммония
Mg(NO3)2 — нитрат магния
Названия кислот и кислотных остатков
| Кислота | Кислотный остаток | ||
| Название | Формула | Название | Формула |
| Соляная (хлороводородная) | HCl | Хлорид | Cl(-) |
| Плавиковая (фтороводородная) | HF | Фторид | F(-) |
| Бромоводородная | HBr | Бромид | Br(-) |
| Иодоводородная | HI | Иодид | I(-) |
| Азотистая | HNO2 | Нитрит | NO2(-) |
| Азотная | HNO3 | Нитрат | NO3(-) |
| Сероводородная | h3S | Сульфид Гидросульфид | S(2-) HS(-) |
| Сернистая | h3SO3 | Сульфит Гидросульфит | SO3(2-) HSO3(-) |
| Серная | h3SO4 | Сульфат Гидросульфат | SO4(2-) HSO4(-) |
| Угольная | h3CO3 | Карбонат Гидрокарбонат | СО3(2-) НСО3(-) |
| Кремниевая | h3SiO3 | Силикат | SiO3(2-) |
| Ортофосфорная | h4PO4 | Ортофосфат Гидроортофосфат Дигидроортофосфат | РО4(3-) НРО4(2-) Н2РО4(-) |
| Муравьиная | НСООН | Формиат | НСОО(-) |
| Уксусная | СН3СООН | Ацетат | СН3СОО(-) |
Полезные ссылки
Источник материала
Классификация неорганических веществ (видео)
Классификация неорганических веществ. Сложные вопросы (видео)
Сложные вопросы (видео)
Кислотные оксиды (видео)
Основные оксиды (видео)
Основания (видео)
Характеристика солей (видео)
Дополнительные материалы
Классификация и номенклатура неорганических веществ (видео)
Классификация соединений (видео)
Аллотропные формы углерода (видео)
Скорость реакции магния с соляной кислотой | Эксперимент
- Четыре из пяти
Магний реагирует с разбавленной соляной кислотой в конической колбе, соединенной с перевернутым мерным цилиндром в ванне с водой. Объем произведенного газообразного водорода измеряется в течение нескольких минут, и результаты используются для построения графика 9.0018
Это предназначено для практических занятий. Лучше всего, если учащиеся будут работать в парах, потому что для установки и начала эксперимента требуется более одной пары рук. Один учащийся может добавить магниевую ленту в кислоту и закупорить колбу, а другой запускает секундомер. Во время эксперимента один ученик может снимать показания, а другой записывать их. Сам эксперимент занимает всего несколько минут. Но дайте учащимся хотя бы 30 минут на настройку, снятие показаний и построение графика.
Лучше всего, если учащиеся будут работать в парах, потому что для установки и начала эксперимента требуется более одной пары рук. Один учащийся может добавить магниевую ленту в кислоту и закупорить колбу, а другой запускает секундомер. Во время эксперимента один ученик может снимать показания, а другой записывать их. Сам эксперимент занимает всего несколько минут. Но дайте учащимся хотя бы 30 минут на настройку, снятие показаний и построение графика.
В ходе эксперимента образуется газообразный водород (чрезвычайно легковоспламеняющийся). Учащиеся не должны иметь доступа к каким-либо источникам воспламенения.
Оборудование
Аппаратура
- Защита глаз
- Коническая колба (100 см 3 )
- Резиновая пробка с одним отверстием и напорная трубка для конической колбы (примечание 1)
- Корыто или пластмассовая чаша для мытья посуды (примечание 2)
- Мерные цилиндры (100 см 3 ), 2 шт.
- Стойка зажима, втулка и зажим
- Секундомер
- Миллиметровая бумага
Примечания к аппарату
- Пробки в колбах должны быть резиновыми.
 Пробки слишком пористые и будут протекать. Трубка через пробку должна быть коротким стеклянным отрезком, затем можно подсоединить гибкую резиновую трубку.
Пробки слишком пористые и будут протекать. Трубка через пробку должна быть коротким стеклянным отрезком, затем можно подсоединить гибкую резиновую трубку. - Газовые шприцы можно использовать вместо корыт с водой и мерных цилиндров. Но они очень дороги и, вероятно, лучше всего используются учителем в демонстрации. Шприцы не должны намокать, иначе поршень застрянет внутри ствола.
Химикаты
- Магниевая лента, нарезанная на отрезки по 3 см
- Разбавленная соляная кислота, 1M
Примечания по охране труда и технике безопасности
- Ознакомьтесь с нашим стандартным руководством по охране труда и технике безопасности
- Всегда используйте защитные очки. Убедитесь, что нет открытого огня.
- Лента из магния, Mg(s) — см. CLEAPSS Hazcard HC59a . Магниевая лента должна быть чистой и не иметь очевидных следов коррозии или окисления. При необходимости очистите, протирая отрезки ленты мелкой наждачной бумагой, чтобы удалить слой окисления.

- Соляная кислота, HCl (водн.) — см. карту опасности CLEAPSS HC47a и книгу рецептов CLEAPSS RB043. Соляная кислота должна быть около 1М для разумной скорости реакции. Для каждого эксперимента потребуется 50 см 3 . Несмотря на низкую опасность, защита глаз необходима, так как вы можете получить брызги, когда крошечные пузырьки лопнут.
- Газообразный водород, H 2 (g) (ЧРЕЗВЫЧАЙНО ОГНЕОПАСНЫЙ) – см. CLEAPSS Hazcard HC048 . Убедитесь, что все открытое пламя потушено и что у учащихся нет других источников воспламенения.
Процедура
- Отмерьте 50 см 3 1М соляной кислоты, используя один из мерных цилиндров. Налейте кислоту в коническую колбу 3 вместимостью 100 см.
- Установите аппарат, как показано на схеме. Наполовину заполните корыто или миску водой.
- Наполните другой мерный цилиндр водой и убедитесь, что он остается наполненным водой, когда вы переворачиваете его вверх дном.

- Когда вы будете готовы, добавьте в колбу 3-сантиметровую полоску магниевой ленты, вставьте пробку обратно в колбу как можно быстрее и включите секундомер.
- Запишите объем выделяемого газообразного водорода через соответствующие интервалы (например, 10 секунд). Продолжайте отсчитывать время до тех пор, пока не перестанет выделяться газ.
Учебные заметки
Уравнение реакции: магний + соляная кислота → хлорид магния + водород
Mg(т) + 2HCl(водн.) → MgCl )
Учащиеся следят за скоростью реакции между магнием и кислотой, измеряя количество выделяющегося газа с 10-секундными интервалами.
3 см магниевой ленты обычно имеет массу 0,04 г и дает 40 см 3 водорода при реакции с избытком кислоты. 50 см 3 1М соляной кислоты представляет собой шестикратный избыток кислоты.
В этой реакции магний и кислота постепенно расходуются. Однако кислота находится в избытке, так что главным образом потеря магния (площадь поверхности становится меньше) вызывает изменение скорости.
Если построить график зависимости объема (ось Y) от времени (ось X), наклон графика будет самым крутым в начале. Это показывает, что реакция протекает быстрее всего в начале. Когда магний израсходован, показатель падает. Это видно на графике, поскольку наклон становится менее крутым, а затем выравнивается, когда реакция останавливается (когда больше не выделяется газ).
Реакция экзотермическая, но разбавленная кислота находится в избытке, и повышение температуры составляет всего порядка 3,5°C. Наблюдается некоторое ускорение скорости реакции из-за повышения температуры. Некоторые студенты могут заметить, что колба становится слегка теплой, и их можно спросить, как это повлияет на скорость реакции и как они могут адаптировать эксперимент, чтобы сделать его «справедливым испытанием».
Дополнительная информация
Это ресурс проекта «Практическая химия», разработанного Фондом Наффилда и Королевским химическим обществом. Эта коллекция из более чем 200 практических заданий демонстрирует широкий спектр химических концепций и процессов. Каждое задание содержит исчерпывающую информацию для учителей и техников, включая полные технические примечания и пошаговые инструкции. Практические занятия по химии сопровождают практические занятия по физике и практической биологии.
Каждое задание содержит исчерпывающую информацию для учителей и техников, включая полные технические примечания и пошаговые инструкции. Практические занятия по химии сопровождают практические занятия по физике и практической биологии.
Проверка здоровья и безопасности, 2016 г.
© Фонд Наффилда и Королевское химическое общество
- Четыре из пяти
Какой тип реакции представляет собой Mg S )+ 2HCl AQ? MgCl2 Aq )+ h3 G?
окислительно-восстановительная реакция
В этой реакции Mg ( s ) + 2 HCl ( водный раствор ) → MgCl 2 ( водный раствор ) + H 2 ( г ) металлический магний окисляется до катионов магния+, Mg2. Водород восстанавливается из водорода ионов Н+ в газообразный водород , h3 . Таким образом, мы можем заключить, что описанная выше реакция является окислительно-восстановительной реакцией .
Таким образом, мы можем заключить, что описанная выше реакция является окислительно-восстановительной реакцией .
реакция с одним замещением Уравнение Mg(s)+2HCl(aq) -> MgCl2(aq) + h3(g) является примером реакции какого типа? реакция однократного замещения.
окислительно-восстановительная реакция Это химическое уравнение описывает окислительно-восстановительную реакцию. Здесь металлический магний окисляется до катионов магния Mg2+. 18 декабря 2016 г.
Реакция между магнием и соляной кислотой объединяется с образованием соли хлорида магния и выделением газообразного водорода. Эта единственная реакция замещения является классическим примером реакции металла в кислоте с выделением газообразного водорода. 23 апреля 2014 г.
Это тип реакции синтеза. 27 февраля 2017 г.
Добавление металлического магния в соляную кислоту приводит к образованию газообразного водорода. Магний растворяется с образованием хлорида магния, MgCl2.
Химические свойства — это просто набор химических изменений, которые возможны для этого вещества. Для элемента магния (Mg) можно сказать, что химические свойства включают: реакцию с кислородом с образованием MgO. реакция с соляной кислотой с образованием MgCl2 и газообразного водорода (h3) 13 августа 2020 г.
Для элемента магния (Mg) можно сказать, что химические свойства включают: реакцию с кислородом с образованием MgO. реакция с соляной кислотой с образованием MgCl2 и газообразного водорода (h3) 13 августа 2020 г.
Реакция замещения Эта реакция называется реакцией замещения, так как она вытесняет медь, которая находится ниже в реакционном ряду, из раствора ее соли. !! 13 августа 2013 г.
Когда цинк реагирует с соляной кислотой, реакция сильно бурлит, так как образуется газообразный водород. … Цинк, реагируя с соляной кислотой, образует пузырьки газообразного водорода. 3 дня назад
Реакция экзотермическая, но избыток разбавленной кислоты и повышение температуры составляет всего порядка 3,5˚C.
Газообразный хлористый водород реагирует с активными металлами и их оксидами, гидроксидами и карбонатами с образованием хлоридов. Эти реакции легко протекают только в присутствии влаги. Полностью сухой хлористый водород очень нереакционноспособен.
экзотермическая реакция Магний отдает два электрона атомам кислорода с образованием этого порошкообразного продукта. Это экзотермическая реакция. Экзотермическая реакция — это термин, описывающий химическую реакцию, в которой происходит чистое выделение энергии (тепла). 05.06.2019
Это экзотермическая реакция. Экзотермическая реакция — это термин, описывающий химическую реакцию, в которой происходит чистое выделение энергии (тепла). 05.06.2019
Ответ: Что еще образуется при двойной реакции замещения нитрата серебра и сульфата калия? 2AgNO3 + K2SO4 → Ag2SO4 +. 06.01.2021
Zn + Cu(NO3)2. 3. ZnCu + 2NO3. 20.11.2018
Да, очевидно, что медь не будет реагировать с соляной кислотой по той простой причине, что она стоит ниже водорода в ряду реактивности. Таким образом, медь не может заменить водород в HCl с образованием CuCl2. Следовательно, когда медь (Cu) реагирует с соляной кислотой (HCl), реакции не будет.
50 см3 1М соляной кислоты – это шестикратный избыток кислоты. В этой реакции магний и кислота постепенно расходуются. Однако кислота находится в избытке, так что главным образом потеря магния (площадь поверхности становится меньше) вызывает изменение скорости.
Реакция между металлическим магнием и соляной кислотой является экзотермической, поскольку при ней выделяется энергия в виде тепла (повышение температуры). Энергия, необходимая для разрыва связей реагентов, была больше, чем энергия, необходимая для образования новых связей продуктов.
Энергия, необходимая для разрыва связей реагентов, была больше, чем энергия, необходимая для образования новых связей продуктов.
Да, следующее уравнение сбалансировано. Потому что Mg равен 1 с обеих сторон. 30.10.2020
Zn + HCl → ZnCl2 + h3. Уравнение слова: хлорид цинка + газообразный водород → цинк + соляная кислота. Тип химической реакции: Для этой реакции у нас есть комбинированная реакция. Стратегии балансировки: когда мы добавляем цинк в соляную кислоту, мы получаем хлорид цинка, соль и газообразный водород.
Приведет ли смесь магния и соляной кислоты к физическим или химическим изменениям? Если соляную кислоту смешать с магнием, это приведет к химическому изменению.
Соляная кислота реагирует с гидроксидом натрия с образованием хлорида натрия (соли) и воды. Хлорид натрия состоит из катионов Na+ из основания (NaOH) и анионов Cl- из кислоты (HCl). HCl+NaOH→h3O+NaCl. Бромид водорода реагирует с гидроксидом калия с образованием бромида калия (соли) и воды. 25 ноября 2010 г.
25 ноября 2010 г.
Смешивание пищевой соды, или NaHCO3, с соляной кислотой, или HCl, дает поваренную соль, NaCl, а также воду, H3O, и двуокись углерода, CO2. Эти эксперименты также могут продемонстрировать стехиометрию, которая касается реагентов и продуктов химических реакций.
Ответ: CuCl₂·2H₂O является лимитирующим реагентом. 20 февраля 2018 г.
Тип химической реакции: Для этой реакции у нас есть одна реакция замещения. Стратегии балансировки: это единственная реакция замещения. Чтобы сбалансировать эту реакцию, я рекомендую начать с AlCl3 при изменении коэффициента, чтобы получить четное число атомов хлора.
Несбалансированная реакция выглядит следующим образом: Рассматривая каждую половину реакции отдельно: Эта реакция показывает, что металлический алюминий окисляется с образованием иона алюминия с зарядом +3. Приведенная ниже полуреакция показывает, что кислород восстанавливается с образованием двух (2) ионов кислорода, каждый из которых имеет заряд -2.
Цинк реагирует с соляной кислотой с образованием водного раствора хлорида цинка и водорода (рисунок ниже). В реакции замещения водорода водород в кислоте заменяется активным металлом. 4 дня назад
Металлическая медь и ртуть не реагируют с разбавленной соляной кислотой, так как идут после водорода в ряду активности, т.е. не могут заменить водород из соляной кислоты.
Серебро, например, растворится в соляной кислоты или HCl с образованием хлорида серебра или AgCl. Однако хлорид серебра нерастворим в воде, а это означает, что в полученном растворе образуется белое твердое вещество из кристаллов AgCl. … Реакция азотной кислоты и серебра дает удушливые оранжевые пары оксида азота. 24 апреля 2017 г.
Чтобы растопить кубик льда, требуется тепло, поэтому процесс эндотермический. Эндотермическая реакция В эндотермической реакции продукты обладают большей энергией, чем реагенты. Следовательно, изменение энтальпии положительно, и реакция поглощает тепло из окружающей среды.
Экзотермический процесс высвобождает тепло, вызывая повышение температуры в непосредственной близости. Эндотермический процесс поглощает тепло и охлаждает окружающую среду».
Приготовление яйца является эндотермическим процессом, потому что добавленная энергия делает его приготовленным. Яйцо без тепла остается (сырым) яйцом. В этой реакции энергия поглощается.
Когда уксус смешивается с солью, уксусная кислота в уксусе реагирует с хлоридом натрия или солью с образованием ацетата натрия и соляной кислоты. Соляная кислота является сильной кислотой.
15.5. Концентрированная соляная кислота (HCl) является наиболее часто используемой галогеновой кислотой для растворения геологических образцов. В отличие от HNO3, HCl является слабой восстановительной кислотой и обычно не используется для разложения органических материалов. Это отличный растворитель для карбонатов, фосфатов, многих оксидов металлов и металлов.
При растворении HCl в воде образуются ионы H и Cl. Водород теряет электрон (становится ионом с зарядом +1), а хлор приобретает электрон (становится ионом с зарядом -1). Сильные кислоты, такие как HCl, выделяют в воду гораздо больше ионов водорода, чем слабые кислоты, такие как уксус или лимонный сок.
Водород теряет электрон (становится ионом с зарядом +1), а хлор приобретает электрон (становится ионом с зарядом -1). Сильные кислоты, такие как HCl, выделяют в воду гораздо больше ионов водорода, чем слабые кислоты, такие как уксус или лимонный сок.
реакция синтеза Этот тип реакции называется реакцией синтеза. Это когда два или более реагента объединяются, образуя один новый сложный продукт. Реагентами являются магний (Mg) и кислород (O₂). Продуктом реакции является оксид магния (MgO). 6 августа 2016 г.
реакция с одной заменой 2 Ответы экспертов-репетиторов Эта реакция является реакцией с одной заменой. 16 ноября 2015 г.
Разложение (a) Разложение: вещество распадается на более мелкие частицы. [например. CaCO3(т) → CaO(т) + CO2(г) Разложение известняка на оксид кальция (негашеную известь) и диоксид углерода при нагревании.]
реакция двойного замещения Следующая реакция является примером того, какой тип реакции: NaCl + AgNO3 дает AgCl + NaNO3. Поскольку между реагентами происходит обмен ионами, это реакция двойного замещения.
Реакция синтеза — это тип реакции, в которой несколько реагентов объединяются с образованием одного продукта. Реакции синтеза выделяют энергию в виде тепла и света, поэтому они экзотермические. … Если у вас есть только один продукт, без знака «плюс», это означает, что это реакция синтеза.
уравновешивает формулу уравнения по закону сохранения массы. коэффициенты — это изменения, а количество атомов подсчитывается с обеих сторон уравнения. когда изображения каждого атома одинаковы как для продуктов, так и для реагентов, уравнение сбалансировано.
Какой пример иллюстрирует химическое изменение? Когда перекись водорода пузырится, она претерпевает химические изменения.
Во-первых: коэффициенты дают количество молекул (или атомов), участвующих в реакции. В примере реакции две молекулы водорода реагируют с одной молекулой кислорода и производят две молекулы воды. Второе: коэффициенты дают количество молей каждого вещества, участвующего в реакции.
Почему природные полимеры не представляют такой серьезной проблемы на свалках, как синтетические полимеры? Природные полимеры биоразлагаемы, а синтетические полимеры не биоразлагаемы.
Железо, кадмий, кобальт, никель, олово и свинец не реагируют с водой, но соляная кислота растворяет их, вытесняя водород из HCl. Железо реагирует с хлористым водородом с образованием хлорида железа, FeCl2, иногда называемого хлоридом железа. 22 мая 2018 г.
Как сбалансировать: CuO + HCl = CuCl2 + h3O| Бреслин.org.
Медь является нереакционноспособным металлом и в нормальных условиях не реагирует с разбавленными кислотами. … Азотная кислота является окислителем, и реакция не является обычной реакцией кислота + металл. Продукты представляют собой оксиды азота вместо водорода. 3 января 2016 г.
Гидроксиды магния предотвращают реакцию магния с HCl, предотвращая встречу реагентов. Следовательно, полоску магния следует очищать от гидроксидов. Это помогает в выполнении правильной реакции. 5 ноября 2019 г.
Порошкообразный Mg имеет большую площадь поверхности по сравнению с лентой Mg, а увеличенная площадь поверхности обеспечивает лучшее взаимодействие с серной кислотой, и, следовательно, происходит больше реакции. поскольку порошок магния имеет меньшую площадь поверхности по сравнению с лентой магния, он быстрее реагирует в разбавленной серной кислоте. 28 июля 2013 г.
поскольку порошок магния имеет меньшую площадь поверхности по сравнению с лентой магния, он быстрее реагирует в разбавленной серной кислоте. 28 июля 2013 г.
HCl является сильной кислотой, так как почти полностью диссоциирует. Напротив, слабая кислота, такая как уксусная кислота (Ch4COOH), плохо диссоциирует в воде — многие ионы H+ остаются связанными внутри молекулы. Подводя итог: чем сильнее кислота, тем больше свободных ионов Н+ высвобождается в раствор.
Горящая магниевая лента излучает свет достаточной интенсивности, чтобы вызвать временную потерю зрения. Старайтесь не смотреть прямо на источник света. При горении магния на воздухе выделяется сильное тепло, которое может вызвать ожоги и инициировать возгорание легковоспламеняющихся материалов.
Реакции нейтрализации обычно экзотермические, поэтому ΔH имеет отрицательное значение. Измерение тепла осуществляется путем проведения реакции в специальном контейнере, называемом калориметром.
Эндотермическая реакция бикарбоната натрия с соляной кислотой. 26 марта 2000 г.
26 марта 2000 г.
Магний и соляная кислота реагируют по химическому уравнению: Mg + 2HCl => MgCl2 + h3. 16 мая 2017 г.
Чтобы сбалансировать химическое уравнение, необходимо убедиться, что количество атомов каждого элемента на стороне реагента равно количеству атомов каждого элемента на стороне продукта. Чтобы сделать обе стороны равными, вам нужно будет умножать количество атомов в каждом элементе, пока обе стороны не станут равными.
Здесь стехиометрический коэффициент HCl равен 5.
Металлический цинк легко реагирует с соляной кислотой с образованием газообразного водорода (h3) и хлорида цинка (ZnCl2). Любая химическая реакция либо производит, либо поглощает тепло. В химии этот эффект описывается как энтальпия реакции. 24 апреля 2017 г.
В поисках ограничивающего реагента — не ограничивайте нашу химию
Шаг первый: на основе коэффициентов реагентов (двух соединений) найдите соотношение.
Шаг второй: Найдите GFW каждого соединения (не объединяйте их).
Шаг третий: Найдите количество молей для каждого соединения. Вы можете сделать это, разделив количество граммов одного из соединений на его GFW (сделайте это для обоих соединений по отдельности).
Шаг четвертый. Возьмите отношение и перепишите его так, чтобы оно было отношением один к чему-то (1:?). Это делается путем деления обоих чисел в отношении на меньшее число в отношении.
Шаг пятый: Какое бы соединение ни было «одной частью» отношения, умножьте его количество молей на другое число в соотношении. Если произведение больше числа молей во втором соединении, то второе соединение является ограничивающим реагентом. Если произведение меньше числа молей во втором соединении, первое соединение является ограничивающим реагентом.
1) Для приведенного ниже сбалансированного уравнения определите предельный реагент для 48 г Mg при взаимодействии со 110 г HCl: Mg + 2HCl —> MgCl2 + h3
Шаг первый: на основе коэффициентов реагентов (двух соединений) найти соотношение.
Соотношение для этого уравнения будет 1:2 [магний (Mg): соляная кислота (HCl)]
Шаг второй: Найдите GFW каждого соединения (не комбинируйте их).
Mg: HCl:
мг — 1×24 = 24 г/моль ч — 1×1 = 1 г/моль
Cl- 1×35,5 = 35,5 г/моль
GFW Mg = 24 г/моль hcl = 36,5 г/моль
Шаг третий: Найдите количество молей для каждого соединения. Вы можете сделать это, разделив количество граммов одного из соединений на его GFW (сделайте это для обоих соединений по отдельности).
мг: HCl:
молей = 48 г/24GWF молей = 110 г/36,5GWF
= 2 молей = 3,01 молей
Шаг четвертый: Возьмите соотношение и повторно его, так что это на что -то к чему -то роту (1. :?). Это делается путем деления обоих чисел в отношении на меньшее число в отношении.
Для этого уравнения вам не нужно переписывать соотношение, потому что оно уже представляет собой соотношение 1 :2
Шаг пятый: Какое бы соединение ни было «одной частью» соотношения, умножьте его число молей на другое число в соотношении. Если произведение больше числа молей во втором соединении, то второе соединение является ограничивающим реагентом. Если произведение меньше числа молей во втором соединении, первое соединение является ограничивающим реагентом.
Если произведение больше числа молей во втором соединении, то второе соединение является ограничивающим реагентом. Если произведение меньше числа молей во втором соединении, первое соединение является ограничивающим реагентом.
На каждый 1 моль Mg требуется два моля HCl. Поскольку «одна часть» — это Mg, что составляет 2 моля, умножьте это на 2 (вторая часть соотношения). Когда вы умножаете их (2 моль х 2), вы получаете, что второе соединение должно иметь 4 моля, чтобы не было лимитирующего реагента. Поскольку второе соединение имеет только 3,01 моль, оно должно быть ограничивающим реагентом, поскольку 3,01 меньше 4. Следовательно, HCl является ограничивающим реагентом.
============================================== ====
2) Для приведенного ниже сбалансированного уравнения определите предельный реагент для 36 г Mg при взаимодействии со 146 г HCl: Mg + 2HCl —> MgCl2 + h3
Шаг первый: на основе коэффициентов реагентов (двух соединений) найти соотношение.
Соотношение для этого уравнения будет 1:2 [магний (Mg): соляная кислота (HCl)]
Шаг второй: Найдите GFW каждого соединения (не комбинируйте их).
Mg: HCl:
мг — 1×24 = 24 г/моль ч — 1×1 = 1 г/моль
Cl- 1×35,5 = 35,5 г/моль
GFW Mg = 24 г/моль hcl = 36,5 г/моль
Шаг третий: Шаг третий: Найдите количество молей для каждого соединения. Вы можете сделать это, разделив количество граммов одного из соединений на его GFW (сделайте это для обоих соединений по отдельности).
мг: HCl:
молей = 36 г/24GWF молей = 146 г/36,5GWF
= 1,5 молей = 4 моля
Шаг Четвертый: Возьмите соотношение и повторно его, что он один к чему -то (1 Ratio (1 Ratio (1 (1 Ratio (1 (1 Ratio (1 (1 Ratio (1 (1 Ratio (1. :?). Это делается путем деления обоих чисел в отношении на меньшее число в отношении.
Для этого уравнения вам не нужно переписывать соотношение, потому что оно уже представляет собой соотношение 1 :2
Шаг пятый: Какое бы соединение ни было «одной частью» соотношения, умножьте его число молей на другое число в соотношении. Если произведение больше числа молей во втором соединении, то второе соединение является ограничивающим реагентом. Если произведение меньше числа молей во втором соединении, первое соединение является ограничивающим реагентом.
На каждый 1 моль Mg требуется два моля HCl. Поскольку «одна часть» — это Mg, что составляет 1,5 моля, умножьте это на 2 (вторая часть соотношения). Когда вы умножаете их (1,5 моль х 2), вы получаете, что второе соединение должно иметь 3 моля, чтобы не было лимитирующего реагента. Поскольку второе соединение имеет 4 моля, это должно быть избытком, потому что 4 больше, чем 3. Следовательно, Mg является ограничивающим реагентом, поскольку HCl является избытком.
============================================== =====
3) Для приведенного ниже сбалансированного уравнения определите предельный реагент для 96 г Mg при взаимодействии с 292 г HCl: Mg + 2HCl —> MgCl2 + h3
Шаг первый: на основе коэффициентов реагентов (двух соединений) найти соотношение.
Соотношение для этого уравнения будет 1:2 [магний (Mg): соляная кислота (HCl)]
Шаг второй: Найдите GFW каждого соединения (не комбинируйте их). HCl:
мг — 1×24 = 24 г/моль ч — 1×1 = 1 г/моль
CL- 1×35,5 = 35,5 г/моль
GFW Mg = 24 г GFW Hcl = 36,5 г/моль
Шаг третий: Найдите количество молей для каждого соединения. Вы можете сделать это, разделив количество граммов одного из соединений на его GFW (сделайте это для обоих соединений по отдельности).
Mg: HCl:
moles = 96g/24GWF moles = 292g/36.5GWF
= 4 moles =8 moles
Step Four: Take the ratio and rewrite it so that it’s a one to something ratio (1 :?). Это делается путем деления обоих чисел в отношении на меньшее число в отношении.
Для этого уравнения вам не нужно переписывать соотношение, потому что оно уже представляет собой соотношение 1 :2
Шаг пятый: Какое бы соединение ни было «одной частью» соотношения, умножьте его число молей на другое число в соотношении. Если произведение больше числа молей во втором соединении, то второе соединение является ограничивающим реагентом. Если произведение меньше числа молей во втором соединении, первое соединение является ограничивающим реагентом.
На каждый 1 моль Mg требуется два моля HCl. Поскольку «одна часть» — это Mg, что составляет 4 моля, умножьте это на 2 (вторая часть соотношения). Когда вы умножаете их (4 моль х 2), вы получаете, что второе соединение должно иметь 8 молей, чтобы не было лимитирующего реагента. Поскольку второе соединение имеет 8 молей, оба соединения имеют количество молей, которое должно быть, чтобы не было ограничивающего реагента. Следовательно, это идеальное соотношение и нет ограничивающего реагента.
Открытые учебники | Siyavula
Загрузите наши открытые учебники в разных форматах, чтобы использовать их так, как вам удобно. Нажмите на обложку каждой книги, чтобы увидеть доступные для загрузки файлы на английском и африкаанс. Лучше, чем просто бесплатные, эти книги также имеют открытую лицензию! См. различные открытые лицензии для каждой загрузки и пояснения к лицензиям в нижней части страницы.
Математика
- Читать онлайн
Учебники
Английский
- 7A PDF (CC-BY-ND)
- 7B PDF (CC-BY-ND)
Африкаанс
- 7A PDF (CC-BY-ND)
- 7B PDF (CC-BY-ND)
- Читать онлайн
Учебники
Английский
- 8A PDF (CC-BY-ND)
- 8B PDF (CC-BY-ND)
Африкаанс
- 8A PDF (CC-BY-ND)
- 8B PDF (CC-BY-ND)
- Читать онлайн
Учебники
Английский
- 9A PDF (CC-BY-ND)
- 9B PDF (CC-BY-ND)
Африкаанс
- 9A PDF (CC-BY-ND)
- 9B PDF (CC-BY-ND)
- Читать онлайн
Учебники
Английский
- PDF (CC-BY-ND)
- ePUB (CC-BY-ND)
- ePUB (CC-BY)
Африкаанс
- PDF (CC-BY-ND)
- ePUB (CC-BY-ND)
- ePUB (CC-BY)
Пособия для учителя
Английский
- PDF (CC-BY-ND)
Африкаанс
- PDF (CC-BY-ND)
- Читать онлайн
Учебники
Английский
- PDF (CC-BY-ND)
- ePUB (CC-BY-ND)
- ePUB (CC-BY)
Африкаанс
- PDF (CC-BY-ND)
- ePUB (CC-BY-ND)
- ePUB (CC-BY)
Пособия для учителя
Английский
- PDF (CC-BY-ND)
Африкаанс
- PDF (CC-BY-ND)
- Читать онлайн
Учебники
Английский
- PDF (CC-BY-ND)
- ePUB (CC-BY-ND)
- ePUB (CC-BY)
Африкаанс
- PDF (CC-BY-ND)
- ePUB (CC-BY-ND)
- ePUB (CC-BY)
Пособия для учителя
Английский
- PDF (CC-BY-ND)
Африкаанс
- PDF (CC-BY-ND)
- Читать онлайн
Учебники
Английский
- PDF (CC-BY-ND)
- ePUB (CC-BY-ND)
- ePUB (CC-BY)
Африкаанс
- PDF (CC-BY-ND)
- ePUB (CC-BY-ND)
- ePUB (CC-BY)
Пособия для учителя
Английский
- PDF (CC-BY-ND)
Африкаанс
- PDF (CC-BY-ND)
Наука
- Читать онлайн
Учебники
Английский
- PDF (CC-BY-ND)
- ePUB (CC-BY-ND)
- ePUB (CC-BY)
Африкаанс
- PDF (CC-BY-ND)
Пособия для учителя
Английский
- PDF (CC-BY-ND)
Африкаанс
- PDF (CC-BY-ND)
- Читать онлайн
Учебники
Английский
- PDF (CC-BY-ND)
- ePUB (CC-BY-ND)
- ePUB (CC-BY)
Африкаанс
- PDF (CC-BY-ND)
- ePUB (CC-BY-ND)
- ePUB (CC-BY)
Пособия для учителя
Английский
- PDF (CC-BY-ND)
Африкаанс
- PDF (CC-BY-ND)
- Читать онлайн
Учебники
Английский
- PDF (CC-BY-ND)
- ePUB (CC-BY-ND)
- ePUB (CC-BY)
Африкаанс
- PDF (CC-BY-ND)
- ePUB (CC-BY-ND)
- ePUB (CC-BY)
Пособия для учителя
Английский
- PDF (CC-BY-ND)
Африкаанс
- PDF (CC-BY-ND)
- Читать онлайн
Учебники
Английский
- PDF (CC-BY-ND)
- ePUB (CC-BY-ND)
- ePUB (CC-BY)
Африкаанс
- PDF (CC-BY-ND)
- ePUB (CC-BY-ND)
- ePUB (CC-BY)
Пособия для учителя
Английский
- PDF (CC-BY-ND)
Африкаанс
- PDF (CC-BY-ND)
- Читать онлайн
Учебники
Пособия для учителя
Английский
Класс 7А
- PDF (CC-BY-ND)
Класс 7Б
- PDF (CC-BY-ND)
Африкаанс
Граад 7А
- PDF (CC-BY-ND)
Граад 7Б
- PDF (CC-BY-ND)
- Читать онлайн
Учебники
Пособия для учителя
Английский
Класс 8А
- PDF (CC-BY-ND)
Класс 8Б
- PDF (CC-BY-ND)
Африкаанс
Граад 8А
- PDF (CC-BY-ND)
Граад 8Б
- PDF (CC-BY-ND)
- Читать онлайн
Учебники
Пособия для учителя
Английский
Класс 9А
- PDF (CC-BY-ND)
Класс 9Б
- PDF (CC-BY-ND)
Африкаанс
Граад 9А
- PDF (CC-BY-ND)
Граад 9Б
- PDF (CC-BY-ND)
- Читать онлайн
Учебники
Пособия для учителя
Английский
Класс 4А
- PDF (CC-BY-ND)
Класс 4Б
- PDF (CC-BY-ND)
Африкаанс
Граад 4А
- PDF (CC-BY-ND)
Граад 4Б
- PDF (CC-BY-ND)
- Читать онлайн
Учебники
Пособия для учителя
Английский
Класс 5А
- PDF (CC-BY-ND)
Класс 5Б
- PDF (CC-BY-ND)
Африкаанс
Граад 5А
- PDF (CC-BY-ND)
Граад 5Б
- PDF (CC-BY-ND)
- Читать онлайн
Учебники
Пособия для учителя
Английский
Класс 6А
- PDF (CC-BY-ND)
Класс 6Б
- PDF (CC-BY-ND)
Африкаанс
Граад 6А
- PDF (CC-BY-ND)
Граад 6Б
- PDF (CC-BY-ND)
Лицензирование наших книг
Эти книги не только бесплатны, но и имеют открытую лицензию! Один и тот же контент, но разные версии (фирменные или нет) имеют разные лицензии, как объяснено:
CC-BY-ND (фирменные версии)
Вам разрешается и поощряется свободное копирование этих версий. Вы можете копировать, распечатывать и распространять их столько раз, сколько захотите. Вы можете загрузить их на свой мобильный телефон, iPad, ПК или флешку. Вы можете записать их на компакт-диск, отправить по электронной почте или загрузить на свой веб-сайт. Единственное ограничение заключается в том, что вы не можете каким-либо образом адаптировать или изменять эти версии учебников, их содержание или обложки, поскольку они содержат соответствующие бренды Siyavula, логотипы спонсоров и одобрены Департаментом базового образования. Для получения дополнительной информации посетите сайт Creative Commons Attribution-NoDerivs 3.0 Unported.
Вы можете копировать, распечатывать и распространять их столько раз, сколько захотите. Вы можете загрузить их на свой мобильный телефон, iPad, ПК или флешку. Вы можете записать их на компакт-диск, отправить по электронной почте или загрузить на свой веб-сайт. Единственное ограничение заключается в том, что вы не можете каким-либо образом адаптировать или изменять эти версии учебников, их содержание или обложки, поскольку они содержат соответствующие бренды Siyavula, логотипы спонсоров и одобрены Департаментом базового образования. Для получения дополнительной информации посетите сайт Creative Commons Attribution-NoDerivs 3.0 Unported.
Узнайте больше о спонсорстве и партнерстве с другими, которые сделали возможным выпуск каждого из открытых учебников.
CC-BY (версии без торговой марки)
Эти версии одного и того же контента без торговой марки доступны для вас, чтобы вы могли делиться ими, адаптировать, преобразовывать, изменять или развивать их любым способом, при этом единственным требованием является предоставление соответствующей ссылки на Siyavula. Для получения дополнительной информации посетите Creative Commons Attribution 3.0 Unported.
Для получения дополнительной информации посетите Creative Commons Attribution 3.0 Unported.
Когда металлический магний реагирует с соляной кислотой, образуются газообразный водород и хлорид магния? – Easyrwithpractice.com
Когда металлический магний реагирует с соляной кислотой, образуются газообразный водород и хлорид магния?
Контрольные вопросы
| Словесное уравнение | соляная кислота + магний → хлорид магния + газообразный водород |
|---|---|
| Химическое уравнение | 2 HCl + Mg → MgCl2 + h3 |
| Общее уравнение | кислота + металл → соль + водород |
Какой тип реакции Mg 2HCl → MgCl2 h3?
комбинированная реакция. Уравнение Mg(т)+2HCl(водн.) -> MgCl2(водн.) + h3(г) является примером реакции какого типа? реакция однократного замещения.
Когда магний реагирует с соляной кислотой, образуется газообразный водород?
При взаимодействии магния с соляной кислотой образуется газообразный водород: 2HCl + Mg → h3 + MgCl2.
Почему магний реагирует с HCl?
Это происходит потому, что магний более реакционноспособен, чем водород, поэтому он вытесняет его в хлоридном соединении. Магний окисляется, теряя два электрона. Водород восстанавливается из иона H+ в газ h3, когда к нему переносятся электроны из магния.
Является ли магний и соляная кислота химической реакцией?
Реакция между магнием и соляной кислотой объединяется с образованием соли хлорида магния и выделением газообразного водорода. Эта единственная реакция замещения является классическим примером реакции металла в кислоте с выделением газообразного водорода.
Какой газ образуется при реакции магния с HCl?
газообразный водород
Что образуется при реакции металлического магния с сильной кислотой?
Магний реагирует с кислотой с образованием ионов магния и газообразного водорода.
Почему магний и соляная кислота выделяют тепло?
Реакция между металлическим магнием и соляной кислотой является экзотермической, поскольку при ней выделяется энергия в виде тепла (повышение температуры). Энергия, необходимая для разрыва связей реагентов, была больше, чем энергия, необходимая для образования новых связей продуктов.
Энергия, необходимая для разрыва связей реагентов, была больше, чем энергия, необходимая для образования новых связей продуктов.
Что происходит, когда лента магния реагирует с соляной кислотой?
Когда лента магния реагирует с соляной кислотой, образуется хлорид магния и выделяется газообразный водород. Произойдет изменение температуры пробирки, легкое шипение пузырьков газа, затем полоска магния растворится в воде, оставив синеву.
Является ли магний и соляная кислота экзотермической реакцией?
Магний и соляная кислота являются экзотермическими при повышении температуры.
Что происходит, когда оксид магния реагирует с соляной кислотой?
Реакция с кислотами: Оксид магния реагирует с кислотами, как это предсказано для простого оксида металла. Например, он реагирует с теплой разбавленной соляной кислотой с образованием раствора хлорида магния.
Какой тип реакции оксида магния и соляной кислоты?
эндотермическая реакция
Растворяется ли оксид магния в соляной кислоте?
Оксид магния реагирует с кислотами так же, как и любой простой оксид металла. Например, он реагирует с теплой разбавленной соляной кислотой с образованием раствора хлорида магния.
Например, он реагирует с теплой разбавленной соляной кислотой с образованием раствора хлорида магния.
Как называется соль, образующаяся при реакции соляной кислоты с оксидом магния?
а) Реакция между гидроксидом магния и соляной кислотой является примером реакции нейтрализации. Ионы гидроксида и водорода будут объединяться, образуя воду. Остальные ионы объединяются, образуя соль нейтрализации. Соль – хлорид магния.
Какое другое обычное повседневное название кислотно-щелочной реакции?
реакция нейтрализации
Растворяется ли оксид магния в воде?
Кислота
Что происходит при растворении оксида магния в воде?
Гидроксид магния образуется в присутствии воды (MgO + h3O → Mg(OH)2), но его можно изменить путем нагревания для удаления влаги.
Какие изменения происходят при растворении оксида магния в воде?
Ответ. Здесь, в приведенной выше химической реакции, когда оксид магния реагирует с водой, он образует гидроксид магния. Это обратимая реакция. Эта реакция протекает в холодной воде.
Это обратимая реакция. Эта реакция протекает в холодной воде.
Какой тип реакции оксида магния и воды?
комбинированная реакция
При растворении оксида магния в воде образуется ?
Ответ: Оксид магния (MgO) в воде (h3O) будет реагировать с образованием гидроксида магния или Mg(OH)2.
Как называется растворение оксида магния в воде?
Ответ. Ответ: Оксид магния (MgO) в воде (h3O) будет реагировать с образованием гидроксида магния или Mg(OH)2.
Какое вещество образуется при растворении оксида магния в воде?
Гидроксид магния
При растворении оксида магния в воде образуется раствор какого цвета?
При растворении оксида магния в воде образующийся раствор * окрашивает красную лакмусовую бумагу в синюю.
Что произойдет, если зола магния растворится в воде, если раствор будет кислым или щелочным?
Золу, собранную после сжигания магниевой ленты, растворяют в воде с получением раствора X. Какова природа раствора X при его тестировании с помощью индикаторов? А) Синий лакмус окрашивается в красный цвет, а фенолфталеин — в розовый, следовательно, это кислый раствор.
Какова природа раствора X при его тестировании с помощью индикаторов? А) Синий лакмус окрашивается в красный цвет, а фенолфталеин — в розовый, следовательно, это кислый раствор.
Что происходит при растворении оксида магния в воде класса 7?
Когда мы растворяем оксид магния в воде, оксид магния соединяется с водой, образуя новое вещество, называемое гидроксидом магния. Новое вещество «гидроксид магния», образующееся при этом изменении, является основанием, которое превращает красную лакмусовую бумажку в синюю. Растворение оксида магния в воде представляет собой химическое изменение.
Что происходит при растворении оксида магния в воде, как действует этот раствор на лакмусовую бумажку?
Оксид магния является основным по своей природе, поэтому его водный раствор окрашивает красную лакмусовую бумагу в синий цвет.
В чем разница между MG и MgO?
Оксид магния — это тип минеральной добавки магния, которая в основном состоит из магния — на самом деле она содержит больше магния, чем другие добавки магния. Оксид магния получают путем сжигания магния чистым кислородом, но этот метод довольно затратный.
Оксид магния получают путем сжигания магния чистым кислородом, но этот метод довольно затратный.
Что образуется при взаимодействии магния с кислородом?
оксид магния
Какое наблюдение произойдет при добавлении двух капель раствора золы магния на синюю и красную лакмусовые бумажки?
Он окрашивает синий лакмус в красный цвет, а фенолфталеин в розовый, следовательно, это кислый раствор.
Решения NCERT для 10 класса. Глава 1. Химические реакции и уравнения.
Решения NCERT для 10 класса. Глава 1. Химические реакции и уравнения. Учащиеся, которые готовятся к экзаменам в 10 классе, должны пройти NCERT Solutions for Class 10 Science Chapter 1 Chemical Reactions and Equations. Все вопросы к упражнениям главы 1 «Химические реакции и уравнения» с решениями помогут вам пересмотреть всю программу и набрать больше баллов.
Вы также можете загрузить научное решение NCERT Solution Class 10, чтобы помочь вам пересмотреть полный учебный план и получить больше баллов на экзаменах.
Учащиеся также могут найти вводный текст NCERT, упражнения и вопросы в конце главы. Также работая над классом 10 по естественным наукам, глава 1, химические реакции и уравнения, решения NCERT будут наиболее полезными для учащихся, чтобы вовремя решать свои домашние задания и задания. Учащиеся также могут загрузить NCERT Solutions for Class 10 Science Chapter 1 Chemical Reactions and Equations в формате PDF, чтобы получить к ним доступ даже в автономном режиме. Кроме того, у вас также будет доступ ко всем БЕСПЛАТНЫМ PDF-файлам с учебными материалами и решениями, а также к абсолютно БЕСПЛАТНЫМ онлайн-тестам, чтобы повысить скорость решения проблем.
Решения NCERT для класса 10 Science Глава 1. Химические реакции и уравнения Решения NCERT для класса 10 Science, представленные здесь, разработаны нашими экспертами в предметной области простым и точным образом.
Решения NCERT для класса 10, наука, глава 1, химические реакции и уравнения
Прежде чем углубляться в детали NCERT Solutions, для класса 10, наука, глава 1, химические реакции и уравнения, давайте рассмотрим список тем и подтем в классе 10, наука. Глава 1 Химические реакции и уравнения :
Глава 1 Химические реакции и уравнения :
- Химические реакции и уравнения
- Химические уравнения
- Типы химических реакций
- Наблюдали ли вы за эффектами окислительных реакций в повседневной жизни? Жизнь?
Бесплатная загрузка NCERT Solutions for Class 10 Science Chapter 1 Chemical Reactions and Equations PDF на хинди Medium, а также на английском Medium для студентов CBSE, Uttarakhand, Bihar, MP Board, Gujarat Board и UP Board, которые используют книги NCERT на основе в обновленной программе CBSE для сессии 2019 г.-20.
- रासायनिक अभिकшить
- Химические реакции и уравнения, класс 10, интеллект-карта
- Химическое уравнение
- Окисление в повседневной жизни
- Типы химических реакций
NCERT Solutions for Class 10 Science Chapter 1 Intext Questions
Номер страницы: 6
Вопрос 1
Почему магниевую ленту необходимо очищать перед сжиганием на воздухе?
Ответ:
Магний покрывается слоем оксида магния при длительном нахождении на воздухе. Этот слой препятствует горению магния. Следовательно, его необходимо очистить перед сжиганием.
Этот слой препятствует горению магния. Следовательно, его необходимо очистить перед сжиганием.
Вопрос 2
Напишите сбалансированное уравнение для следующих химических реакций.
(i) Водород + Хлор → Хлороводород
(ii) Хлорид бария + Сульфат алюминия → Сульфат бария + Хлорид алюминия
(iii) Натрий + Вода → Гидроксид натрия + Водород
Ответ:
(i) H 2 + Cl 2 → 2HCl
(II) 3 Bacl 2 + AL 2 (SO 4 ) 3 → BASO 4 + 2 ALCL 3
(III) 2NA + 2H 9.0081 2 O → 2NaOH + H 2 ↑
Вопрос 3
Напишите сбалансированное химическое уравнение с символами состояния для следующих реакций:
(i) Растворы хлорида бария и сульфата натрия в воде реагируют с образованием нерастворимого сульфата бария и раствор хлорида натрия.
(ii) Раствор гидроксида натрия (в воде) реагирует с раствором соляной кислоты (в воде) с образованием раствора хлорида натрия и воды.
Ответ:
(i) BaCl 2 (водн.) + Na 2 SO 4 (водн.) → BaSO 4 (т) + 2NaCl (водн.)
(ii) NaOH (водн.) + HCl (водн.) → NaCl (водн.) + H 2 O(ж)
Номер страницы: 10
Вопрос 1
Раствор вещества «Х» используется для стирки белых вещей.
(i) Назовите вещество «X» и напишите его формулу.
(ii) Напишите реакцию вещества «X», указанного в (i) выше, с водой.
Ответ:
(i) Вещество, раствор которого в воде используется для побелки, представляет собой окись кальция (или негашеную известь). Его формула CaO.
Вопрос 2
Почему количество газа, собранного в одной из пробирок в учебнике Упражнение 1.7 (т. е. электролиз воды), вдвое превышает количество газа, собранного в другой? Назовите этот газ. [CBSE 2015 (Дели)]
Ответ:
В Упражнении 1.7 вода подвергается электролизу с получением газа H 2 на одном электроде и газа O 2 на другом электроде.
2H 2 O(ж) → 2H 2 (ж) + O 2 (ж)
Таким образом, две молекулы воды при электролизе дают две молекулы газообразного водорода и одну молекулу газообразного кислорода или, другими словами, количество собранного газообразного водорода будет вдвое больше, чем газообразного кислорода.
Номер страницы: 13
Вопрос 1
Почему меняется цвет раствора медного купороса, если в него окунуть железный гвоздь?
ИЛИ
Железный гвоздь погружают в раствор медного купороса примерно на 30 минут. Укажите наблюдаемое изменение окраски. Укажите причину изменения. [CBSE 2015 (Дели)]
Ответ:
Когда железный гвоздь погружают в раствор сульфата меди, происходит реакция замещения. Цвет раствора медного купороса тускнеет за счет образования светло-зеленого раствора железного купороса.
Вопрос 2
Приведите пример реакции двойного смещения, отличной от приведенной в Упражнении 1.10 (учебник NCERT).
Ответ:
Гидроксид натрия и соляная кислота реагируют с образованием хлорида натрия и воды.
Вопрос 3
Укажите вещества, которые окисляются и восстанавливаются в следующих реакциях.
(i) 4Na(т) + O 2 (г) → 2Na 2 O(т)
(ii) CuO (т) + H 2 (г) → Cu (т) + H 2 O(l)
Ответ:
(i) Вещества, которые окисляются, это Na, поскольку он получает кислород, а кислород восстанавливается.
(ii) Вещества, которые восстанавливаются, представляют собой Cu, поскольку водород окисляется по мере того, как он получает кислород.
Решения NCERT для класса 10 по естественным наукам Глава 1 Конец главы учебника Вопросы
Вопрос 1
Какие из приведенных ниже утверждений о реакции неверны?
2 PbO(s) + C(s) → 2Pb(s) + CO 2 (g)
(a) Свинец восстанавливается.
(b) Углекислый газ окисляется.
(c) Углерод окисляется.
(d) Оксид свинца восстанавливается.
(i) (a) и (b)
(ii) (a) и (c)
(iii) (a), (b) и (c)
(iv) Все
Ответ:
(i) (a) и (b)
Вопрос 2
Fe 2 O 3 + 2Al → Al 2 O 3 + 2Fe
Вышеприведенная реакция является примером реакции сочетания
(a) (
б) реакция двойного замещения
(в) реакция разложения
(г) реакция замещения
Ответ:
(г) Реакция смещения.
Вопрос 3
Что произойдет, если к железным опилкам добавить разбавленную соляную кислоту? Отметьте правильный ответ:
(а) Производится газообразный водород и хлорид железа.
(b) Производится газообразный хлор и гидроксид железа.
(c) Реакции не происходит.
(d) Производство соли железа и воды.
Ответ:
(а) Производится газообразный водород и хлорид железа.
Вопрос 4
Что такое сбалансированное химическое уравнение? Почему химические уравнения должны быть сбалансированы?
Ответ:
Сбалансированное химическое уравнение имеет равное количество атомов различных элементов в реагентах и продуктах.
Химические уравнения должны быть сбалансированы, чтобы удовлетворять закону сохранения массы.
Вопрос 5
Переведите следующие утверждения в химические уравнения и сбалансируйте их.
(a) Газообразный водород соединяется с азотом с образованием аммиака.
(b) Сероводород горит на воздухе с образованием воды и двуокиси серы.
(c) Хлорид бария реагирует с сульфатом алюминия с образованием хлорида алюминия и осадка сульфата бария.
(d) Металлический калий реагирует с водой с образованием гидроксида калия и газообразного водорода.
Ответ:
(а) 3H 2 (ж) + N 2 (ж) → 2NH 3 (ж)
(б) H 2 S (ж) + 3O 2 (ж) → SO 2 (г) + 2H 2 O(ж)
(в) 3BaCl 2 (водн.) + Al 2 (SO 4 ) 3 18 2 0 3 9 0 8 2 (водн.) (водн.) + 3BaSO 4 ↓(т)
(г) 2K (т) + 2H 2 O (ж) → 2KOH (водн.) + H 2 (g)
Вопрос 6
Уравновесьте следующие химические уравнения: б) NaOH + H 2 SO 4 → Na 2 SO 4 + H 2 O
(в) NaCl + AgNO 3 → AgCl + NaNO 3 2 + H 2 SO 4 → BaSO 4 + HCl
Ответ:
(a) 2HNO 3 + CA (OH) 2 → CA (№ 3 ) 2 + 2H 2 O
(B) 2NAOH + H 2 SO 4 → NA 2 SO 4 40082 → NA 2 SO 4 + 2 +2 +2 +2 +2 +2 +2 +2 +2 +2 +2 +2 +2 +2 + 2 + 2 + 2 + 2 SO 4 4 → NA 2 SO 4 4 → NA 2 SO 4 . 2H 2 O
2H 2 O
(C) NACL + AGNO 3 → AGCL + NANO 3
(D) BACL 2 + H 2 SO 4 → BASO 4 + 2HLE 4 → BASO 4 + 2HLE → BASO 4 + 2 + 2.
Напишите сбалансированные химические уравнения для следующих реакций:
(a) Гидроксид кальция + Углекислый газ → Карбонат кальция + Вода
(b) Цинк + нитрат серебра → нитрат цинка + серебро
(c) алюминий + хлорид меди → хлорид алюминия + медь
(d) хлорид бария + сульфат калия → сульфат бария + хлорид калия
Ответ:
(a) Ca ( OH) 2 + CO 2 → CACO 3 + H 2 O
(B) Zn + 2AGNO 3 → Zn (№ 3 ) 2 + 2 AG
(C) 2AL 2AL 2AL 2AL 2AL 2AL 2AL 2AL 2AL 2. + 3 CuCl 2 → 2AlCl 3 + 3 Cu
(г) BaCl 2 + K 2 SO 4 → BaSO 4 + 2KCl
Вопрос 8
Напишите сбалансированное химическое уравнение для следующего и укажите тип реакции в каждом случае:
(a) Бромид калия (водн. ) + иодид бария ( водный раствор → йодид калия (водный раствор) + барий
) + иодид бария ( водный раствор → йодид калия (водный раствор) + барий
(б) карбонат(ы) цинка → оксид(ы) цинка + диоксид углерода (г) бромид(ы)
(в) водород (г) + хлорид (г) → водород хлорид (г)
(г) Магний (тв) + соляная кислота (водн.) → хлорид магния (водн.) + водород (г)
Ответ:
(a) 2KBr (водн.) + Bal 2 (водн.) → 2Kl (водн.) + BaBr 2 (s)
Тип: Двойная реакция замещения
(b) ZnCO 3 (s) → ZnO (т) + CO 2 (г)
Тип: реакция разложения
(в) H 2 (г) + Cl 2 (г) → 2HCl(г)
Тип: реакция сочетания
(d) Mg (т) + 2HCl (водн.) → MgCl 2 (водн.) + H 2 (г)
Тип: реакция замещения
Вопрос 9
Что понимают под экзотермическими и эндотермическими реакциями? Приведите примеры.
Ответ:
Экзотермические реакции : Те реакции, в которых выделяется тепло, известны как экзотермические реакции. Экзотермическая реакция обозначается записью «+ Heat» в части уравнения, относящейся к продуктам.
Пример:
(i) C (s) + O 2 (g) → CO 2 (g) + Heat
(ii) N 2 (g) + 3H 2 (g) → 2Nh4 (g) + Тепло
Эндотермические реакции: Те реакции, в которых поглощается тепло, известны как эндотермические реакции. Эндотермическая реакция обычно обозначается записью «Тепло» на стороне продукта химического уравнения.
Примеры:
(i) C (s) + 2S (s) → CS 2 (l) – Тепло
(ii) N 2 (g) + O 2 (g) → 2NO(g) – Тепло
Вопрос 10
Почему дыхание считается экзотермической реакцией? Объяснять.
Ответ:
Дыхание является экзотермическим процессом, потому что при дыхании глюкоза соединяется с кислородом в клетках нашего тела с образованием углекислого газа и воды наряду с производством энергии.
Вопрос 11
Почему реакции разложения называются противоположными реакциям соединения? Напишите уравнения этих реакций.
Ответ:
В реакции разложения одно соединение распадается с образованием двух или более простых веществ.
Например:
В то время как в реакции соединения два или более вещества просто объединяются, образуя новое вещество.
Например:
Вопрос 12
Напишите по одному уравнению для каждой реакции разложения, при которой энергия поступает в виде тепла, света или электричества.
ИЛИ
Реакции разложения требуют энергии в виде тепла, света или электричества для разрушения реагентов. Напишите по одному уравнению для реакций разложения, в которых энергия поступает в виде тепла, света и электричества. [CBSE 2015 (Дели)]
Ответ:
Вопрос 13
В чем разница между реакциями смещения и двойного смещения? Напишите уравнения этих реакций.
Ответ:
В реакциях замещения более активный металл вытесняет из раствора менее активный металл. Например,
Fe(тв) + CuSO 4 (водн.) → Cu(тв) + FeSO 4 (водн.)
Это реакция замещения, при которой железо вытесняет медь из раствора.
В реакциях двойного замещения два реагента в растворе обмениваются ионами. Например,
Например,
AgNO 3 (водн.) + NaCl (водн.) → AgCl(т) + NaNO 3 (водн.)
Это реакция двойного замещения, при которой нитрат серебра и хлорид натрия обмениваются Cl – и NO 3 – иона между ними.
Вопрос 14
При аффинаже серебра извлечение серебра из раствора нитрата серебра включало замещение металлической медью. Запишите соответствующую реакцию.
Ответ:
Вопрос 15
Что вы подразумеваете под реакцией осаждения? Объясните, приведя примеры.
Ответ:
Реакция, при которой образуется нерастворимое твердое вещество, называемое осадком, которое отделяется от раствора, называется реакцией осаждения.
Пример: При смешивании раствора хлорида железа (III) и гидроксида аммония образуется коричневый осадок гидроксида железа (III).
Вопрос 16
Объясните следующее с точки зрения поступления или потери кислорода с двумя примерами в каждом:
(a) Окисление и
(b) Восстановление.
Ответ:
(а) Окисление: Присоединение кислорода к веществу называется окислением.
Пример:
(i) S(s) + O 2 (g) → SO 2 (g) (Добавление кислорода к сере)
(ii) 2Mg(s) + O 2 (g) → 2MgO(s) (Добавление кислорода к магнию)
(b) Восстановление : Удаление кислорода из вещества называется восстановлением.
Пример: (i) CuO + h3 \(\underrightarrow { Heat }\) Cu + H 2 O
Здесь оксид меди восстанавливается до меди, поскольку из оксида меди удаляется кислород.
(ii) ZnO + C → Zn + CO
Здесь оксид цинка восстанавливается до цинка, поскольку из оксида цинка удаляется кислород.
Вопрос 17
Элемент X блестящего коричневого цвета при нагревании на воздухе становится черным. Назовите элемент «X» и образовавшееся соединение черного цвета.
Ответ:
Элемент «X» — это медь (Cu).
Соединение черного цвета представляет собой оксид меди (CuO). Происходит реакция
Вопрос 18
Почему мы наносим краску на изделия из железа?
Ответ:
Краска не допускает контакта железных изделий с воздухом, водой и предохраняет железные изделия от повреждений, вызванных ржавлением.
Вопрос 19
Пищевые продукты, содержащие масла и жиры, продуваются азотом. Почему ?
Ответ:
Чтобы продукты оставались свежими и не подвергались окислению, продукты продуваются азотом.
Вопрос 20
Объясните следующие термины, используя по одному примеру для каждого (a) Коррозия, (b) Прогорклость.
Ответ:
(a) Коррозия: Это процесс, при котором металлы постепенно изъедаются под действием воздуха, влаги или химических веществ (например, кислот) на их поверхности.
Пример: Когда железо подвергается воздействию влажного воздуха в течение длительного периода времени, его поверхность покрывается коричневым чешуйчатым веществом, называемым ржавчиной. Ржавчина в основном представляет собой гидратированный оксид железа (III) [Fe 2 O 3 .xH 2 0].
(b) Прогорклость: Состояние, вызванное окислением жиров и масел в пищевых продуктах с неприятным запахом и вкусом, называется прогорклостью.
Прогорклость портит пищевые материалы, приготовленные в жирах и маслах, которые хранились в течение значительного времени, и делает их непригодными для употребления в пищу.
Прогорклость можно предотвратить, добавляя антиоксиданты в продукты, содержащие жиры и масла. Это также можно предотвратить, промыв жиро- и маслосодержащие продукты азотом перед запечатыванием.
| Доска | CBSE |
| Учебник | NCERT |
| Класс | Класс 10 |
| Субъект | Наука |
| Глава | Глава 1 |
| Название главы | Химические реакции и уравнения |
| Количество решенных вопросов | 28 |
| Категория | Решения NCERT |
Решения NCERT для науки 10 класса, глава 1 Химические реакции и уравнения
Решения NCERT для науки 10 класса (химия), глава 1 Химические реакции и уравнения являются частью решений NCERT для науки 10 класса. Здесь мы дали Class 10 Science NCERT Solutions Chapter 1.
Вопрос 1
Какие из данных утверждений о реакции ниже неверны?
а. Свинец восстанавливается
Свинец восстанавливается
b. Углекислый газ окисляется 903:20 с. Углерод окисляется
d. Оксид свинца восстанавливается
(i) (a) и (b)
(ii) (a) и (c)
(iii) (a), (b) и (c)
(iv) все
Решение:
(i) (a) и (b)
Вопрос 2
Приведенная выше реакция является примером реакции
(i). Комбинационная реакция
(ii). Реакция двойного замещения
(iii). Реакция разложения
(iv). Реакция замещения
Решение:
(iv) Реакция замещения
Вопрос 3
Что происходит, когда разбавленную соляную кислоту добавляют к железным пломбам? Отметьте правильный ответ. 903:20 а. Газообразный водород и хлорид железа производятся
b. Производится газообразный хлор и гидроксид железа
c. Реакции не происходит
d Образуются соль железа и вода
Решение:
Образуются газообразный водород и хлорид железа
Загрузить NCERT Solutions for Class 10 Science Chapter 1 Chemical Reactions and Equations PDF
Вопрос 4
Что такое сбалансированное химическое уравнение ? Почему химические уравнения должны быть сбалансированы?
Решение:
Уравнение химической реакции — это уравнение, в котором количество атомов для каждого элемента в реакции и общий заряд одинаковы как для реагентов, так и для продуктов. Другими словами, масса и заряд уравновешиваются по обе стороны реакции.
Другими словами, масса и заряд уравновешиваются по обе стороны реакции.
Вопрос 5
Переведите следующие утверждения в химические уравнения, а затем сбалансируйте их.
а. Газообразный водород соединяется с азотом с образованием аммиака
b. Сероводород горит на воздухе с образованием воды и двуокиси серы 90–320 c. Хлорид бария реагирует с сульфатом алюминия с образованием хлорида алюминия и осадка сульфата бария 90–320 d. Металлический калий реагирует с водой с образованием гидроксида калия и газообразного водорода
Решение:
a. 3Н 2 + Н 2 → 2NH 3
б. 2H 2 S + 3O 2 → 2H 2 O + 2SO 2
c. 3BaCl 2 + Al 2 (SO 4 ) 3 → 2AlCl 3 + 3BaSO 4
d. 2K + 2H 2 O → 2KOH + H 2
Вопрос 6
Уравновесьте следующие химические уравнения.
а. HNO 3 + Ca(OH) 2 → Ca(NO 3 ) 2 + H 2 O
b.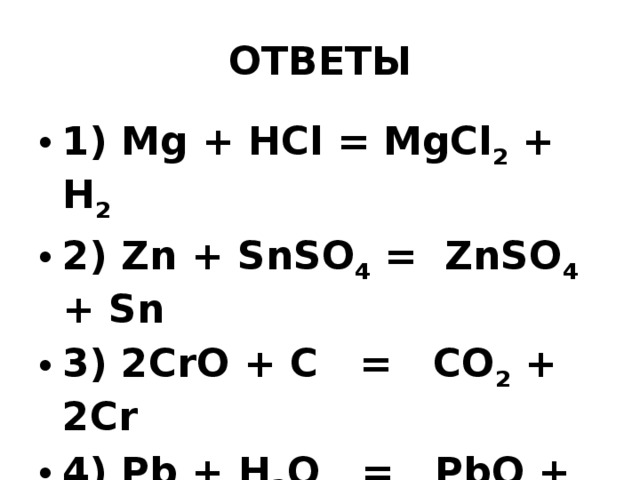 NaOH + H 2 SO 4 → Na 2 SO 4 + H 2 O
NaOH + H 2 SO 4 → Na 2 SO 4 + H 2 O
C. NaCl + AgNO 3 → AgCl + NaNO 3 903 BaCl 2 + H 2 SO 4 → BaSO 4 + HCl
Раствор:
a. 2HNO 3 + 2Ca(OH) 2 → Ca(NO 3 ) 2 + 2H 2 O
б. 6NaOH + 3H 2 SO 4 → 3Na 2 SO 4 + 6H 2 O
C. NaCl + AgNO 3 → AgCl + NaNO 3
d. BaCl 2 + H 2 SO 4 → BaSO 4 + 2HCl
Вопрос 7
Напишите сбалансированные химические уравнения для следующих реакций:
(a) Гидроксид кальция + Диоксид углерода → Карбонат кальция + Вода( б) Цинк + нитрат серебра → нитрат цинка + серебро (в) алюминий + хлорид меди → хлорид алюминия + медь (г) хлорид бария + сульфат калия → сульфат бария + хлорид калия Ответ: (а) Ca (OH)2 + CO2 → CaCO3 + h3O(b) Zn + 2AgNO3 → Zn(NO3)2 + 2 Ag(c) 2Al + 3 CuCl2 → 2AlCl3 + 3 Cu(d) BaCl2 + K2SO4 → BaSO4 + 2KCl
Вопрос 8
Напишите сбалансированное химическое уравнение для следующего и определите тип реакции в каждом случае.
Решение:
а. 2KBr + BaI 2 → 2KI + BaBr 2 — Двойная реакция смещения
б. ZnCO 3 → ZnO + CO 2 — Реакция разложения
c. H 2 + Cl 2 → 2HCl — Реакция сочетания
d. Mg + 2HCl → MgCl 2 + H 2 — Реакция замещения
Вопрос 9
Что понимают под экзотермическими и эндотермическими реакциями? Приведите примеры.
Решение:
Экзотермическая реакция — это реакция, при которой выделяется тепло.
Если 1 моль молекулы N 2 реагирует с 1 молем молекулы O 2 , то для инициирования реакции необходимо подать тепло 184 кДж, чтобы получить 1 моль молекулы NO. Это означает, что связи между N-N и O-O настолько прочны, что их нелегко разорвать. N 2 имеет тройную ковалентную связь между двумя атомами N. О 2 имеет двойную ковалентную связь. Таким образом, в реакцию необходимо вложить энергию, чтобы разорвать прочные связи. Таким образом, приведенная выше реакция является хорошим примером эндотермической реакции.
Таким образом, приведенная выше реакция является хорошим примером эндотермической реакции.
Вопрос 10
Почему дыхание считается экзотермической реакцией?
Решение:
Во время дыхания глюкоза соединяется с кислородом в клетках нашего тела с образованием углекислого газа и воды вместе с производством энергии.
Глюкоза + кислород → углекислый газ + вода + энергия
Это экзотермическая реакция, поскольку в ходе этого процесса вырабатывается энергия.
Вопрос 11
Почему реакции разложения называются противоположными реакциям соединения? Напишите уравнения реакций разложения.
Решение:
По сути, реакции разложения противоположны реакциям соединения. Соединение разлагается (т. е. «расщепляется») на два или более соединений и/или элементов. Например, оксид ртути (II) будет разлагаться на металлическую ртуть и кислород при нагревании:
2HgO → 2Hg + O 2
Поскольку для протекания этой реакции необходимо добавить тепло, это эндотермическая реакция. Большинство реакций разложения являются эндотермическими. Другим примером реакции разложения является нагревание карбоната кальция (раковины, мела):
Большинство реакций разложения являются эндотермическими. Другим примером реакции разложения является нагревание карбоната кальция (раковины, мела):
Вопрос 12
Напишите по одному уравнению для реакций разложения, в которых энергия передается в виде тепла, света или электричества?
Решение:
При нагревании карбонат кальция разлагается с образованием оксида кальция и диоксида углерода:
Вопрос 13
В чем разница между реакциями замещения и двойного замещения? Напишите соответствующие уравнения для приведенного выше?
Решение:
Разница между реакциями замещения и двойного замещения состоит в том, что в реакции замещения один элемент вытесняет другой в силу его большей реакционной способности, тогда как при двойном замещении два аниона и два катиона меняются местами между двумя соединениями соответственно.
Например:
CuSO 4 (водн.) + Zn(s) → ZnSO 4 + Cu(s)
Синий раствор сульфата меди при взаимодействии с твердым цинком дает бесцветный раствор сульфата цинка и твердую медь.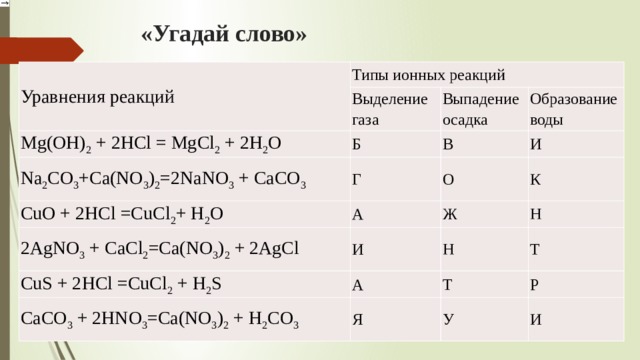 Таким образом, Zn вытесняет Cu в форме соли. Zn более активен, чем Cu.
Таким образом, Zn вытесняет Cu в форме соли. Zn более активен, чем Cu.
Примером реакции двойного замещения является реакция между карбонатом натрия и хлоридом кальция, оба в водном растворе.0081 3 (ppt) + 2NaCl(aq)
Вопрос 14
При аффинаже серебра извлечение серебра из раствора нитрата серебра включает замещение металлической медью. Запишите соответствующую реакцию.
Решение:
Вопрос 15
Что вы подразумеваете под реакцией осаждения? Объясните, приведя примеры:
Решение:
Реакция осаждения – это реакция, в которой растворимые ионы в отдельных растворах смешиваются друг с другом с образованием нерастворимого соединения, которое осаждается из раствора в виде твердого вещества. Это нерастворимое соединение называется осадком.
Пример реакции осаждения
Водный нитрат серебра (AgNO3) при добавлении к раствору, содержащему хлорид калия (KCl), выпадает в осадок белого твердого вещества, и наблюдается хлорид серебра.
AgNO 3 (водн. ) + KCl (водн.) → AgCl (тв.) + KNO 3 (водн.)
) + KCl (водн.) → AgCl (тв.) + KNO 3 (водн.)
Хлорид серебра (AgCl) представляет собой твердое вещество, осадок.
Вопрос 16
Блестящий коричневый элемент «X» при нагревании на воздухе становится черным. Назовите элемент «X» и образовавшееся соединение черного цвета.
Решение:
Блестящий коричневый элемент X представляет собой металлическую медь (Cu). Когда металлическая медь нагревается на воздухе, она образует сложный оксид меди черного цвета. Итак, соединение черного цвета — это оксид меди или оксид меди (II), CuO.
Вопрос 17
Почему мы красим изделия из железа?
Решение:
Ржавчина — это мягкое и пористое вещество, которое постепенно падает с поверхности железного предмета, а затем железо под ним начинает ржаветь. Таким образом, ржавление железа (или коррозия железа) представляет собой непрерывный процесс, который, если его вовремя не предотвратить, съедает весь железный предмет. Итак, когда мы наносим краску на железные изделия, она уменьшает ржавчину железа.
Итак, когда мы наносим краску на железные изделия, она уменьшает ржавчину железа.
Вопрос 18
Пищевые продукты, содержащие масла и жиры, продуваются азотом. Почему?
Решение:
Упаковка жиро- и маслосодержащих пищевых продуктов в газообразный азот может предотвратить прогорклость. Когда жиры и масла, присутствующие в пищевых материалах, окисляются (на воздухе), продукты их окисления имеют неприятный запах и вкус. Когда он окружен нереакционноспособным газом, азотом, нет кислорода (воздуха), чтобы вызвать его окисление и сделать его прогорклым.
Вопрос 19
Объясните следующие термины, используя по одному примеру. 903:20 а. Коррозия
б. Прогорклость
Решение:
а. Коррозия – это процесс, при котором металлы постепенно изнашиваются под действием воздуха, влаги или химических веществ на их поверхности. Коррозия вызывается главным образом окислением металлов кислородом воздуха.
Пример: Ржавление железа является наиболее распространенной формой коррозии. Когда железный предмет остается во влажном воздухе в течение значительного периода времени, он покрывается красно-коричневым хлопьевидным веществом, называемым «ржавчиной». Это называется ржавлением железа.
Когда железный предмет остается во влажном воздухе в течение значительного периода времени, он покрывается красно-коричневым хлопьевидным веществом, называемым «ржавчиной». Это называется ржавлением железа.
б. Состояние, вызванное воздушным окислением жира и масла в пище, которое характеризуется неприятным запахом и вкусом, называется прогорклостью.
Пример: Прогорклость можно замедлить, храня продукты в холодильнике.
В холодильнике низкая температура. Когда пища хранится в холодильнике, окисление жира и масла в ней замедляется из-за низкой температуры. Таким образом, развитие прогорклости вследствие окисления замедляется.
Вопрос 20
Почему магниевую ленту необходимо очищать перед сжиганием на воздухе?
Решение:
Для удаления оксидного слоя и облегчения быстрого горения.
Вопрос 21
Напишите сбалансированное уравнение для следующих химических реакций.
я. Водород + хлорид → хлористый водород
ii. Хлорид бария + сульфат алюминия → сульфат бария + хлорид алюминия
iii. Натрий + вода → гидроксид натрия + водород
Натрий + вода → гидроксид натрия + водород
Раствор:
i. H 2 + Cl 2 → 2HCl
ii. 3BaCl 2 + Al 2 (SO 4 ) 3 → 3BaSO 4 + 2AlCl 3
iii. 2Na + 2H 2 O → 2NaOH + H 2
Вопрос 22
Напишите сбалансированное химическое уравнение и укажите символы для следующих реакций.
а. Растворы хлорида бария и сульфата натрия в воде реагируют с образованием нерастворимого сульфата бария и раствора хлорида натрия
b. Раствор гидроксида натрия (в воде) реагирует с раствором соляной кислоты (в воде) с образованием раствора хлорида натрия и воды.
Решение:
Вопрос 23
Раствор вещества «X» используется для стирки белья.
Назовите вещество «Х» и напишите его формулу.
(i) Напишите реакцию вещества «X; названный в (ii) выше с водой
Решение:
Вопрос 24
Почему цвет раствора медного купороса меняется, когда в него опускают железный гвоздь?
Решение:
В этой реакции железо вытесняет медь из раствора сульфата меди. Глубокий синий цвет раствора медного купороса тускнеет за счет образования светло-зеленого раствора железного купороса. На поверхности металлического железа образуется красно-коричневый налет металлической меди. Эта реакция замещения происходит потому, что железо более реакционноспособно, чем медь.
Глубокий синий цвет раствора медного купороса тускнеет за счет образования светло-зеленого раствора железного купороса. На поверхности металлического железа образуется красно-коричневый налет металлической меди. Эта реакция замещения происходит потому, что железо более реакционноспособно, чем медь.
Вопрос 25
Укажите вещества, которые окисляются и восстанавливаются в следующих реакциях.
я. 4Na(т) + O 2 (г) → 2Na 2 O(т)
ii. CuO(т) + H 2 (г) → Cu(т) + H 2 O(ж)
Раствор:
i. 4Na(т) + O 2 (г) → 2Na 2 O(т)
Здесь к натрию добавляется кислород. Присоединение кислорода называется окислением. Таким образом, окисляется натрий Na.
ii. CuO(т) + H 2 (g) → Cu(s) + H 2 O(l)
В этой реакции оксид меди (CuO) дает кислород, необходимый для окисления водорода; следовательно, оксид меди является окислителем. Водород отвечает за удаление кислорода из оксида меди; поэтому водород здесь является восстановителем.
NCERT Solutions for Class 10 Science Chapter 1 (MCQs) [по 1 отметке]
Вопрос 1.
При сильном нагревании кристаллов нитрата свинца в сухой пробирке
(a) кристаллы немедленно плавятся
(b) остается коричневый осадок
(c) в пробирке появляются белые пары
(d) остается желтый осадок
Ответ:
(b) Резкий запах, коричневые пары выделяются из-за газа NO 2 и остается коричневый остаток оксида свинца (PbO).
Вопрос 2.
В стакан с подкисленным раствором перманганата постепенно добавляли разбавленный раствор сульфата железа. Светло-фиолетовая окраска раствора тускнеет и, наконец, исчезает. Что из следующего является правильным объяснением наблюдения? [Пример NCERT]
(a) KMnO 4 – окислитель, окисляет FeSO 4
(b) FeSO 4 – окислитель и окисляет KMnO 4
(c) Цвет исчезает при разбавлении, нет идет реакция
(d) KMnO 4 является нестабильным соединением и разлагается в присутствии FeSO 4 до бесцветного соединения
Ответ:
(a) Перманганат калия (KMnO 4 ) в присутствии разб. H 2 SO 4 , т.е. в кислой среде действует как сильный окислитель. В кислой среде KMnO 4 окисляет сульфат железа до сульфата железа.
H 2 SO 4 , т.е. в кислой среде действует как сильный окислитель. В кислой среде KMnO 4 окисляет сульфат железа до сульфата железа.
Вопрос 3.
К гранулированному цинку, взятому в пробирку, добавляют разбавленную соляную кислоту. Фиксируются следующие наблюдения. Укажите правильное наблюдение.
(а) Поверхность металла становится блестящей
(б) Реакционная смесь мутнеет
(в) Регистрируется запах резко пахнущего газа
(г) Выделяется бесцветный газ без запаха
Ответ:
(г) Цинк металл реагирует с разб. HCl с образованием хлорида цинка и пузырьков бесцветного газообразного водорода без запаха.
Вопрос 4.
При сжигании магниевой ленты на воздухе образуется пепел
(а) черный
(б) белый
(в) желтый
(г) розовый
Ответ:
(б) Когда Mg лента сгорает на воздухе, образуется пепел оксида магния белого цвета.
2Mg(r) + O 2 (g) → 2MgO(f)
Вопрос 5.
Были взяты три стакана, обозначенные как A, B и C, каждый из которых содержал 25 мл воды. Небольшое количество NaOH, безводн. CuSO 4 и NaCl добавляли в стаканы A, B и C соответственно. Наблюдалось повышение температуры растворов, содержащихся в стаканах А и В, тогда как в стакане С температура раствора падала. Какое из следующих утверждений верно? 903:20 I. В стаканах А и В произошел экзотермический процесс.
II. В стаканах А и В происходил эндотермический процесс.
III. В стакане С произошел экзотермический процесс.
IV. В стакане С произошел эндотермический процесс. [NCERT Exemplar]
(a) Только I
(b) Только II
(c) I и IV
(d) II и III
Ответ:
(c) Как и в случае стаканов A и B, выделяется тепло , поэтому температура стала высокой, следовательно, это экзотермическая реакция, в то время как в стакане C тепло поглощается водой, поэтому температура падает, следовательно, это эндотермический процесс.
Вопрос 6.
Что из следующего потребуется для идентификации газа, выделяющегося при реакции разбавленной соляной кислоты с металлическим цинком?
(а) Красная лакмусовая бумажка
(б) рН-бумага
(в) Известковая вода
(г) Горящая лучина
Ответ:
(г) При взаимодействии с разд. HCl, металлический цинк образует хлорид цинка, и выделяется газообразный водород. Наличие газообразного водорода можно проверить по горящей осколке, поскольку газ H 4 сгорает в осколке с хлопком.
HCl, металлический цинк образует хлорид цинка, и выделяется газообразный водород. Наличие газообразного водорода можно проверить по горящей осколке, поскольку газ H 4 сгорает в осколке с хлопком.
Вопрос 7.
Погрузив железный гвоздь в раствор CuSO 4 на несколько минут, вы заметите, что
(а) реакция не происходит
(б) цвет раствора исчезает
(в) поверхность железа ногти приобретают черный налет
(г) цвет раствора меняется на зеленый
Ответ:
(б) Fe(s) + CuSO 4 (водн.) → FeSO 4 (водн.) + Cu(s)
Fe присутствует выше в ряду реакционной способности металлов. Следовательно, Fe вытесняет Cu из CuSO 4 решение. И цвет раствора тускнеет. Это пример реакции смещения.
Вопрос 8.
Что происходит при нагревании кристаллов сульфата железа? [CCE 2014]
(a) Выделяется газ с запахом горящей серы
(b) Газ не выделяется
(c) Выделяется газ коричневого цвета
(d) Выделяется бесцветный газ без запаха
Ответ:
( а) Зеленый цвет кристаллов сульфата железа меняется на коричневато-черный оксид железа и появляется запах горящей серы из-за SO 2 и SO 3 .
Вопрос 9.
Цвет осадка, образующегося при смешивании раствора хлорида бария с раствором сульфата натрия [CCE 2014]
(a) синий
(b) черный
(c) белый
(d) зеленый
Ответ :
(c) Это пример реакции двойного замещения, при которой образуется белый осадок сульфата бария.
Вопрос 10.
Как изменяется цвет при контакте газов после термического разложения железного купороса с подкисленным раствором бихромата калия?
(a) от зеленого до оранжевого
(b) от красного до бесцветного
(c) от оранжевого до зеленого
(d) от синего до зеленого
Ответ:
(c) Цвет меняется с оранжевого на зеленый из-за образования железа ( III) sulphate
NCERT Solutions for Class 10 Science Chapter 1 Chemical Reactions and Equations (Hindi Medium)
Class 10 Science Chemical Reactions and Equations Mind Map
Химическое уравнение
Представление химической реакции с помощью символов веществ в виде формул называется химическим уравнением.
Например, N 2 + 3H 2 ⇌ 2NH 3
Сбалансированное химическое уравнение
Сбалансированное химическое уравнение имеет одинаковое количество атомов каждого элемента, участвующих в реакции как слева, так и справа. Реакция.
Согласно закону сохранения массы, общая масса элементов, присутствующих в продуктах химической реакции, должна быть равна общей массе элементов, присутствующих в реагентах.
Уравновешивание химического уравнения
Общее количество атомов на правой стороне = Общее количество атомов на левой стороне.
FE 3 O 4 T H 2 → FE + H 2 0
[FE] FE 3 O 2 + H 2 → 3F + H 2 0 9081 2 → 3F + H 2 0
1 [0] 0 2 → 3F + H 2 0
1 [0] 0
1 [0] 0 2 → 3F + H 2 0 [0] 2 → 3F + H 2 0 . Fe 3 O 4 + H 2 → 3Fe + 4H 2 0
Fe 3 O 4 + H 2 → 3Fe + 4H 2 0
[H] Fe 3 O 4 + 4H 2 → 3Fe + 4H 2 0
Oxidation In Повседневная жизнь
Ржавчина
При взаимодействии железа с кислородом и влагой образуется красное вещество, называемое ржавчиной.
Коррозия
Металлы при контакте с кислородом, водой, кислотами или газами, присутствующими в воздухе, меняют свою поверхность. Это называется коррозией, например. черное покрытие на серебре и зеленое покрытие на меди.
Профилактика – окраска, гальванизация, промасливание, смазка
Прогорклость
Масла и жиры при воздействии воздуха изменяют вкус и запах. Это свойство известно как прогорклость.
Профилактика – добавление антиоксидантов, Вакуумная упаковка, охлаждение, продувка продуктов азотом
Превращение химического вещества в новое химическое вещество путем образования и разрыва связей между различными атомами известно как химическая реакция.
Реакция объединения
Когда два элемента или одно соединение и один элемент или два соединения объединяются с образованием нового продукта.
Foi Пример
• H 2 + CL 2 → 2HCL
• Zn + CUS0 4 → ZNS0 4 + CU
• NAOH + H 2 SO 4 → NA 2 SO 4 40081 40081 40081 40081 40082 4 40082 40082 40081 40082 4 40082 → NA 2 SO 40082 4 → NA 2 SO 40081 40081 40082. O
Экзотермические реакции
Реакции, производящие энергию, называются экзотермическими реакциями.
Большинство комбинированных реакций носят экзотермический характер.
Например: CaO + H 2 O → Ca(OH) 2 + Тепло
Окисление
Получение кислорода или удаление водорода называется окислением, например.
• Zn + O 2 → ZnO
• Mn + HCl → MnCl 2 + H 2
Восстановление
Получение водорода или удаление кислорода называется восстановлением.
напр. CuO + H 2 → Cu + H 2 0
Окислительно-восстановительные реакции
Химическая реакция, в которой одновременно происходят и окисление, и восстановление, называется окислительно-восстановительной реакцией.
Например,
CuO + H 2 → Cu + H 2 O
Реакция разложения
Когда соединение расщепляется на два или более простых продукта, например,
Реакция разложения требует энергии в виде тепла, света или электричества для разложения реакций
Эндотермические реакции
Реакции, требующие энергии для происходят так называемые эндотермические реакции.
Например:
Реакции замещения
Это происходит, когда более активный металл вытесняет менее активный металл. Например:
Fe + CuSO 4 → FeSO 4 + Cu
Реакции двойного замещения
В этих реакциях происходит обмен ионами между двумя реагентами с образованием новых соединений.
Реакция осаждения :
В некоторых реакциях образуется нерастворимая масса, известная как осадок, и такие реакции называются реакцией осаждения.
Например,
Na 2 SO 4 + BaCl 2 → 2NaCl + BaSO 4 Осадок
Возможности решений NCERT для класса 10 Глава 1 Наука Химические реакции и уравнения Учащиеся могут получить всестороннюю практику балансировки различных видов уравнений.
- Узнайте, как составить сбалансированное химическое уравнение, и узнайте о химических реакциях с помощью учебных ресурсов CBSE Class 10 по химии.
- NCERT Solution поможет вам правильно написать различные химические уравнения. Помогает вам тщательно попрактиковаться в решении вопросов различной сложности перед основным экзаменом.
- Наш обширный набор учебных материалов служит идеальным руководством при выполнении домашних заданий и подготовке к экзамену.
- На LearnCBSE.
 in наши эксперты помогут вам понять химию с помощью CBSE Class 10 Chemistry, таких как CBSE Class 10 Chemistry notes, MCQ и решений NCERT в соответствии с последней программой.
in наши эксперты помогут вам понять химию с помощью CBSE Class 10 Chemistry, таких как CBSE Class 10 Chemistry notes, MCQ и решений NCERT в соответствии с последней программой.
С помощью приложения LearnCBSE.in NCERT Solutions Learning на вашем мобильном телефоне вы сможете посещать БЕСПЛАТНЫЕ ЖИВЫЕ мастер-классы и БЕСПЛАТНЫЕ концептуальные видеоролики. Получите 100-процентное точное решение NCERT Book Solution для класса 10 по естественным наукам, глава 1 (химические реакции и уравнения), объясненное опытными преподавателями естественных наук.
Глубокие знания и хорошая практика помогут вам получить высшие оценки по вопросам, заданным в этой главе. Изучить основы химии в CBSE Class 10 теперь легко.
Теперь, когда вам предоставлена вся необходимая информация о решениях NCERT для химических реакций 10 Science Chapter 1, мы надеемся, что эти подробные решения NCERT будут вам полезны. Студенты также могут бесплатно ознакомиться с книгами NCERT, учебным планом CBSE, образцами документов CBSE, решениями RD Sharma на сайте LearnCBSE.


 Пробки слишком пористые и будут протекать. Трубка через пробку должна быть коротким стеклянным отрезком, затем можно подсоединить гибкую резиновую трубку.
Пробки слишком пористые и будут протекать. Трубка через пробку должна быть коротким стеклянным отрезком, затем можно подсоединить гибкую резиновую трубку.
