Ответы | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||
|
|
| |||||||||||||||||||||||||||||||||||||||||||||||||||
Посмотреть всех экспертов из раздела Учеба и наука
Пользуйтесь нашим приложением
что, как сбалансировать и часто задаваемые вопросы —
By Саина Наушад
Фторид водорода (HF) является слабой кислотой, а гидроксид калия (KOH) является сильным основанием. Теперь рассмотрим несколько фактов о реакции HF + KOH.
Теперь рассмотрим несколько фактов о реакции HF + KOH.
HF может существовать в виде бесцветного газа, дымящейся жидкости или в виде растворенного вещества в воде. Плавиковая кислота образуется при растворении HF в воде. Гидроксид калия используется в пищевых продуктах для регулирования pH, в качестве стабилизатора и загустителя. КОН также известен как едкий калий.
В этой статье описывается, как сбалансировать реакцию HF и KOH, продукт реакции, тип реакции, буферный раствор и многие другие аспекты реакции HF+KOH.
Что является продуктом HF и KOH?Когда HF и KOH реагируют, фторид калия (KF) и молекулы воды (H2О) образуются. Уравнение реакции выглядит следующим образом:
HF + KOH→KF + H2O
Какой тип реакции HF + KOH?Реакция HF + KOH является реакцией нейтрализации. В этом случае реакция протекает таким образом, что кислота (HF) и основание (KOH) количественно реагируют с образованием соли (KF) и воды в качестве продуктов. Реакция нейтрализации включает образование воды за счет комбинации H+ ионы и ОН– ионов.
Реакция нейтрализации включает образование воды за счет комбинации H+ ионы и ОН– ионов.
HF + KOH→KF + H2O
Как сбалансировать HF + KOH?Этапы приравнивания схемы реакции HF + KOH следующие:
- Уравнение считается сбалансированным, когда каждый элемент имеет одинаковое количество атомов как в реагенте, так и в продукте.
- С обеих сторон имеется 2 атома водорода, 1 атом кислорода, 1 атом фтора и 1 атом калия. Т.е. стороны реагента и продукта равны.
- HF + KOH→KF + H2O
- Следовательно, уравнение уравновешено.
Титрование HF и KOH классифицируется как кислотно-основное титрование. KOH — сильное основание, а HF — слабая кислота.
Устройство:В качестве аппарата используют бюретку, коническую колбу, штатив для бюретки, химический стакан, воронку и пипетку.
В этом случае в качестве индикатора используется фенолфталеин.
Процедура:- Заполните штатив для бюреток стандартизированным раствором КОН после промывки и ополаскивания водой.
- В коническую колбу пипеткой вносят 10 мл HF, затем 2-3 капли индикатора фенолфталеина.
- Начните добавлять раствор КОН в коническую колбу по каплям, пока она постоянно вращается.
- Когда раствор HF + KOH в конической колбе достигнет конечной точки, цвет изменится на светло-розовый.
- Чтобы получить соответствующие показания, повторите эти шаги.
- S1V1 = S2V2 – формула для расчета концентрации HF.
Суммарное ионное уравнение HF + KOH
Итоговое ионное уравнение для HF + KOH выглядит следующим образом:
HF (Водно) + OH–(Водно) →Ф–(Водно) + H2O (L)
- Первым шагом является балансировка приведенного молекулярного уравнения.
 Это уравнение, оно уже уравновешено.
Это уравнение, оно уже уравновешено. - HF + KOH→KF + H2O
- Обозначьте состояние каждого вещества как жидкое-XNUMX, твердое-с или водное-водное.
- HF (водн.) + KOH (водн.) → KF (водн.) + H2О (л)
- Разделить электролиты на ионы
- ВЧ + К+ + OH– → К+ + F– + H2O
- Сокращая ионы-спектаторы в обеих частях уравнения, получается чистое ионное уравнение.
- HF (Водно) + OH–(Водно) →Ф–(Водно) + H2O (L)
В реакции HF + KOH указанные сопряженные пары отличаются одним протоном:
- Сопряженное кислотно-щелочное пар в ВЧ ВЧ и Ф–.
- Компания сопряженная кислота сильного основания KOH это К+.

ВЧ + КОН реакция имеет следующие межмолекулярные силы,
- сильный водородная связь и диполь-дипольные взаимодействия – межмолекулярные силы в HF. Из-за присутствия сильно электроотрицательного атома фтора дипольные взаимодействия более заметны.
- KOH обладает лондонскими дисперсионными силами, диполь-дипольными силами и водородной связью.
Стандартная энтальпия реакции для HF + KOH составляет -5.66 кДж/моль. Значения энтальпии образования приведены ниже –
| Реагенты и продукты | Энтальпия в кДж/моль |
|---|---|
| HF | -332.36 кДж/моль |
| KOH | -482. 37 кДж/моль 37 кДж/моль |
| KF | -567.27 кДж/моль |
| H2O | -241.8 кДж/моль |
HF + KOH представляет собой буферный раствор. В этом случае фтористый водород (HF) — слабая кислота, а KF — соль, образованная слабой кислотой HF и сильным основанием KOH; таким образом, он образует буфер в водном растворе.
Является ли HF + KOH полной реакцией?HF + KOH является полной реакцией, поскольку после нейтрализации она дает KF и воду.
Является ли реакция HF + KOH экзотермической или эндотермической?HF + KOH представляет собой экзотермическая реакция. Поскольку отрицательная теплота образования означает, что энергия продуктов меньше энергии реагентов. В результате в ходе реакции выделяется энергия, и реакция является экзотермической.Экзотермическая реакция
В результате в ходе реакции выделяется энергия, и реакция является экзотермической.Экзотермическая реакция
Реакция HF + KOH не является окислительно-восстановительная реакция. Поскольку степени окисления всех элементов остаются одинаковыми до и после реакции
Является ли HF + KOH реакцией осаждения?HF + KOH не является реакцией осаждения. Поскольку по окончании реакции не образуется твердого продукта
Является ли реакция HF + KOH обратимой или необратимой?HF+ KOH является необратимым. Поскольку продукты больше не вступают в обратные реакции с образованием реагентов в аналогичных условиях
Является ли реакция замещения HF + KOH?Реакция HF + KOH является примером реакция двойного вытеснения. Потому что ОН– из KOH вытесняется в HF за счет удаления F–, КФ и Н2О образуются
Потому что ОН– из KOH вытесняется в HF за счет удаления F–, КФ и Н2О образуются
В этой статье освещается реакция между HF и KOH. KF можно использовать в органической химии для преобразования хлоруглеродов во фторуглероды. Гидроксид калия используется в широком спектре химических, промышленных и производственных процессов.
What, How to Balance & FAQs —
By Saina Naushad
Фторид водорода (HF) является слабой кислотой, а гидроксид калия (KOH) является сильным основанием. Теперь давайте рассмотрим несколько фактов о реакции HF + KOH.
HF может существовать в виде бесцветного газа, дымящейся жидкости или в виде растворенного в воде вещества. Плавиковая кислота образуется при растворении HF в воде. Гидроксид калия используется в пищевых продуктах для регулирования pH, в качестве стабилизатора и загустителя. КОН также известен как едкий калий.
В этой статье описывается, как сбалансировать реакцию HF и KOH, продукт реакции, тип реакции, буферный раствор и многие другие аспекты реакции HF+KOH.
При взаимодействии HF и KOH образуются фторид калия (KF) и молекулы воды (H 2 O). Уравнение реакции выглядит следующим образом:
HF + KOH→KF + H 2 O
Какой тип реакции HF + KOH?Реакция HF + KOH является реакцией нейтрализации. В этом случае реакция протекает таким образом, что кислота (HF) и основание (KOH) количественно реагируют с образованием соли (KF) и воды в качестве продуктов. Реакция нейтрализации включает образование воды при соединении ионов Н + и ионов ОН – .
HF + KOH→KF + H 2 O
Как сбалансировать HF + KOH?Этапы уравнивания схемы реакции HF + KOH следующие:
- Уравнение считается сбалансированным, если каждый элемент имеет одинаковое количество атомов как в реагенте, так и в продукте.

- С обеих сторон 2 атома водорода, 1 атом кислорода, 1 атом фтора и 1 атом калия. То есть стороны реагента и продукта равны.
- HF + KOH→KF + H 2 O
- Следовательно, уравнение сбалансировано.
Титрование HF и KOH классифицируется как кислотно-щелочное титрование. KOH — сильное основание, а HF — слабая кислота.
Аппаратура:В качестве аппарата используются бюретка, коническая колба, штатив для бюретки, химический стакан, воронка и пипетка.
Используемый индикатор:В данном случае в качестве индикатора используется фенолфталеин.
Процедура:- Заполните штатив для бюретки стандартизированным раствором КОН после промывки и ополаскивания водой.

- Внесите пипеткой 10 мл HF в коническую колбу, затем добавьте 2-3 капли индикатора фенолфталеина.
- Начните добавлять раствор КОН в коническую колбу по каплям, пока она постоянно вращается.
- Когда раствор HF + KOH в конической колбе достигнет конечной точки, цвет изменится на светло-розовый.
- Чтобы получить соответствующие показания, повторите эти шаги.
- S1V1 = S2V2 – формула для расчета концентрации HF.
HF + KOH net ionic equation
The net ionic equation for HF + KOH is as follows:
HF (aq) + OH – (aq) →F – (водн.) + H 2 O (л)
- Первым шагом является балансировка представленного молекулярного уравнения.
 Это уравнение, оно уже уравновешено.
Это уравнение, оно уже уравновешено. - HF + KOH→KF + H 2 O
- Обозначьте состояние каждого вещества как жидкое-1, твердое-с или водное-водное.
- HF (водн.) + KOH (водн.) → KF (водн.) + H 2 O (ж)
- Разделить электролиты на ионы
- HF + 4OH 900 → K + + F – + H 2 O
- Путем исключения ионов-спектаторов в обеих частях уравнения получается результирующее ионное уравнение.
- HF (aq) + OH – (aq) →F – (aq) + H 2 O (l)
В реакции HF + KOH упомянутые конъюгатные пары различаются по одному протону:
- Спряжение с кислотной базой в HF- HF и F —.

- конъюгированная кислота сильного основания KOH есть K + .
HF + KOH реакция имеет следующие межмолекулярные силы,
- Из-за присутствия сильно электроотрицательного атома фтора дипольные взаимодействия более заметны.
- KOH обладает лондонскими дисперсионными силами, диполь-дипольными силами и водородной связью.
Стандартная энтальпия реакции для HF + KOH составляет -5,66 кДж/моль. Значения энтальпии формирования приведены ниже —
| Реагенты и продукты | Энтальпия в KJ/MOL |
|---|---|
| 93 | |
| KOH | -482.37 kJ/mol |
| KF | -567.27 kJ/mol |
| H 2 O | -241.8 kJ/mol |
HF + KOH представляет собой буферный раствор. В этом случае фтористый водород (HF) — слабая кислота, а KF — соль, образованная слабой кислотой HF и сильным основанием KOH; таким образом, он образует буфер в водном растворе.
Является ли HF + KOH полной реакцией?HF + KOH является полной реакцией, поскольку после нейтрализации образуется KF и вода.
Является ли реакция HF + KOH экзотермической или эндотермической? HF + KOH является экзотермической реакцией. Поскольку отрицательная теплота образования означает, что энергия продуктов меньше энергии реагентов. В результате в ходе реакции выделяется энергия, и реакция является экзотермической. Экзотермическая реакция
Поскольку отрицательная теплота образования означает, что энергия продуктов меньше энергии реагентов. В результате в ходе реакции выделяется энергия, и реакция является экзотермической. Экзотермическая реакция
Реакция HF + KOH не является окислительно-восстановительной реакцией. Поскольку степени окисления всех элементов остаются одинаковыми до и после реакции
Является ли HF + KOH реакцией осаждения?HF + KOH не является реакцией осаждения . Поскольку по завершении реакции не образуется твердого продукта
Является ли реакция HF + KOH обратимой или необратимой?HF+ KOH необратим. Поскольку продукты больше не вступают в обратные реакции с образованием реагентов в аналогичных условиях
Является ли реакция замещения HF + KOH? Реакция HF + KOH является примером реакции двойного замещения. Поскольку OH – из KOH вытесняется в HF при удалении F – , образуются KF и H 2 O
Поскольку OH – из KOH вытесняется в HF при удалении F – , образуются KF и H 2 O
В этой статье рассматривается реакция между HF и KOH. KF можно использовать в органической химии для преобразования хлоруглеродов во фторуглероды. Гидроксид калия используется в широком спектре химических, промышленных и производственных процессов.
кислотно-щелочное определение рН среди HF и KOH
Задавать вопрос
спросил
Изменено 2 года, 9 месяцев назад
Просмотрено 6к раз
$\begingroup$
Хорошо, я столкнулся с этим вопросом в домашнем задании.
100,0 мл образца 0,20 М HF титруют 0,10 М КОН. Определите рН раствора после добавления 200 мл КОН. Ка ВЧ составляет 3,5 х 10-4?
О да, это множественный выбор
- 3,46
- 10,54
- 8.14
- 9,62
- 7,00
Я нашел ответы на похожие вопросы. Здесь
Но с этим вопросом у меня возникла другая проблема. T he HF и KOH компенсируют друг друга, поскольку они имеют одинаковое количество молей
I предположим, что то, на что мы смотрим с другой стороны, будет иметь 0,02 моля и является кислотой
9(-2))) = хтак что есть другой способ решить эту проблему
Я получил отзыв об этой реакции: «Вы предполагаете, что первая реакция завершается, когда Ка не так высока»
Если она не идет к завершение, что мне делать?!
Мне действительно просто нужно посмотреть, как это работает, и знать, почему это происходит $\endgroup$
16
$\begingroup$
Из комментариев:
[OP] Хорошо, спасибо всем, наконец-то понял.
так что K просто выброшен в окно. и у нас осталось уравнение (F- + h3O <-> FH + OH-). Итак, я беру Ka, чтобы сделать Kb на (Kw/Ka), и моя концентрация F- и OH- была (0,02/0,3), что Я подключился к sqrt((Kb)*(M OH- или F-)) взял -log того, что получил pOH, а затем преобразовал его обратно в pH (14 — pH). И последнее, почему I K из окна делает это означает, что он нейтрален. Ну и ответы 8.14
Парафраз с абзацами:
Сильное основание ($\ce{KOH}$) реагирует со слабой кислотой ($\ce{HF}$) при стехиометрическом соотношении:
$$\ce{KOH + HF -> h3O + F- + K+}$$
Основным соединением является фторид, слабое основание с pKb = 14 — pKa, где pKa соответствует фтористоводородной кислоте. Ион калия — зритель. Чтобы найти рН, используйте свою любимую стратегию для чистого слабого основания. В результате рН = 8,14.
Как отметил MaxW в комментариях, это зависит от правильного получения стехиометрического соотношения. Если $\ce{KOH}$ даже в небольшом избытке (скажем, на одну десятую миллимоля на литр слишком много), pH будет сильнощелочным (pH 10).

 11.18
11.18 Это уравнение, оно уже уравновешено.
Это уравнение, оно уже уравновешено.

 Это уравнение, оно уже уравновешено.
Это уравнение, оно уже уравновешено. 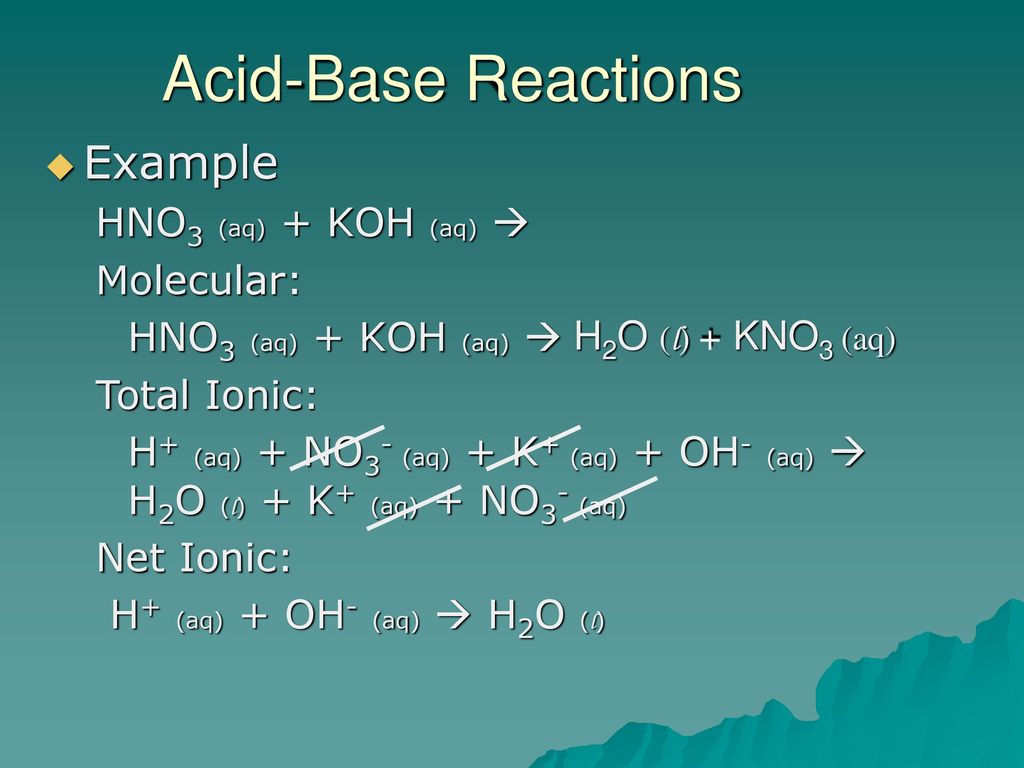
 8
8 так что K просто выброшен в окно. и у нас осталось уравнение (F- + h3O <-> FH + OH-). Итак, я беру Ka, чтобы сделать Kb на (Kw/Ka), и моя концентрация F- и OH- была (0,02/0,3), что Я подключился к sqrt((Kb)*(M OH- или F-)) взял -log того, что получил pOH, а затем преобразовал его обратно в pH (14 — pH). И последнее, почему I K из окна делает это означает, что он нейтрален. Ну и ответы 8.14
так что K просто выброшен в окно. и у нас осталось уравнение (F- + h3O <-> FH + OH-). Итак, я беру Ka, чтобы сделать Kb на (Kw/Ka), и моя концентрация F- и OH- была (0,02/0,3), что Я подключился к sqrt((Kb)*(M OH- или F-)) взял -log того, что получил pOH, а затем преобразовал его обратно в pH (14 — pH). И последнее, почему I K из окна делает это означает, что он нейтрален. Ну и ответы 8.14