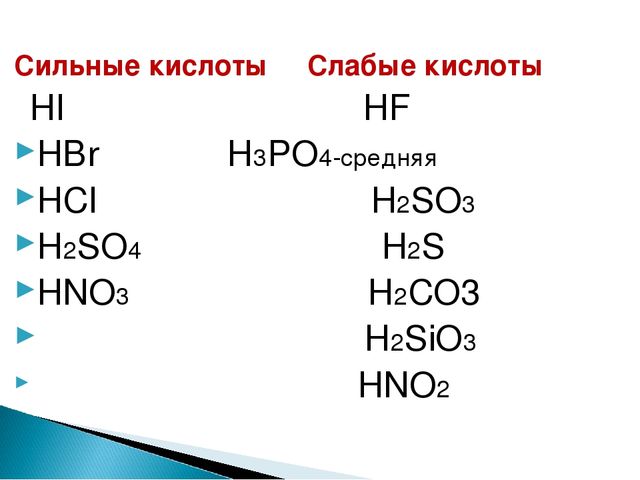
Сбалансируйте следующее уравнение: $HI + HN{O_3} \to {I_2} + NO + {H_2}O$A. $6HI + 2HN{O_3} \to 3{I_2} + 2NO + 4{H_2}O$B. $6HI + 4HN{O_3} \to 3{I_2} + 2NO + {H_2}O$C. $3HI + 2HN{O_3} \to 2{I_2} + 2NO + 4{H_2}O$D. Ни один из этих
Подсказка: Мы можем сбалансировать это уравнение, используя метод степени окисления. Сначала мы записываем степени окисления каждого элемента, а затем уравновешиваем все элементы, кроме водорода и кислорода. Тогда мы можем уравнять степени восстановления и окисления. Наконец, мы можем добавить молекулы воды, чтобы сбалансировать кислород.
Полный пошаговый ответ:
Первым шагом в уравновешивании окислительно-восстановительных реакций является запись степени окисления каждого элемента над реакцией. Водород всегда имеет степень окисления $+1$, а кислород $-2$. Для нейтральных молекул (без заряда) сумма степеней окисления равна нулю. Поскольку все молекулы здесь нейтральны, сумма степеней окисления в этом случае всегда равна нулю.
В $HI$ водород имеет степень окисления $ + 1$. Следовательно, степень окисления йода получается вычитанием степени окисления водорода из нуля, то есть $0 — 1 = — 1$
В $HN{O_3}$ степень окисления водорода $ + 1$, кислорода $ — 2$. Поскольку атомов кислорода три, их суммарный вклад равен $(- 2 \times 3) = — 6$. Следовательно, степень окисления азота получается путем вычитания степеней окисления водорода и кислорода из нуля. Следовательно, он равен $0 — 1 — (- 6) = + 5$.
Так как ${I_2}$ является молекулой элемента в нормальном состоянии, то в этой молекуле степень окисления йода равна нулю.
В ${H_2}O$ степень окисления водорода $ + 1$, кислорода $ — 2$. 9{ — 2} $
Наш следующий шаг — сбалансировать элементы, кроме водорода и кислорода. Это йод и азот. Обе стороны имеют по одному атому азота, так что мы можем оставить это без внимания. В левой части находится только один йод, а в правой — два. Поэтому мы ставим $2$ рядом с $HI$:
$2HI + HN{O_3} \to {I_2} + NO + {H_2}O$
Возвращаясь к нашим степеням окисления, мы видим, что степень окисления азота уменьшается. снижен с $+5$ до $+2$. Следовательно, он восстанавливается, и каждый атом азота претерпевает изменение $ + 5 — 2 = + 3$.
снижен с $+5$ до $+2$. Следовательно, он восстанавливается, и каждый атом азота претерпевает изменение $ + 5 — 2 = + 3$.
Йод окисляется (от $ — 1$ до $0$). Таким образом, изменение степени окисления составляет $ + 1$ на атом.
Мы должны уравнять изменения в процессах окисления и восстановления, чтобы сбалансировать уравнение. В процессе восстановления изменение составляет $ + 3$, а в процессе окисления — $2 \times ( + 1) = + 2$, так как участвуют две молекулы $HI$, как это получено из нашего предыдущего сбалансированного уравнения. Чтобы уравнять оба процесса, мы должны найти НОК обоих чисел, а затем соответственно умножить каждую молекулу. НОК $3$ и $2$ равен $6$. Отсюда умножаем молекулы процесса окисления ($HN{O_3}$ и $NO$) на $2$, так как $( + 3) \times 2 = 6$ и умножаем молекулы процесса окисления ($HI$ и ${I_2}$) с $3$, так как $( + 2) \times 3 = 6$ . Таким образом, мы получаем:
$6HI + 2HN{O_3} \to 3{I_2} + 2NO + {H_2}O$
Обратите внимание, что коэффициент $HI$ теперь становится $6$, так как ранее у нас уже было $2$.
Последним шагом является уравновешивание атомов кислорода путем добавления молекул воды там, где это необходимо. С левой стороны у нас есть шесть кислородов, а с правой стороны у нас есть три кислорода. Таким образом, мы добавляем три молекулы воды в правую часть. Поскольку с правой стороны уже есть молекула воды, общее количество молекул воды с правой стороны теперь будет четыре:
$6HI + 2HN{O_3} \to 3{I_2} + 2NO + 4{H_2}O$
Теперь мы должны сбалансировать атомы водорода. Но мы видим, что они уже уравновешены, так как с обеих сторон по восемь атомов водорода. Поскольку мы уравновесили все элементы, это окончательное уравновешенное уравнение:
$6HI + 2HN{O_3} \to 3{I_2} + 2NO + 4{H_2}O$
Итак, правильный ответ — Вариант A .
Примечание: Помимо метода степени окисления, мы также можем использовать метод полуреакции. В этом методе мы разделяем всю реакцию на половину окисления и половину восстановления и уравновешиваем их отдельно. В конце они объединяются, чтобы получить окончательное уравнение.
Обратите внимание, что окисление — это удаление электронов, а восстановление — это приобретение электронов.
What, How to Balance & FAQs —
By Ayon Majumder
HI — бесцветный сжиженный газ, а HNO 3 (азотная кислота) — красно-желтая дымящаяся жидкость с удушливым запахом. Дайте нам знать некоторые факты о том, как эти двое реагируют друг на друга.
HI является самой сильной кислотой среди галогеноводородов и сильным восстановителем. С другой стороны, HNO 3 — одна из сильных кислот и окислитель.
В этой статье мы более подробно обсудим продукты в различных условиях реакции, уравновешивание реакции, обратимость, тип и многие другие факты о реакции между HI и HNO 3 .
Что является продуктом HI и HNO 3 В основном оксид азота (NO), йод (I 2 ) и H 2 являются продуктами реакции между HI и HNO 3 . Но в некоторых условиях реакции образуется HIO 3 в качестве промежуточного продукта.
Но в некоторых условиях реакции образуется HIO 3 в качестве промежуточного продукта.
- Если конц. азотной кислоты высока (60% раствор), затем она реагирует с йодоводородом с образованием HIO 3 , NO 2 и H 2 O . Схема реакции: 6HNO 3 + HI = HIO 3 +6NO 2 + 3H 2 O
- Если конц. HI выше, чем конц. HNO 3 , затем они реагируют с образованием оксида азота (NO), йода (I 2 ) и H 2 O . The reaction scheme is : 6HI + 2HNO 3 = 2NO + 3I 2 + 4H 2 O
The type of reactions между HI и HNO 3 и Окислительно-восстановительная реакция , Необратимая реакция , Эндотермическая реакция .
- The unbalanced redox reaction is as follows: HI + HNO 3 → I 2 +NO +H 2 O
- После уравновешивания атомов I и N мы получаем уравнение в виде : 2HI + HNO 3 → I 2 +NO +H 2 O
- Сначала найдите степени окисления каждого атома, чтобы определить, какие атомы окисляются, а какие восстанавливаются. Из приведенной выше схемы реакции мы можем составить таблицу степеней окисления каждого атома.
| Атомы | О.Н. на стороне реагента | О.Н. on the product side |
|---|---|---|
| I | -1 | 0 |
| N | +5 | +2 |
| 0 | -2 | -2 |
- Степень окисления йода изменяется от -1 до 0.
 изменение О.Н. составляет 2 единицы.
изменение О.Н. составляет 2 единицы. - Степень окисления N изменяется от +5 до +2. общее изменение О.Н. на один атом N составляет 3 единицы.
- Снижение О.Н. уравновешивается уменьшением О.Н. перекрестным умножением.
(2i — → I 2 ) *3
(HNO 3 → NO) *2
- . Уравнение: 6HI + 2HI + 2HI + 2. 3I 2 + H 2 O
- Наконец, мы уравновешиваем H 2 O, проверяя атомы кислорода с обеих сторон.
- Следовательно, окончательное сбалансированное уравнение: 6HI + 2HNO 3 = 2NO + 3I 2 + 4H 2 O
- С методом ионо-электронов мы также можем сделать это:-
2N (V) + 6E — → 2N (II) 44444444444444444444444444444444444444444444444444444444444444444444444444444444444444444 4E — . восстановление)
восстановление)
6I (-1) – 6e – → 6I (0) (окисление)
- После этого проверяем и уравновешиваем уравнение, добавляя атом кислорода с обеих сторон H 2 O.
Титрование между HI и HNO 3 нельзя проводить напрямую, так как эти два реагента являются сильными кислотами.
HI + HNO 3 net ionic equationThe net ionic equation of HI + HNO 3 is :-
6H + +6I – +2H + + 2НО 3 – = 2НО + 3И 2 + 4Н + +4ОН –
· Поскольку HI и HNO 3 являются сильными кислотами, в водном растворе HI разлагается на ионы H + и
I – .
· HNO 3 разлагается на ионы H + и NO 3 – соответственно.
· Со стороны продукта I 2 и NO являются газами, поэтому они не разлагаются на
ионов.
· H 2 O ионизируется до ионов H + и OH – .
· Таким образом, после разложения на ионы чистое ионное уравнение становится:-
6H + + 6i — + 2H + + 2NO 3 444636- + 2NO 3 444636- + 2NO 3 44636- . + 4H + +4OH –
HI + HNO 3 сопряженные пары HI + HNO 3 как правило, не имеет сопряженных пар, так как они не соединяются друг с другом с образованием нейтрализованных соединений.
- HI является сильной кислотой, поэтому в водном растворе она отдает протон, так что I – является сопряженным основанием HI.
- HNO 3 – сильная кислота. Он быстро отдает свой протон. NO 3 – является сопряженным основанием HNO 3 .
В реакции HI + HNO 3 в молекулах реагентов действуют следующие межмолекулярные силы:
- HI – полярная ковалентная сильная кислота. Он обладает ионными диполь-дипольными взаимодействиями, наиболее важными межмолекулярными силами, присутствующими между H + и I – для формирования HI.
- Поскольку HNO 3 представляет собой полярную ковалентную молекулу, она обладает диполь-дипольными взаимодействиями и лондоновскими дисперсионными силами.

- Продукт NO имеет неспаренный электрон, поэтому по своей природе является парамагнитным. Таким образом, оксид азота может участвовать в диполь-дипольных взаимодействиях, а также имеет слабые взаимодействия Ван-дер-Воллса.
- В I 2 присутствует только лондонская дисперсионная сила притяжения, так как это неполярная ковалентная молекула.
- В воде присутствует межмолекулярная Н-связь.
Энтальпия реакции между HI и HNO 3 составляет +85,06 кДж/моль.
The standard enthalpies of the formation of reactants and products are as follows :
| Molecules | Enthalpy of formation(KJ/mol) |
|---|---|
| HI | 25. 94 94 |
| HNO 3 | -173,1 |
| H 2 O | -286 |
| I 2 | 0 |
| NO | 90.25 |
Reaction Enthalpy ΔH f = Standard энтальпия продуктов – Стандартная энтальпия реагентов
Таким образом, ΔH f = [3*0+2*(90,25) +(-286)] – [6*(25,94) + 2*(-173,1)]
= (-105,5) – (155,64-346,2) кДж/моль
= +85,06 кДж/моль
IS HI + HNO 3 Буферный раствор HI + HNO 3 не является раствором из буфера, а HI — сильная кислота, и HNO 3 3 3 не является раствором буфера. также является сильной кислотой, поэтому не может производить буферный раствор . A s эти двое не могут поддерживать P H решения.
также является сильной кислотой, поэтому не может производить буферный раствор . A s эти двое не могут поддерживать P H решения.
Реакция HI + HNO 3 является полной реакцией, поскольку после нее не происходит никакой дальнейшей реакции, а также не происходит обратной реакции.
HI + HNO 3 экзотермическая или эндотермическая реакцияРеакция HI + HNO 3 носит эндотермический характер, так как положительное значение (+85,06 кДж/моль) энтальпии общей реакции что реакция требует энергии для осуществления реакции в прямом направлении в виде тепла.
Is HI + HNO 3 окислительно-восстановительная реакция ) происходит одновременно. Здесь HI — восстановитель, а HNO 3 — окислитель.

 изменение О.Н. составляет 2 единицы.
изменение О.Н. составляет 2 единицы.