Получение и свойства соединений и материалов в системах графит-FeCl3-HNO3 и графит-Fe(NO3)-HNO3-Н2О — дипломная работа
В связи с техническими работами в центре обработки данных, возможность загрузки и скачивания файлов временно недоступна.
скрыть
Получение и свойства соединений и материалов в системах графит-FeCl3-HNO3 и графит-Fe(NO3)-HNO3-Н2Одипломная работа (Специалист)
- Научный руководитель: Шорникова О.Н.
- Автор: Лутфуллин Марат Адиятуллович
- Тип: Специалист
- Организация, в которой проходила защита: МГУ имени М.В. Ломоносова
- Год защиты: 2010
- Аннотация:
Изучено взаимодействие ИСГ-FeCl3 с концентрированной азотной кислотой.
 Показано, что при взаимодействии HNO3 с соединениями I ступени происходит ча-стичное разложение ИСГ и образование фазы нитрата графита. При взаимодействии HNO3 с соединениями II и III ступеней наблюдается образование тройных ИСГ со структурой типа «сэндвич» и чередованием слоев FeCl3-HNO3-FeCl3-графит и FeCl3-графит-HNO3-FeCl3-HNO3-графит соответственно. Установлены периоды идентичности для данных ТИСГ.
Анодной поляризацией графита в электролитах Fe(NO3)3 – h3O и Fe(NO3)3 – HNO3 – h3O получен окисленный графит, модифицированный соединениями желе-за. Показано, что нитрат железа (III) не образует интеркалированных соединений графита в условиях проведения эксперимента. Методами мессбауэровской спек-троскопии и сканирующей электронной микроскопии установлено, что железо в виде основной соли нитрата железа (III) сосредоточено на дефектах матрицы окис-ленного графита. Установлено и показано влияние условий синтеза окисленных графитов на насыпные плотности соответствующих пенографитов.
Термической обработкой модифицированного окисленного графита получен пенографит, содержащий оксиды железа.
Показано, что при взаимодействии HNO3 с соединениями I ступени происходит ча-стичное разложение ИСГ и образование фазы нитрата графита. При взаимодействии HNO3 с соединениями II и III ступеней наблюдается образование тройных ИСГ со структурой типа «сэндвич» и чередованием слоев FeCl3-HNO3-FeCl3-графит и FeCl3-графит-HNO3-FeCl3-HNO3-графит соответственно. Установлены периоды идентичности для данных ТИСГ.
Анодной поляризацией графита в электролитах Fe(NO3)3 – h3O и Fe(NO3)3 – HNO3 – h3O получен окисленный графит, модифицированный соединениями желе-за. Показано, что нитрат железа (III) не образует интеркалированных соединений графита в условиях проведения эксперимента. Методами мессбауэровской спек-троскопии и сканирующей электронной микроскопии установлено, что железо в виде основной соли нитрата железа (III) сосредоточено на дефектах матрицы окис-ленного графита. Установлено и показано влияние условий синтеза окисленных графитов на насыпные плотности соответствующих пенографитов.
Термической обработкой модифицированного окисленного графита получен пенографит, содержащий оксиды железа.
- Добавил в систему: Шорникова Ольга Николаевна
Структура Льюиса HNO3, характеристики: 47 полных кратких фактов
Эта статья должна содержать структуру Льюиса HNO3 и ее различные важные факты. Давайте обсудим структуру Льюиса HNO3.
Давайте обсудим структуру Льюиса HNO3.
В структуре Льюиса HNO3 молекула состоит из атомов N, H и трех атомов O. Все атомы в структуре Льюиса HNO3 образуют ковалентную связь. N – структура Льюиса HNO3 – sp2 гибридизуется, в то время как O представляет собой sp3 гибридизированный. Имеется одна группа -ОН и присутствуют две кетоновые группы. Благодаря наличию ОН-группы молекула становится кислой. Электроотрицательность O и N настолько высока, что делает H более кислым.
HNO3 или азотная кислота является одной из самых сильных неорганических кислот. Из этой кислоты делают царскую водку. Структура HNO3 различна, потому что здесь две центральные гибридизации разные. Вокруг N он тригонально-плоский, а вокруг O — тетраэдрический.
Некоторые важные факты о HNO3Физическое состояние азотной кислоты жидкое. Цвет азотной кислоты бесцветный, но при длительном хранении ее цвет меняется на желтоватый из-за разложения оксида азота. Температура кипения и температура плавления азотной кислоты составляют 356 К и 231 К соответственно. Молярная масса этой кислоты составляет 63.012 г/моль. Запах азотной кислоты кислый и очень удушающий. Плотность этой кислоты 1.51 г/см.3. Дымящаяся азотная кислота имеет давление паров и составляет 48 мм рт.ст. при 200C.
Температура кипения и температура плавления азотной кислоты составляют 356 К и 231 К соответственно. Молярная масса этой кислоты составляет 63.012 г/моль. Запах азотной кислоты кислый и очень удушающий. Плотность этой кислоты 1.51 г/см.3. Дымящаяся азотная кислота имеет давление паров и составляет 48 мм рт.ст. при 200C.
Его можно получить реакцией воды и диоксида азота.
4 НЕТ2 + 2H2О → 2 HNO3 + НЕТ + НЕТ2 + H2O
Чистая реакция,
3 НЕТ2 + H2О → 2 HNO3 + НЕТ
Пузырьки диоксида азота проходят через перекись водорода, улучшая выход продукта.
2 НЕТ2 + H2O2 → 2 ННО3
В лаборатории азотную кислоту можно получить путем термического разложения нитрата меди с образованием диоксида азота, а затем этот диоксид азота вступает в реакцию с водой с получением азотной кислоты.
2 Cu(НЕТ3)2 → 2 CuO + 4 NO2 + О2
2 НЕТ2 + H2О → HNO2 + ННО3
Описанный выше процесс называется Оствальдский процесс.
Азотная кислота может вести себя как сильный окислитель. Для включения нитрогруппы в любом органическом синтезе широко используется азотная кислота.
1. Как нарисовать структуру Льюиса HNO3?HNO3 структура льюиса сильно отличается от другой ковалентной молекулы, потому что она имеет два центральных атома, один из которых представляет собой N, а другой представляет собой атом O. N и O оба являются элементами p-блока, поэтому они должны следовать правилу октета на чертеже структуры Льюиса HNO3. Рассмотрим структуру Льюиса HNO3.
Шаг 1 — На первом этапе структуры Льюиса HNO3 мы должны подсчитать валентные электроны для каждого присутствующего в ней атома. Электронная конфигурация H равна 1 с.1. Таким образом, у него есть только один электрон, и этот электрон используется в качестве его валентного электрона, и через этот единственный электрон H может образовывать связь. Мы знаем, что O — это элемент группы 6 и p-блочный элемент, поэтому его последняя орбиталь должна быть p-орбиталью, а электронная конфигурация O — [He] 2s22p4. Таким образом, у него есть шесть электронов на валентной оболочке, которые можно использовать для образования связи.
Таким образом, у него есть шесть электронов на валентной оболочке, которые можно использовать для образования связи.
Теперь для N электронная конфигурация [He]2s22p3, поэтому он имеет пять электронов на своей валентной оболочке, а максимальное количество связей, которое может образовать N, равно четырем. Теперь мы добавляем все валентные электроны в структуре Льюиса HNO3 и полные валентные электроны для структуры Льюиса. Структура Льюиса HNO3: 1+5+(6*3) = 24 электрона. Присутствуют три атома O, и каждый O содержит шесть валентных электронов.
Шаг 2 — Теперь это самый запутанный шаг, что здесь мы выбираем центральный атом, здесь N и O оба присутствуют в центральном положении, и разница в электроотрицательности между ними очень мала. В HNO3 структура льюиса, все атомы не связаны через атомы N или O, но центральный атом должен соединять все атомы.
Вот почему здесь N и один О считаются центральными атомами, и по этой причине мы должны вычислять гибридизацию для двух атомов отдельно, а значения гибридизации двух атомов разные. Два атома находятся в разных средах.
Два атома находятся в разных средах.
Шаг 3 – В структуре Льюиса HNO3 все атомы принадлежат блокам s и p, поэтому они должны подчиняться правилу октетов. Для блочного элемента s они пытаются завершить только свою s-орбиталь, поскольку s является их валентной орбиталью. общее количество электронов, накопленных s-орбиталью, равно 2. Для p-орбитали общее количество накопленных электронов равно 6.
Теперь, согласно правилу октета, электроны, необходимые дляСтруктура Льюиса HNO3 состоит из 2+(4*8) = 34 электронов. Но валентных электронов в структуре Льюиса HNO3 24, поэтому нехватка электронов составляет 34-24 = 10 электронов. Эти 10 электронов должны накопиться в количестве подходящих связей. Таким образом, для облигаций требовалось 10/2 = 5 облигаций. Таким образом, требуется минимум пять облигаций. Чтобы определить пять связей, нам нужно добавить двойную связь между N и O.
Шаг 4 – На этом этапе мы должны соединить каждый атом в структуре Льюиса HNO3 через необходимое количество связей. Существует одна связь между концевыми H и O, одна связь между O группы -OH и N. Затем используются три другие связи между N и двумя атомами O, а между одним атомом O и N имеется двойная связь.
Существует одна связь между концевыми H и O, одна связь между O группы -OH и N. Затем используются три другие связи между N и двумя атомами O, а между одним атомом O и N имеется двойная связь.
Шаг 5 — На этом последнем шаге мы добавляем неподеленные пары и кратные связи, чтобы завершить валентность атомов. O имеет шесть электронов в своей валентной оболочке и образует две связи, одну с H и одну с N, поэтому у него есть четыре неспаренных электрона, которые существуют как две пары неподеленных пар. Другие атомы O, которые образуют двойную связь с N, имеют те же четыре электрона в своей валентной оболочке, и они существуют в виде двух пар неподеленных пар. Последний O, который образует одинарную связь с N, образует дательную связь, и после образования одной связи существует шесть электронов, поэтому он получает отрицательный заряд и две пары неподеленных пар.
2. Форма структуры Льюиса HNO3Форма молекулы зависит от количества электронов и основана на центральном атоме, но в структуре Льюиса HNO3 есть два центральных атома, один из которых — N, а другой — O. Для N форма молекулы плоская, но относительно Форма молекулы тетраэдрическая. Электронная плотность различна для двух атомов и формы структуры Льюиса HNO3.
Для N форма молекулы плоская, но относительно Форма молекулы тетраэдрическая. Электронная плотность различна для двух атомов и формы структуры Льюиса HNO3.
Структура Льюиса HNO3 в газообразном состоянии плоская. Такая же структура и для твердотельного тела. Длина связи NO в нитрогруппе одинакова. Третье расстояние связи NO больше и соответствует одинарной связи. Мы знаем, что нитро представляет собой переменную структуру, и между двумя атомами O и N показан характер двойной связи. Нитрогруппа отклонена от атомов H на 20.
Если мы рассмотрим VSEPR (теорию пар электронов валентной оболочки), то мы должны посчитать электроны и рассмотреть структуру. Но здесь структура различна для разных атомов. Для кислорода -OH их количество электронов составляет 8, включая две неподеленные пары, поэтому, согласно VSEPR, он принимает тетраэдрическую форму. Но для нитрогруппы количество электронов равно 6, поэтому она принимает тригональную плоскую структуру, где три атома o присутствуют в трех вершинах.
Для расчета общего количества валентных электронов для структуры Льюиса HNO3 мы должны посчитать отдельные валентные электроны для каждого атома. Имеется три атома O, один атом N и один атом h. Окружение трех атомов N различно, и поэтому их валентные электроны также различны.
HNO3 валентные электроныИз электронной конфигурации N видно, что на валентной оболочке N присутствует пять электронов. O является элементом группы 6, поэтому он имеет шесть электронов на своей валентной оболочке, которые готовы к образованию связи. Но O образует только одну связь с N, а остальные два электрона существуют в виде неподеленных пар. H имеет только один электрон, и этот один электрон является валентным электроном для атома H.
Таким образом, общее число валентных электронов структуры Льюиса HNO3 составляет 1+5+(6*3) = 24 электрона.
4. Неподеленные пары структуры Льюиса HNO3В структуре Льюиса HNO3 доступны только неподеленные пары атомов O, N образует дательную связь с O в нитрогруппе, тогда у него есть неподеленные пары, в противном случае их нет.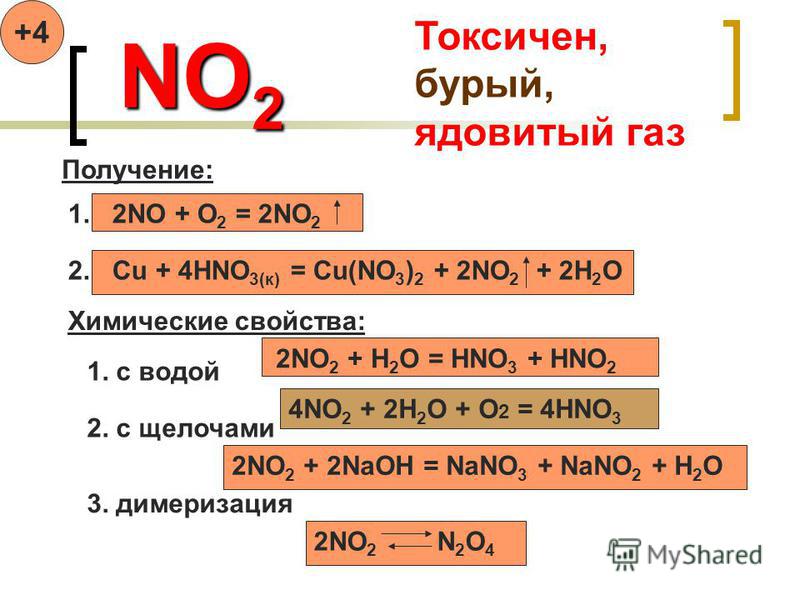
Для подсчета неподеленных пар мы должны проверить доступные электроны в валентной оболочке каждого атома после образования связи. H имеет только один электрон, поэтому H не может содержать неподеленную пару. Теперь O имеет шесть электронов в своей валентной оболочке, а после образования двух сигма-связей у него остаются четыре электрона. Эти четыре электрона существуют как две пары неподеленных пар над O в группах -OH.
Одиночные пары HNO3Что касается нитрогрупп, то в структуре Льюиса HNO3 присутствует два атома O. Один O образует двойную связь с N для завершения октета, поэтому он имеет четыре электрона, и снова возникает тот же случай. Этот атом O имеет две пары неподеленных пар. Теперь другие атомы O образуют переменную связь с N, две двойные связи для N невозможны, потому что N не может проявлять пятивалентность, поэтому есть только один возможный способ, которым O образует одинарную связь с N или образует дательный падеж.
Дательная связь представляет собой координационную ковалентную связь. Электронная плотность находится ближе к узлу O. Этот O также несет отрицательный заряд и содержит три пары неподеленных пар. Учет N состоит в том, что они содержат положительный заряд.
Электронная плотность находится ближе к узлу O. Этот O также несет отрицательный заряд и содержит три пары неподеленных пар. Учет N состоит в том, что они содержат положительный заряд.
Таким образом, общее количество неподеленных пар над HNO3 структура льюиса составляет 2+2+3=7 пар неподеленных пар, в противном случае шесть пар неподеленных пар, если они не образуют дательный падеж.
5. Формальный заряд структуры Льюиса HNO3Из HNO3 структура льюиса, можно сказать, что над N и O в нитрогруппе присутствует заряд. Вычисляя формальный заряд, следует предсказать заряд каждого атома. Это гипотетическая концепция, объясняющая одинаковую электроотрицательность каждого атома в структуре Льюиса HNO3.
Формула, которую мы можем использовать для расчета формального заряда, ФК = Нv — NЛ.П. -1/2 Нбп
Где Nv — количество электронов на валентной оболочке или на самой внешней орбитали, Nлп — количество электронов в неподеленной паре, а Nбп это общее число электронов, которые участвуют только в образовании связи.
Окружение трех атомов О должно быть разным, поэтому мы должны вычислить формальный заряд индивидуально для всех атомов.
Формальный заряд атома H: 1-0-(2/2) = 0
Формальный заряд атома О в группе -ОН = 6-4-(4/2) = 0
Формальный заряд атома N равен 5-1-(8/2) = 0.
Формальный заряд над O в нитрогруппе: 6-4-(4/2) = 0.
Из формального расчета заряда нельзя сказать, что между N и O в нитрогруппе существует дативная связь. В целом молекула нейтральна.
6. Структурный угол Льюиса HNO3Валентный угол HNO3 структура льюиса отличается из-за наличия двух разных центральных атомов и двух форм молекулы. Гибридизация двух атомов различна, и окружение тоже различно. Так, в структуре Льюиса HNO3 наблюдаются два валентных угла относительно атомов N и O.
Угол связи HNO3Для нитрогруппы в структуре Льюиса HNO3 присутствуют только три атома, окружающие центральный атом N, и нет неподеленных пар над атомом N. Согласно теории ВСЕПР, если молекула AX3 не имеет неподеленной пары над центральным атомом, то валентный угол должен быть равен 1200. Но здесь присутствуют неподеленные пары из трех атомов О.
Согласно теории ВСЕПР, если молекула AX3 не имеет неподеленной пары над центральным атомом, то валентный угол должен быть равен 1200. Но здесь присутствуют неподеленные пары из трех атомов О.
Итак, если валентный угол равен 1200, то возникают массивные неподеленные пары — происходит отталкивание неподеленных пар. Таким образом, чтобы свести к минимуму такое отталкивание, N изменил угол связи на 112°.0. Это значение также соответствует присутствию трех электроотрицательных атомов, и s-характер значения гибридизации увеличивается.
Теперь для другого атома O есть один атом H и один атом N, окружающие этот атом O. Также присутствуют две пары одиночных пар. Итак, эта форма похожа на молекулу воды, как V-образная форма, поэтому валентный угол составляет почти 1040, из-за отталкивания неподеленных пар и наличия одного электроотрицательного атома N.
7. Правило октета структуры Льюиса HNO3В структуре Льюиса HNO3 присутствуют блочные элементы s и p, поэтому они должны следовать правилу октетов. Правило октета для s-блочных элементов состоит в том, чтобы завершить s-орбиталь за счет двух электронов, а для p-блочных элементов они завершают свой октет за счет восьми электронов. Поскольку p-орбиталь может аккумулировать максимальное количество шести электронов.
Правило октета для s-блочных элементов состоит в том, чтобы завершить s-орбиталь за счет двух электронов, а для p-блочных элементов они завершают свой октет за счет восьми электронов. Поскольку p-орбиталь может аккумулировать максимальное количество шести электронов.
В структуре Льюиса HNO3 мы должны проверять каждый атом, чтобы завершить его октет. Атом H имеет только один электрон на s-орбитали, и ему нужен еще один электрон, чтобы завершить свой октет. Через образование связи с атомом O H и O делят по одному электрону каждый, и поэтому H может завершить свой октет через один электрон из позиции O.
Теперь для O группы -OH у него шесть электронов на валентной оболочке, так как это группа 6.th элемент. Таким образом, для завершения октета потребовалось еще два электрона в его валентной оболочке. Теперь этот O образует связь с атомами H и N, имеющими два общих электрона. Таким образом, он завершает свой октет, получая два электрона от N и O, которые используются совместно при образовании связи.
Теперь N имеет пять электронов в своей валентной оболочке, и ему нужно еще три электрона в своей валентной оболочке, чтобы завершить свой октет. Таким образом, он образует связь с тремя атомами О и делит с ними три электрона. Теперь N также может завершить свой октет, получив те три электрона от трех атомов O, которые являются общими при образовании связи.
Два атома O нитрогруппы одновременно образуют двойную связь с атомом N и, следовательно, они также могут завершить свой октет, разделяя два электрона в двойной связи.
8. Резонанс структуры Льюиса HNO3В структуре Льюиса HNO3 будет наблюдаться резонанс, потому что внутри молекулы присутствует больше электронных облаков, которые могут быть делокализованы по различным формам скелета структуры Льюиса HNO3. Молекула показывает положительный и отрицательный заряд внутри нее, и присутствует большее количество неподеленных пар, поэтому их можно делокализовать, потому что октет N и кетонового O каким-то образом не завершен.
все вышеперечисленные три структуры являются различными каркасными формами структуры Льюиса HNO3, или можно сказать, что они являются резонирующей структурой. Среди этих трех структура I и структура II подобны, отрицательный заряд распределен по двум атомам O в нитрогруппе. Эти две структуры вносят наибольший вклад, потому что все три структуры содержат одинаковое количество ковалентных связей, но в этих двух структурах наиболее электроотрицательный атом O получает отрицательный заряд, а менее электроотрицательный атом N получает положительный заряд.
В структуре III количество ковалентных связей такое же, но здесь N получает положительный заряд, но O также получает положительный заряд, что является дестабилизирующим фактором. O — более электроотрицательный атом, и положительный заряд над ним является фактором дестабилизации.
9. гибридизация HNO3Гибридизация структуры Льюиса HNO3 отличается тем, что она имеет два центральных атома, и мы должны предсказать гибридизацию двух центральных атомов по отдельности.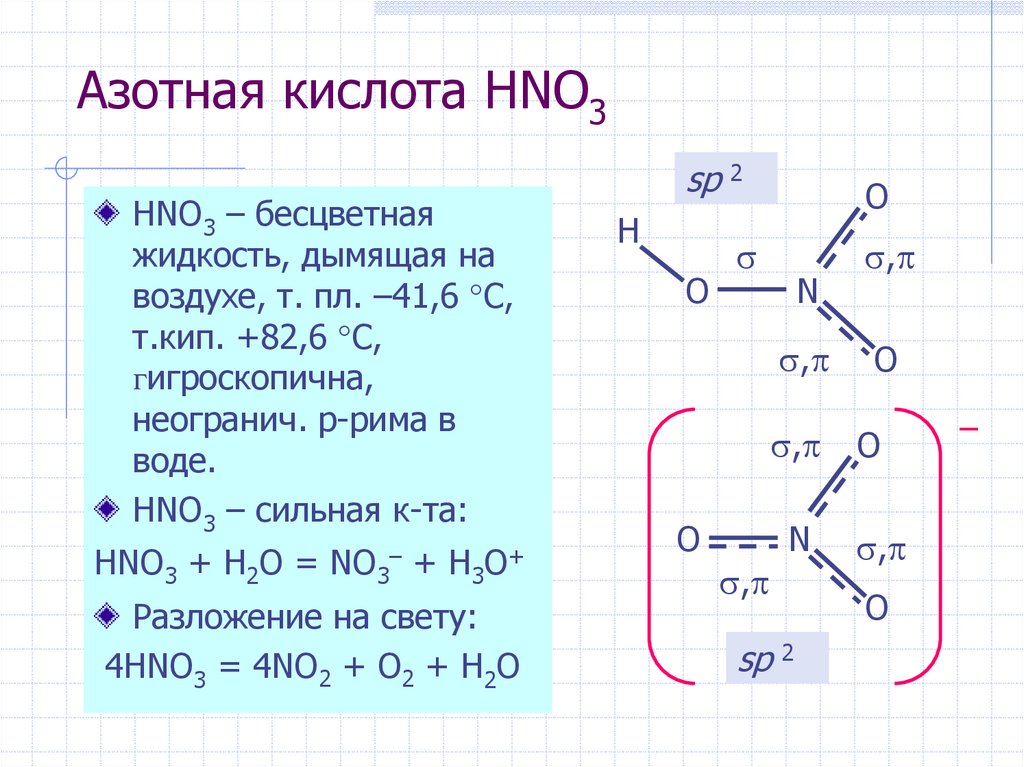 Энергия 1s-орбитали H и 2p-орбитали O не эквивалентна, поэтому они подвергаются гибридизации с образованием эквивалентной орбитали. Точно так же атом N также подвергается гибридизации с гибридной орбитали с тремя атомами O.
Энергия 1s-орбитали H и 2p-орбитали O не эквивалентна, поэтому они подвергаются гибридизации с образованием эквивалентной орбитали. Точно так же атом N также подвергается гибридизации с гибридной орбитали с тремя атомами O.
Мы рассчитываем гибридизацию структуры Льюиса HNO3, используя следующую формулу:
H = 0.5(V+M-C+A), где H = значение гибридизации, V — количество валентных электронов в центральном атоме., M = одновалентные атомы в окружении, С=нет. катиона, А=нет. аниона.
Когда мы находим гибридизацию N в HNO3 структура льюиса, есть три электрона для N и три атома O присутствуют в окружающем положении.
Так, гибридизация центрального N в HNO3 структура льюиса равно ½(3+3+0+0) = 3 (sp2)
Для атомов O валентные электроны равны 6 и присутствуют один атом N и один атом H.
Таким образом, гибридизация O в структуре Льюиса HNO3 составляет ½ (6 + 2 + 0 + 0) = 4 (sp3)
| Структура | Значение гибридизации | Состояние гибридизации центрального атома | Бондовый угол |
| Линейные приводы | 2 | сп/сд/пд | 1800 |
| Планировщик тригональный | 3 | sp2 | 1200 |
| четырехгранный | 4 | sd3/сп3 | 109. 50 50 |
| Тригональный бипирамидальный | 5 | sp3д/дсп3 | 900 (осевой), 1200(экваториальный) |
| восьмигранный | 6 | sp3d2/ д2sp3 | 900 |
| Пятиугольная бипирамидальная | 7 | sp3d3/d3sp3 | 900, 720 |
Из вышеприведенной таблицы гибридизации можно сделать вывод, что если значение гибридизации равно 4, то центральные атомы имеют sp3 гибридизуются, и если количество орбиталей, участвующих в гибридизации, равно трем, то атомы имеют sp2 гибридизированный.
Давайте разберемся с гибридизацией атомов N и O отдельно.
Гибридизация NИз диаграммы гибридизации видно, что мы не можем учитывать π-связь в гибридизации. Мы рассматриваем только сигма-связь с атомами O, N образует трехсигма-связь с тремя атомами O, испытывающими sp2 гибридизация. S-орбиталь не может участвовать в образовании кратной связи, поэтому мы рассматриваем p-орбиталь электрона для образования двойной связи.
Мы рассматриваем только сигма-связь с атомами O, N образует трехсигма-связь с тремя атомами O, испытывающими sp2 гибридизация. S-орбиталь не может участвовать в образовании кратной связи, поэтому мы рассматриваем p-орбиталь электрона для образования двойной связи.
Из диаграммы гибридизации мы можем сказать, что неподеленные пары атомов О также участвуют в гибридизации. По этой причине форма вокруг этого атома O является тетраэдрической, и это также приводит к тому, что значение валентного угла составляет около 109.5.0.
10 растворимость HNO3В структуре Льюиса HNO3 можно сказать, что наблюдается разделение зарядов, и это делает молекулу слегка полярной и ионной, поэтому она может растворяться в другом полярном растворителе. HNO3 является очень хорошим растворителем для различных металлов. Он образует царскую водку, которая является хорошим растворителем растворимого металлического золота. HNO3 растворим в следующих растворителях,
HNO3 растворим в следующих растворителях,
- Бензол
- Спирт этиловый
- воды
- CCl4
В HNO3 структура льюиса, мы видим некоторую полярность в этой молекуле, поэтому она растворима в полярном растворителе. HNO3 непосредственно в воде не растворяется, смешивается с водой, плотность воды и HNO3 различна, но имеет полярный характер, ионизируется в воде и смешивается с водным раствором.
12. яs HNO3 полярная или неполярная?Наличие различных атомов и форма структуры Льюиса HNO3 делают молекулу полярной. Хотя электроотрицательность N и O почти близка, электроотрицательность кетонового кислорода и спиртового О различна. Форма молекулы относительно N плоская, а относительно O — тетраэдрическая и из-за своей несимметричной формы делает молекулу полярной. Из-за несимметричной структуры дипольный момент молекулы не компенсируется, и молекула имеет некоторый результирующий дипольный момент.
Из-за несимметричной структуры дипольный момент молекулы не компенсируется, и молекула имеет некоторый результирующий дипольный момент.
Направление дипольного момента от N к O, так как N получает положительный заряд и здесь увеличивается электроположительность, а O получает отрицательный заряд, и увеличивается электроотрицательность, и по этой причине разница между электроотрицательностью и дипольным моментом выше работает. исходя из структуры, мы можем сказать, что дипольный момент не компенсируется или не полностью противоположен друг другу. Таким образом, он имеет правильное значение дипольного момента и делает структуру Льюиса HNO3 полярной.
13 Является ли HNO3 электролитом?Да, HNO3 является электролитом, он растворяется в воде и делает водный раствор ионным.
14 Является ли HNO3 сильным электролитом?HNO3 является сильным электролитом, потому что, когда он сольватируется в водном растворе, он ионизируется в H+ и нитрат-ионы. Мобильность H+ ион очень высок, и по этой причине структура Льюиса HNO3 является сильным электролитом.
Мобильность H+ ион очень высок, и по этой причине структура Льюиса HNO3 является сильным электролитом.
HNO3 сильно кислая, при растворении в воде выделяет H+ легко ионы и делает более сильным кислым.
16 Является ли HNO3 сильной кислотой?HNO3 — сильная кислота, она может выделять H+ ион легко, потому что присутствует электроотрицательный атом O, а из-за электроотрицательности он притягивает электронную плотность к себе и делает связи OH более слабыми, а H+ легко расщепляется, если молекула высвобождает H+ легко, тогда кислотная природа этой молекулы очень высока и делает кислоту более сильной.
17 Является ли HNO3 аррениевой кислотой?Если молекула дает H+ ион, то это называется Аррениусовая кислота и HNO3 легко высвобождает H+ ион, поэтому HNO3 является кислотой Аррениуса.
HNO3 может действовать как кислота Льюиса, потому что она может принимать электронную плотность в атоме N, потому что она положительно заряжена.
19 HNO3 сильнее HNO2?HNO3 является более сильной кислотой, чем HNO2, потому что сопряженным основанием HNO3 является NO3-, который более стабилен благодаря сопряжению по сравнению с сопряженным основанием HNO2, которым является NO2-. Таким образом, более стабильным сопряженным основанием является более сильная кислота.
20 HNO3 сильнее h3SO4?HNO3 менее сильна, чем h3SO4, так как h3SO4 является двухосновной кислотой, а также сопряженным основанием h3SO4 является SO42-, которое является более стабильным сопряженным основанием из-за лучшего перекрытия между O и S по сравнению с сопряженным основанием HNO3, которым является NO3. -. SO HNO3 является более слабой кислотой, чем h3SO4.
-. SO HNO3 является более слабой кислотой, чем h3SO4.
Никакая HNO3 сама по себе не является кислотой и не является кислотой, сопряженной с другой молекулой.
22 Является ли HNO3 сопряженным основанием?HNO3 — это кислота, поэтому она имеет сопряженное основание, а сопряженное основание HNO3 — NO3-, которое более стабильно и делает HNO3 более сильной кислотой.
23 Является ли HNO3 дипротонной?Присутствует один атом водорода, и он может быть пожертвован, поэтому HNO3 является монопротонной, а не двухпротонной.
24 Является ли HNO3 бинарным или тройным?HNO3 представляет собой тройную оксокислоту.
25 Является ли HNO3 буфером?Когда HNO3 реагирует со слабым основанием, она может образовать буфер сильной кислоты, в противном случае это кислота.
HNO3 является кислотой и при взаимодействии с сильным основанием образует соль и молекулу воды.
27 Проводит ли HNO3?HNO3 является проводящим агентом, если он растворим в воде, он может проводить электричество.
28 HNO3 вызывает коррозию?HNO3 обладает высокой коррозионной активностью.
29 Является ли HNO3 водородной связью?Н-связь в структуре HNO3 не наблюдается.
30 Является ли HNO3 линейной?HNO3 имеет нелинейную форму, а плоскую и тетраэдрическую форму.
31 HNO3 парамагнетик или диамагнетик?HNO3 имеет только один неспаренный электрон над атомом N и является парамагнитным.
32 Является ли HNO3 амфотерной?HNO3 является сильной кислотой и отдает H+ ионы только поэтому он не амфотерный.
HNO3 является дегидратирующим агентом, он может удалять молекулы воды.
34 Является ли HNO3 газом?Физическое состояние HNO3 жидкое.
35 Является ли HNO3 электрофилом?Ион нитрония в HNO3 действует как электрофил.
36 Является ли HNO3 гигроскопичным?Разбавленная HNO3 гигроскопична, а концентрированная – нет.
37. РеУ HNO3 есть заряд?HNO3 не является заряженной молекулой, но между кетоновыми группами в HNO3 распределен отрицательный заряд.
38 HNO3 тяжелее воздуха?Плотность HNO3 намного выше, чем в воздухе.
39 HNO3 жидкая или водная?Физическое состояние HNO3 жидкое.
HNO3 имеет один заменяемый H+ ион присутствует, поэтому это одноосновная кислота.
41 Является ли HNO3 кислым металлом?HNO3 не является металлическим соединением.
42 Является ли HNO3 окислителем?В HNO3 степень окисления N высока, и ее можно уменьшить, чтобы она действовала как более сильный окислитель.
43 Является радикалом HNO3Нет, HNO3 не радикал, она может ионизироваться.
44 Является ли HNO3 реагентом?Да, в органическом синтезе он используется в качестве реагента с включенной нитрогруппой.
45 Является ли HNO3 трехатомным?Да, HNO3 является трехатомным, так как содержит атомы N, O и H.
Да, он более летуч, чем h3SO4.
47 почему HNO3 желтый?Когда HNO3 сохраняется в течение длительного времени, то осаждается оксид N, и по этой причине цвет HNO3 желтый.
ЗаключениеHNO3 — одноосновная сильная кислота в жидкой форме. Он используется в качестве реагента в различных химических синтезах.
Азотная кислота | Свойства, формула, использование и факты
- Ключевые люди:
- Георг Брандт Иоганн Рудольф Глаубер
- Похожие темы:
- водород азот кислород царская водка биогенный газ
Просмотреть весь связанный контент →
Самые популярные вопросы
Что такое азотная кислота?
Азотная кислота представляет собой бесцветную, дымящуюся и сильно коррозионную жидкость, которая является обычным лабораторным реагентом и важным промышленным химикатом для производства удобрений и взрывчатых веществ.
Является ли азотная кислота сильной или слабой кислотой?
Азотная кислота — сильная кислота, полностью ионизированная в водном растворе до ионов гидроксония (H 3 O+) и нитрата (N O 3 -), и сильный окислитель.
Вредна ли азотная кислота?
Азотная кислота (HNO 3 ) представляет собой высококоррозионную жидкость, которая является токсичной и может вызвать сильные ожоги.
Для чего используется азотная кислота?
Азотная кислота используется для производства аммиачной селитры, основного компонента удобрений. Он также используется для производства взрывчатых веществ, таких как нитроглицерин и тринитротолуол (ТНТ), а также для окисления металлов.
азотная кислота , (HNO 3 ), бесцветная, дымящая и сильно коррозионная жидкость (температура замерзания –42 °C [–44 °F], точка кипения 83 °C [181 °F]), представляющая собой обычный лабораторный реагент и важный промышленный химикат для производства удобрений и взрывчатых веществ. Он ядовит и может вызвать сильные ожоги.
Он ядовит и может вызвать сильные ожоги.
Приготовление и использование азотной кислоты были известны еще древним алхимикам. Обычный лабораторный процесс, использовавшийся в течение многих лет и приписываемый немецкому химику Иоганну Рудольфу Глауберу (1648 г.), заключался в нагревании нитрата калия с концентрированной серной кислотой. В 1776 году Антуан-Лоран Лавуазье показал, что он содержит кислород, а в 1816 году Жозеф-Луи Гей-Люссак и Клод-Луи Бертолле установили его химический состав.
Подробнее Из Britannica
Кислота азотная: Азотная кислота и нитратные соли
Основным методом производства азотной кислоты является каталитическое окисление аммиака. В методе, разработанном немецким химиком Вильгельмом Оствальдом в 1901 году, газообразный аммиак последовательно окисляется до оксида азота и диоксида азота воздухом или кислородом в присутствии катализатора из платиновой сетки. Диоксид азота поглощается водой с образованием азотной кислоты.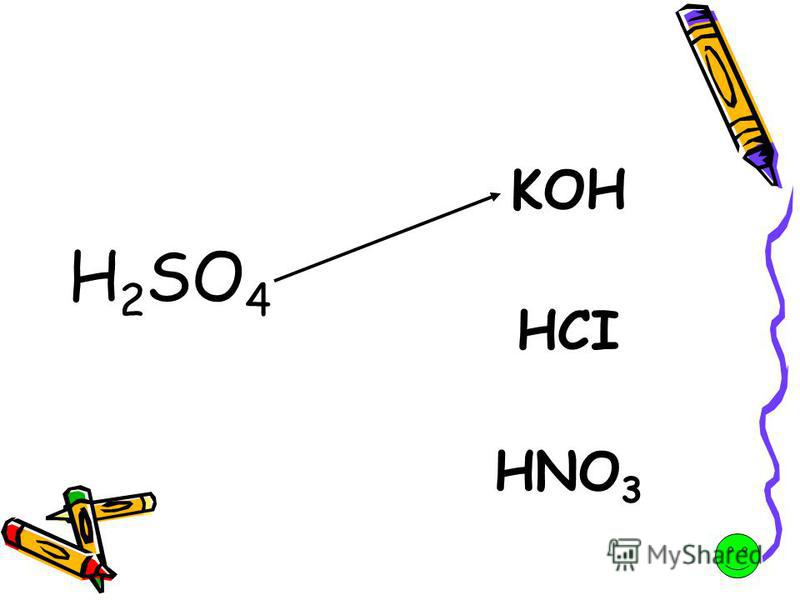 Полученный раствор кислоты в воде (около 50–70 процентов по весу кислоты) можно обезвожить путем перегонки с серной кислотой.
Полученный раствор кислоты в воде (около 50–70 процентов по весу кислоты) можно обезвожить путем перегонки с серной кислотой.
Азотная кислота разлагается на воду, диоксид азота и кислород с образованием коричневато-желтого раствора. Это сильная кислота, полностью ионизированная до ионов гидроксония (H 3 O + ) и нитрата (NO 3 — ) в водном растворе, а также сильный окислитель (тот, который действует как акцептор электронов при окислении). -восстановительные реакции). Среди многих важных реакций азотной кислоты: нейтрализация аммиаком с образованием нитрата аммония, основного компонента удобрений; нитрование глицерина и толуола с образованием взрывчатых веществ нитроглицерин и тринитротолуол (ТНТ) соответственно; получение нитроцеллюлозы; и окисление металлов до соответствующих оксидов или нитратов.
Редакторы Британской энциклопедии Эта статья была недавно отредактирована и обновлена Адамом Августином.
Азотная кислота — The Chemical Company
Азотная кислота TCC относится к группе неорганических кислот. Он одновременно чрезвычайно агрессивен и токсичен. Следовательно, прямой контакт может привести к тяжелым ожогам. Азотная кислота в чистом виде бесцветна, но в старом состоянии имеет желтоватый оттенок из-за накопления оксидов азота. При перегонке азотная кислота в чистом виде начинает кипеть при 78,2°С и затвердевает при хорошем охлаждении.
Азотная кислота является сильным окислителем. Он легко ионизируется в растворе, образуя хороший проводник электричества. Реагирует с металлами, оксидами и гидроксидами, образуя нитратные соли.
В основном азотная кислота используется для приготовления удобрений, например нитрата аммония, и взрывчатых веществ, например нитроглицерина и тринитротолуола (ТНТ). Он также используется в производстве химикатов, например, при производстве красителей, а также в металлургии, флотации руды, травлении стали, фотогравировке и переработке отработавшего ядерного топлива.
Азотная кислота производится в основном путем окисления аммиака по процессу Оствальда. Небольшие количества получают при обработке нитрата натрия серной кислотой. Азотная кислота также является компонентом кислотных дождей.
Спецификации
Азотная кислота Спецификация TCC – Нажмите здесь, чтобы загрузить
Информация о доставке
Азотная кислота TCC доступна для доставки по всей континентальной части США со сроком поставки одна (1) неделя. Подробности уточняйте по телефону (401) 360-2800. Азотная кислота отгружается наливом, в контейнерах (цистернах IBC) и в бочках.
Азотная кислота TCC (HNO 3 ) представляет собой сильно коррозионную и токсичную сильную минеральную кислоту, которая обычно бесцветна, но имеет тенденцию приобретать желтый оттенок из-за накопления оксидов азота при длительном хранении. Обыкновенная азотная кислота имеет концентрацию 68%. Когда раствор содержит более 86% HNO3, его называют дымящей азотной кислотой.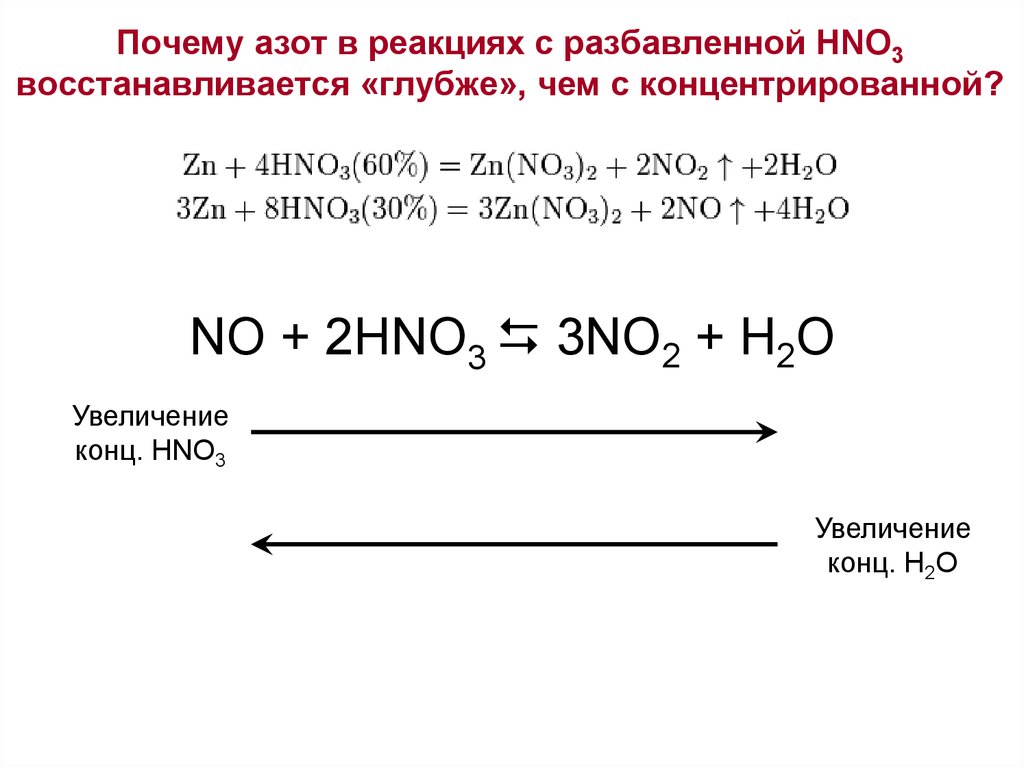 В зависимости от количества присутствующего диоксида азота дымящаяся азотная кислота далее характеризуется как белая дымящаяся азотная кислота или красная дымящаяся азотная кислота, концентрации выше 95%. Азотная кислота также широко используется в качестве сильного окислителя.
В зависимости от количества присутствующего диоксида азота дымящаяся азотная кислота далее характеризуется как белая дымящаяся азотная кислота или красная дымящаяся азотная кислота, концентрации выше 95%. Азотная кислота также широко используется в качестве сильного окислителя.
Кислота азотная безводная чистая (100 %) представляет собой бесцветную подвижную жидкость плотностью 1,512 г/см2, затвердевающую при -42°С с образованием белых кристаллов. Она кипит при 83°С. Следовательно, безводную азотную кислоту следует хранить при температуре ниже 0°С во избежание разложения.
Азотную кислоту получают реакцией двуокиси азота (NO 2 ) с водой. Обычно оксид азота, образующийся в результате реакции, повторно окисляется кислородом воздуха с образованием дополнительного количества диоксида азота. Добавляя серную кислоту к азотнокислой соли и нагревая смесь на масляной бане, можно получить почти чистую азотную кислоту. Конденсатор используется для конденсации паров азотной кислоты, выделяющихся из раствора.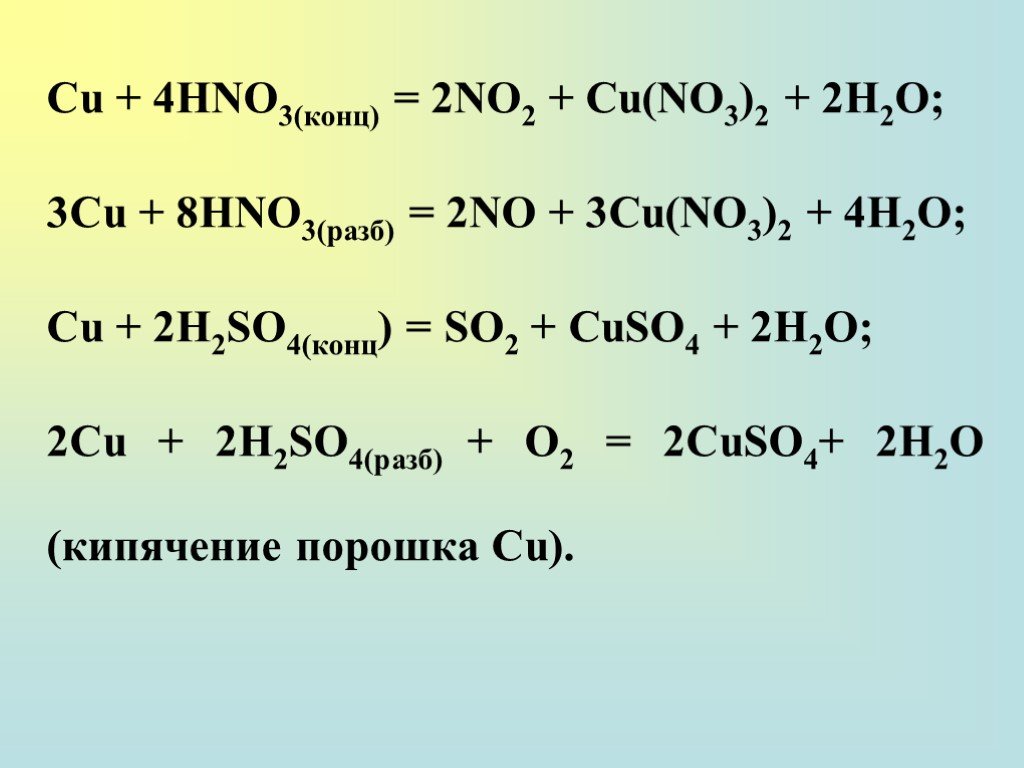
В промышленности крепкая азотная кислота производится путем растворения дополнительного количества диоксида азота в 68% азотной кислоте в абсорбционной колонне. Растворенные оксиды азота либо удаляются в случае белой дымящей азотной кислоты, либо остаются в растворе, образуя красную дымящую азотную кислоту. Совсем недавно были разработаны электрохимические средства для производства безводной кислоты из исходного концентрированного азотнокислого сырья.
Растворы азотной кислоты товарного сорта обычно содержат от 52% до 68% азотной кислоты. Производство азотной кислоты осуществляется по процессу Оствальда, названному в честь немецкого химика Вильгельма Оствальда. В этом процессе безводный аммиак окисляется до оксида азота в присутствии платинового или родиевого калибровочного катализатора при высокой температуре около 500 К и давлении 9бар.
Области применения
Азотная кислота используется в производстве аммиачной селитры для удобрений, изготовления пластмасс и красителей.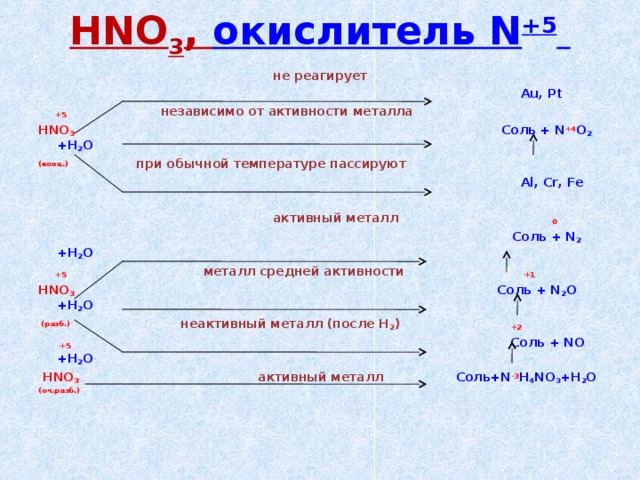 Он также используется для изготовления взрывчатых веществ, таких как нитроглицерин и тротил. При соединении его с соляной кислотой образуется элемент, называемый царской водкой. Это реагент, способный растворять золото и платину. Кроме того, он используется в колориметрическом тесте для различения героина и морфина.
Он также используется для изготовления взрывчатых веществ, таких как нитроглицерин и тротил. При соединении его с соляной кислотой образуется элемент, называемый царской водкой. Это реагент, способный растворять золото и платину. Кроме того, он используется в колориметрическом тесте для различения героина и морфина.
Азотная кислота обычно используется в научных лабораториях в школах для экспериментов при специальном тестировании на хлорид. Это достигается путем добавления образца с раствором нитрата серебра и азотной кислотой для проверки наличия белого осадка хлорида серебра. В области медицины азотная кислота используется в чистом виде как едкое средство для удаления шанкров и бородавок. Разведенные растворы применяют при лечении диспепсии.
Азотная кислота использовалась в различных формах в качестве окислителя в жидкостных ракетах. Эти формы включают красную дымящую азотную кислоту, белую дымящую азотную кислоту, смеси с серной кислотой и формы с ингибитором HF.
Он также обычно используется в процессе разложения образцов мутной воды, образцов твердого ила, а также других типов уникальных образцов, требующих элементного анализа с помощью ICP-MS, ICP-OES, ICP-AES, GFAA и пламенной атомной абсорбции.

 Показано, что при взаимодействии HNO3 с соединениями I ступени происходит ча-стичное разложение ИСГ и образование фазы нитрата графита. При взаимодействии HNO3 с соединениями II и III ступеней наблюдается образование тройных ИСГ со структурой типа «сэндвич» и чередованием слоев FeCl3-HNO3-FeCl3-графит и FeCl3-графит-HNO3-FeCl3-HNO3-графит соответственно. Установлены периоды идентичности для данных ТИСГ.
Анодной поляризацией графита в электролитах Fe(NO3)3 – h3O и Fe(NO3)3 – HNO3 – h3O получен окисленный графит, модифицированный соединениями желе-за. Показано, что нитрат железа (III) не образует интеркалированных соединений графита в условиях проведения эксперимента. Методами мессбауэровской спек-троскопии и сканирующей электронной микроскопии установлено, что железо в виде основной соли нитрата железа (III) сосредоточено на дефектах матрицы окис-ленного графита. Установлено и показано влияние условий синтеза окисленных графитов на насыпные плотности соответствующих пенографитов.
Термической обработкой модифицированного окисленного графита получен пенографит, содержащий оксиды железа.
Показано, что при взаимодействии HNO3 с соединениями I ступени происходит ча-стичное разложение ИСГ и образование фазы нитрата графита. При взаимодействии HNO3 с соединениями II и III ступеней наблюдается образование тройных ИСГ со структурой типа «сэндвич» и чередованием слоев FeCl3-HNO3-FeCl3-графит и FeCl3-графит-HNO3-FeCl3-HNO3-графит соответственно. Установлены периоды идентичности для данных ТИСГ.
Анодной поляризацией графита в электролитах Fe(NO3)3 – h3O и Fe(NO3)3 – HNO3 – h3O получен окисленный графит, модифицированный соединениями желе-за. Показано, что нитрат железа (III) не образует интеркалированных соединений графита в условиях проведения эксперимента. Методами мессбауэровской спек-троскопии и сканирующей электронной микроскопии установлено, что железо в виде основной соли нитрата железа (III) сосредоточено на дефектах матрицы окис-ленного графита. Установлено и показано влияние условий синтеза окисленных графитов на насыпные плотности соответствующих пенографитов.
Термической обработкой модифицированного окисленного графита получен пенографит, содержащий оксиды железа.