Азотная кислота, HNO3, химические свойства, получение
1
H
ВодородВодород
1,008
1s1
2,2
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
ГелийГелий
4,0026
1s2
Бесцветный газ
t°кип=-269°C
3
Li
ЛитийЛитий
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
БериллийБериллий
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
БорБор
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
УглеродУглерод
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
7
N
АзотАзот
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
КислородКислород
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
ФторФтор
18,998
2s2 2p5
4,0
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
НеонНеон
20,180
2s2 2p6
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
НатрийНатрий
22,990
3s1
0,93
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
МагнийМагний
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
АлюминийАлюминий
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
КремнийКремний
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
ФосфорФосфор
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
СераСера
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
ХлорХлор
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
АргонАргон
39,948
3s2 3p6
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
19
K
КалийКалий
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
КальцийКальций
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
СкандийСкандий
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
ТитанТитан
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип=3260°C
23
V
ВанадийВанадий
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
ХромХром
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
МарганецМарганец
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
ЖелезоЖелезо
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
КобальтКобальт
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
НикельНикель
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
МедьМедь
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
ЦинкЦинк
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
t°кип=907°C
31
Ga
ГаллийГаллий
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
ГерманийГерманий
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
МышьякМышьяк
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
СеленСелен
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°пл=217°C
t°кип=685°C
35
Br
БромБром
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
КриптонКриптон
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
РубидийРубидий
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
СтронцийСтронций
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
ИттрийИттрий
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
ЦирконийЦирконий
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
НиобийНиобий
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
МолибденМолибден
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
ТехнецийТехнеций
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
РутенийРутений
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
РодийРодий
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
ПалладийПалладий
106,42
4d10
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
СереброСеребро
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
КадмийКадмий
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
ИндийИндий
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
ОловоОлово
118,71
5s2 5p2
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
СурьмаСурьма
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
ТеллурТеллур
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
ИодИод
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
КсенонКсенон
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
ЦезийЦезий
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
БарийБарий
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
ЛантанЛантан
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
ЦерийЦерий
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
ПразеодимПразеодим
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
НеодимНеодим
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
ПрометийПрометий
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
СамарийСамарий
150,36
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
ЕвропийЕвропий
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
ГадолинийГадолиний
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
ТербийТербий
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
ДиспрозийДиспрозий
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
ГольмийГольмий
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
ЭрбийЭрбий
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
ТулийТулий
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
ИттербийИттербий
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
ЛютецийЛютеций
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
ГафнийГафний
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
ТанталТантал
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
ВольфрамВольфрам
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
РенийРений
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
ОсмийОсмий
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
ИридийИридий
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
ПлатинаПлатина
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
ЗолотоЗолото
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
РтутьРтуть
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
ТаллийТаллий
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
СвинецСвинец
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
ВисмутВисмут
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
ПолонийПолоний
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
АстатАстат
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
РадонРадон
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
ФранцийФранций
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
РадийРадий
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
АктинийАктиний
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
ТорийТорий
232,04
f-элемент
Серый мягкий металл
91
Pa
ПротактинийПротактиний
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
УранУран
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
НептунийНептуний
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
ПлутонийПлутоний
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
АмерицийАмериций
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
КюрийКюрий
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
БерклийБерклий
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
КалифорнийКалифорний
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
ЭйнштейнийЭйнштейний
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
ФермийФермий
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
МенделевийМенделевий
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
НобелийНобелий
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
ЛоуренсийЛоуренсий
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
РезерфордийРезерфордий
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
ДубнийДубний
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
СиборгийСиборгий
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
БорийБорий
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
ХассийХассий
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
МейтнерийМейтнерий
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
ДармштадтийДармштадтий
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
Ответы на контрольную работу по теме «Неметаллы» (Габриелян) решебник
Вариант 1.
ЧАСТЬ А. Тестовые задания с выбором ответа
1. Заряд ядра атома +8 имеют атомы химического элемента:
Б. Кислорода.
2. Число общих электронных пар в молекуле хлора:
В. Три.
3. Ковалентная полярная связь имеется в молекуле вещества, формула которого:
Б. СО2.
4. Степень окисления азота в ряду веществ, формулы которых N2—NO—NО2—HNО3:
А. Повышается от 0 до +5.
5. Структурная формула водородного соединения элемента Э главной подгруппы VI группы Периодической системы:
В. Н—Э—Н.
6. Уравнение химической реакции h3S + С12 = 2НС1 + S соответствует схеме превращения хлора:
A. Cl0→Cl-1
7. Вещество X в ряду превращений С02→ X→Са(НСО3)2→ CО2↑ имеет формулу:
В. СаСО3.
8. Реактивом на хлорид-анион является катион:
Реактивом на хлорид-анион является катион:
Б. Ag+.
9. Химическая реакция возможна между веществами, формулы которых:
Г. h3SО4 и MgO.
10. Оксид азота (IV) образуется при взаимодействии веществ, формулы которых:
В. НNО3(конц) и Ag.
ЧАСТЬ Б. Задания со свободным ответом
11. Запишите уравнения реакций, с помощью которых можно осуществить превращения согласно схеме:
2P + 3Zn = Zn3P2
Zn3P2 + 3h3O + 4O2 = 3Zn(OH)2 + P2O5
P2O5 + 3h3O = 2h4PO4
2h4PO4 + 6Na = 2Na3PO4 + 3h3
Na3PO4 + 3AgNO3 = Ag3PO4↓+ 3NaNO3
12. Превращение 2 из задания 11 рассмотрите с точки зрения ОВР.
Zn3P2-3 + 3h3O + 4O20 = 3Zn(OH)2 + P2+5O5-2
O2 0 → 2O -2 +2 e, окислитель
P -3 → P +5 – 8 е, восстановитель
13. Из задания 11 выберите реакцию ионного обмена и запишите ее в ионном виде.
Na3PO4 + 3AgNO3 = Ag3PO4↓ + 3NaNO3
3Na+ + PO4 3-+ 3Ag+ + 3NO3- = Ag3PO4↓+ 3Na+ + 3NO3-
PO4 3-+ 3Ag+= Ag3PO4↓
14. Вычислите массу (в кг) хлороводорода, который получается при взаимодействии 4,48 м3 хлора с избытком водорода.
Вычислите массу (в кг) хлороводорода, который получается при взаимодействии 4,48 м3 хлора с избытком водорода.
n(Cl2) = 4480дм3/22,4 дм3/моль = 200моль
n (НСl) = 2n (Cl2) = 400 моль
m (НСl) = 400моль*36,5г/моль = 14600 г = 14,6 кг
15. Назовите химический элемент, имеющий изотоп, в ядре которого отсутствуют нейтроны.
водород
Вариант 2.
ЧАСТЬ А. Тестовые задания с выбором ответа
1. Заряд ядра атома +17 имеют атомы химического элемента:
Г. Хлора.
2. Число общих электронных пар в молекуле водорода:
А. 1.
3. Ковалентная неполярная связь имеется в молекуле вещества, формула которого:
А. N2.
4. Степень окисления фосфора в ряду веществ, формулы которых Са3Р2—Р—Р2О3—Р2О5:
Б. Повышается от -3 до +5.
5. Структурная формула водородного соединения элемента Э главной подгруппы V группы Периодической системы:
Г. Н—Э—Н.
Н
6. Уравнение химической реакции 2SО2 + О2 = 2SО3 соответствует схеме превращения серы:
В. S+4→ S+6.
S+4→ S+6.
7. Вещество X в ряду превращений N2→ Nh4→ X→ NО2 имеет формулу:
Б. NO.
8. Реактивом на карбонат-анион является катион:
А. Н+.
9. Химическая реакция возможна между веществами, формулы которых:
В. Р2О5 и NaOH.
10. Оксид серы (IV) не образуется при взаимодействии веществ, формулы которых:
Г. СаСО3 и h3SО4.
ЧАСТЬ Б. Задания со свободным ответом
11. Запишите уравнения реакций, с помощью которых можно осуществить превращения согласно схеме:
1. Mg + S = MgS
2. 2 MgS + ЗО2 = 2MgО + 2SО2↑,
3. 2SO2 + O2 = 2SO3
4. SO3 + Na2O = Na2SO4
5. Na2SO4 + BaCl2 = BaSO4 ↓+ 2NaCl
12. Превращение 2 из задания 11 рассмотрите с точки зрения ОВР.
2 MgS-2 + ЗО20 = 2MgО-2 + 2S+4О2-2↑,
S-2 → S+4 , -6e, восстановитель
O20 → 2O-2 +2*2е, окислитель
13. Из задания 11 выберите реакцию ионного обмена и запишите ее в ионном виде.
Na2SO4 + BaCl2 = BaSO4 ↓+ 2NaCl
SO42- + Ba2+ = BaSO4 ↓
14. Вычислите массу (в кг) аммиака, который получается при взаимодействии 2 кмоль азота с избытком водорода.
Вычислите массу (в кг) аммиака, который получается при взаимодействии 2 кмоль азота с избытком водорода.
N2 + 3h3 = 2Nh4
n(Nh4) = 2n(N2) = 4кмоль = 4000 моль
m(Nh4) = 4000 моль *17 г/моль = 68000 г = 68 кг.
15. Назовите химический элемент, который в соединениях никогда не проявляет положительную степень окисления.
Фтор
Вариант 3.
ЧАСТЬ А. Тестовые задания с выбором ответа
1. Заряд ядра атома +14 имеют атомы химического элемента:
В. Кремния.
2. Число общих электронных пар в молекуле брома:
А. 1.
3. Ковалентная полярная связь имеется в веществе, формула которого:
Б. h3S.
4. Степень окисления серы в ряду веществ, формулы которых SО3—SО2—S—h3S:
Г. Понижается от +6 до -2.
5. Структурная формула водородного соединения элемента Э главной подгруппы VII группы Периодической системы:
А. Н—Э.
6. Уравнение химической реакции 4Nh4 + 5О2 = 4NO + 6Н2О соответствует схеме превращения азота:
В. N-3→ N+2.
N-3→ N+2.
7. Вещество X в ряду превращений РН3→ Р2О5 → X→ Са3(РО4)2 имеет формулу:
А. Н3РО4.
8. Реактивом на сульфат-анион является катион:
В. Ва2+.
9. Химическая реакция возможна между веществами, формулы которых:
А. СО2 и NaOH.
10. Оксид углерода (IV) образуется при взаимодействии веществ, формулы которых:
Б. СаСО3 и НС1.
ЧАСТЬ Б. Задания со свободным ответом
11. Запишите уравнения реакций, с помощью которых можно осуществить превращения согласно схеме:
Sih5→ SiО2 →Na2SiО3→ h3SiО3 →SiО2→ Si.
1. Sih5 + 2O2 = SiO2 + 2h3O
2. SiO2 + Na2O = Na2SiO3
3. Na2SiO3 + 2HCl = h3SiO3↓ + 2NaCl
4. h3SiO3 = SiO2 + h3O
5. SiO2+2C—> Si + 2CO
12. Превращение 5 из задания 11 рассмотрите с точки зрения ОВР.
Si+4O2+2C0—> Si0 + 2C+2O
Si+4 →Si0 +4е, окислитель
C0 →C+2 -2е, восстановитель
13. Из задания 11 выберите реакцию ионного обмена и запишите ее в ионном виде.
Na2SiO3 + 2HCl = h3SiO3↓ + 2NaCl
SiO32- + 2H+ = h3SiO3↓
14. Вычислите массу (в кг) хлорида аммония, который образуется при взаимодействии 11,2 м3 хлороводорода с избытком аммиака.
HCl + Nh4 = Nh5Cl
n(HCl) = n(Nh5Cl) = 11200 дм3/ 22,4 дм3/моль = 500 моль
m(Nh5Cl) = 500 моль *56,5 г/моль = 28250 г = 28,250 кг.
15. Расположите химические элементы фосфор, кислород, серу, хлор в порядке увеличения неметаллических свойств.
Фосфор, сера, кислород, хлор
Вариант 4.
ЧАСТЬ А. Тестовые задания с выбором ответа
1. Заряд ядра атома +16 имеют атомы химического элемента:
В. Серы.
2. Число общих электронных пар в молекуле азота:
В. 3.
3. Ковалентная неполярная связь имеется в веществе, формула которого:
В. О2.
4. Степень окисления углерода в ряду веществ, формулы которых СН4—С—СО—СО2:
Б. Повышается от -4 до +4.
5. Структурная формула водородного соединения элемента Э главной подгруппы IV группы Периодической системы:
В.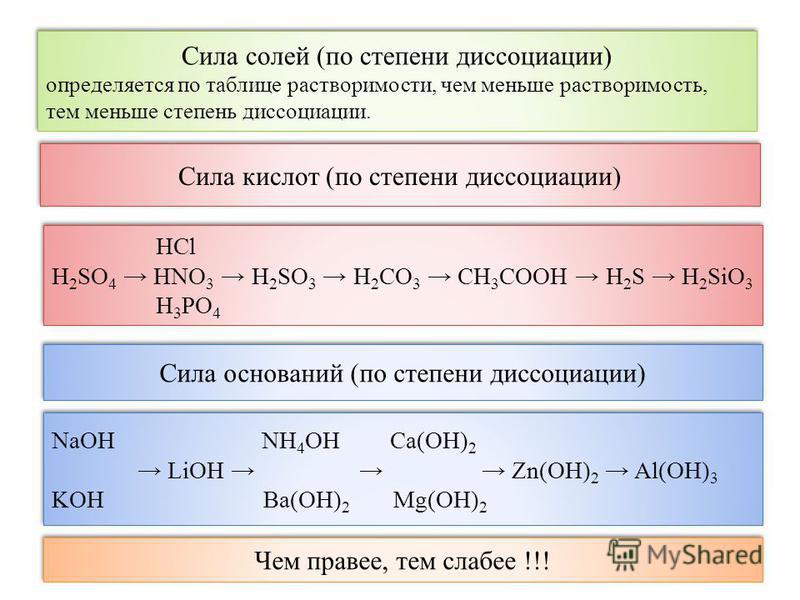 Н—Э—Н
Н—Э—Н
6. Уравнение химической реакции Си + 4HNО3 = CU(NО3)2 + 2NО2↑ + 2Н2О соответствует схеме превращения азота:
Г. N+5 →N+4.
7. Вещество X в ряду превращений S→ S02→ X→ Na2SО3 имеет формулу:
Г. h3SО3.
8. Реактивом на фосфат-анион является катион:
Г. Ag+.
9. Химическая реакция возможна между веществами, формулы которых:
Б. СО2 и Са(ОН)2.
10. Кремниевая кислота образуется при взаимодействии веществ, формулы которых:
В. Na2SiО3 и НС1.
ЧАСТЬ Б. Задания со свободным ответом
11. Запишите уравнения реакций, с помощью которых можно осуществить превращения согласно схеме:
N2 →Nh4 →NО→NО2→ HNО3→ KNО3.
1. N2 + 3h3 =2Nh4
2. 4Nh4 + 5O2 = 4NO + 6h3O
3. 2NO + O2 = 2NO2
4. 4NO2 + О2 + 2Н2О → 4HNO3
5. HNO3 + KOH =KNO3 + h3O
12. Превращение 2 в задании 11 рассмотрите с точки зрения ОВР.
4N-3h4 + 5O20 = 4N+2O-2 + 6h3O
N-3 ->N+2, -5е, восстановитель
O20-> 2O-2 ,+ 2*2е, окислитель
13. Из задания 11 выберите реакцию ионного обмена и запишите ее в ионном виде.
Из задания 11 выберите реакцию ионного обмена и запишите ее в ионном виде.
HNO3 + KOH =KNO3 + h3O
H+ + OH- = h3O
14. Вычислите массу (в кг) оксида серы (IV), образовавшегося при сгорании 4,48 м3 сероводорода в избытке кислорода.
2h3S + 3O2 = 2SO2 + 2h3O
n(h3S) = n(SO2) = 44800 дм3/ 22,4 дм3/моль = 2000 моль
m(SO2) = 2000 моль *64 г/моль = 128000 г = 128 кг
15. Назовите химический элемент самый распространенный:
А. В земной коре:
кислород
Б. Во Вселенной:
водород
какова моляльность азотной кислоты в концентрированном растворе азотной кислоты (68% HNO3 по массе)?
Химия
АФФАР Б.
спросил 24.10.19Подписаться І 1
Подробнее
Отчет
3 ответа от опытных наставников
Лучший Новейшие Самый старыйАвтор: Лучшие новыеСамые старые
Джесси Э. ответил 24.10.19
ответил 24.10.19
Репетитор
4.6 (8)
Магистр химии и бакалавр биологии
См. таких репетиторов
Смотрите таких репетиторов
Молярность, m, определяется как количество молей растворенного вещества на кг растворителя. Для этой задачи нам нужно сначала найти моли растворенного вещества, а затем массу растворителя.
1.) Моли растворенного вещества:
68% HNO3 по массе означает, что на каждые 68 граммов HNO3 приходится 32 грамма воды, которая считается растворителем, если не указано иное. HNO3 имеет молекулярную массу 63,018 грамма на моль. Мы используем размерный анализ для определения молей:
68 граммов x (1 моль/63,018 грамма) = 1,08 моля.
2.) Масса растворителя
Чтобы найти количество растворителя, вычитаем количество растворенного вещества из суммы: 100 грамм — 68 грамм = 32 грамма воды. Затем мы переводим это в килограммы.
Затем мы переводим это в килограммы.
32 грамма (1 кг/1000 г) = 0,032 кг.
Теперь у нас есть все, что нужно. Чтобы найти моляльность, мы разделим моли растворенного вещества на растворитель.
моляльность (m) = 1,08 моль/0,032 кг = 33,75 моль/кг
Голосовать за 1 голос против
Подробнее
Отчет
Дж. Р. С. ответил 24.10.19
Репетитор
5,0 (140)
к.т.н. Профессор университета со стажем репетиторства более 10 лет
Об этом репетиторе ›
Об этом репетиторе ›
68% HNO3 по массе = 68 г HNO3/100 г раствора
Чтобы найти моляльность, нам нужно знать количество молей HNO3 и кг воды вода = 100 г — 68 г = 32 г x 1 г/1000 кг = 0,032 кг воды
Моляльность = моль/кг растворителя = 1,08 моль/0,032 кг = 33,8 м
Голосовать за 1 голос против
Подробнее
Отчет
Тони М.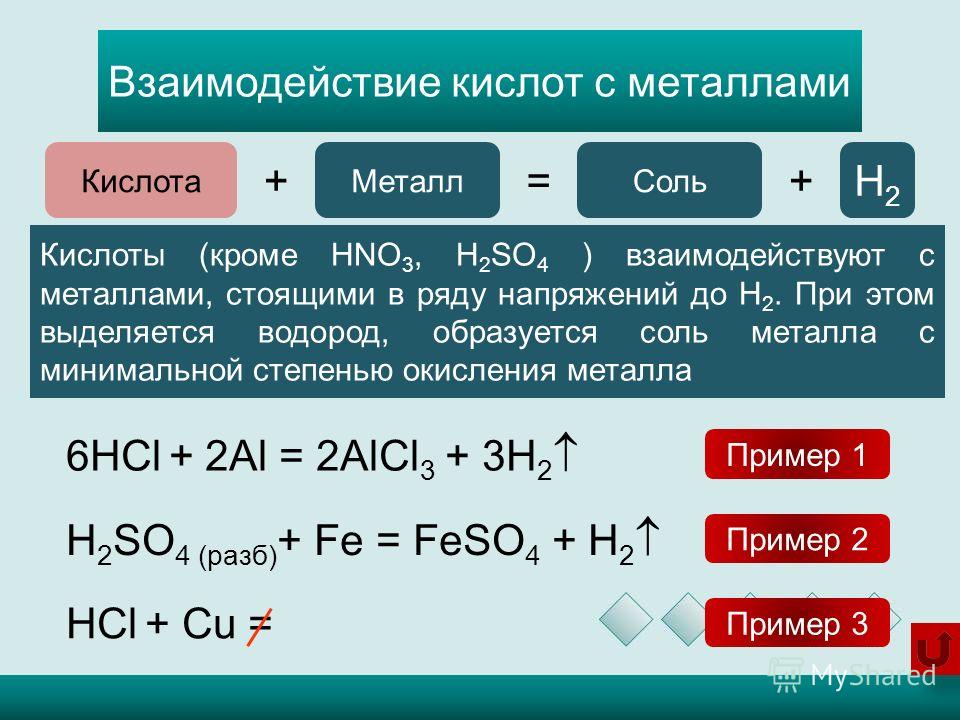 ответил 24.10.19
ответил 24.10.19
Репетитор
4.7 (177)
Несколько лет преподавания курсов химии в колледже начального уровня
Об этом репетиторе ›
Об этом репетиторе ›
Во-первых, что такое моляльность? Моляльность – моли растворенного вещества/кг растворенного вещества
Чтобы получить моли растворенного вещества, нам нужно знать молекулярную массу HNO 3 = 63,013 г/моль
Концентрированный раствор азотной кислоты – это 68% HNO 3 по массе что означает, что на 100 граммов раствора приходится 68 граммов HNO 3 . Если в растворе 68 граммов HNO 3 , то должно быть 32 грамма воды, растворителя.
Расчет можно произвести следующим образом:
Моляльность = моли HNO 3 /кг растворенного вещества = (68 граммов HNO 3 /32 грамма растворенного вещества)(1 моль HNO 3 /63,013 г)(10013 г) /1 кг) = 34 м
Голосовать за 0 голос против
Подробнее
Отчет
Все еще ищете помощи? Получите правильный ответ, быстро.

Задайте вопрос бесплатно
Получите бесплатный ответ на быстрый вопрос.
Ответы на большинство вопросов в течение 4 часов.
ИЛИ
Найдите онлайн-репетитора сейчас
Выберите эксперта и встретьтесь онлайн. Никаких пакетов или подписок, платите только за то время, которое вам нужно.
Расчет отчетных вододиссоциируемых нитратов
Используйте эту таблицу для расчета приблизительного количества нитратов, образующихся на вашем предприятии в результате нейтрализации азотной кислоты.
Начать
- Загрузите калькулятор растворимых в воде нитратных соединений (электронная таблица).
- Загрузите информационный бюллетень: Отчетность о растворимых в воде нитратах (PDF).

- Соберите информацию о вашем учреждении о количестве азотной кислоты, используемой в год.
Дополнительные ресурсы для
Использование инструмента для расчета нитратов
- Введите соответствующую информацию в каждую из заштрихованных областей.
- Суммарное образование растворимых в воде нитратных соединений в килограммах и фунтах приведено в последней строке.
- Инструкции по расчету «эффективности очистки» см. в руководстве Агентства по охране окружающей среды США по отчетности о растворимых в воде нитратах.
- Если известна молекулярная масса образовавшегося нитратного соединения, введите это значение в поле «Молекулярная масса нитратного соединения (кг/кмоль)». Если вы не уверены, каким может быть полученное нитратное соединение, молекулярная масса NaNO3 (84,99 кг/кмоль) можно использовать по умолчанию.
Пример расчета порога
В этом примере азотная кислота (HNO3) нейтрализуется гидроксидом натрия (NaOH), образуя нитратные соединения в форме нитрата натрия (NaNO3). Этот расчет определяет количество азотной кислоты (в фунтах), которое предприятие должно нейтрализовать, чтобы превысить пороговые значения отчетности EPCRA/TURA.
Этот расчет определяет количество азотной кислоты (в фунтах), которое предприятие должно нейтрализовать, чтобы превысить пороговые значения отчетности EPCRA/TURA.
Реакция нейтрализации: HNO3 + NaOH -> NaNO3 + h3O
Сначала определите молекулярную массу HNO3 и NaNO3.
МВт HNO3 = 1 x 63 кг/кмоль
МВт NaNO3 = 1 x 85 кг/кмоль просто разделите молекулярную массу HNO3 на молекулярную массу NaNO3. Это дает соотношение нейтрализованной HNO3 и образовавшегося NaNO3 в терминах их молекулярных масс.
(63 кг/кмоль HNO3)/(85 кг/кмоль NaNO3) = 0,74
В-третьих, умножьте это соотношение на пороговый уровень отчетности для NaNO3.
Порог составляет 25 000 фунтов в год.
(0,74)(25 000 фунтов) = 18 529 фунтов.
В этом примере установка, нейтрализующая 18 529 фунтов или более HNO3 в год с помощью NaOH, превысит порог отчетности в 25 000 фунтов и должна отчитываться по EPCRA и TURA. Дополнительную информацию см. в соответствующих правилах требований к отчетности.
Дополнительную информацию см. в соответствующих правилах требований к отчетности.
Уведомление об инструменте расчета нитратов и сценариях отчетности
Этот расчет предоставляется «как есть» без явных или подразумеваемых гарантий. Из-за разнообразия условий, в которых может использоваться эта программа, она может не соответствовать вашим требованиям.
Хотя азотная кислота сама по себе является химическим веществом, подлежащим регистрации в соответствии с разделом 313 Закона о праве на информацию о планировании действий в чрезвычайных ситуациях (EPCRA) (также известного как Реестр выбросов токсичных веществ) и Закона штата Массачусетс о сокращении использования токсичных веществ (TURA), объекты также должны быть известно, что побочный продукт нейтрализации азотной кислоты образует растворимые в воде нитратные соединения, о которых сообщается выше определенных пороговых уровней в соответствии с EPCRA и TURA.
Пороговое значение для сообщения о случайно произведенных растворимых в воде нитратных соединениях в соответствии с EPCRA и TURA составляет 25 000 фунтов в год. Для получения полной информации предприятиям следует обращаться к руководству Агентства по охране окружающей среды США по отчетности о растворимых в воде нитратных соединениях.
Для получения полной информации предприятиям следует обращаться к руководству Агентства по охране окружающей среды США по отчетности о растворимых в воде нитратных соединениях.
Помогите нам улучшить Mass.gov своими отзывами
Вы нашли то, что искали на этой веб-странице?Если у вас есть предложения по сайту, сообщите нам. Как мы можем улучшить страницу? *
Пожалуйста, не указывайте личную или контактную информацию.
Отзывы будут использованы только для улучшения сайта. Если вам нужна помощь, обратитесь в Управление технической помощи и технологий (OTA). Пожалуйста, ограничьте ввод до 500 символов.
Пожалуйста, удалите любую контактную информацию или личные данные из вашего отзыва.
Если вам нужна помощь, обратитесь в Управление технической помощи и технологий (OTA).
Пожалуйста, сообщите нам, как мы можем улучшить эту страницу.

