Лучший ответ по мнению автора | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||
|
|
| |||||||||||||||||||||||||||||||||||||||||||||||||||
Посмотреть всех экспертов из раздела Учеба и наука > Химия
| Похожие вопросы |
Структурная формула всех изомеров С7Н16
В воде средней жесткости (р=1 г/см3) концентрация ионов Mg 2+ составляет 4,0 *10-4 моль/дм3. Указать количество вещества (%) гидрокарбоната магния в этой воде ( других соединений магния в воде нет)
Указать количество вещества (%) гидрокарбоната магния в этой воде ( других соединений магния в воде нет)
В каком году была сформулирована теория — предшественница кислородной теории горения.
электронный баланс Nh4+O2=NO+h3O
Массовая доля углерода в соединении равна 83.3%, водорода — 16.7%. Определите строение вещества, если известно, что при его бромировании образуется только одно монобромпроизводное.
Как решать 33 задание ЕГЭ по химии, примеры и алгоритмы решения
Решение расчётных задач по химии подчиняется логике и проводится по определенным алгоритмам. Прежде всего, нужно внимательно прочитать и проанализировать условие задачи, написать необходимые уравнения химических реакций. Важно осознать ключевой (главный) вопрос в задаче и понять, количество какого вещества следует найти и по количеству какого вещества будет производиться расчёт. На основе анализа условия определить причинно-следственные связи и составить план последовательности решения задачи. Почему мы главным вопросом задачи считаем нахождение количества вещества? По количеству вещества всегда можно найти его массу, объём и массу раствора (массу и объём газа) и ответить на возможные дополнительные вопросы, содержащиеся в задаче.
Почему мы главным вопросом задачи считаем нахождение количества вещества? По количеству вещества всегда можно найти его массу, объём и массу раствора (массу и объём газа) и ответить на возможные дополнительные вопросы, содержащиеся в задаче.
В рассматриваемых примерах мы не будем пояснять выполнение формальных расчётов, предполагая, что вы проводите их без затруднений.
Пример 1. Электролиз 470 г 5%-ного раствора нитрата меди(II) прекратили после того, как масса раствора уменьшилась на 8 г. Из полученного раствора отобрали порцию массой 92,4 г. Вычислите массу 11,2 %-ного раствора едкого кали, необходимого для полного осаждения меди из отобранной порции раствора.
| Дано: | Анализ и решение: |
А) Проводим анализ условия
(составляем уравнения химических реакций, о которых упоминается в условии задачи).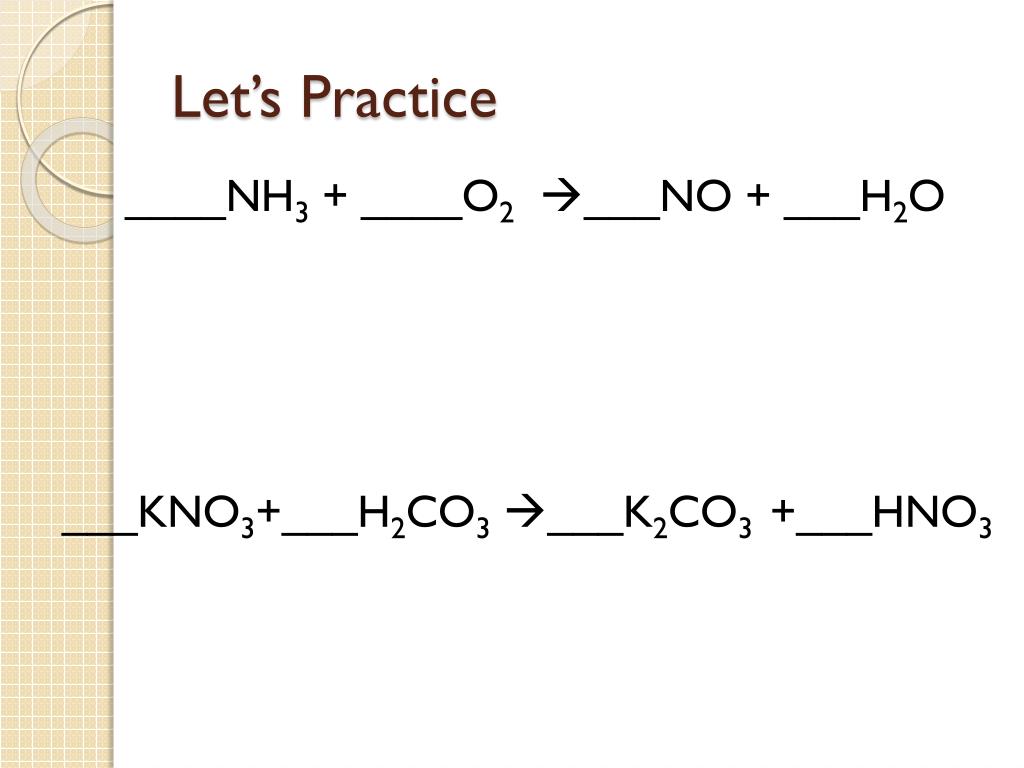
1-й фрагмент.
«Электролиз 470 г 5%-ного раствора нитрата меди(II) прекратили… ».
При проведении этого этапа стараемся не обращать внимания на численные значения, а выделяем только химическую часть условия – она выделена в тексте фрагмента полужирным шрифтом.
2-й фрагмент.
«…Из полученного раствора отобрали порцию массой 92,4 г. Вычислите массу 11,2 %-ного раствора едкого кали, необходимого для полного осаждения меди из отобранной порции раствора».
Необходимо понять: в смеси после реакции находятся продукты реакции (Cu, O2, HNO3) и исходные вещества, которые не прореагировали, были «в избытке» (Cu(NO3)2, h3O), и следует рассматривать возможность взаимодействия каждого из этих веществ с добавляемым реагентом.
Б) Устанавливаем логические связи
(формулируем главный вопрос задачи, т. е. находим вещество, количество которого необходимо рассчитать, и логическую цепочку, связывающую количество этого вещества с веществами, количество которых мы знаем или можем вычислить).
е. находим вещество, количество которого необходимо рассчитать, и логическую цепочку, связывающую количество этого вещества с веществами, количество которых мы знаем или можем вычислить).
Главный вопрос – найти количество KOH (прореагировавшего с HNO3 и Cu(NO3)2, находящимися в отобранной части раствора).
Выводы (логическая цепочка):
При проведении расчётов будем использовать уменьшение массы раствора на 8 г (единственная количественная величина, относящаяся к протеканию реакции), которое происходит за счёт осаждения меди и выделения кислорода.
1) Количество KOH связано с количеством Cu(NO3)2 и HNO3 в порции раствора (уравнения (2) и (3)).
2) Количество HNO3 связано с количеством Cu и O2, которые образовались в процессе электролиза (уравнение (1)).
3) Количество Cu(NO3)2 в растворе после электролиза (избыток Cu(NO3)2) связано с количеством выделившихся Cu и O2.
В) План решения задачи.
1) Найти количество Cu(NO3)2 до электролиза.
2) Найти количество образовавшейся HNO3 по количеству выделившихся Cu и O2 (уравнение 1).
3) По уменьшению массы (т.е. по количеству выделившихся Cu и O2) найти количество прореагировавшего Cu(NO3)2 по уравнению (1).
4) Найти количество непрореагировавшего Cu(NO3)2.
5) Найти количество Cu(NO3)2 и HNO3в отобранной порции раствора.
6) По количеству Cu(NO3)2 и HNO3 в порции найти количество прореагировавшего KOH.
7) Вычислить массу раствора KOH.
Г) Решение.
1) Находим количество вещества Cu(NO3)2 до электролиза.
2) По уравнению (1) находим количество прореагировавшего Cu(NO3)2:
Пусть прореагировало x моль Cu(NO3)2, тогда
г)
3) По уравнению (1) находим количество прореагировавшего HNO3:
г)
4) Находим количество вещества Cu(NO3)2 и HNO3 в отобранной порции раствора.
а)
б) находим количество вещества Cu(NO3)2 с помощью пропорции – концентрация вещества одинакова как во всём растворе, так и в любой его части
а)
в) находим количество вещества HNO3 в отобранной порции:
а)
5) Находим количество KOH и массу добавленного раствора KOH.
а) По уравнению (2).
б) По уравнению (3).
в)
Пример 2. Насыщенный раствор нитрата алюминия получили, растворив кристаллогидрат Al(NO3)3·12h3O (растворимость 241 г в 100 г воды при 25 ºС) в 250 г воды. Полученный раствор разделили на две части. В первую добавили раствор Na2CO3 (избыток), во вторую 400 г раствора аммиака (избыток). Во второй колбе осадок в 4 раза тяжелее, чем в первой. Найдите концентрацию соли во второй колбе.
В ответе приведите уравнения реакций, которые указаны в условии задачи, и все необходимые вычисления (указывайте единицы измерения искомых физических величин).
| Дано: | Анализ и решение: |
А) Проводим анализ условия
Разбиваем условие на смысловые фрагменты, выделяем ключевые слова и понятия и составляем уравнения реакций (химическая часть задачи).
1-й фрагмент:
«Насыщенный раствор нитрата алюминия получили, растворив кристаллогидрат Al(NO3)3·12h3O (растворимость 241 г в 100 г воды при 25 ºС) в 250 г воды. Полученный раствор разделили на две части».
2-й фрагмент:
« В первую добавили раствор Na2CO3 (избыток), …»
3-й фрагмент:
«во вторую 200 г раствора аммиака (избыток)»
4-й фрагмент:
«Во второй колбе осадок в 4 раза тяжелее, чем в первой. Найдите концентрацию соли во второй колбе».
Найдите концентрацию соли во второй колбе».
Химических превращений нет.
Б) Устанавливаем логические связи (формулируем главный вопрос задачи, т.е. находим вещество, количество которого необходимо рассчитать, и логическую цепочку, связывающую количество этого вещества с веществами, количество которых мы знаем или можем вычислить).
Главный вопрос – найти количество Nh5NO3.
Выводы (логическая цепочка):
Единственная цифра, которую можно использовать при проведении расчётов, это «4» – отношение масс Al(OH)3, образовавшихся во 2-й и 1-й колбах.
В) План решения задачи.
1) Найти количество Al(NO3)3(общее).
2) Найти количество Al(NO3)3 в 1-й части (уравнение (1) по Al(OH)3.
3) Найти количество Al(NO3)3 во 2-й части (уравнение 2) по Al(OH)3.
4) Найти количество Nh5NO3 (по уравнению (3)) по количеству AlCl3 (2-я часть)).
5) Найти ω(Nh5NO3) по уравнению (3).
Г) Решение
1) Находим количество Al(NO3)3 в исходном растворе.
а) находим количество Al(NO3)3·12h3O, которое растворилось в 250 г воды:
Используя данные по растворимости (растворимость 241 г в 100 г воды при 25 ºС), составляем пропорцию,
б)
2) Находим количество Al(NO3)3, прореагировавшего по уравнениям (2) и (3):
Пусть по уравнению (1) прореагировало x моль Al(NO3)3, по уравнению (2) – y моль Al(NO3)3, тогда
а) x + y = 1,4
б) по уравнению (2):
в) по уравнению (3):
г)
3) По уравнению (3) находим количество Nh5NO3:
а)
4) По уравнению (3) находим количество образовавшегося Al(OH)3:
5) Находим массу 2-й части раствора Al(NO3)3.
Концентрация вещества в растворе и в любой его части одинакова, следовательно
6) Находим массовую долю Nh5NO3 в растворе:
а)
б)
Вернуться
Поделиться
H = 1, N = 14, O = 16]
Ответ
Проверено
211.2k+ просмотров как растворенное, так и растворяющее. Чтобы узнать моляльность раствора, разделите количество молей азотной кислоты на массу раствора в кг.
Полный пошаговый ответ:
Дано,
Процентное содержание раствора $HN{O_3}$ 12,2 %
Атомная масса водорода 1,
Атомная масса азота 14.
Атомная масса кислорода 16.
12,2 % раствор $HN{O_3}$ означает, что в 100 г раствора содержится 12,2 г $HN{O_3}$.
Молярная масса $HN{O_3}$ составляет 63 г/моль.
Формула для расчета количества молей приведена ниже.
$n = \dfrac{m}{M}$
Где
n — количество молей.
m – заданная масса
M – молярная масса
Чтобы вычислить количество молей азотной кислоты ($HN{O_3}$), подставьте значения массы и молярной массы в приведенное выше уравнение.
$\Rightarrow n = \dfrac{{12,2г}}{{63г/моль}}$
$\Rightarrow n = 0,194моль$
Масса воды 87,8г.
Молярная масса воды 18 г/моль.
Чтобы рассчитать количество молей воды, подставьте значения массы и молярной массы в приведенное выше уравнение.
$\Rightarrow n = \dfrac{{87,8 г}}{{18 г/моль}}$
$\Rightarrow n = 4,88 моль$
Формула для расчета мольной доли приведена ниже.
${X_A} = \dfrac{{{n_A}}}{{{n_A} + {n_B}}}$
Где
${X_A}$ — молярная доля соединения A.
${n_A}$ — количество молей соединения A.
${n_B}$ — количество молей соединения B.
Чтобы рассчитать мольную долю $HN{O_3}$, подставьте значения в приведенные выше уравнение.
$\Rightarrow {X_{HN{O_3}}} = \dfrac{{0,194моль}}{{0,194моль + 4,88моль}}$
$\Rightarrow {X_{HN{O_3}}} = 0,0396$
моляльность раствора определяется как количество растворенного вещества, растворенного в 1 кг раствора.
Формула для расчета моляльности показана ниже.
$m = \dfrac{n}{{Кг\;раствора}}$
Где
м — моляльность.
n — количество молей.
1000 г раствора = 1 кг.
Чтобы рассчитать моляльность, подставьте значение молей и массу раствора в кг в вышеприведенное уравнение.
$\Rightarrow m = \dfrac{{0,194моль}}{{1кг}}$
$\Rightarrow m = 0,194м$
Следовательно, молярная доля $HN{O_3}$ равна 0,0396, а моляльность равна 0,194 м .
Примечание:
Процентное содержание раствора выражается в массовых процентах, где указанное процентное содержание представляет собой массу растворенного вещества, а оставшееся процентное содержание в массе растворителя образует 100 % раствор.
Недавно обновленные страницы
В Индии по случаю бракосочетания фейерверк 12 класса химии JEE_Main
Щелочноземельные металлы Ba Sr Ca и Mg могут быть организованы 12 класса химии JEE_Main
Что из следующего имеет самый высокий электродный потенциал Химический класс 12 JEE_Main
Что из следующего является истинным пероксидом A rmSrmOrm2 Химический класс 12 JEE_Main
Какой элемент обладает наибольшим радиусом атомов Химический класс 11 JEE_Main
Фосфин получают из следующей руды А Кальций класса 12 по химии JEE_Main
В Индии по случаю бракосочетания фейерверков класс 12 по химии JEE_Main
Щелочноземельные металлы Ba Sr Ca и Mg могут быть отнесены к классу 12 по химии JEE_Main
Что из нижеперечисленного имеет самый высокий электродный потенциал Химический класс 12 JEE_Main
Что из следующего является истинным пероксидом A rmSrmOrm2 Химический класс 12 JEE_Main
Какой элемент обладает наибольшим атомным радиусом А Химический класс 11 JEE_Main
Фосфин получают из следующей руды A Химический класс кальция 12 JEE_Main
Тенденции сомнений
Расчеты с использованием моляльности, молярности, плотности, массовых процентов, мольных долей 1,836 г/мл и массовой доли H
2 SO 4 96,00%, найти молярность, моляльность и молярную долю.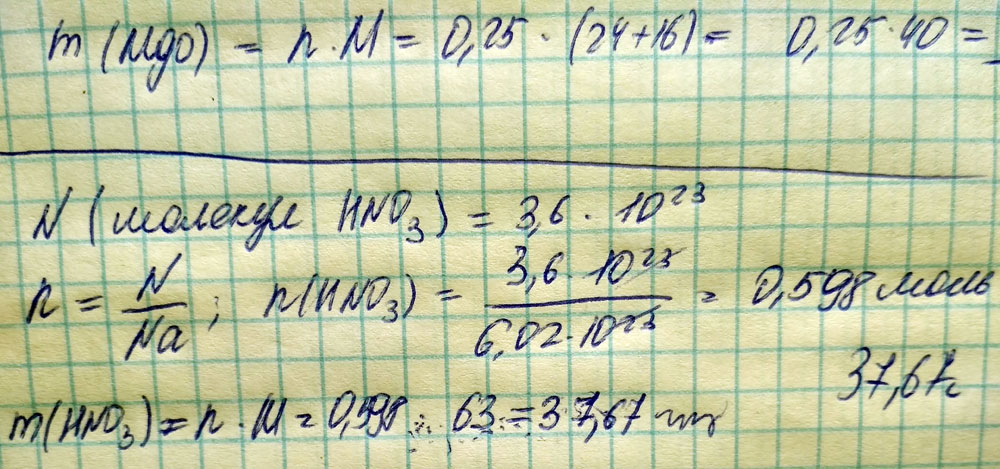 Молярная масса воды 18,015 г/моль, а молярная масса серной кислоты 9.8,078 г/моль. (Показаны два разных исходных предположения.)
Молярная масса воды 18,015 г/моль, а молярная масса серной кислоты 9.8,078 г/моль. (Показаны два разных исходных предположения.)1) Предположим, что имеется объем 1000 л раствора. Определить общую массу раствора:
17,9710 моль + 4,0766 моль = 22,0476 моль H 2 SO 4 —> 17,9710 моль / 22,0476 моль = 0,8151
H 2 O —> 4,0766 моль / 22,0476 моль = 0,1849
Часто последнюю молярную долю получают вычитанием:
Н 2 О —> 1 − 0,8151 = 0,1849
5) Определите молярность раствора:
17,9710 моль/1,000 л = 17,97 М (до четырех знаков фиг.)
6) Определите моляльность раствора:
73,44 г = 0,07344 кг17,9710 моль/0,07344 кг = 244,7 м
Скорпион реагирует.
Раствор при наличии определенной массы раствора:
1) Предположим, что имеется 100,0 г раствора. Определить массу каждого компонента раствора:
Н 2 SO 4 —> (100,0 г) (0,9600) = 96,00 г
H 2 O —> (100,0 г) (0,0400) = 4,00 г
2) Определите мольную долю:
H 2 SO 4 —> 96,00 г / 98,078 г/моль = 0,978813 моль
H 2 O —> 4,00 г / 18,015 г/моль = 0,222037 моль0,978813 моль + 0,222037 моль = 1,20085 моль
H 2 SO 4 —> 0,978813 моль / 1,20085 моль = 0,8151
H 2 O —> 0,222037 моль / 1,20085 моль = 0,1849или H 2 O можно получить вычитанием:
1 − 0,8151 = 0,1849
3) Определите моляльность:
4,00 г = 0,00400 кг0,978813 моль/0,00400 кг = 244,7 м
4) Определите молярность:
100,0 г / 1,836 г/мл = 54,46623 мл = 0,05446623 л0,978813 моль/0,05446623 л = 17,97 М
5) Кстати, этот раствор можно рассматривать как воду (растворенное вещество), растворенную в серной кислоте (растворитель). Рассчитайте моляльность воды:
Рассчитайте моляльность воды:
1762,56 г = 1,76256 кг4,0766 моль/1,76256 кг = 2,313 м
Пример #2: Учитывая плотность 1,769 г/мл и мольную долю H 2 SO 4 0,5000, найдите моляльность, молярность и процент по массе.
Решение:
1) Мы будем использовать молярную долю 0,5000, что означает, что 0,5000 моль присутствует в 1,0000 моль раствора. Определить массу каждой молярной доли:
Н 2 SO 4 —> (0,5000 моль) (98,078 г/моль) = 49,039 г
H 2 O —> (0,5000 моль) (18,015 г/моль) = 9,0075 г
Комментарий: Молярная доля 0,50 может означать 1,0 моль одного компонента в 2,0 общих молях. Использование 0,5 и 1 является простейшим значением мольной доли 0,5. Мы могли бы использовать любую комбинацию чисел, которая дает молярную долю 0,5. Окончательные ответы будут одинаковыми, но цифры в расчетах будут другими.
2) Определить массовую долю каждого компонента:
49,039 г + 9,0075 г = 58,0465 гH 2 SO 4 —> 49,039 г / 58,0465 г = 84,48%
H 2 O —> 9,0075 г / 58,0465 г = 15,52%Часто последний массовый процент получают вычитанием:
Н 2 О —> 100,00 − 84,48 = 15,52
3) Определите моляльность:
9,0075 г = 0,00кг
0,5000 моль/0,00
кг = 55,51 м
4) Определите молярность:
58,0465 г / 1,769 г/мл = 32,81 мл = 0,03281 л0,5000 моль/0,03281 л = 15,24 М
Пример #3: Учитывая плотность 1,059 г/мл и молярность H 2 SO 4 1,000 М, найдите моляльность, молярную долю и массовый процент.
Решение:
1) Предположим, что имеется 1,0000 л раствора. Определить массу раствора:
(1,059 г/мл) (1000,0 мл) = 1059 г
2) Определить массовую долю каждого компонента:
H 2 SO 4 —> 98,078 г (помните, это 1 М раствор)
H 2 O —> 1059 г − 98,078 г = 960,922 гH 2 SO 4 —> 100 − 90,74 = 9,26%
H 2 O —> 960,922 г / 1059 г = 90,74%Обратите внимание, что я вычислил большее значение делением, а меньшее значение вычитанием.
3) Определите мольную долю:
H 2 SO 4 —> 98,078 г / 98,078 г/моль = 1,000 моль (или просто помните, что это 1 М раствор)
H 2 O —> 960,922 г / 18,015 г/моль = 53,349 моль53,349 моль + 1,000 моль = 54,349 моль
H 2 SO 4 —> 1 − 0,9816 = 0,0184
H 2 O —> 53,349 моль / 54,349 моль = 0,9816
4) Определите моляльность:
960,922 г = 0,960922 кг1 000 моль / 0,960922 кг = 1,041 м
Пример #4: При плотности 1,122 г/мл и моляльности H 2 SO 4 4,500 m найдите молярность, молярную долю и массовый процент.
Решение:
1) Данная моляльность означает 4 500 моль, растворенных в 1 000 кг воды. Определить массу каждого компонента:
H 2 SO 4 —> (4,500 моль) (98,078 г/моль) = 441,351 г
H 2 O —> 1000 кг = 1000 г
2) Определить массовые проценты:
1000.г + 441,351 г = 1441,351 г (общая масса раствора)
H 2 O —> 1000 г / 1441,351 г = 69,38%
H 2 SO 4 —> 100 − 69,38 = 30,62%
3) Определите мольную долю:
H 2 SO 4 —> 4.500 моль
H 2 O —> 1000. г / 18,015 г/моль = 55,509 моль55,509 моль + 4,500 моль = 60,009 моль
H 2 SO 4 —> 1 − 0,9250 = 0,0750
H 2 O —> 55,509 моль / 60,009 моль = 0,9250
4) Определите молярность:
1441,351 г / 1,122 г/мл = 1296,179 мл = 1,296179 л4,500 моль/1,296179 л = 3,472 М
Пример #5: Рассчитайте процентное содержание бромида кадмия(II) по массе в водном растворе с мольной долей растворенного вещества 0,114 и плотностью 1,047 г/мл.
Решение:
1) Определить мольную долю воды:
1 − 0,114 = 0,886
2) Предположим, что имеется раствор с 0,114 моль CdBr 2 и 0,886 моль воды. Определить массу каждого компонента раствора:
Определить массу каждого компонента раствора:
CdBr 2 —> (0,114 моль) (272,218 г/моль) = 31,033 г
H 2 O —> (0,886 моль) (18,015 г/моль) = 15,889 г
3) Массовая доля CdBr 2 составляет:
[31,033 г / (31,033 г + 15,889 г)] * 100 = 66,1%Плотность раствора не требуется.
Обратите внимание, что в каждом из приведенных выше примеров указана плотность. Это обеспечивает необходимый мост между единицей молярности концентрации, основанной на объеме, и другими единицами концентрации (моляльностью, молярной долей и массовым процентом), ни одна из которых не использует объем в своем определении.
Если бы вы были только , учитывая два из них: (1) массовый процент или (2) моляльность или (3) молярную долю (и без плотности), вы не могли бы получить молярность (или плотность).
Однако предположим, что вам дано одно из следующих значений: (1) массовый процент или (2) моляльность или (3) молярная доля, а затем вместо плотности задана молярность. Не могли бы вы добраться до плотности и других единиц? Другими словами, можно ли в данной части задачи поменять местами плотность и молярность? Посмотрим . . . .
Не могли бы вы добраться до плотности и других единиц? Другими словами, можно ли в данной части задачи поменять местами плотность и молярность? Посмотрим . . . .
Пример #6: Азотная кислота хч представляет собой 70,40% HNO 3 (63,0119 г/моль) по массе и ее молярность составляет 16,00 М. Рассчитайте плотность, моляльность и молярную долю азотной кислоты в растворе.
Решение:
1) 16,0 моль означает следующее:
16,0 моль HNO 3
1,000 л (что соответствует 1000 мл) раствора.
2) Ключевым моментом является то, что 16,00 молей HNO 3 составляют 70,40% всей массы 1000 мл раствора.
(63,0119 г/моль) (16,0 моль) = 1008,19 г1008,19 г / 0,7040 = 1432 г (это общая масса раствора)
3) Плотность:
1432 г/1000 мл = 1,432 г/мл
4) Моляльность:
1432 г − 1008,19 г = 423,81 г = 0,42381 кг16,00 моль/0,42381 кг = 37,75 м
5) Молярная доля
423,81 г / 18,015 г/моль = 23,5254 моль (воды)16,00 моль + 23,5254 моль = 39,5254 моль (всего молей)
23,5254 моль / 39,5254 моль = 0,5952 (мольная доля воды)
1 − 0,5952 = 0,4048 (мольная доля азотной кислоты)
Вот еще вопрос:
.. . можно ли поменять местами плотность и молярность в данной части задачи?
И ответ очень твердый ДА. Сделаем другой. . . .
Пример #7: Азотная кислота реактивного качества (HNO 3 , ММ = 63,0119 г/моль) имеет молярность 16,00 М и ее моляльность 37,75 М. Рассчитайте плотность, массовую долю и мольную долю азотной кислоты в растворе.
Решение:
1) Используйте моляльность:
37,75 моль (HNO 3 )
1000 кг растворителя (вода)
2) Рассчитайте массу вышеуказанного раствора:
(37,75 моль) (63,0119 г/моль) = 2378,7 г1000 г + 2378,7 г = 3378,7 г
3) Вычислите массовые проценты (я сделаю только азотную кислоту):
2378,7 г / 3378,7 г = 70,40%
4) Рассчитайте мольную долю азотной кислоты:
ХНО 3 —> 37,75 моль
H 2 O —> 1000 г / 18,015 г/моль = 55,509 моль55,509 моль + 37,75 моль = 93,259 моль
37,75 моль / 93,259 моль = 0,4048
5) Используйте молярность, чтобы получить плотность раствора:
37,75 моль/х = 16,00 моль/лх = 2,359375 л
3378,7 г / 2359,375 мл = 1,432 г/мл
Оказывается, все работает нормально, если заданы плотность и молярность. См. пример № 3, чтобы узнать, как № 8.
См. пример № 3, чтобы узнать, как № 8.
Пример #8: Азотная кислота реактивного качества (HNO 3 , молекулярная масса = 63,0119 г/моль) имеет молярность 16,00 М и плотность 1,432 г/мл. Рассчитайте моляльность, массовую долю и мольную долю азотной кислоты в растворе.
Решение:
1) Предположим, что имеется 1000 л раствора. Определить его массу:
(1,432 г/мл) (1000 мл) = 1432 г
2) Определите массовую долю (только азотной кислоты):
(16,00 моль) (63,0119г/моль) = 1008,19 г1008,19 г / 1432 г = 70,40%
3) Моляльность:
1432 — 1008,19 = 423,81 г = 0,42381 кг16,00 моль/0,42381 кг = 37,75 м
4) Мольное соотношение (только воды):
HNO 3 —> 1008,19 г / 63,0119 г/моль = 16,00 моль
H 2 O —> 423,81 г / 18,015 г = 23,5254 моль23,5254 моль + 16,00 моль = 39,5254 моль
23,5254 / 39,5254 = 0,5952
Пример #9: Какова молярность 30,0% (вес/вес) раствора перекиси водорода?
Комментарий: обратите внимание, как нужно искать плотность (вероятно, в другом месте главы учебника, из которой взят этот вопрос), чтобы решить проблему. (Команда ChemTeam не задавала этот вопрос.) Если вы не понимаете, что вам нужно указать плотность, вы можете подумать, что это неразрешимый вопрос.
(Команда ChemTeam не задавала этот вопрос.) Если вы не понимаете, что вам нужно указать плотность, вы можете подумать, что это неразрешимый вопрос.
Решение:
1) Поискав в Интернете, плотность оказалась 1,11 г/мл. Причина, по которой плотность доступна, заключается в том, что 30% H 2 O 2 имеется в продаже. Его плотность указана в паспорте безопасности материала, который должны иметь поставщики и покупатели химикатов. Вот один на 30% H 2 O 2 .
2) Предположим, что имеется 1,00 л раствора. (Это удобный объем, потому что вам нужна молярность, которая определяется как количество молей растворенного вещества на литр раствора.)
3) Рассчитайте массу 1,00 л раствора:
(1,11 г/мл) (1000 мл) = 1110 г
4) Рассчитайте массу H 2 O 2 в литре раствора
(1110 г) (0,300) = 333 г H 2 O 2
5) Вычислить количество молей H 2 O 2 в растворе:
333 г / 34,0138 г/моль = 9,79 моль
6) Вычислите молярность:
9,79 моль/1,00 л = 9,79 М
Пример #10: Имеется 1,55 М раствор глюкозы (C 6 H 12 O 6 ). Определите молярное соотношение каждого компонента раствора, а также массовый процент.
Определите молярное соотношение каждого компонента раствора, а также массовый процент.
Решение:
1) 1,55 м означает 1,55 моль глюкозы, растворенной в 1,00 кг воды. Определить массовые проценты:
глюкоза —> (1,55 моль) (180,1548 г/моль) = 279,23994 г
H 2 O —> 1000 г1000 г + 279,23994 г = 1279,23994 г
глюкоза —> 100 − 71,87 = 21,83%
H 2 O —> 1000 г / 1279,23994 г = 78,17%
2) Определите мольные отношения:
глюкоза —> 1,55 моль
H 2 O —> 1000 г / 18,015 г/моль = 55,5091,55 + 55,509 = 57,059 моль
глюкоза —> 1 − 0,9728 = 0,0272
Н 2 О —> 55,509 / 57,059 = 0,9728
Комментарий: Дайте мне плотность, и я смогу вычислить молярность. Дайте мне молярность, и я смогу вычислить плотность. Однако, поскольку ни один из них не присутствует, вышеупомянутая проблема — это то, что мы можем сделать.
Пример №11: Определите мольную долю H 2 O и CH 3 OH в растворе с моляльностью 2,00 мкм.
Решение:
1) В качестве растворителя будем считать воду. Это означает:
2,00 моль CH 3 OH, растворенный в 1,00 кг H 2 O
2) Определить количество молей воды:
1000 г ––––––––– = 55,509 моль 18,015 г/моль
3) Определить общее количество родинок:
55,509 моль + 2,00 моль = 57,509 моль
4) Определите мольную долю воды:
55,509 моль ––––––––– = 0,965 57,509 моль
5) Молярную долю метилового спирта можно получить вычитанием:
1 − 0,965 = 0,035Вы также можете сделать это путем деления, но имейте в виду, что молярные доли могут не давать в сумме 1 из-за ошибок округления.
Примеры #12–14: Заполните пустые места в таблице для водных растворов показанных соединений. Плотность раствора в г/см 3 .
Соединение MW плотность м %(масс./масс.) 6 9073
М NH 3 17,0307 0,9228 20,00 7697NA 2 CR 2 O 7 261,965 1,1260 0,7271 096999967967 9967967967 9967967 9967 996967 9967 9967 9967 9967 9967 9967 9967 0,7271 67
. NH 2 CONH 2 60,0556 1,0276 7 3 693 1,882
Растворы для аммиака:
1) Предположим, что имеется 100,0 г раствора. 20,00% (вес/вес) говорит нам следующее:
аммиак: 20,00 г
вода: 80,00 г
2) Для расчета моляльности нам необходимо знать количество молей аммиака:
20,00 г ––––––––– = 1,17435 моль 17,0307 г/моль Затем рассчитайте моляльность:
1,17435 моль ––––––––– = 14,68 м 0,08000 кг
3) Для мольных долей нам нужно знать количество молей воды, чтобы затем определить общее количество молей в растворе:
80,00 г ––––––––– = 4,440744 моль 18,015 г/моль всего молей —> 1,17435 моль + 4,440744 моль = 5,615094 моль
χ вода —> 4,440744 моль / 5,615094 моль = 0,7908
χ аммиак —> 1 − 0,7908 = 0,2092
4) Для молярности мы сначала используем плотность и 100,0 г раствора, чтобы получить объем раствора:
100,0 г ––––––––– = 108,366 см 3 0,9228 г/см 3 Расчет молярности:
1,17435 моль ––––––––– = 10,84 М 0,108366 л
Растворы дихромата натрия:
1) Моляльность говорит нам об этом:
Na 2 Cr 2 O 7 —> 0,7271 моль
H 2 O —> 1000 кг
2) Преобразование молей в граммы:
(0,7271 моль) (261,965 г/моль) = 190,475 г
3) Рассчитайте массовые проценты:
H 2 O —> 1000 г / 1190,475 г = 84,00%
На 2 Cr 2 O 7 —> 1 − 0,8400 = 16,00%
4) Для мольной доли мы знаем, сколько молей Na 2 Cr 2 O 7 содержится в растворе (0,7271 моль). Определить количество молей воды:
Определить количество молей воды:
1000 г ––––––––– = 55,5093 моль 18,015 г/моль мольная доля воды —> 55,5093 моль / 56,2364 моль = 0,9871
мольных долей дерн. дихромат —> 1 — 0,9871 = 0,0129
5) Для расчета молярности мы сначала используем общую массу раствора (1190,475 г; рассчитано для массовых процентов выше), чтобы определить объем раствора:
1190,475 г ––––––––– = 1057,26 см 3 = 1,05726 л 1,1260 г/см 3 Расчет молярности:
0,7271 моль ––––––––– = 0,6877 М 1. 05726 л
Растворы мочевины:
1) Предположим, имеется 1000 л раствора. Используя плотность, определим массу раствора:
1000 см 3 ––––––––– = 973,1413 г 1,0276 г/см 3
2) В 1000 л раствора содержится 1,882 моля мочевины. Определить его массу:
(1,882 моль) (60,0556 г/моль) = 113,0246 г
3) Определите моляльность:
973,1413 г − 113,0246 г = 860,1167 г воды
1,882 моль ––––––––– = 2,188 м 0,8601167 кг
4) Чтобы определить мольные доли, нам нужно знать, сколько молей воды присутствует:
860,1167 г ––––––––– = 47,7445 моль 18,015 г/моль Рассчитайте мольные доли:
вода —> 47,7445 моль / 49,6265 моль = 0,9621
мочевина —> 1 − 0,9621 = 0,0379
5) Массовые проценты:
вода —.>860,1167 г / 973,1413 г = 88,38%
мочевина —> 11,62%
Пример № 15: Разбавьте водой 38% (по весу) соляную кислоту до рН 1,00. Плотность 38% HCl составляет 1,19.г/мл
Решение:
1) Начнем с анализа того, что мы знаем о конечном результате.
(a) Предположим, что конечный объем равен 1,00 л.
(b) pH 1,00 означает, что конечный раствор содержит 0,10 моль HCl.результат в (b) получается из этого:[H + ] = 10 -pH = 10 -1,00 = 0,10 М
(c) Помните, HCl — сильная кислота, поэтому она ионизирует на 100 %.
(d) Молярная масса HCl составляет 36,461 г/моль, поэтому требуется 3,6461 г HCl. (В конце я округлю до трех цифр.)
2) Теперь наша задача звучит так: какая масса 38% раствора HCl требуется для получения 3,6461 г HCl? Простое соотношение и пропорция — это все, что требуется:
38 г 3,6461 г ––––– = ––––––– 100 г х х = 9,595 г
3) Мы можем легко взвесить 9,595 г 38% раствора и разбавить это количество до 1,00 л раствора.


 г + 441,351 г = 1441,351 г (общая масса раствора)
г + 441,351 г = 1441,351 г (общая масса раствора) . . можно ли поменять местами плотность и молярность в данной части задачи?
. . можно ли поменять местами плотность и молярность в данной части задачи?