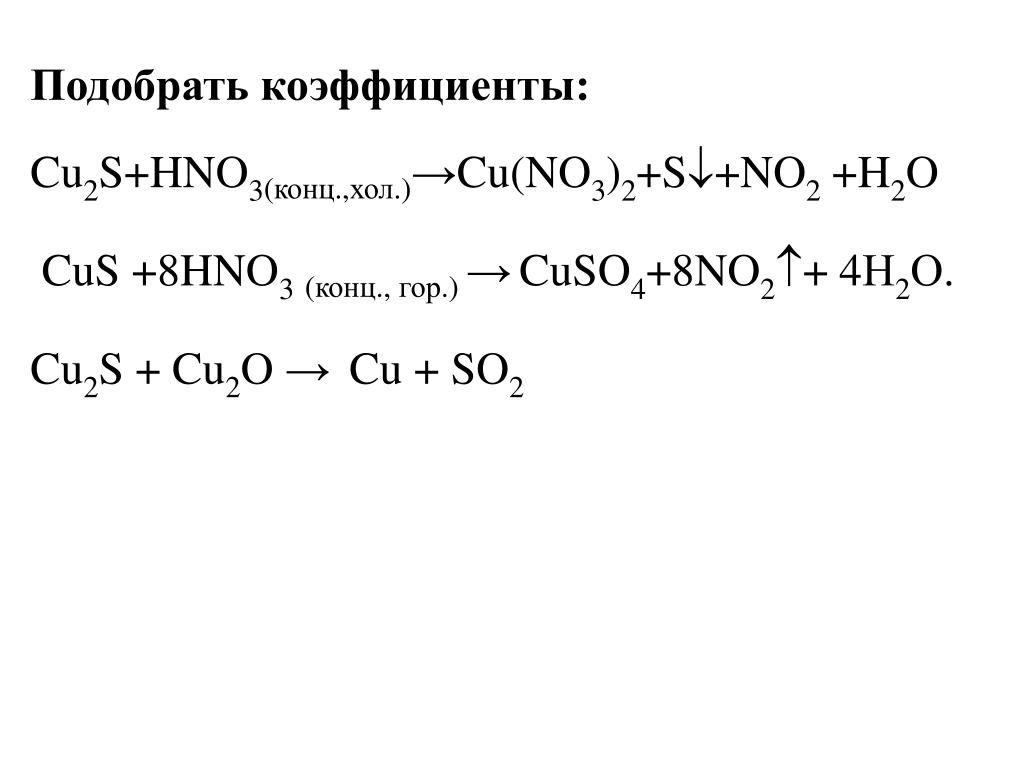
Окисно-відновні реакції варіант 1 | Тест з хімії – «На Урок»
Запитання 1
Окисно-відновні — це реакції, в яких…
варіанти відповідей
не змінюється ступінь окиснення елементів
змінюється ступінь окиснення елементів
визначення реакцій не повязано зі ступенем окиснення елементів
Запитання 2
Окисник…
варіанти відповідей
не змінює ступеня окиснення під час хімічної реакції
віддає електрони
приєднує електрони
Запитання 3
Укажіть ступінь окиснення елемента в простій речовині:
варіанти відповідей
позитивний і дорівнює номеру групи елемента:
негативний і дорівнює номеру групи елемента — 8
Запитання 4
Окиснення — це…
варіанти відповідей
процес приєднання електронів
процес віддачі електронів
немає правильної відповіді
Запитання 5
Відновлення — це…
варіанти відповідей
процес приєднання електронів
процес віддачі електронів
немає правильної відповіді
Запитання 6
Серед запропонованих реакцій виберіть окисно-відновні реакції:
варіанти відповідей
BaCl2 + H2SO4 → 2HCl + BaSO4↓
2H2O2 = 2Н2О + O2↑
4К + O2 = 2К2O
Zn + 2HCl = ZnCl2 + H2↑
Запитання 7
Укажіть ступінь окиснення Мангану в калій перманганаті KMnО4:
варіанти відповідей
Запитання 8
Виберіть електронне рівняння, де зображений процес відновлення:
варіанти відповідей
Mn+7 + 5е = Mn+2
2Cl-1 — 2е = Cl20
Al+3 + 3е = Al0
Cr+3 — 3е = Cr+6
Запитання 9
Укажіть елемент, атоми якого у сполуках виявляють лише ступінь окиснення -1:
варіанти відповідей
Запитання 10
Установіть кількість електронів, що беруть участь у процесі, який відображено схемою: Мn+4 → Mn+7:
варіанти відповідей
Запитання 11
Укажіть формулу сполуки, у якій Сульфур може виявляти як окисні, так i відновні властивості в хімічних реакціях:
варіанти відповідей
Запитання 12
Укажіть у даній схемі S-2 . ……→ S+4 кількість приєднаних або відданих електронів:
……→ S+4 кількість приєднаних або відданих електронів:
варіанти відповідей
віддано 2е—
приєднано 6е—
віддано 6е—
приєднано 2е—
Запитання 13
Максимальний ступінь окиснення Сульфуру
варіанти відповідей
Запитання 14
Атоми, молекули або йони , які в ході реакції віддають електрони, називаються:
варіанти відповідей
окисники
відновники
протони
нейтрони
Запитання 15
Процес, під час якого частинки реагентів віддають електрони називається
варіанти відповідей
окисненням
відновленням
горінням
розкладом
Запитання 16
В ході хімічної реакції відновник
варіанти відповідей
приєднує електрони і його ступінь окиснення збільшується
приєднує електрони і його ступінь окиснення зменшується
віддає електрони і його ступінь окиснення збільшується
віддає електрони і його ступінь окиснення зменшується
Запитання 17
Виберіть формулу речовини, яка в хімічній реакції може бути лише відновником:
варіанти відповідей
Запитання 18
Визнач кількість відданих або приєднаних електронів. Укажи окисник та відновник S –2 → S+6
Укажи окисник та відновник S –2 → S+6
варіанти відповідей
окисник
відновник
Запитання 19
Укажіть ступінь окиснення елемента в простій речовині:
варіанти відповідей
позитивний і дорівнює номеру групи елемента:
негативний і дорівнює номеру групи елемента — 8
Запитання 20
Укажіть речовину, ступінь окиснення Хрому у якій дорівнює +6:
варіанти відповідей
K2Cr2O7
Запитання 21
При взаємодії яких речовин реакція буде окисно- відновною?
варіанти відповідей
ZnSО4 і BаСl2
Zn і Н2SО4
ZnO і Н2SО4
Zn(OH)2 і HNO3
Запитання 22
Рівняння називається окисно- відновним, якщо…
варіанти відповідей
Один елемент змінює ступінь окиснення
Один елемент передає електрони іншому
Ступінь окиснення елементів не змінюється
вони належать до йонного обміну
Запитання 23
Який атом є окисником в реакції: SO2+O2=SO3
і скільки він приймає електронів?
варіанти відповідей
Сульфур, 2 електрони
Сульфур, 4 електрони
Оксиген, 4 електрони
Оксиген,2 електрони
Запитання 24
Урівняйте рівняння з допомогою електронного балансу. Вкажіть суму коефіцієнтів в рівнянні Zn + HNO3(k) = Zn(NO3)2 + h3O + N2
Вкажіть суму коефіцієнтів в рівнянні Zn + HNO3(k) = Zn(NO3)2 + h3O + N2
варіанти відповідей
Створюйте онлайн-тести
для контролю знань і залучення учнів
до активної роботи у класі та вдома
Створити тест
Натисніть «Подобається», щоб слідкувати за оновленнями на Facebook
Расставьте коэффициенты в следующих уравнениях s+hno3 — h3so4+no2+h3o p+hno3 — h4po4+no2+h3o
Химия, 13.08.2019 15:30, Nastyadavydenko
Посмотреть ответы
Другие вопросы по: Химия
.(От москвы до минска 750 км. их этих городов выехали одновременно навстречу друг другу два автомобиля. через6 часов они встретились. скорость первого 60 км в час. какова скорость…
Опубликовано: 27.02.2019 22:20
Ответов: 2
.(Красная шапочка приготовила на бабушкин д. рождения 26 пирожков с повидлом , пироженное с кремом , которых было на 15 больше , чем пирожков и ватрушек с сыром . причем пироженных…
причем пироженных…
Опубликовано: 28.02.2019 17:50
Ответов: 2
Анализ стихотворения лермонтова родина . напишите быстро только не из сети…
Опубликовано: 03.03.2019 17:40
Ответов: 3
Решите уравнение 4x в квадрате — 5x + 1 = 0…
Опубликовано: 04.03.2019 00:30
Ответов: 1
Куб вписан в шар радиусом 3. найдите объем куба….
Опубликовано: 04.03.2019 02:50
Ответов: 1
Сократить дробь 1)5x-15yдробная черта х во 2 степени -9yво2степени…
Опубликовано: 04.03.2019 08:50
Ответов: 1
Знаешь правильный ответ?
Расставьте коэффициенты в следующих уравнениях s+hno3 — h3so4+no2+h3o p+hno3 — h4po4+no2+h3o…
Популярные вопросы
Сократи дроби, используя признаки делимости: 105/210, 1400/600, 135/162, 375/500….
Опубликовано: 02. 03.2019 10:20
03.2019 10:20
Ответов: 2
Для нового станка сделали 2 детали. масса одной из них в 3 раза больше массы другой. чему равна масса каждой детали, если масса одной из них на 700 г меньше массы другой…
Опубликовано: 02.03.2019 20:40
Ответов: 3
Пейзажные зарисовки 6-8 односоставных предложений о природе !…
Опубликовано: 02.03.2019 22:20
Ответов: 2
Твір на тему моє улюблене заняття опис процесу праці художнього стилю…
Опубликовано: 02.03.2019 22:50
Ответов: 3
Во второй день со склада выдали в 2 раза больше проволоки, чем в 1-й, а в третий- в 3 раза больше, чем в первый. сколько кг проволоки выдали в эти 3 дня если в первый день выдали н…
Опубликовано: 03.03.2019 09:20
Ответов: 3
Сочинение на тему как работает продавец…
Опубликовано: 03. 03.2019 13:00
03.2019 13:00
Ответов: 2
Путешественник проехал 720 км. из них 5/9 он проехал в первый день. сколько км он проехал после этого?…
Опубликовано: 03.03.2019 20:50
Ответов: 1
Самолет может пролететь без заправки 8000км может ли этот самолет двигаясь со среднейскоростью950км/ч быть в полете без заправки 8ч? 9ч?…
Опубликовано: 04.03.2019 03:30
Ответов: 3
Сумма сторон ав и ас треугольника авс равна 85 см, что на 15 см меньше суммы сторон ав и вс. периметр треугольника равен 138 см. чему равны стороны треугольника?…
Опубликовано: 06.03.2019 18:30
Ответов: 1
Розкрийте дужки і знайдіть значення виразу: -8,76-(3,25-10,76)=…
Опубликовано: 06.03.2019 23:10
Ответов: 2
Больше вопросов по предмету: Химия Случайные вопросы
Популярные вопросы
Что такое азотная кислота (HNO3) в химии? | КАКАЛИ ГОШ, преподаватель, блогер.
 Магистр химии.
Магистр химии.Известно семь оксокислот азота. Азотная кислота является одним из них с молекулярной формулой HNO3 . Азотная кислота — очень агрессивная минеральная кислота.
Большинство металлов и неметаллов растворимы в азотной кислоте . По этой причине азотная кислота также известна как aqua fortis, что означает «крепкая вода».
Чистая азотная кислота представляет собой бесцветную жидкость при комнатной температуре, но старый образец азотной кислоты может иметь желтый или красновато-коричневый цвет. Он удушающий, а также едко пахнущий кислотой.
Коптится во влажном воздухе. Температура плавления чистого HNO3 составляет 231 К, а температура кипения чистой азотной кислоты составляет 355,6 К.
При попадании концентрированной азотной кислоты на нашу кожу образуются болезненные язвы, и кожа желтеет.
Что такое формула и структура азотной кислоты?
Центральный атом N молекулы HNO3 sp2-гибридизирован. Следовательно, геометрия азотной кислоты является тригонально-плоской.
На самом деле азотная кислота имеет две разные резонирующие структуры. Эти два резонансных гибрида HNO3 показаны ниже.
Что такое дымящая или красная дымящаяся азотная кислота?
Чистая азотная кислота представляет собой бесцветную жидкость. Но когда азотная кислота остается на солнце в течение длительного времени, азотная кислота разлагается с образованием NO2 и O2.
В этом состоянии при открытии бутылки с азотной кислотой выделяется красновато-коричневый газ NO2. Эта красновато-коричневая азотная кислота с NO2 называется дымящей азотной кислотой .
Подробнее: Химия HCl
Опять же, когда концентрированная азотная кислота перегоняется с небольшим количеством As2O3 или крахмала, получаемая азотная кислота называется кислота азотная дымящая .
Теперь, в зависимости от количества присутствующего NO2, дымящая азотная кислота дополнительно характеризуется как красная дымящая азотная кислота при концентрации выше 86% или белая дымящая азотная кислота при концентрации выше 95%.
Как приготовить азотную кислоту?
Существует два метода получения азотной кислоты . Один из них — лабораторный метод приготовления, а другой — промышленный метод приготовления.
Лабораторный препарат:
В лаборатории азотная кислота готовится путем нагревания смеси KNO3 или NaNO3 и концентрированной серной кислоты при 200°C.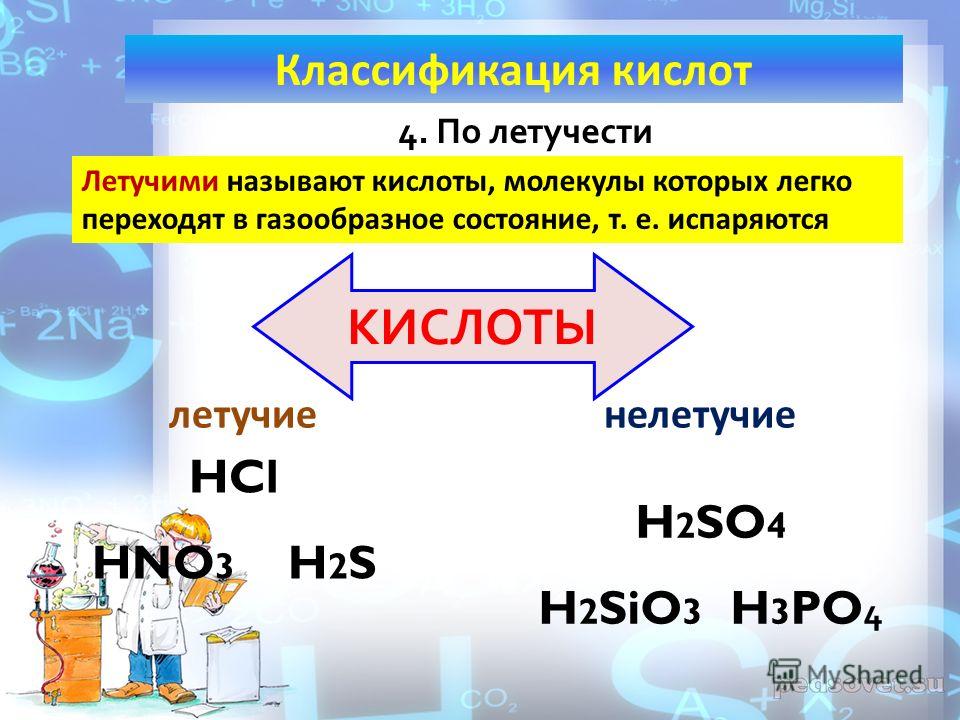
Реакция протекает в две стадии. На первом этапе KHSO4 и HNO3 получают реакцией KNO3 и концентрированной серной кислоты при 200°C-230°C.
KNO3 + h3SO4 ⟶ KHSO4 + HNO3
На втором этапе образующийся KHSO4 реагирует с неизмененным KNO3 с образованием K2SO4 и HNO3. Реакция происходит при 800ᵒC.
KNO3 + KHSO4 ⟶ K2SO4 + HNO3
Промышленное получение азотной кислоты (метод Оствальда):
Азотную кислоту получают промышленным способом по методу Оствальда . Этот метод состоит из трех шагов.
На первом этапе аммиак окисляется до NO кислородом воздуха в присутствии платинового или Pt-Rh катализатора. Реакция протекает при температуре 1100К при давлении 5 атмосфер. На втором этапе образующийся NO дополнительно окисляется воздухом до NO2.
Наконец, NO2 поглощается водой с образованием азотной кислоты и NO. это разбавлено азотная кислота . 68% концентрированная азотная кислота получается перегонкой этой разбавленной азотной кислоты.
Тогда при обезвоживании этой азотной кислоты серной кислотой можно получить 98% концентрированную HNO3.
Азотная кислота , производимая промышленным способом, представляет собой разбавленную азотную кислоту. Теперь при перегонке этой разбавленной азотной кислоты получается 68% концентрированный раствор азотной кислоты.
Постоянно кипящая азеотропная смесь. Известны два твердых гидрата азотной кислоты: моногидрат (HNO3.h3O) и тригидрат (HNO3.3h3O).
Эта азотная кислота известна как концентрированная азотная кислота . Крепость этого раствора азотной кислоты составляет около 16 (Н).
Расчет рН азотной кислоты
Растворим в воде в любой пропорции. Когда водный раствор азотной кислоты выпаривают при 120,5°С в одной атмосфере, получается 68% раствор HNO3. Это пример азеотропной смеси.
Перегонка 68% концентрированной HNO3 с концентрированной H3SO4 дает 98% концентрированной HNO3.
Экспериментально установлено, что прочность концентрированной HNO3 составляет примерно 16(Н).
Поскольку азотная кислота является сильной одноосновной кислотой, она полностью диссоциирует в водном растворе.
Отсюда концентрация иона H+ равна концентрации HNO3 . То есть концентрация иона Н+ равна 16(N).
Следовательно, pH= — log [H+] = — log16 = — 1,20.
Азотная кислота является очень сильным окислителем. Он используется в качестве окислителя как в органической, так и в неорганической химии.
Азотная кислота используется для приготовления нитрата аммония, основного нитрата кальция и т.д. Опять же, нитрат аммония используется для приготовления взрывчатых веществ.
Азотная кислота также используется для приготовления различных взрывчатых веществ, таких как нитроглицерин, гексоген, нитроцеллюлоза, тринитротолуол, пикриновая кислота и т. д.
Циклогексанон, адипиновая кислота и т. д. Сырье из нейлона производится с использованием азотной кислоты. Кроме того, терефталевую кислоту, являющуюся сырьем для получения терилена, также получают из азотной кислоты.
д. Сырье из нейлона производится с использованием азотной кислоты. Кроме того, терефталевую кислоту, являющуюся сырьем для получения терилена, также получают из азотной кислоты.
Азотная кислота используется в качестве царской водки (3 порции HCl + 1 порция HNO3) для очистки золота и платины.
Используется при травлении и очистке нержавеющей стали, в качестве окислителя в ракетном топливе, при получении различных нитратных соединений и в качестве важного реагента в лаборатории.
Чем опасна азотная кислота?
Азотная кислота является коррозионной кислотой, а также сильным окислителем. Основную опасность представляют его химические ожоги.
Воздействие азотная кислота вызывает болезненные язвы на коже и пожелтение кожи. Белковое вещество организма реагирует с концентрированной азотной кислотой с образованием соединения желтого цвета, называемого ксантопротеином.
Опять рыба гибнет из-за кислотных дождей или подмешивания азотной кислоты в воду с заводов. Потому что тело рыбы состоит из белка.
Потому что тело рыбы состоит из белка.
Является ли HNO3 кислотой или основанием? Сильный против слабого
Главная > Химия > Является ли HNO3 кислотой или основанием?
Азотная кислота является сильным окислителем с химической формулой HNO 3 . Он состоит из трех элементов водорода, кислорода и азота. Чистое соединение азотной кислоты бесцветно и имеет удушливый запах. . Он используется в производстве различных органических и неорганических нитратов.
В этой статье мы обсудим, является ли HNO 3 кислотой или основанием, сильной или слабой? его сопряженное основание или кислота и т. д.
Итак, является ли HNO 3 кислотой или основанием? HNO 3 представляет собой кислоту. Поскольку при растворении в водном растворе он диссоциирует на два иона (H + и NO 3 – ), и все, что высвобождает ион H + в растворе, считается кислотным по своей природе.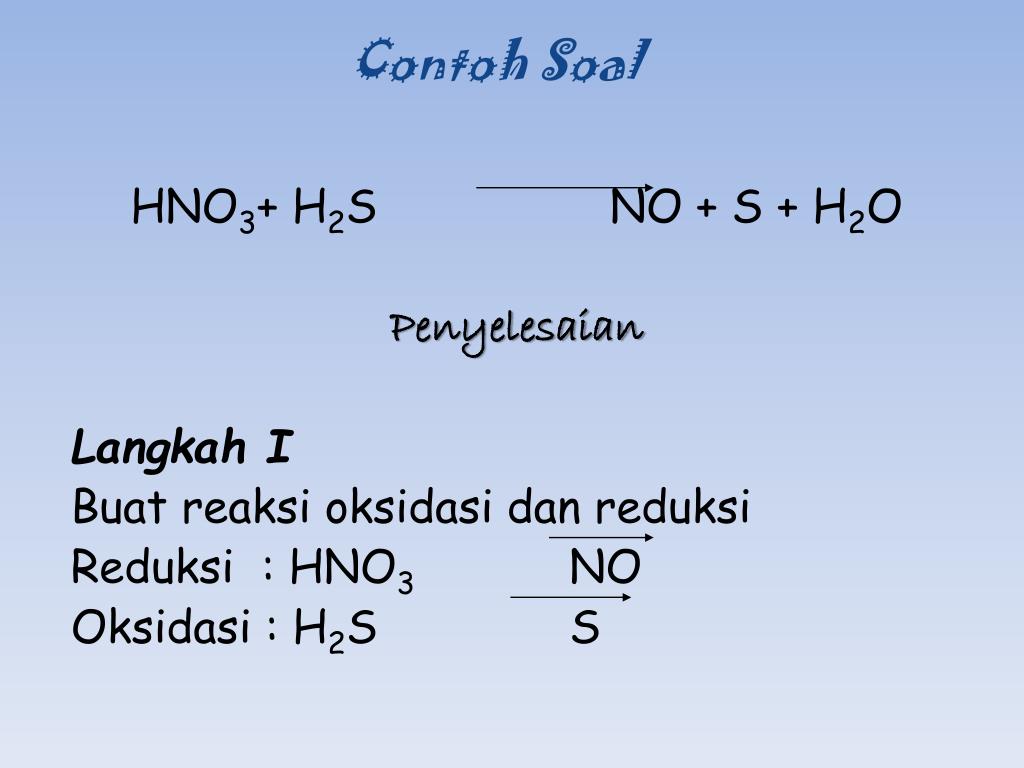
| Name of Molecule | Nitric acid |
| Chemical formula | HNO 3 |
| Nature | Strong acid |
| Сопряженная основа | NO 3 – |
| pH value | 3.01 |
| Acidity (pK a ) | -1.4 |
| Solubility в воде | Полностью смешивается |
Согласно различным теориям кислотно-щелочного равновесия, кислота — это то, что высвобождает протон или H 9Ион 0211 + при растворении в водном растворе.
В случае HNO 3 полностью диссоциирует в водном растворе с образованием ионов H 3 O + и NO 3 – .
⇒ HNO 3 + H 2 O → H 3 O + + NO 3 —
ЗДЕСЬ. O и сформированный NO 3 – сопряженное основание. А h3O действует как основание, поскольку принимает протон от HNO 3 и образует сопряженную кислоту H 3 O + .
Теории для проверки того, является ли HNO 3 кислотой или основанием.
1. Теория Аррениуса для кислоты:
Теория Аррениуса утверждает, что кислота представляет собой вещество, которое дает ионы H + или увеличивает количество ионов водорода в водном растворе.
Итак, молекула HNO 3 при растворении в водном растворе диссоциирует на H + ионы, которые быстро образуют ионы гидроксония (H 3 O + ). Итак, можно сказать, что HNO 3 – это кислота Аррениуса.
Итак, можно сказать, что HNO 3 – это кислота Аррениуса.
2. Теория Бренстеда-Лоури для кислоты:
Она утверждает, что соединение является кислотой, когда оно отдает протон другому соединению и само образует сопряженное основание. А основание — это то, что принимает протон от другого вида и само образует сопряженную кислоту.
Рассмотрим реакцию HNO 3 с H 2 O.
Согласно приведенной выше реакции, HNO 3 отдает протон H 2 O и сама образует сопряженное основание, которое представляет собой NO 3 – . Следовательно, можно сказать, что в приведенной выше реакции HNO 3 действует как кислота Бренстеда-Лоури, а H 2 O действует как основание Бренстеда-Лоури.
Азотная кислота (HNO3) сильная или слабая? Для проверки наличия азотной кислоты (HNO 3 ) сильной или слабой, сначала мы должны четко понять различия между сильными и слабыми кислотами.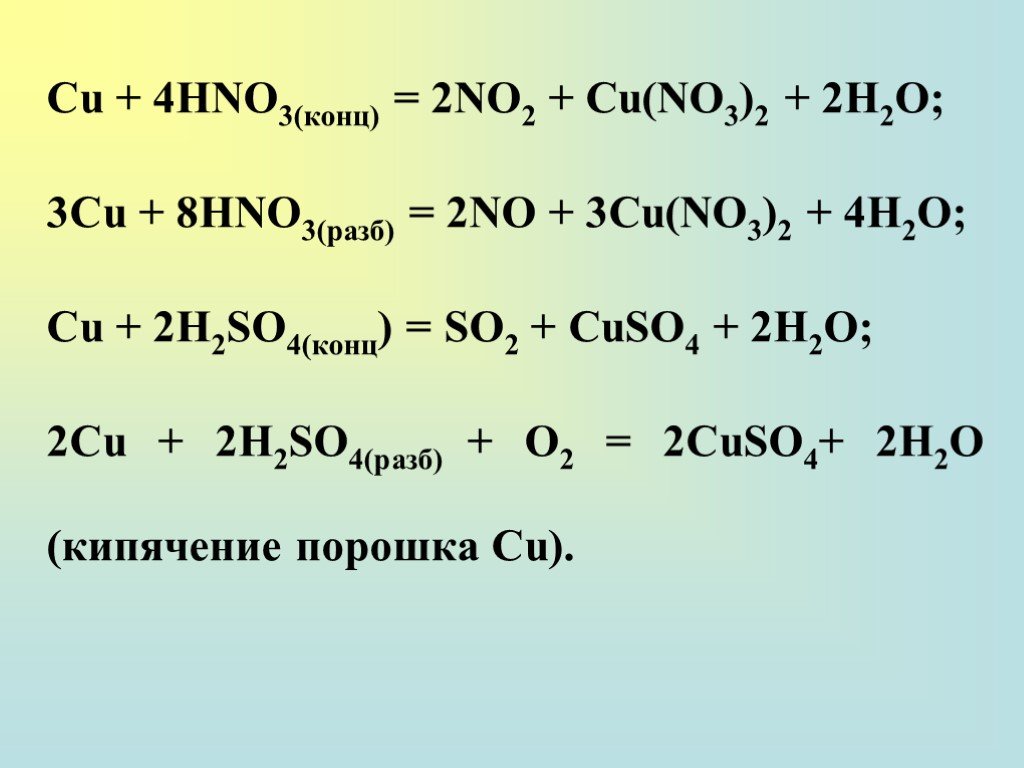
Сильная кислота обычно представляет собой соединение, которое полностью диссоциирует или на 100% ионизируется в растворе с образованием ионов H + , что означает, что в растворе не остается недиссоциированной кислоты, все моли кислоты полностью отрываются и выделяют много ионов H + .
Пример- HCl, HBr, H 2 SO 4 , HI, HClO 4 и т. д.
Читайте также :-
- Является ли HBr сильной кислотой?
- Является ли h3SO4 сильной кислотой?
- Является ли HCl сильной кислотой?
- Является ли HI сильной кислотой?
- Является ли HClO4 сильной кислотой?
И слабая кислота обычно является соединением, которое частично или не полностью ионизировано в растворе, что означает, что некоторые моли кислоты остаются недиссоциированными в растворе и не распадаются полностью на ионы.
Примеры слабых кислот- Синильная кислота (HCN), Уксусная кислота (CH 3 COOH), Ammonium ion (NH 4 + ), Phosphoric acid(H 3 PO 4 ), HNO 2 , HF, HCOOH, H 2 CO 3 , etc .
Также прочтите :-
- Является ли Ch4COOH слабой кислотой?
- Является ли HF слабой кислотой?
- Является ли HCN слабой кислотой?
- Является ли HNO2 слабой кислотой?
- Является ли HCOOH слабой кислотой?
- Является ли h4PO4 слабой кислотой?
- Является ли h3CO3 слабой кислотой?
- Является ли Nh5+ слабой кислотой?
| Сильная кислота | Слабая кислота |
| Полностью ионизируются. | Ионизируют не полностью. |
| Обладают высокой проводимостью. | Обладают меньшей проводимостью. |
| Значение pH находится в диапазоне от 0 до 3. | Значение pH находится в диапазоне от 3 до 7. |
| Они полностью диссоциируют с образованием иона H + . | Они частично диссоциируют с образованием иона H + . |
Это сильные электролиты. | Это слабые электролиты по сравнению с сильными кислотами. |
| Пример – HNO3, h3SO4, HBr и т.д. | Пример – C2h3O4, HNO2, HCOOH и т.д. Азотная кислота (HNO 3 ) является сильной кислотой. Потому что при растворении в водном растворе полностью диссоциирует на H + и NO 3 – ионов в растворе. Как и при растворении HNO 3 в водном растворе, водород не остается связанным, весь диссоциирует и превращается в ионы H + , что означает повышение концентрации ионов водорода в растворе. Следовательно, мы можем сказать, что HNO 3 является сильной кислотой или действует как сильная кислота. Примечание: В разбавленной форме HNO 3 является слабой, но в концентрированной форме это очень опасная или сильная кислота. Как видно из рисунка выше, когда HNO 3 растворяется в водном растворе, он полностью ионизируется или диссоциирует на ионы H + и NO 3 – .
Единственная стрелка, используемая в приведенной выше реакции, показывает, что будет иметь место только прямая реакция. Поскольку NO 3 – является очень слабым сопряженным основанием HNO 3 , поэтому он не может преобразоваться с расщепляющим ионом H + в водном растворе и снова произвести молекулу HNO 3 . Следовательно, только расщепляющие ионы (H + и NO 3 – ) HNO 3 будет доступен в водном растворе, что, соответственно, указывает на его сильнокислотную природу. Кроме того, значение константы кислотной диссоциации (K a ) для HNO 3 составляет 2,3 × 10 1 .
⇒ Если значение константы диссоциации кислоты больше 1 (K a >> 1), то природа соединения — сильная кислота. ⇒ Если K a << 1, то природа соединения является слабой кислотой. Уловка для запоминания силы кислотности оксикислот «Оксикислота — это кислота, которая содержит кислород, водород и еще один элемент (металл или неметалл)». Примеры оксикислот: H 2 SO 4 , HNO 3 , H 3 PO 4 и т. д. более сильная кислота. ∴ HNO 3 оксикислота имеет три кислорода и один водород, поэтому (3 -1 = 2) , у нас осталось два кислорода. Следовательно, по правилу это сильная кислота. ∴ H 2 SO 4 оксикислоты имеют четыре кислорода и два атома водорода, поэтому (4 – 2 = 2) , у нас осталось два кислорода, следовательно, это сильная кислота. ∴ H 3 PO 4 оксикислота имеет четыре кислорода и три атома водорода, поэтому (4 – 3 = 1) , у нас остался только один кислород, следовательно, это слабая оксикислота. Вот список некоторых распространенных сильных и слабых кислот. Является ли HNO3 также основанием? Когда HNO 3 сталкивается с вышестоящим или реагирует с ним, то в этом состоянии он действует как основание. Что это значит? Это просто означает, что когда HNO 3 реагирует с менее активным элементом, который принимает протон, он будет действовать как кислота . И когда HNO 3 реагирует с более реакционноспособным соединением, таким как серная кислота или суперкислоты, которые должны отдавать протон, он будет действовать как основание . Давайте подробнее, чтобы понять, в каких условиях HNO 3 действует как кислота и в каких основаниях. HNO 3 действует как кислота:
Просто запомните эти два условия, чтобы понять, когда HNO 3 действует как кислота. Давайте возьмем пример, чтобы кристально прояснить ваши сомнения. Здесь HNO 3 действует как кислота , поскольку отдает протон H 2 O и образует сопряженное основание. Н 2 O очень менее реакционноспособен и менее кислотен, чем HNO 3 , поэтому он должен принимать протон от сильной кислоты, такой как HNO 3 . HNO 3 действует как основание:
Пример. Серная кислота более реакционноспособна и более кислая, чем HNO 3 . Так, при реакции с серной кислотой HNO 3 принимает от него протон и образует сопряженную кислоту. Поскольку h3SO4 более кислая, она должна отдать протон HNO 3 , чтобы обрести стабильность, следовательно, она образовала сопряженное основание HSO 4 – . Принимая во внимание, что HNO 3 должен принять протон, поскольку H 2 SO 4 превосходит его, следовательно, образуя сопряженную кислоту NO 2 + . ⇒ H 2 SO 4 + HNO 3 → H 2 NO 3 + + HSO 4 —
∴ H 2 SO 4 + HNO 3 → NO 2 + + H 2 O + HSO 4 – Therefore, in this case, HNO 3 действует как основание, так как принимает протон от H 2 СО 4 . Является ли HNO3 кислотой или основанием Льюиса?Короче говоря, , HNO 3 действует как кислота Льюиса Поскольку, согласно теории Льюиса для кислоты, соединение, которое принимает электронную пару от другого соединения, классифицируется как кислота Льюиса, поскольку HNO 3 имеет H + ион, который может принимать электронные пары от составного донора. ⇒ Кислота Льюиса → акцептор электронной пары ⇒ Основание Льюиса → донор электронной пары Примечание: Кислота Льюиса представляет собой надмножество кислот Бренстеда-Лоури, что означает, что каждое соединение, попадающее в категорию кислоты Бренстеда-Лоури, является кислотой Льюиса. Как мы уже обсуждали, HNO 3 является кислотой Бренстеда-Лоури , потому что она отдает протон, когда реагирует с менее кислыми соединениями, чем она, такими как H 2 O, и образует сопряженное основание. Следовательно, HNO 3 также действует как кислота Льюиса. Технически HNO 3 действует как кислота Льюиса. Потому что центральный атом азота имеет дефицит электронов и может принять электронную пару от другого соединения, чтобы освободить от него протон. И мы знаем, что все, что принимает электронную пару от других соединений, по своей природе является кислотой Льюиса. Что такое сопряженная кислота и основание HNO3Сопряженная кислота образуется при добавлении одного H + к исходному основанию, а сопряженное основание образуется при присоединении одного протона или иона H + удалены от исходной кислоты. Понятие о сопряженной кислотно-основной паре.
Как известно, HNO 3 иногда действует как основание, а иногда как кислота. Таким образом, очевидно, что его сопряженная кислотно-основная пара также зависит от его природы.
Итак, когда HNO 3 действует как кислота, его сопряженным основанием является NO 3 – , а когда он действует как основание, его сопряженной кислотой является NO 2 + . Является ли HNO3 более сильной кислотой, чем HNO2? Да, HNO 3 является более сильной кислотой, чем HNO 2 , одна из причин заключается в том, что HNO 2 не полностью диссоциирует в водном растворе с высвобождением протона или H + ионы, тогда как HNO 3 почти на 100% ионизирована в водном растворе и полностью диссоциирует на ионы H + и NO 3 – ионы. Или проверьте сопряженное основание кислот, чтобы узнать стабильность соединения. Здесь основанием сопряжения HNO 3 является NO 3 — , которое более стабильно, чем основание сопряжения HNO 2 , которое представляет собой NO 2 — . Поскольку в случае № 3 – электрон может делокализоваться по трем атомам кислорода, но в случае NO 2 – электрон может делокализоваться только по двум атомам кислорода. Итак, NO 3 – электрон имеет больший объем для стабилизации заряда, чем NO 2 – . Таким образом, NO 3 – более стабилен, чем NO 2 – . Примечание: Если сопряженное основание кислоты А более стабильно, чем сопряженное основание кислоты В, то кислота А более сильная, чем кислота В. Использование азотной кислоты
А вот и последняя часть! Пришло время перемотать эту статью на HNO 3 кислота или основание с некоторыми выделенными или важными моментами.
|

 Недиссоциированных частей его в растворе не остается, все части полностью отрываются и ионизируются в водном растворе. присутствие высоких ионов протонов в растворе показывает сильную кислотную способность HNO 3 .
Недиссоциированных частей его в растворе не остается, все части полностью отрываются и ионизируются в водном растворе. присутствие высоких ионов протонов в растворе показывает сильную кислотную способность HNO 3 .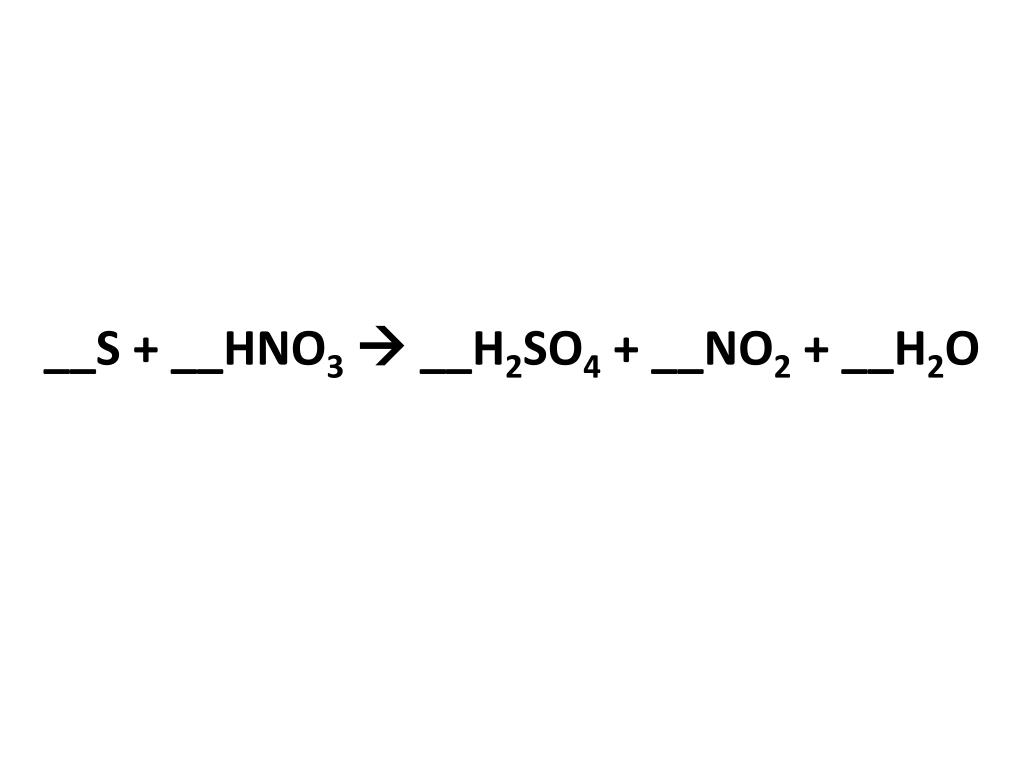

 Имеет ли это смысл?
Имеет ли это смысл?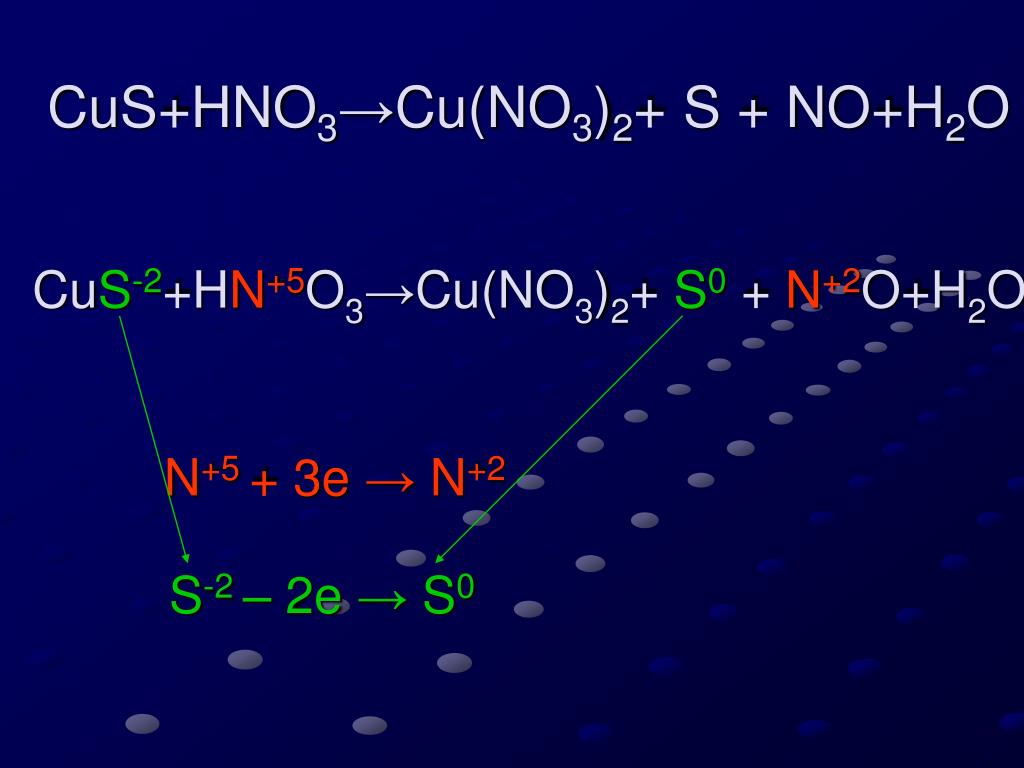
 2 + .
2 + .