Реакции обмена — что это и как составить химическое уравнение?
Поможем понять и полюбить химию
Начать учиться
Этот материал поможет вам узнать или вспомнить, что собой представляют реакции ионного обмена, при каких условиях они протекают и как составить уравнение такой реакции.
Что такое реакция ионного обмена
Чтобы дать определение понятию «реакция ионного обмена», разберем его на составные части:
обмен — значит, что у нас есть два сложных вещества, которые чем-то обмениваются между собой;
ионный — значит, что эти вещества обмениваются между собой ионами, то есть заряженными частицами.
Теперь соединим все вместе и получим, что реакция ионного обмена — это химическая реакция между двумя сложными веществами, которая приводит к обмену заряженными частицами (ионами), в результате чего образуются новые сложные соединения.
С определением разобрались, теперь нужно понять, есть ли какие-то условия, которые гарантируют нам протекание химической реакции. С этим нам поможет правило Бертолле.
Правило Бертолле
Реакции ионного обмена возможны и протекают до конца только в том случае, если при взаимодействии выпадает осадок, выделяется газ или образуется малодиссоциирующее вещество (вода). В иных случаях принято считать, что химическая реакция невозможна.
А между какими соединениями протекают реакции ионного обмена? На самом деле все просто: это кислоты, гидроксиды (растворимые и нерастворимые) и соли.
Полезные подарки для родителей
В колесе фортуны — гарантированные призы, которые помогут наладить учебный процесс и выстроить отношения с ребёнком!
Примеры реакций ионного обмена
Давайте рассмотрим примеры, которые характеризуют каждый из трех признаков протекания химической реакции:
Выпадение осадка:
2KOH + CuCl2 = Cu(OH)2↓ + 2KCl.

-
Выделение газа:
Na2CO3 + 2HCl = H2O + CO2↑ + 2NaCl.
Образование малодиссоциирующего вещества (воды):
NaOH + HCl = H2O + NaCl.
Составление уравнений обменных реакций
Химические уравнения реакций обмена можно записать:
в молекулярной форме:
2NaCl + Pb(NO3)2 = PbCl2↓ + 2NaNO3.
в полной ионной форме — с указанием всех существующих в растворе ионов:
2Na+ + 2Cl− + Pb2+ + 2NO3− = PbCl2↓ + 2Na+ + 2NO3−.
в сокращенной ионной форме, которая, собственно, и выражает взаимодействие ионов:
Pb2+ + 2Cl− = PbCl2↓.

Перейдем к правилам записи ионных уравнений:
Записываем уравнение в молекулярном виде и обязательно расставляем коэффициенты.
Далее с помощью таблицы растворимости определяем растворимость каждого химического соединения.
Составляем полное ионное уравнение с учетом коэффициентов и не забываем указывать заряды ионов.
Важно помнить, что мы не расписываем на ионы нерастворимые соединения, воду, оксиды, все слабые электролиты, анионы кислотных остатков кислых солей слабых кислот и катионы основных солей слабых оснований, а также комплексные катионы. Их следует оставить в молекулярной форме.
Находим одинаковые ионы в левой и правой частях полного ионного уравнения и сокращаем их.
Далее переписываем оставшихся участников ионного уравнения и получаем сокращенное ионное уравнение.

Практика
Чтобы новые знания лучше усвоились, немного попрактикуемся. Для проиллюстрированных химических реакций обмена нужно составить молекулярное, полное ионное и сокращенное ионное уравнения:
Решать задачки гораздо интереснее на интерактивной платформе с мгновенной проверкой. А опытный преподаватель тут же поможет разобраться, если ответ получился неправильным или что-то осталось непонятным. Все это ждет учеников на онлайн-курсах по химии в школе Skysmart.
Ксения Боброва
К предыдущей статье
Основные функции белков в организме
К следующей статье
Способы получения алкенов
Получите план обучения, который поможет понять и полюбить химию
На вводном уроке с методистом
Выявим пробелы в знаниях и дадим советы по обучению
Расскажем, как проходят занятия
Подберём курс
Написать уравнение реакций между веществами k + cl2 2)Na + N2 3)Li2o + N2O5 4) K20 + h3o 5)LioH + Co2 6) KOH +h4Po4 7) NaoH +FeCl2 — Знания.
 site
siteОтветы 1
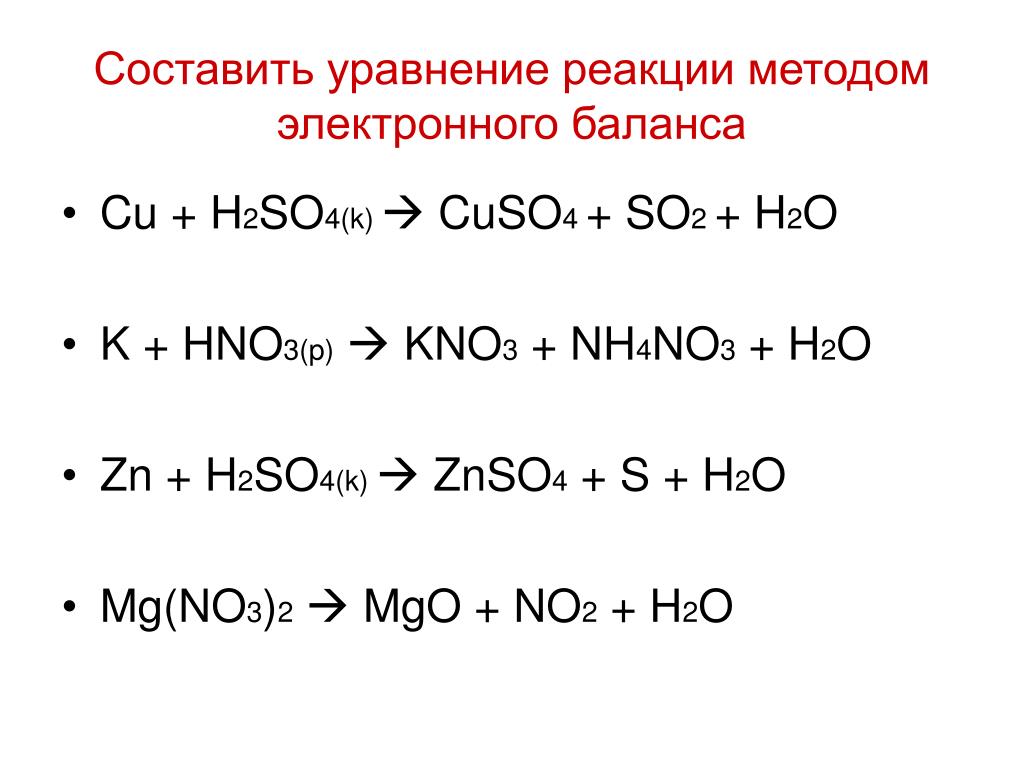
1) K+Cl₂ = 2kCl
2) Na+N₂ =2NaN
3) Li₂O+2H₂O =2LiOH+H₂
4) K₂O +2 H₂O =2KOH + H₂
5) LiOH+CO₂
6)3KOH+H₃PO₄ = K₃PO₄ +3H₂
7)2 NaOH + FeCl₂ =2 NaCl + Fe(OH₂)
Знаешь ответ? Добавь его сюда!
Последние вопросы
Математика
1 час назад
Для строительства детской площадки рабочие проводили измерительные работы. Они подготовили две площадки квадратной формы. Найди их периметр, если известно, что величина периметра каждого из них меньше 90 м. Если цифры в записи одного периметра поменять местами, то получится периметр второго участка. Как записать решение?
Математика
9 часов назад
Запишите решение в столбик и ответ.Русский язык
9 часов назад
Рус. яз 9 класс
яз 9 классФизика
9 часов назад
Металлический шар массой 880 грамм падает на земл с высоты 3м. Какую работу при этом совершает сила тяжестиФизика
9 часов назад
Процесс появление электрической дуги, ее физическое явление, способы гашения дугиМатематика
9 часов назад
Нужна формула расчетаРусский язык
9 часов назад
Русский язык 8 классРусский язык
10 часов назад
Вставте пропущенные буквы в словахГеометрия
10 часов назад
Задача по геометрииБиология
10 часов назад
Биология дз срочноХимия
10 часов назад
1. Назовите групповой реагент и перечислите катионы, входящие в IV группу.
2. Укажите цвет гидроксидов катионов IV
Назовите групповой реагент и перечислите катионы, входящие в IV группу.
2. Укажите цвет гидроксидов катионов IVИстория
10 часов назад
Что произошло в риме после смерти ЦезаряГеография
10 часов назад
Расположите регионы России в той последовательности, в которой их жители встречают Новый год.Русский язык
10 часов назад
Подскажите пожалуйста с заданием по русскому языку, дать характеристику предложениюГеография
10 часов назад
Расположите регионы россии в порядке уменьшения среднегодового количества осадков.
How much to ban the user?
1 hour 1 day 100 years
Cl2 + 2K = 2KCl
| Поиск |
хлор + калий = хлорид калия | Температура: комнатная температура
Содержание
Нажмите, чтобы увидеть более подробную информацию и рассчитать вес/моль >>
Окислительно-восстановительная реакция
| 110405000000-22933.png» substance-weight=»70.9060″> Cl 2 | + | 130521000000-Untitled.png» substance-weight=»74. 5513″> 2KCl 5513″> 2KCl | |||||||||
| хлор | калий | ||||||||||
| (ки) | (рун) | (рун) ) | |||||||||
| (внешний) | (внешний) | (внешний) | |||||||||
| 2 | 2 | Хо Со | |||||||||
| Нгуен-Фанто06 (г/моль) | Сум моль | ||||||||||
| Khối lượng (g) |
Реклама
Дополнительная информация об уравнении Cl
2 + 2K → 2KClВ каких условиях Cl2 (хлор) реагирует с K (калием)?
Температура: комнатная температура
Объяснение: идеальные условия окружающей среды для реакции, такие как температура, давление, катализаторы и растворитель. Катализаторы — это вещества, которые ускоряют темп (скорость) химической реакции, не потребляясь и не становясь частью конечного продукта.
Катализаторы не влияют на равновесные ситуации.
Катализаторы — это вещества, которые ускоряют темп (скорость) химической реакции, не потребляясь и не становясь частью конечного продукта.
Катализаторы не влияют на равновесные ситуации.
Как могут происходить реакции с образованием KCl (хлорида калия)?
Хлор реагирует с калием
В полном предложении вы также можете сказать, что Cl2 (хлор) реагирует с K (калием) и производит KCl (хлорид калия)
Явление после того, как Cl2 (хлор) реагирует с K (калием)
Это уравнение не несет никакой конкретной информации о явлении.
В этом случае вам просто нужно наблюдать, чтобы убедиться, что вещество продукта KCl (хлорид калия), появляющийся в конце реакции.
Или если какое-либо из следующих реагентов K (калий), исчезающий
Какую другую важную информацию вы должны знать о реакции
У нас нет дополнительной информации об этой химической реакции.
Категории уравнения
Дополнительные вопросы, связанные с химическими реакциями Cl
2 + 2K → 2KClВопросы, связанные с реагентом Cl2 (хлор)
Каковы химические и физические характеристики Cl2 (хлор)? химические реакции, в которых реагентом является Cl2 (хлор)?
Вопросы, связанные с реагентом К (калий)
Каковы химические и физические характеристики К (калий)? В каких химических реакциях используется К (калий) в качестве реагента?
Вопросы, связанные с продуктом KCl (хлорид калия)
Каковы химические и физические характеристики KCl (калий)? Какие химические реакции происходят с KCl (хлоридом калия) в качестве продукта?
Новости Только 5% НАСЕЛЕНИЯ знают
Essentt — Подобранные продукты
Подобранные вручную продукты незаменимы при работе из дома!
Уравнения с Cl2 в качестве реагента
хлор
Cl 2 + 2Na → 2NaCl Cl 2 + C 3 H 8 → HCl + C 3 H 7 +2PC 9 5Cl 2 л 5 Просмотреть все уравнения с Cl2 в качестве реагента
Уравнения с K в качестве реагента
калий
2H 2 O + 2K + CuSO 4 → Cu(OH) 2 + H 2 + K 2 SO 4 2H 2 O + 2K → H 2 + 2KOH 2 2009 I 2900 КИ Просмотреть все уравнения с K в качестве реагента
Реклама
Уравнения с K в качестве произведения
калий
2KI → I 2 + 2K 2KCl → Cl 2 + 2K KF → F 2 + K Просмотреть все уравнения с K в качестве продукта
Стехиометрия: Задачи на массу-массу #1 — 10
Стехиометрия: Массовые задачи №1–10Стехиометрия
Массовые задачи
#1 — 10
Десять примеров
Проблема № 11-25
Вернуться в меню стехиометрии
Задача №1: Учитывая следующее уравнение: 2C 4 H 10 + 13O 2 —> 8CO 2 + 10H 2 O
показывают, какими должны быть следующие молярные соотношения.
(а) С 4 Н 10 : О 2
(b) O 2 : CO 2
(c) O 2 : H 2 O
(d) C 4 H 10 : CO 2
(e) C 4 H 10 : H 2 O
Решение:
(а) 2 : 13
(б) 13 : 8
(в) 13 : 10
(г) 2 : 8 (или 1 : 4)
(д) 2 : 10 (или 1 : 5)
Задача №2: Учитывая следующее уравнение: 2KClO 3 —> 2KCl + 3O 2
Сколько молей O 2 можно получить, если подвергнуть реакции 12,00 молей KClO 3 ?
Решение:
Молярное соотношение KClO 3 и O 2 составляет 2:3.
2 моль KClO 3 12,00 моль KClO 3 ––––––––––– = ––––––––––––– 3 моль О 2 х х = 18,00 моль О 2
Задача №3: Учитывая следующее уравнение: 2K + Cl 2 —> 2KCl
(a) Сколько граммов KCl получается из 2,50 г K и избытка Cl 2 .
(b) Из 1,00 г Cl 2 и избытка K?
Решение (а):
1) Определить количество молей K:
2,50 г / 39,098 г/моль = 0,063942 моль K
2) Молярное отношение K к KCl составляет 2:2. Поэтому:
2 моль К 0,063942 моль К –––––––– = ––––––––––––– 2 моль KCl х х = 0,063942 моль KCl
3) Определите массу KCl:
(0,063942 моль) (74,551 г/моль) = 4,77 г KCl (до трех знаков)
4) Размерный анализ:
2,50 г К 1 моль К 2 моль KCl 74,551 г KCl –––––––– х ––––––––– х –––––––– х –––––––––– = 4,77 г KCl 1 39,098 г К 2 моль К 1 моль KCl
Решение (б):
1) Определение молей Cl 2 :
1,00 г / 70,906 г/моль = 0,0141032 моль Cl 2
2) Молярное соотношение Cl 2 и KCl составляет 1:2. Используйте отношение и пропорцию:
Используйте отношение и пропорцию:
1 моль Cl 2 0,0141032 моль Cl 2 –––––––– = ––––––––––––––– 2 моль KCl х х = 0,0282064 моль KCl
3) Определите массу образовавшегося KCl:
(0,0282064 моль) (74,551 г/моль) = 2,10 г KCl (до трех знаков)
4) Размерный анализ:
1,00 г Cl 2 1 моль Cl 2 2 моль KCl 74,551 г KCl –––––––– х ––––––––– х –––––––– х –––––––––– = 2,10 г KCl 1 70,906 г Cl 2 1 моль Cl 2 1 моль KCl
Задача №4: Дано следующее уравнение: Na 2 O + H 2 O —> 2NaOH
(a) Сколько граммов NaOH получается из 1,20 x 10 2 граммов Na 2 O?
(b) Сколько граммов Na 2 O требуется для получения 1,60 x 10 2 граммов NaOH?
(c) Когда 3,45 х 10 2 граммов Na 2 O реагируют, сколько граммов воды расходуется?
Решение (а):
1) Определить количество молей Na 2 O:
120 г / 61,979 г/моль = 1,93614 моль Na 2 O
2) Молярное соотношение между Na 2 O и NaOH составляет 1:2. Определить количество молей NaOH, которое образовалось:
Определить количество молей NaOH, которое образовалось:
1 моль Na 2 O 1,93614 моль Na 2 O ––––––––––– = –––––––––––––– 2 моль NaOH х x = 3,87228 моль NaOH
3) Определите массу полученного NaOH:
(3,87228) (40,00 г/моль) = 155 г NaOH
4) Размерный анализ:
120 г Na 2 O 1 моль Na 2 O 2 моль NaOH 40,00 г NaOH –––––––––– х –––––––––––– х –––––––––– х –––––––––––– = 155 г NaOH 1 61,979 г Na 2 O 1 моль Na 2 O 1 моль NaOH
Решение (б):
1) Определить количество молей полученного NaOH:
160 г / 40,00 г/моль = 4,00 моль NaOH
2) Молярное соотношение между Na 2 O и NaOH составляет 1:2. Определить моли Na 2 O, которые израсходованы:
Определить моли Na 2 O, которые израсходованы:
1 моль Na 2 O х –––––––––– = ––––––––––––– 2 моль NaOH 4,00 моль NaOH x = 2,00 моль Na 2 O
3) Определить массу Na 2 О потребляется:
(2,00 моль) (61,979 г/моль) = 124 г Na 2 O
4) Размерный анализ:
160 г NaOH 1 моль NaOH 1 моль Na 2 O 61,979 г Na 2 O –––––––––– х –––––––––––– х –––––––––– х –––––––––––– = 124 г Na 2 O 1 40,00 г NaOH 2 моль NaOH 1 моль Na 2 O
Решение (с):
1) Определить количество молей Na 2 O, прореагировавших:
345 г / 61,979 г/моль = 5,5664 моль Na 2 O
2) Молярное соотношение между Na 2 O и H 2 О 1:1. Используйте соотношение и пропорцию для определения молей потребленной воды:
Используйте соотношение и пропорцию для определения молей потребленной воды:
1 моль Na 2 O 5,5664 моль Na 2 O –––––––––––– = –––––––––––––––– 1 моль H 2 O х х = 5,5664 моль H 2 O
3) Определите массу израсходованной воды:
(5,5664 моль) (18,015 г/моль) = 100, г H 2 O (до трех знаков фиг.)Альтернативный способ записать ответ, который показывает три знака цифры, это 1,00 x 10 2 г.
4) Размерный анализ:
345 г Na 2 O 1 моль Na 2 O 1 моль H 2 O 18,015 г В 2 О –––––––––– х –––––––––––– х –––––––––– х –––––––––––– = 100, г H 2 O 1 61,979 г Na 2 O 1 моль Na 2 O 1 моль H 2 O
Задача №5: Учитывая следующее уравнение: 8Fe + S 8 —> 8FeS
а) Какая масса железа потребуется для реакции с 16,0 г серы?
(b) Сколько граммов FeS произведено?
Решение (а):
1) Определите количество молей серы:
16,0 г / 256,52 г/моль = 0,0623733 моль S 8
2) Соотношение и пропорция. S 8 для Fe 1:8
S 8 для Fe 1:8
1 моль S 8 0,0623733 моль S 8 –––––– = ––––––––––––– 8 моль Fe х х = 0,4989864 моль Fe
3) Определить массу израсходованного Fe:
(0,4989864 моль) (55,845 г/моль) = 27,9 г Fe
4) Размерный анализ:
16,0 г S 8 1 моль S 8 8 моль Fe 55,845 г Fe –––––––––– х –––––––––––– х –––––––––– х –––––––––––– = 27,9 г Fe 1 256,52 г S 8 1 моль S 8 1 моль Fe
Решение (б):
1) 0,0623733 моль S 8 присутствует.
2) Определить количество молей FeS (молярное соотношение S 8 к FeS составляет 1:8).
1 моль S 8 0,0623733 моль S 8 –––––– = ––––––––––––– 8 моль FeS х x = 0,4989864 моль FeS
3) Определите массу FeS:
(0,4989864 моль) (87,91 г/моль) = 43,9 г FeS
4) Размерный анализ:
16,0 г S 8 1 моль S 8 8 моль FeS 87,91 г FeS –––––––––– х –––––––––––– х –––––––––– х –––––––––––– = 43,9 г FeS 1 256,52 г S 8 1 моль S 8 1 моль FeS
Ответ на проблему № 5:
1) Иногда уравнение записывается так:
Fe + S —> FeS
2) Это влияет на ответ? Вот размерный анализ для (b) с использованием пересмотренного химического уравнения:
16,0 г S 1 моль S 1 моль FeS 87,91 г FeS –––––––––– х –––––––––––– х –––––––––– х –––––––––––– = 43,9 г FeS 1 32,065 г S 1 моль S 1 моль FeS
3) На окончательный ответ никак не влияет использование «другого» химического уравнения.
Задача № 6: Учитывая следующее уравнение: 2NaClO 3 —> 2NaCl + 3O 2
(a) 120,0 г NaClO 2 3
(b) Сколько граммов NaCl образуется при производстве 80,0 граммов O 2 ?
Решение (а):
1) Определить количество молей NaClO 3 :
120,0 г / 106,44 г/моль = 1,127396 моль NaClO 3
2) Соотношение и пропорция времени. Молярное соотношение NaClO 3 и O 2 составляет 2:3.
2 моль NaClO 3 1,127396 моль NaClO 3 –––––––––––– = ––––––––––––––– 3 моль О 2 х х = 1,6 моль О 2
3) Определить массу O 2 :
(1,6 моль) (32,00 г/моль) = 54,11 г O 2 (до четырех цифр)
4) Размерный анализ:
120,0 г NaClO 3 1 моль NaClO 3 3 моль О 2 32,00 г O 2 –––––––––– х –––––––––––– х –––––––––– х ––––––––– = 54,11 г О 2 1 106,44 г NaClO 3 2 моль NaClO 3 1 моль О 2
Решение (б):
1) Определить количество молей O 2 :
80,0 г / 32,00 г/моль = 2,50 моль O 2
2) Определить количество молей NaCl (мольное отношение O 2 к NaCl составляет 3:2).
3 моль О 2 2,50 моль O 2 ––––––––– = –––––––––– 2 моль NaCl Икс x = 1,667 моль NaCl
3) Определите массу NaCl:
(1,667 моль) (58,44 г/моль) = 97,4 г NaCl
4) Метод факторных меток (другое название размерного анализа):
80,0 г O 2 1 моль О 2 2 моль NaCl 58,44 г NaCl –––––––– х ––––––––– х –––––––––– х ––––––––––– = 97,4 г NaCl 1 32,00 г O 2 3 моль О 2 1 моль NaCl
Задача № 7: Учитывая следующее уравнение: Cu + 2AgNO 3 —> Cu(NO 3 ) 2 + 2Ag
Если было получено 89,5 граммов серебра, сколько граммов меди вступило в реакцию?
Решение:
1) Определить количество молей полученного Ag:
89,5 г / 107,87 г/моль = 0,8297 моль Ag
2) Молярное отношение Ag к Cu составляет 2:1. Определите количество молей израсходованной Cu:
Определите количество молей израсходованной Cu:
2 моль серебра 0,8297 моль Ag ––––––– = ––––––––––– 1 моль Cu х х = 0,41485 моль Cu
3) Определите массу Cu:
(0,41485 моль) (63,546 г/моль) = 26,4 г Cu
4) Размерный анализ:
89,5 г Ag 1 моль Ag 1 моль Cu 63,546 г меди –––––––– х –––––––––– х –––––––– х –––––––––– = 97,4 г NaCl 1 107,87 г серебра 2 моль серебра 1 моль Cu
Задача №8: Расплавленное железо и монооксид углерода получают в доменной печи в результате реакции оксида железа(III) и кокса (чистого углерода). Сколько килограммов железа можно получить, если использовать 25,0 кг чистого Fe 2 O 3 ? Реакция:
Сколько килограммов железа можно получить, если использовать 25,0 кг чистого Fe 2 O 3 ? Реакция:
Fe 2 O 3 + 3C —> 2Fe + 3CO
Решение:
1) Определение молей Fe 2 O 3 б/у:
25000 г / 159,694 г/моль = 156,5494 моль Fe 2 O 3
2) Используйте соотношение и пропорцию для определения молей произведенного Fe:
1 моль Fe 2 O 3 156,5494 моль Fe 2 O 3 –––––––––– = –––––––––––––––– 2 моль Fe х х = 313,0988 моль
3) Определить граммы, затем килограммы Fe:
(313,0988 моль) (55,847 г/моль) = 17485,6 г FeДо трех знаков инжира и после перевода в кг получается 17,5 кг Fe
4) Я сделал размерный анализ немного иначе:
25,0 кг Fe 2 O 3 1 моль Fe 2 O 3 2 моль Fe 55,847 г Fe –––––––––––– х ––––––––––––– х –––––––––– х –––––––––– = 17,5 кг Fe 1 159,694 г Fe 2 О 3 1 моль Fe 2 O 3 1 моль Fe
5) Обратите внимание, что все единицы измерения, кроме кг, отменяются. Я хочу сосредоточиться на «g Fe 2 O 3 » и «g Fe». Они компенсируют друг друга, потому что UNIT в обоих случаях равен граммам. Fe 2 O 3 и Fe — это просто дескрипторы, говорящие о том, что один грамм соответствует количеству Fe 2 O 3 и один грамм – это количество Fe. Однако обе единицы являются массами и компенсируют друг друга.
Я хочу сосредоточиться на «g Fe 2 O 3 » и «g Fe». Они компенсируют друг друга, потому что UNIT в обоих случаях равен граммам. Fe 2 O 3 и Fe — это просто дескрипторы, говорящие о том, что один грамм соответствует количеству Fe 2 O 3 и один грамм – это количество Fe. Однако обе единицы являются массами и компенсируют друг друга.
6) Этот DA включает явное преобразование из кг в г в начале и преобразование из г в кг в конце.
25,0 кг Fe 2 O 3 1000 г Fe 2 O 3 1 моль Fe 2 O 3 2 моль Fe 55,847 г Fe 1 кг Fe –––––––––––– х ––––––––––– х –––––––––––– х –––––––––– х –––––––––– х ––––––––– = 17,5 кг Fe 1 1 кг Fe 2 O 3 159,694 г Fe 2 O 3 1 моль Fe 2 O 3 1 моль Fe 1000 г Fe
Проблема №9: В среднем человеку требуется 120,0 г глюкозы (C 6 H 12 O 6 ) в день. Сколько граммов СО 2 (в реакции фотосинтеза) требуется на это количество глюкозы? Фотосинтетическая реакция это:
Сколько граммов СО 2 (в реакции фотосинтеза) требуется на это количество глюкозы? Фотосинтетическая реакция это:
6CO 2 + 6H 2 O —> C 6 H 12 O 6 + 6O 2
Решение:
1) Определите количество молей глюкозы:
120,0 г / 180,162 г/моль = 0,6660672 моль C 6 H 12 O 6
2) Молярное соотношение между CO 2 и глюкозой составляет 6:1. Определить количество молей CO 2 требуется:
6 моль CO 2 х ––––––––––––– = –––––––––––––––––––– 1 моль C 6 H 12 O 6 0,6660672 моль C 6 H 12 O 6 x = 3,9964 моль
3) Определить массу CO 2 , вступившего в реакцию:
(3,9964 моль) (44,009 г/моль) = 175,9 г CO 2 (до четырех цифр)
4) DA не предоставляется.
Задача № 10: Супероксид калия, KO 2 , используется для производства O 2 в космических экспедициях с использованием CO 2 , что определяется следующим уравнением:
4KO 2 + 2CO 2 —> 2K 2 CO 3 + 3O 2
(a) Сколько граммов O 2 производится из 100 г KO 2 при достаточном количестве CO 2 ?
(b) Сколько граммов CO 2 банка 100 г KO 2 потреблять?
Комментарий: иногда элемент или соединение опускается. Это было сделано для решений, предоставленных для проблемы № 10.
Решение (а):
1) Определение молей КО 2 :
100 г / 71,096 г/моль = 1,40655 моль
2) Из коэффициентов сбалансированного уравнения определяем, что молярное соотношение KO 2 к O 2 составляет 4 : 3.




 Назовите групповой реагент и перечислите катионы, входящие в IV группу.
2. Укажите цвет гидроксидов катионов IV
Назовите групповой реагент и перечислите катионы, входящие в IV группу.
2. Укажите цвет гидроксидов катионов IV