Объемное восстановление расплава FeCl2–CaCl2 кальцием, растворенным в хлориде кальция | Поляков
1. Лыков П.А. Разработка гидропневмоагрегатов машин по производству микропорошков из жидких металлов: Автореф. дис. … Кандидат технических наук. Челябинск: ЮУрГУ, 2014. http://tekhnosfera.com/view/ 447915/a?#?page=1.
2. Анциферов В.Н., Бобров Г.В., Дружинин Л.К., Кипарисов С.С., Костиков В.И., Крупин А.В., Кудинов В.В., Либенсон Г.А., Митин Б.С., Роман О.В. Порошковая металлургия и напыленные покрытия. М.: Металлургия, 1987.
3. Кипарисов С.С., Либенсон Г.А. Порошковая металлургия. М.: Металлургия, 1972.
4. Ramakrishnan P. Iron powder from iron scrap // Conservat. Recycl. 1983. Vol. 6. No. 1. P. 49—54. DOI: dx.doi.org/10.1016/0361-3658(83)90016-4.
5. Hoeges S., Zwiren A., Schade C. Additive manufacturing using water atomized steel powders // Metal Powder Rep. 2017. Vol 72. No. 2. P. 111—117. DOI: dx.doi.org/10.1016/j.mprp.2017.01.004.
6. Зленко М.А., Нагайцев М. В., Довбыш В.М. Аддитиивные технологии в машиностроении: Пособие для инженеров. М.: НАМИ, 2015. С. 160—171.
В., Довбыш В.М. Аддитиивные технологии в машиностроении: Пособие для инженеров. М.: НАМИ, 2015. С. 160—171.
7. Tsantrizos P.G., Allaire F., Entezarian M. Method of production of metal and ceramic powders by plasma atomization: Pat. 5707419 (USA). 1998. https://www.google.com/patents/US5707419.
8. Boulos M. Plasma power can make better powders // Metal Powder Rep. 2004. Vol. 59. No. 5. P. 16—21. DOI: dx.doi.org/10.1016/S0026-0657(04)00153-5.
9. Александров В.Влияние «теплого прессования» и степени легирования на структуру и свойства изделий из металлических порошков: Автореф. дис. … Кандидат технических наук. Пермь: ПНИПУ, 2005. http://pstu.ru/files/file/adm/dissertacii/aleksandrov/aftoreferat_aleksandrov_vg.pdf.
10. Ye Q., Zhu H., Zhang L., Ma J., Zhou L., Liu P., Chen J., Chen G., Peng J. Preparation of reduced iron powder using combined distribution of wood-charcoal by microwave heating // J. Alloys and Compd. 2014. Vol. 613. P. 102—106. DOI: dx.doi.org/10.1016/j.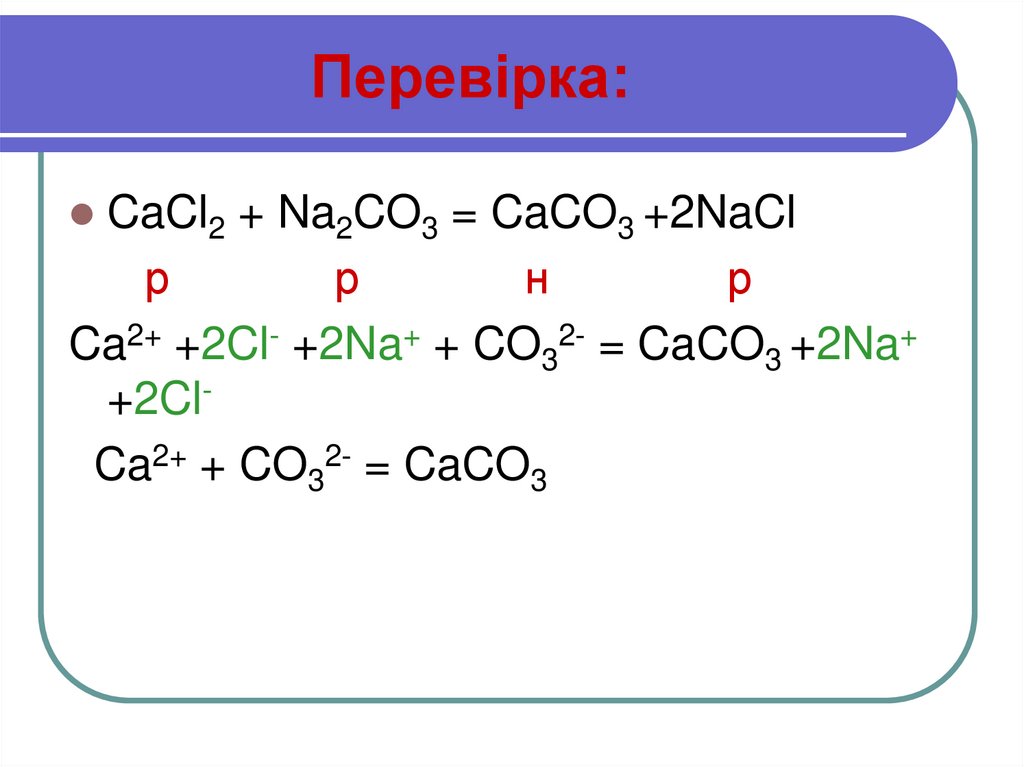 jallcom. 2014.06.016.
jallcom. 2014.06.016.
11. Martin M.I., Lopez F.A., Torralba J.M. Production of sponge iron powder by reduction of rolling mill scale // Ironmaking and Steelmaking. 2012. Vol 39. No. 3. P. 155—162.
12. Squires A.M., Johnson C.A. The h-iron process // J. Metals. 1957. P. 586—590.
13. Brooks J. Production of ferrous chloride and metallic iron powder: Pat. 2762700 A (US). 1956.
14. Gaballah N., Zikry A., Khalifa M., Farag A., El-Hussiny N., Shalabi M. Production of iron from mill scale industrial waste via hydrogen // Open J. Inorg. Non-metal. Mater. 2013. Vol. 3 No. 3. P. 23—28. DOI: dx.doi.org/10.4236/ojinm.2013.33005.
15. Bloemacher D. Carbonyl iron powders: Its production and new developments // Metal Powder Rep. 1990. Vol. 45. No. 2. P. 117—119. DOI: dx.doi.org/10.1016/S0026-0657(10)80122-5.
16. Benchiheub O., Mechachti S., Serrai S., Khalifa M.G. Elaboration of iron powder from mill scale // J. Mater. Envir. Sci. 2010. Vol. 1. No. 4. P. 267—276.
17. Despeisse M., Ford S. The role of additive manufacturing in improving resource efficiency and sustainability // Proc. Int. Conf. APMS 2015. United Kingdom: Institute for Manufacturing, University of Cambridge, 2015. http://www.apms-conference.org.
Despeisse M., Ford S. The role of additive manufacturing in improving resource efficiency and sustainability // Proc. Int. Conf. APMS 2015. United Kingdom: Institute for Manufacturing, University of Cambridge, 2015. http://www.apms-conference.org.
18. Petrick I., Simpson T. 3D Printing disrupts manufacturing // Res. Technol. Management. 2013. Vol. 56. No. 6. DOI: dx.doi.org/10.5437/08956308X5606193.
19. Berman B. 3-D Printing: The new industrial revolution // Business Horizons. 2012. Vol. 55. P. 155—162. DOI: dx.doi.org/10.1016/j.bushor.2011.11.003.
20. Petrovic V., Gonzalez J., Ferrando O., Gordillo J., Puchades J., Griñan L. Additive layered manufacturing: Sectors of industrial application shown through case studies // Int. J. Production Res. 2011. Vol. 49. No. 4. P. 1061—1079. DOI: dx.doi.org/10.1080/00207540903479786.
21. Gibson I. Additive manufacturing technologies: 3D printing, rapid prototyping, and direct digital manufacturing. N.Y.: Springer-Verlag, 2015. DOI: dx.doi.org/10.1007/978-1-4939-2113-3.
DOI: dx.doi.org/10.1007/978-1-4939-2113-3.
22. Баймаков Ю.В., Ветюков М.М. Электролиз расплавленных солей. М.: Металлургия, 1966.
23. Родякин В.В. Металлургия кальция. М.: Металлургия, 1957.
24. Лаптев Д.А., Поляков В.В., Бабин А.В., Лебедев В.А. Восстановительная способность растворов кальция в его расплавленном хлориде // Матер. 3-й научный-техн. конф. «Металлургия легких и тугоплавких металлов» (10—11 окт. 2014). Екатеринбург: УрФУ, 2014. С. 169—172.
Ответы | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||
|
|
| |||||||||||||||||||||||||||||||||||||||||||||||||||
Посмотреть всех экспертов из раздела Учеба и наука
| Похожие вопросы |
тело находится в равновесии под действием трех сил.
Решите уравнение (5x+2)(-x-4)=0 если уравнение имеет более одного корня в ответ запишите больший из корней напишите решение плииз
Решено
Радиус вписанной в квадрат окружности равен 4√2 найти радиус окружности описанной около этого квадрата
Можно ли силу 8 Н разложить на две по 5 Н каждая? Можно ли ту же силу разложить на две по 9 Н?
Пользуйтесь нашим приложением
хлорид кальция (CaCl₂) – получение, свойства, формула и часто задаваемые вопросы
Дата последнего обновления: 20 апреля 2023 г. 3 2 есть говорят, что это ионное соединение, имеющее химическое название хлорид кальция. Мы также можем назвать его либо дихлоридом кальция, либо безводным хлоридом кальция.
Хлорид кальция представляет собой ионное соединение, состоящее из хлора и кальция. Это кристаллическое твердое вещество белого цвета при комнатной температуре, хорошо растворимое в воде и, следовательно, гигроскопичное по своей природе. Он имеет очень высокую энтальпию растворения и не имеет запаха. Этот состав широко используется для борьбы с обледенением и пылеудалением.
Получение хлорида кальция
Хлорид кальция можно получить следующим образом:
Соединение хлорида кальция было открыто в 15 веке, но до второй половины 18 века мало изучалось или привлекало внимание. Вся ранняя работа была выполнена с образцами, приготовленными в лаборатории, потому что они не производились в промышленных масштабах до тех пор, пока не был введен в действие аммиачно-содовый процесс производства кальцинированной соды. На самом деле, он считался отходами, пока не было обнаружено его применение.
Важные свойства хлорида кальция можно занести в следующую таблицу.
Свойства хлорида кальция (CaCl
2 ) ХлоридПлотность
Безводный: 2,15 г/ см 3
Молекулярный вес/ Молярная масса
110,98 г/моль
Температура кипения
1935 °C
03 Температура плавления
772 °C
CaCl2 Структура
Молекулы хлорида кальция имеют две ионные связи между одним катионом кальция и двумя анионами хлора. Молекулы структуры хлорида кальция представлены ниже. Следует отметить, что катион кальция имеет заряд величиной +2, а каждый анион хлорида имеет заряд -1 величины. Следовательно, соединение электрически нейтрально.
(Изображение скоро будет обновлено)
Формула хлорида кальция
Химическая формула хлорида кальция может быть представлена как CaCl 2 .
Это ионное соединение, состоящее из одного катиона кальция Ca 2+ и двух хлорид-анионов. Двухвалентный металлический кальций образует ионную связь с двумя атомами хлора.
Хлорид кальция представляет собой ионное соединение, состоящее из ионов. Как мы все знаем, ионы могут иметь положительный или отрицательный заряд, но основная идея заключается в том, что общий заряд ионного соединения должен сбалансироваться, чтобы стать нейтральным.
Кальций находится в группе 2 с зарядом 2+, а хлор находится в группе 7 с зарядом -1. Поскольку общий заряд равен 0 для нейтрали, должен быть баланс зарядов. Таким образом, для уравновешивания заряда ионов кальция необходимо два иона хлора, поскольку 2−2=0.
Образование CaCl 2 происходит в основном при взаимодействии известняка (CaCO 3 ) с соляной кислотой (HCl). Химическое уравнение можно представить следующим образом.
CaCO 3 + 2HCl → CaCl 2 + CO 2 + H 2 O(водн. )
)
Он также производится в качестве основного побочного продукта при производстве кальцинированной соды Na 2 CO 3 с использованием процесса Сольвея, где реагирует с раствором NaCl.
Приготовление хлорида кальция
Чтобы приготовить хлорид кальция, необходимо выполнить шаги, перечисленные ниже.
Шаг 1
Возьмите стакан и поместите в него известняки, надев перчатки, пока стакан не заполнится на четверть от общего объема.
Шаг 2
Теперь добавьте HCl (соляную кислоту) на 1/4 стакана примерно до уровня известняка.
Этап 3
Когда соляная кислота растворяет известняк, начинают образовываться пузырьки. Теперь осторожно перемешайте содержимое в стакане и будьте осторожны, чтобы реакция завершилась. Если все известняки растворятся в нем полностью, добавьте немного известняка.
Этап 4
Затем отфильтруйте твердые частицы, выливая раствор через фильтровальную бумагу, как только раствор перестанет пузыриться.
Шаг 5
Теперь нагрейте второй стакан с раствором хлорида кальция. Твердый хлорид кальция — это то, что остается после испарения воды.
CaCl
2 ПрименениеХлорид кальция имеет множество применений. Несколько применений хлорида кальция перечислены ниже.
Применяется в качестве пищевого консерванта, пищевой добавки, для борьбы с обледенением дорог зимой и в качестве рассола в холодильных установках.
Используется на водоочистных сооружениях.
Он имеет множество применений в бурении нефтяных скважин, металлургии, резиновой, красильной, бумажной и лакокрасочной промышленности.
Может использоваться для коррекции дефицита минералов при пивоварении.

Мы можем использовать его в самонагревающихся банках и грелках.
Может также использоваться в качестве стерилизатора для самцов животных.
Опасность для здоровья, связанная с хлоридом кальция
Хлорид кальция является раздражающим соединением, и с ним необходимо работать в перчатках.
Относительно безопасен в обращении, но при попадании внутрь вступает в экзотермическую реакцию с водой и может вызвать жжение в пищеводе или во рту.
Преимущества хлорида кальция
Хлорид кальция можно использовать несколькими способами. Но поскольку это химическое соединение, вы должны поговорить со своим врачом, прежде чем физически принимать хлорид кальция или использовать это химическое соединение.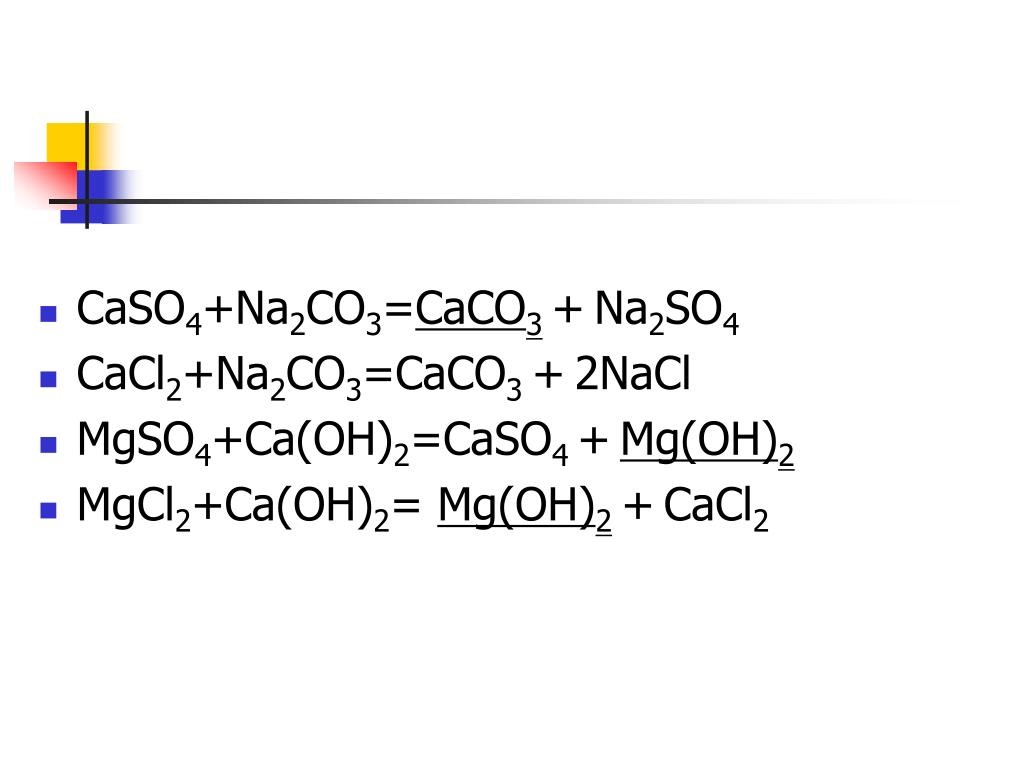 Если у вас диагностировано какое-либо физическое заболевание или вы принимаете определенные лекарства, будет разумно проконсультироваться со своим врачом, прежде чем включать хлорид кальция в свою повседневную жизнь.
Если у вас диагностировано какое-либо физическое заболевание или вы принимаете определенные лекарства, будет разумно проконсультироваться со своим врачом, прежде чем включать хлорид кальция в свою повседневную жизнь.
Говоря о преимуществах, мы должны обратить внимание на практическое использование этого химического соединения и на то, как готовят лекарства с помощью хлорида кальция.
Если вы страдаете от низкого уровня кальция, и вы пробовали много других лекарств, но вы не заметили каких-либо изменений в своем состоянии, то большинство врачей порекомендуют вам принять рекомендованное количество кальция. хлорид кальция.
У людей диагностируют высокий уровень калия, который может повлиять на состояние их сердца. Чтобы защитить сердце и предотвратить другие заболевания, которые могут возникнуть из-за высокого уровня калия в организме, практикующие врачи часто рекомендуют хлорид кальция.

Химические соединения, входящие в состав хлорида кальция, могут оказывать прямое воздействие на некоторые соединения, такие как магний, калий. Чрезмерное присутствие магния в организме может сказаться на здоровье людей. Высокий уровень магния также может негативно влиять на сердце и легкие человека. Для защиты людей от негативных последствий состояний здоровья, возникающих из-за присутствия в организме высокого содержания магния, и для предотвращения других состояний здоровья предлагается хлорид кальция.
Врачи часто рекомендуют хлорид кальция для лечения других заболеваний. Но поскольку это химическое соединение, длительное его использование также может вызвать некоторые побочные эффекты. У некоторых людей также могут быть аллергические реакции из-за этого.
Люди всегда должны практиковаться в приеме лекарств, содержащих хлорид кальция, под руководством опытных врачей и практикующих врачей.
 Врачи часто заменяют лекарства чем-то другим, к чему их организм может адаптироваться, если они начинают чувствовать какие-то побочные эффекты. Самое главное, люди всегда должны потреблять необходимое количество рекомендуемого количества хлорида кальция.
Врачи часто заменяют лекарства чем-то другим, к чему их организм может адаптироваться, если они начинают чувствовать какие-то побочные эффекты. Самое главное, люди всегда должны потреблять необходимое количество рекомендуемого количества хлорида кальция.
Побочные эффекты приема хлорида кальция
Если хлорид кальция принимать без рекомендации врача или сверх предписанной дозы, это может вызвать множество побочных эффектов. Это может привести к сыпи и другим раздражениям кожи.
Высокая доза хлорида кальция может вызвать гиперкальциемию.
Люди также могут испытывать такие симптомы, как низкое кровяное давление, потливость или тошнота. У них также может развиться склонность к рвоте.
Беременные женщины никогда не должны принимать хлорид кальция в качестве лекарства, если это не рекомендовано врачом.
 Лекарства могут оказать негативное влияние на здоровье и развитие ребенка.
Лекарства могут оказать негативное влияние на здоровье и развитие ребенка.
Заключение
Студенты могут получить подробную информацию об определении, свойствах, формуле, опасности для здоровья, а также о различных преимуществах хлорида кальция из вышеприведенного содержания.
Для химической реакции 2 HCl + Ca ( OH ) 2 ⟶ CaCl 2 + 2 H 2 O сколько молей хлорида кальция (CaCl2) образуется из 2,0 моль соляной кислоты (HCl)
Химия
Венди М.
спросил 17.03.20Подписаться І 2
Подробнее
Отчет
2 ответа от опытных наставников
Лучший Новейшие Самый старыйАвтор: Лучшие новыеСамые старые
Фрэнк А. ответил 17.03.20
Репетитор
5 (16)
Четверть века преподавания физики IB, GCSE, AP и фармацевтической математики.
Смотрите таких репетиторов
Смотрите таких репетиторов
Коэффициент представляет количество молей каждого ингредиента в химическом уравнении. Это число слева от ингредиента. В этом случае HCl имеет 2 слева от него, а CaCl 2 не имеет ничего (что означает 1, а не 0). Так на 2 моля HCl приходится 1 моль CaCl 2 Производится.
Надеюсь, это поможет.
г-н А
Подробнее
Отчет
Дж. Р. С. ответил 17.03.20
Репетитор
5,0 (141)
к.т.н. Профессор университета с более чем 10-летним опытом репетиторства
Об этом репетиторе ›
Об этом репетиторе ›
Чтобы решить эти типы задач, вам нужно посмотреть на сбалансированное уравнение и обратить внимание на МОЛЬНЫЕ ОТНОШЕНИЯ, то есть на стехиометрию.

 10.17
10.17

 Врачи часто заменяют лекарства чем-то другим, к чему их организм может адаптироваться, если они начинают чувствовать какие-то побочные эффекты. Самое главное, люди всегда должны потреблять необходимое количество рекомендуемого количества хлорида кальция.
Врачи часто заменяют лекарства чем-то другим, к чему их организм может адаптироваться, если они начинают чувствовать какие-то побочные эффекты. Самое главное, люди всегда должны потреблять необходимое количество рекомендуемого количества хлорида кальция. Лекарства могут оказать негативное влияние на здоровье и развитие ребенка.
Лекарства могут оказать негативное влияние на здоровье и развитие ребенка.