Ответы | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||
|
|
| |||||||||||||||||||||||||||||||||||||||||||||||||||
Посмотреть всех экспертов из раздела Учеба и наука > Физика
| Похожие вопросы |
ClO2 → HCl→ NaCl→NaClO3→NaCl
Из пропилена получить 2,2,3 триметилбутан
Из пропилена получить 2,2,3 триметилбутановую кислоту
Помогите осуществить превращение
Чистый нитрат кальция
Чистый нитрат кальция Получение безводного нитрата кальция, предоставленное BASF Использование: Приготовление безводной азотной кислоты, добавка для сохранения чего-н. влажный, производство сухого газообразного диоксида азота путем разложения
влажный, производство сухого газообразного диоксида азота путем разложения
Нитрат кальция является удобрением только специального назначения из-за его низкое содержание азота, поэтому его трудно усваивать. это нитрат кальция содержащее удобрение представляет собой двойную соль формулы 5Ca(NO3)2Nh5NO3.10h3O а Nh5NO3 можно было удалить повторной перекристаллизацией из кипящую воду, так как Nh5NO3 гораздо лучше растворим в горячей воде, чем Ca(NO3)2.
Таким образом, в большинстве случаев процесс, который мы выбираем, должен быть аммиачным. реакция нитрат-оксид кальция, которая подробно описана ниже насколько это возможно, чтобы предотвратить разочарование и пустую трату времени.
Следующее описание основано на десятках экспериментальных попыток. оптимизировать и упростить метод.
Уравнение реакции: CaO + h3O + 2Nh5NO3 > Ca(NO3)2 + Nh4 + 2h3O
Побочные реакции: Nh4 + h3O > Nh4.h3O
Разложение (нежелательное): Ca(NO3)2 > CaO + 2NO2 + O2
Шаг 1) возьмите 50-килограммовый* мешок удобрения KAS 27 EU или аналогичный нитро
продукт(27%N, в основном аммиачная селитра), желательно летом, или
вам зададут много вопросов — все равно это не так уж и дорого. ..
..
Насыпьте удобрение в несколько ведер и герметично закройте их. хранилище.
Шаг 2) Получите 40 кг* — мешок извести (>92% CaO). Насыпьте лайм в несколько ведер и герметично закройте их для хранения.
* меньшие количества трудно получить
Шаг3) взвешиваем 3,4 части*(по весу или также по объему, если гранулированное удобрение осталось сухим) удобрения KAS 27 и растворить его при сильном перемешивании в наименьшем количестве теплой воды.
Затем дайте постоять несколько минут и осторожно слейте раствор. от нерастворимых добавок CaCO3 и MgO.
Промойте оставшееся твердое вещество несколькими миллилитрами горячей воды, дайте отстояться и декантируйте. остальное раствор аммиачной селитры.
Подготовьте подходящий горшок для следующего шага, достаточно большой, чтобы поместить выбранный количество реагентов при этом заполняется только на половину его объема.
*только в случае использования европейского союза — удобрения KAS 27, которое
содержит около 77% аммиачной селитры; примечание: это удобрение гранулированное,
и гранулы имеют точный размер таким образом, что объем (л) равен
к весу (кг) — и это очень практично.
Шаг 3) отвесить 1 часть (по весу), — более 2 частей, если хотите чтобы ускорить процесс- извести и поместить ее в кастрюлю.
Шаг 4) Найдите хорошее место снаружи (необходима хорошая вентиляция) и добавьте в 4 или 5 порций при сильном перемешивании раствор аммиачной селитры.
Внимание: используйте защитные очки!
В результате реакции выделится много тепла, и раствор закипит.
Не вдыхайте вредные пары аммиака (интоксикация аммиачным газом). редки из-за сильного запаха, так что не паникуйте, просто будьте осторожны).
Шаг 5) Нагрейте кастрюлю, пока она не закипит.
Сохраняйте смесь влажной, часто добавляя воду.
Не допускайте высыхания смеси, так как она перегреется и достичь температуры разложения нитрата кальция.
Весь процесс преобразования занимает много часов, поэтому оставьте его кипеть на ваш источник тепла и вернуться для частого перемешивания.
Реакция заканчивается, когда после добавления небольшого количества
извести уже не наблюдается запаха аммиака или влажного лакмуса
бумага не меняет свой цвет, когда ее кладут над горшком.
Шаг 6) добавьте как можно больше холодной воды и перемешайте.
Дайте карбонату кальция и непрореагировавшему гидроксиду кальция осесть. и осторожно перелейте раствор нитрата кальция в подходящие кофейные фильтры.
Вы можете значительно ускорить процесс фильтрации, повесив шнур через фильтр, это будет поддерживать поток в любое время. Вы можете повторить процесс, добавив воду к оставшемуся слагу, чтобы получить последние несколько граммов нитрата кальция из него.
Шаг 7) сначала приготовьте раствор до сухости.
Внимание: всегда есть вероятность того, что раствор закипит в тот момент, когда нитрат кальция начинает выпадать в осадок.
Затем тщательно высушите нитрат кальция при температуре от 130 и 400 градусов по Цельсию. (400C — серое свечение, красное свечение выше 500C) Это важно, так как более высокие температуры (красное свечение) разлагают нитрат кальция, образуя сильно ядовитый диоксид азота.
Шаг 9) высушенный нитрат кальция будет таким же твердым, как камень, и наиболее
часто его приходится удалять с помощью молотка и зубила. Попробуйте сделать это
пока еще горячо, а то нитрат кальция придется сушить
опять же, так как он очень гигроскопичен.
Попробуйте сделать это
пока еще горячо, а то нитрат кальция придется сушить
опять же, так как он очень гигроскопичен.
Шаг 10), так как нитрат кальция чаще всего потребуется в виде порошка, раздавите куски кувалдой, удерживая их в подходящем полиэтиленовый пакет для защиты от влаги.
Хранение: Полностью герметичные контейнеры.
Скорость всего процесса определяется соотношением удобрений и извести (как упомянутый в шаге 3), перемешивание и выбранный реакционный контейнер (широкий предпочтительнее открывать контейнеры).
Минерализация CO2, вызванная ассимиляцией нитратов грибами
. 2011 Январь; 102 (2): 1562-6.
doi: 10.1016/j.biortech.2010.08.080. Epub 2010 26 августа.
Вэйго Хоу 1 , Бин Лиан, Сяоцин Чжан
принадлежность
- 1 Государственная ключевая лаборатория геохимии окружающей среды Института геохимии Китайской академии наук, Гуйян 550002, Китай; Выпускник Университета Китайской академии наук, Пекин 100039, Китай.

- PMID: 20880701
- DOI: 10.1016/j.biortech.2010.08.080
Weiguo Hou et al. Биоресурсная технология. 2011 Январь
. 2011 Январь; 102 (2): 1562-6.
doi: 10.1016/j.biortech.2010.08.080. Epub 2010 26 августа.
Авторы
Вэйго Хоу 1 , Бин Лянь, Сяоцин Чжан
принадлежность
- 1 Государственная ключевая лаборатория геохимии окружающей среды Института геохимии Китайской академии наук, Гуйян 550002, Китай; Выпускник Университета Китайской академии наук, Пекин 100039, Китай.

- PMID: 20880701
- DOI: 10.1016/j.biortech.2010.08.080
Абстрактный
Образование CaCO3, вызванное физиологической активностью грибов, является потенциальным способом секвестрации атмосферного CO2 в экосистеме. Альтернария сп. Сапрофитный гриб, выделенный из лесной почвы. Мы исследовали осаждение CaCO3, индуцированное грибком в ответ на различные уровни Ca(NO3)2 или CaCl2 в агаризованной среде, и биогенез CaCO3 был подтвержден низким значением δ13C. Образовавшийся CaCO3 был идентифицирован рентгеноструктурным анализом как кальцит. Квадратные, прямоугольные и ромбические кристаллы CaCO3 и аморфный карбонат кальция наблюдались вокруг мицелия при более высоких уровнях Ca(NO3)2. Подкисление происходило в средах при низких концентрациях (0 и 0,0002 М) Ca(NO3)2, и CaCO3 в этих средах не образовывался. Количество CaCO3, образующегося в среде, увеличивалось с увеличением концентрации Ca(NO3)2 и в значительной степени коррелировало с биомассой грибов, значением pH и концентрацией нитритов. В средах с CaCl2 на всех уровнях CaCO3 не образовывался. Эти результаты в совокупности показали, что образование CaCO3 может быть вызвано ассимиляцией нитратов грибами. Исследование также показало, что биогенный кристалл CaCO3 имеет тенденцию расти на ядре кремния, а аморфный карбонат кальция (ACC) является переходной стадией кристалла CaCO3.
Подкисление происходило в средах при низких концентрациях (0 и 0,0002 М) Ca(NO3)2, и CaCO3 в этих средах не образовывался. Количество CaCO3, образующегося в среде, увеличивалось с увеличением концентрации Ca(NO3)2 и в значительной степени коррелировало с биомассой грибов, значением pH и концентрацией нитритов. В средах с CaCl2 на всех уровнях CaCO3 не образовывался. Эти результаты в совокупности показали, что образование CaCO3 может быть вызвано ассимиляцией нитратов грибами. Исследование также показало, что биогенный кристалл CaCO3 имеет тенденцию расти на ядре кремния, а аморфный карбонат кальция (ACC) является переходной стадией кристалла CaCO3.
Copyright © 2010 Elsevier Ltd. Все права защищены.
Похожие статьи
Индуцированная метаболизмом биоминерализация CaCO3 во время реактивного транспорта в микромодели: последствия для изменения пористости.

Сингх Р., Юн Х., Сэнфорд Р.А., Кац Л., Фоуке Б.В., Верт С.Дж. Сингх Р. и др. Технологии экологических наук. 2015 20 октября; 49 (20): 12094-104. doi: 10.1021/acs.est.5b00152. Epub 2015 5 октября. Технологии экологических наук. 2015. PMID: 26348257
Метод контролируемого добавления карбоната для аморфных сфер карбоната кальция, стабилизированных полиакриловой кислотой.
Huang SC, Naka K, Chujo Y. Хуанг С.К. и др. Ленгмюр. 2007 20 ноября; 23 (24): 12086-95. doi: 10.1021/la701972n. Epub 2007 27 октября. Ленгмюр. 2007. PMID: 17963412
Образование карбоната кальция Synechococcus sp. штамм PCC 8806 и Synechococcus sp. штамм PCC 8807.
Ли Б.
 Д., Апель В.А., Уолтон М.Р.
Ли Б.Д. и соавт.
Биоресурсная технология. 2006 декабрь; 97 (18): 2427-34. doi: 10.1016/j.biortech.2005.09.028. Epub 2005 10 ноября.
Биоресурсная технология. 2006.
PMID: 16289626
Д., Апель В.А., Уолтон М.Р.
Ли Б.Д. и соавт.
Биоресурсная технология. 2006 декабрь; 97 (18): 2427-34. doi: 10.1016/j.biortech.2005.09.028. Epub 2005 10 ноября.
Биоресурсная технология. 2006.
PMID: 162896261альфа(ОН)D3 Один-альфа-гидроксихолекальциферол – активный аналог витамина D. Клинические исследования по профилактике и лечению вторичного гиперпаратиреоза у уремических больных на хроническом диализе.
Брэнди Л. Брэнди Л. Дэн Мед Булл. 2008 ноябрь; 55 (4): 186-210. Дэн Мед Булл. 2008. PMID: 19232159 Обзор.
Биологически образованный аморфный карбонат кальция.
Вайнер С., Леви-Калисман Ю., Раз С., Аддади Л. Вайнер С.
 и соавт.
Подключить тканевый рез. 2003; 44 Приложение 1:214-8.
Подключить тканевый рез. 2003.
PMID: 12952200
Обзор.
и соавт.
Подключить тканевый рез. 2003; 44 Приложение 1:214-8.
Подключить тканевый рез. 2003.
PMID: 12952200
Обзор.
Посмотреть все похожие статьи
Цитируется
Защита ДНК избранных видов пяти царств в природе с помощью карбонатов кремнезема Ba (II), Sr (II) и Ca (II): выводы о биогенности и переходе от пребиотической химии к биологической химии.
Куэльяр-Крус М., Ислас С.Р., Рамирес-Рамирес Н., Педраса-Рейес М., Морено А. Куэльяр-Крус М. и соавт. АСУ Омега. 2022 12 октября; 7(42):37410-37426. doi: 10.1021/acsomega.2c04170. Электронная коллекция 2022 25 октября. АСУ Омега. 2022. PMID: 36312347 Бесплатная статья ЧВК.
Биоминерализация, характеристика и стабильность органического вещества, содержащего карбонат кальция.


 05.20
05.20


 Д., Апель В.А., Уолтон М.Р.
Ли Б.Д. и соавт.
Биоресурсная технология. 2006 декабрь; 97 (18): 2427-34. doi: 10.1016/j.biortech.2005.09.028. Epub 2005 10 ноября.
Биоресурсная технология. 2006.
PMID: 16289626
Д., Апель В.А., Уолтон М.Р.
Ли Б.Д. и соавт.
Биоресурсная технология. 2006 декабрь; 97 (18): 2427-34. doi: 10.1016/j.biortech.2005.09.028. Epub 2005 10 ноября.
Биоресурсная технология. 2006.
PMID: 16289626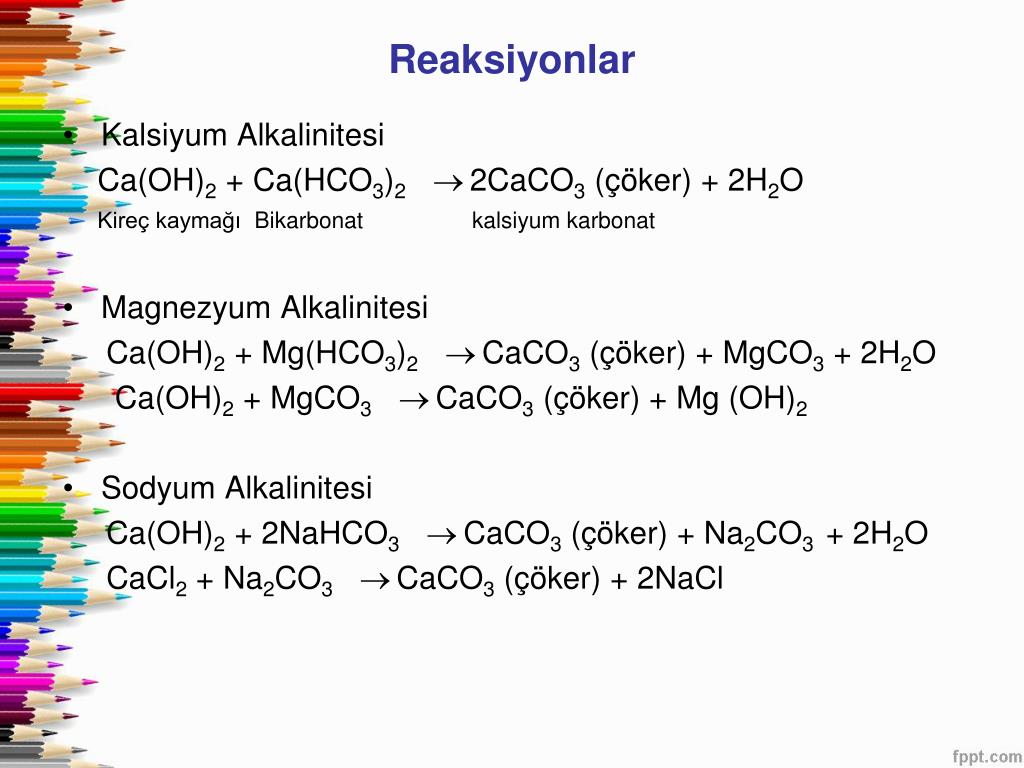 и соавт.
Подключить тканевый рез. 2003; 44 Приложение 1:214-8.
Подключить тканевый рез. 2003.
PMID: 12952200
Обзор.
и соавт.
Подключить тканевый рез. 2003; 44 Приложение 1:214-8.
Подключить тканевый рез. 2003.
PMID: 12952200
Обзор.