Как определить число протонов и нейтронов в атоме? Примеры.
Как определить число нуклонов в ядре атома?
Число нуклонов в ядре атома равно массовому числу атома (относительная атомная масса химического элемента) или сумме протонов и нейтронов.
Как определить число протонов в атоме?
Число протонов в атоме равно заряду его ядра (обозначается как Z) или порядковому номеру элемента в периодической таблице Менделеева.
Как определить число нейтронов в атоме?
Очень просто!
N = A – Z
Где N – число нейтронов, A – атомная масса элемента (в целых числах), Z – заряд ядра атома или порядковый номер атома в периодической таблице Менделеева.
Развернутый ответ
Масса атома складывается из двух величин: масса протонов + масса нейтронов. Дело в том, что масса электронов пренебрежимо мала.
Масса нейтрона = 1,674 927 498 04(95)⋅10⁻²⁷ кг= 1,008 664 915 60(57) а.е.м.
Масса протона = 1,672 621 923 69(51)⋅10⁻²⁷ кг = 1,007276466621(53) а. е.м.
е.м.
Масса электрона = 9,109383 7015(28)⋅10⁻³¹ кг = 0,000548579909065 а.е.м.
То есть даже 100 электронов дадут в сумме всего 0,0548579909065 а.е.м.
Первоначально Д. И. Менделеев в построении своей периодической таблицы исходил из атомных весов элементов. Однако, дальнейшее развитие науки показало, что свойства химических элементов находятся в прямой зависимости не от атомной массы химического элемента, а от заряда ядра его атома. Таким образом, в периодической таблице химические элементы выстроены в порядке возрастания заряда ядра атома и номер элемента в таблице соответствует заряду его ядра. А заряд ядра равен сумме протонов. То есть № (элемента) = Z (заряд ядра или число протонов).
Остаток массы ядра приходится на нейтроны. Поэтому чтобы определить число нейтронов в атоме нужно всего лишь вычесть из атомной массы число протонов, которое равно заряду ядра или порядковому номеру элемента в таблице Менделеева.
Примеры
Сколько протонов и нейтронов в атоме натрия?
Ar (Na) = 23 а. е.м.
е.м.
Z (Na) = 11 (протонов)
N = Ar (Na) – Z (Na) = 23 – 11 = 12 (нейтронов)
Ответ: число протонов в атоме натрия равно 11, а число нейтронов в атоме натрия равно 12.
Сколько протонов и нейтронов в атоме фосфора?
Ar (P) = 31 а.е.м.
Z (P) = 15 (протонов)
N = Ar (P) – Z (P) = 31 – 15 = 16 (нейтронов)
Ответ: число протонов в атоме фосфора равно 15, а число нейтронов в атоме фосфора равно 16.
Сколько протонов и нейтронов в атоме золота?
Ar (Au) = 197 а.е.м.
Z (Au) = 79 (протонов)
N = Ar (Au) – Z (Au) = 197 – 79 = 118 (нейтронов)
Ответ: число протонов в атоме золота равно 79, а число нейтронов в атоме золота равно 118.
Сколько протонов и нейтронов в атоме кремния?
Ar (Si) = 28 а.е.м.
Z (Si) = 14 (протонов)
N = Ar (Si) – Z (Si) = 28 – 14 = 14 (нейтронов)
Ответ: число протонов и нейтронов в атоме кремния равно 14.
Сколько протонов и нейтронов в атоме углерода?
Ar (C) = 12 а.е.м.
Z (C) = 6 (протонов)
N = Ar (C) – Z (C) = 12 – 6 = 6 (нейтронов)
Ответ: число протонов и нейтронов в атоме углерода равно 6.
Сколько протонов и нейтронов в атоме калия?
Ar (K) = 39 а.е.м.
Z (K) = 19 (протонов)
N = Ar (K) – Z (K) = 39 – 19 = 20 (нейтронов)
Ответ: число протонов в атоме калия равно 19, а число нейтронов в атоме калия равно 20.
Сколько протонов и нейтронов в атоме железа?
Ar (Fe) = 39 а.е.м.
Z (Fe) = 19 (протонов)
N = Ar (Fe) – Z (Fe) = 56 – 26 = 30 (нейтронов)
Ответ: число протонов в атоме железа равно 19, а число нейтронов в атоме железа равно 30.
Сколько протонов и нейтронов в атоме алюминия?
Ar (Al) = 27 а.е.м.
Z (Al) = 13 (протонов)
N = Ar (Al) – Z (Al) = 27 – 13 = 14 (нейтронов)
Ответ: число протонов в атоме алюминия равно 13, а число нейтронов в атоме алюминия равно 14 .
Сколько протонов и нейтронов в атоме фтора?
Ar (F) = 19 а.е.м.
Z (F) = 9 (протонов)
N = Ar (F) – Z (F) = 19 – 9 = 10 (нейтронов)
Ответ: число протонов в атоме фтора равно 9, а число нейтронов в атоме фтора равно 10.
Сколько протонов и нейтронов в атоме хлора?
Ar (Cl) = 35 а. е.м.
е.м.
Z (Cl) = 17 (протонов)
N = Ar (Cl) – Z (Cl) = 35 – 17 = 18 (нейтронов)
Ответ: число протонов в атоме хлора равно 17, а число нейтронов равно 18.
Сколько протонов и нейтронов в атоме кислорода?
Ar (O) = 16 а.е.м.
Z (O) = 8 (протонов)
N = Ar (O) – Z (O) = 16 – 8 = 8 (нейтронов)
Ответ: число протонов и нейтронов в атоме кислорода равно 8.
Сколько протонов и нейтронов в атоме серы?
Ar (S) = 32 а.е.м.
Z (S) = 16 (протонов)
N = Ar (S) – Z (S) = 32 – 16 = 16 (нейтронов)
Ответ: число протонов и нейтронов в атоме серы равно 16.
Сколько протонов и нейтронов в атоме магния?
Ar (Mg) = 32 а.е.м.
Z (Mg) = 16 (протонов)
N = Ar (Mg) – Z (Mg) = 24 – 12 = 12 (нейтронов)
Ответ: число протонов в атоме магния равно 16, а число нейтронов равно 12.
Сколько протонов и нейтронов в атоме цинка?
Ar (Zn) = 65 а.е.м.
Z (Zn) = 30 (протонов)
N = Ar (Zn) – Z (Zn) = 65 – 30 = 35 (нейтронов)
Ответ: число протонов в атоме цинка равно 30, а число нейтронов в атоме цинка равно 35.
Похожие вопросы:
– Какие атомы имеют одинаковое число нейтронов?
– Как определить общее число электронов в атоме?
Число протонов нейтронов электронов в атоме элемента (Таблица)
Число протонов нейтронов и электронов в атоме химического элемента (изотопа) можно определить, зная порядковый номер элемента в периодической таблице Менделеева и его атомную массу:
— Число протонов = число электронов = порядковый номер элемента
— Число нейтронов = атомная масса – число протонов
Вычислим число нейтронов в атоме на примере кислорода 16O:
16 — 8 = 8 (в кислороде 8 нейтронов)
Таблица число протонов нейтронов электронов в атоме химического элемента
Справочная таблица содержит список элементов (изотопов) и их число протонов, нейтронов и электронов, а также атомную массу изотопа.
| Элемент, изотоп | Число протонов (= электронов) | Число нейтронов | Атомная масса изотопа |
| 1H | 1 | 0 | 1,0078 |
| 2H | 1 | 1 | 2,0141 |
| 3He | 2 | 1 | 3,0160 |
| 4He | 2 | 2 | 4,0026 |
| 6Li | 3 | 3 | 6,0151 |
| 7Li | 4 | 7,0160 | |
| 9Be | 4 | 5 | 9,0122 |
| 10B | 5 | 5 | 10,0129 |
| 11B | 5 | 6 | 11,0093 |
| 12C | 6 | 6 | 12,0000 |
| 13C | 6 | 7 | 13,0034 |
| 14N | 7 | 7 | 14,0031 |
| 15N | 7 | 8 | 15,0001 |
| 16O | 8 | 8 | 15,9949 |
| 17O | 8 | 9 | 16,9991 |
| 18O | 8 | 10 | 17,9992 |
| 19 F | 9 | 10 | 18,9984 |
| 20Ne | 10 | 10 | 19,9924 |
| 21Ne | 10 | 11 | 20,9938 |
| 22Ne | 10 | 12 | 21,9914 |
| 23Na | 11 | 12 | 22,9898 |
| 24Mg | 12 | 12 | 23,9850 |
| 25Mg | 12 | 13 | 24,9858 |
| 26Mg | 12 | 14 | 25,9826 |
| 27Al | 13 | 14 | 26,9815 |
| 28Si | 14 | 14 | 27,9769 |
| 29Si | 14 | 15 | |
| 30Si | 14 | 16 | 29,9738 |
| 31P | 15 | 16 | 30,9738 |
| 32S | 16 | 16 | 31,9721 |
| 33S | 16 | 17 | 32,9715 |
| 34S | 16 | 18 | 33,9679 |
| 36S | 16 | 20 | 35,9671 |
| 35Cl | 17 | 18 | 34,9689 |
| 37Cl | 17 | 20 | 36,9659 |
| 36Ar | 18 | 18 | 35,9675 |
| 38Ar | 18 | 20 | 37,9627 |
| 40Ar | 18 | 22 | 39,9624 |
| 39K | 19 | 20 | 38,9637 |
| 40K* | 19 | 21 | 39,9640 |
| 41K | 19 | 22 | 40,9618 |
| 40Ca | 20 | 20 | 39,9626 |
| 42Ca | 20 | 22 | 41,9586 |
| 43Ca | 20 | 23 | 42,9588 |
| 44Ca | 20 | 24 | 43,9555 |
| 46Ca | 20 | 26 | 45,9537 |
| 48Ca* | 20 | 28 | 47,9525 |
| 45Sc | 21 | 24 | 44,9559 |
| 46Ti | 22 | 24 | 45,9526 |
| 47Ti | 22 | 25 | 46,9518 |
| 48Ti | 22 | 26 | 47,9479 |
| 49Ti | 22 | 27 | 48,9479 |
| 50Ti | 22 | 28 | 49,9448 |
| 50V* | 23 | 27 | 49,9472 |
| 51V | 23 | 28 | 50,9440 |
| 50Cr | 24 | 26 | 49,9460 |
| 52Cr | 24 | 28 | 51,9405 |
| 53Cr | 24 | 29 | 52,9406 |
| 54Cr | 24 | 30 | 53,9389 |
| 55Mn | 25 | 30 | 54,9380 |
| 54Fe | 26 | 28 | 53,9396 |
| 56Fe | 26 | 30 | 55,9349 |
| 57Fe | 26 | 31 | 56,9354 |
| 58Fe | 26 | 32 | 57,9333 |
| 59Co | 27 | 32 | 58,9332 |
| 58Ni | 28 | 30 | 57,9353 |
| 60Ni | 28 | 32 | 59,9308 |
| 61Ni | 28 | 33 | 60,9311 |
| 62Ni | 28 | 34 | 61,9283 |
| 64Ni | 28 | 36 | 63,9280 |
| 63Cu | 29 | 34 | 62,9296 |
| 65Cu | 29 | 36 | 64,9278 |
| 64Zn | 30 | 34 | 63,9291 |
| 66Zn | 30 | 36 | 65,9260 |
| 67Zn | 30 | 37 | 66,9271 |
| 68Zn | 30 | 38 | 67,9248 |
| 70Zn | 30 | 40 | 69,9253 |
| 69Ga | 31 | 38 | 68,9256 |
| 71Ga | 31 | 40 | 70,9247 |
| 70Ge | 32 | 38 | 69,9242 |
| 72Ge | 32 | 40 | 71,9221 |
| 73Ge | 32 | 41 | 72,9235 |
| 74Ge | 32 | 42 | 73,9212 |
| 75As | 33 | 42 | 74,9216 |
| 74Se | 34 | 40 | 73,9225 |
| 76Se | 34 | 42 | 75,9192 |
| 77Se | 34 | 43 | 76,9199 |
| 78Se | 34 | 44 | 77,9173 |
| 80Se | 34 | 46 | 79,9165 |
| 82Se * | 34 | 48 | 81,9167 |
| 79Br | 35 | 44 | 78,9183 |
| 81Br | 35 | 46 | 80,9163 |
| 78Kr * | 36 | 42 | 77,9204 |
| 80Kr | 36 | 44 | 79,9164 |
| 82Kr | 36 | 46 | 81,9135 |
| 83Kr | 36 | 47 | 82,9141 |
| 84Kr | 36 | 48 | 83,9115 |
| 86Kr | 36 | 50 | 85,9106 |
| 85Rb | 37 | 48 | 84,9118 |
| 87Rb* | 37 | 50 | 86,9092 |
| 84Sr | 38 | 46 | 83,9134 |
| 86Sr | 38 | 48 | 85,9093 |
| 87Sr | 38 | 49 | 86,9089 |
| 88Sr | 38 | 50 | 87,9056 |
| 89Y | 39 | 50 | 88,9058 |
| 90Zr | 40 | 50 | 89,9047 |
| 91Zr | 40 | 51 | 90,9056 |
| 92Zr | 40 | 52 | 91,9050 |
| 94Zr | 40 | 54 | 93,9063 |
| 93Nb | 41 | 52 | 92,9064 |
| 92Mo | 42 | 50 | 91,9068 |
| 94Mo | 42 | 52 | 93,9051 |
| 95Mo | 42 | 53 | 94,9058 |
| 96Mo | 42 | 54 | 95,9047 |
| 97Mo | 42 | 55 | 96,9060 |
| 98Mo | 42 | 56 | 97,9054 |
| 100Mo* | 42 | 58 | 99,9075 |
| 96Ru | 44 | 52 | 95,9076 |
| 98Ru | 44 | 54 | 97,9053 |
| 99Ru | 44 | 55 | 98,9059 |
| 100Ru | 44 | 56 | 99,9042 |
| 101Ru | 44 | 57 | 100,9056 |
| 102Ru | 44 | 58 | 101,9043 |
| 104Ru | 44 | 60 | 103,9054 |
| 103Rh | 45 | 58 | 102,9055 |
| 102Pd | 46 | 56 | 101,9056 |
| 104Pd | 46 | 58 | 103,9040 |
| 105Pd | 46 | 59 | 104,9051 |
| 106Pd | 46 | 60 | 105,9035 |
| 108Pd | 46 | 62 | 107,9039 |
| 110Pd | 46 | 64 | 109,9052 |
| 107Ag | 47 | 60 | 106,9051 |
| 109Ag | 47 | 62 | 108,9048 |
| 106Cd | 48 | 58 | 105,9065 |
| 108Cd | 48 | 60 | 107,9042 |
| 110Cd | 48 | 62 | 109,9030 |
| 111Cd | 48 | 63 | 110,9042 |
| 112Cd | 48 | 64 | 111,9028 |
| 113Cd* | 48 | 65 | 112,9044 |
| 114Cd | 48 | 66 | 113,9034 |
| 116Cd* | 48 | 68 | 115,9048 |
| 113In | 49 | 64 | 112,9041 |
| 115In* | 49 | 66 | 114,9039 |
| 112Sn | 50 | 62 | 111,9048 |
| 114Sn | 50 | 64 | 113,9028 |
| 115Sn | 50 | 65 | 114,9033 |
| 116Sn | 50 | 66 | 115,9017 |
| 117Sn | 50 | 67 | 116,9030 |
| 118Sn | 50 | 68 | 117,9016 |
| 119Sn | 50 | 69 | 118,9033 |
| 120Sn | 50 | 70 | 119,9022 |
| 122Sn | 50 | 72 | 121,9034 |
| 124Sn | 50 | 74 | 123,9053 |
| 121Sb | 51 | 70 | 120,9038 |
| 123Sb | 51 | 72 | 122,9042 |
| 120Te | 52 | 68 | 119,9040 |
| 122Te | 52 | 70 | 121,9030 |
| 123Te | 52 | 71 | 122,9043 |
| 124Te | 52 | 72 | 123,9028 |
| 125Te | 52 | 73 | 124,9044 |
| 126Te | 52 | 74 | 125,9033 |
| 128Te* | 52 | 76 | 127,9045 |
| 130Te* | 52 | 78 | 129,9062 |
| 127I | 53 | 74 | 126,9045 |
| 124Xe* | 54 | 70 | 123,9059 |
| 126Xe | 54 | 72 | 125,9043 |
| 128Xe | 54 | 74 | 127,9035 |
| 129Xe | 54 | 75 | 128,9048 |
| 130Xe | 54 | 76 | 129,9035 |
| 131Xe | 54 | 77 | 130,9051 |
| 132Xe | 54 | 78 | 131,9042 |
| 134Xe | 54 | 80 | 133,9054 |
| 136Xe* | 54 | 82 | 135,9072 |
| 133Cs | 55 | 78 | 132,9055 |
| 130Ba* | 56 | 74 | 129,9063 |
| 132Ba | 56 | 76 | 131,9051 |
| 134Ba | 56 | 78 | 133,9045 |
| 135Ba | 56 | 79 | 134,9057 |
| 136Ba | 56 | 80 | 135,9046 |
| 137Ba | 56 | 81 | 136,9058 |
| 138Ba | 56 | 82 | 137,9052 |
| 138La* | 57 | 81 | 137,9071 |
| 139La | 57 | 82 | 138,9064 |
| 136Ce | 58 | 78 | 135,9072 |
| 138Ce | 58 | 80 | 137,9060 |
| 140Ce | 58 | 82 | 139,9054 |
| 142Ce | 58 | 84 | 141,9092 |
| 141Pr | 59 | 82 | 140,9077 |
| 142Nd | 60 | 82 | 141,9077 |
| 143Nd | 60 | 83 | 142,9098 |
| 144Nd* | 60 | 84 | 143,9101 |
| 145Nd | 60 | 85 | 144,9126 |
| 146Nd | 60 | 86 | 145,9131 |
| 148Nd | 60 | 88 | 147,9169 |
| 150Nd* | 60 | 90 | 149,9209 |
| 144Sm | 62 | 82 | 143,9120 |
| 147Sm* | 62 | 85 | 146,9149 |
| 148Sm* | 62 | 86 | 147,9148 |
| 149Sm | 62 | 87 | 148,9172 |
| 150Sm | 62 | 88 | 149,9173 |
| 152Sm | 62 | 90 | 151,9197 |
| 154Sm | 62 | 92 | 153,9222 |
| 151Eu* | 63 | 88 | 150,9199 |
| 153Eu | 63 | 90 | 152,9212 |
| 152Gd* | 64 | 88 | 151,9198 |
| 154Gd | 64 | 90 | 153,9209 |
| 155Gd | 64 | 91 | 154,9226 |
| 156Gd | 64 | 92 | 155,9221 |
| 157Gd | 64 | 93 | 156,9240 |
| 158Gd | 64 | 94 | 157,9241 |
| 160Gd | 64 | 96 | 159,9271 |
| 159Tb | 65 | 94 | 158,9253 |
| 156Dy | 66 | 90 | 155,9243 |
| 158Dy | 66 | 92 | 157,9244 |
| 160Dy | 66 | 94 | 159,9252 |
| 161Dy | 66 | 95 | 160,9269 |
| 162Dy | 66 | 96 | 161,9268 |
| 163Dy | 66 | 97 | 162,9287 |
| 164Dy | 66 | 98 | 163,9292 |
| 165Ho | 67 | 98 | 164,9303 |
| 162Er | 68 | 94 | 161,9288 |
| 164Er | 68 | 96 | 163,9292 |
| 166Er | 68 | 98 | 165,9303 |
| 167Er | 68 | 99 | 166,9320 |
| 168Er | 68 | 100 | 167,9324 |
| 170Er | 68 | 102 | 169,9355 |
| 169Tm | 69 | 100 | 168,9342 |
| 168Yb | 70 | 98 | 167,9339 |
| 170Yb | 70 | 100 | 169,9348 |
| 171Yb | 70 | 101 | 170,9363 |
| 172Yb | 70 | 102 | 171,9364 |
| 173Yb | 70 | 103 | 172,9382 |
| 174Yb | 70 | 104 | 173,9389 |
| 176Yb | 70 | 106 | 175,9426 |
| 175Lu | 71 | 104 | 174,9408 |
| 176Lu* | 71 | 105 | 175,9427 |
| 174Hf* | 72 | 102 | 173,9400 |
| 176Hf | 72 | 104 | 175,9414 |
| 177Hf | 72 | 105 | 176,9432 |
| 178Hf | 72 | 106 | 177,9437 |
| 179Hf | 72 | 107 | 178,9458 |
| 180Hf | 72 | 108 | 179,9466 |
| 181Ta | 73 | 108 | 180,9480 |
| 180W* | 74 | 106 | 179,9467 |
| 182W | 74 | 108 | 181,9482 |
| 183W | 74 | 109 | 182,9502 |
| 184W | 74 | 110 | 183,9509 |
| 186W | 74 | 112 | 185,9544 |
| 185Re | 75 | 110 | 184,9530 |
| 187Re* | 75 | 112 | 186,9558 |
| 184Os | 76 | 108 | 183,9525 |
| 186Os* | 76 | 110 | 185,9538 |
| 187Os | 76 | 111 | 186,9558 |
| 188Os | 76 | 112 | 187,9558 |
| 189Os | 76 | 113 | 188,9581 |
| 190Os | 76 | 114 | 188,9581 |
| 192Os | 76 | 116 | 191,9615 |
| 191Ir | 77 | 114 | 190,9606 |
| 193Ir | 77 | 116 | 191,9626 |
| 190Pt* | 78 | 112 | 189,9599 |
| 192Pt | 78 | 114 | 191,9610 |
| 194Pt | 78 | 116 | 193,9627 |
| 195Pt | 78 | 117 | 194,9648 |
| 196Pt | 78 | 118 | 195,9650 |
| 198Pt | 78 | 120 | 197,9679 |
| 197Au | 79 | 118 | 196,9666 |
| 196Hg | 80 | 116 | 195,9658 |
| 198Hg | 80 | 118 | 197,9668 |
| 199Hg | 80 | 119 | 198,9683 |
| 200Hg | 80 | 120 | 199,9683 |
| 201Hg | 80 | 121 | 200,9703 |
| 202Hg | 80 | 122 | 201,9706 |
| 204Hg | 80 | 124 | 203,9735 |
| 203Tl | 81 | 122 | 202,9723 |
| 205Tl | 81 | 124 | 204,9744 |
| 204Pb | 82 | 122 | 203,9730 |
| 206Pb | 82 | 124 | 205,9745 |
| 207Pb | 82 | 125 | 206,9759 |
| 208Pb | 82 | 126 | 207,9767 |
| 209Bi* | 83 | 126 | 208,9804 |
| 232Th* | 90 | 142 | 232,0381 |
| 235U* | 92 | 143 | 235,0439 |
* это нестабильные изотопы и с большим периодом полураспада, который равняется возрасту Вселенной.
4.8: Изотопы — когда число нейтронов меняется
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 47477
Цели обучения
- Объяснить, что такое изотопы и как изотоп влияет на атомную массу элемента.
- Определить количество протонов, электронов и нейтронов элемента с заданным массовым числом.
Все атомы одного и того же элемента имеют одинаковое количество протонов, но некоторые могут иметь разное количество нейтронов. Например, все атомы углерода имеют шесть протонов, и большинство из них также имеют шесть нейтронов. Но некоторые атомы углерода имеют семь или восемь нейтронов вместо обычных шести. Атомы одного и того же элемента, различающиеся числом нейтронов, называются изотопами . Многие изотопы встречаются в природе. Обычно один или два изотопа элемента являются наиболее стабильными и распространенными. Различные изотопы элемента обычно имеют одинаковые физические и химические свойства, потому что они имеют одинаковое количество протонов и электронов.
Атомы одного и того же элемента, различающиеся числом нейтронов, называются изотопами . Многие изотопы встречаются в природе. Обычно один или два изотопа элемента являются наиболее стабильными и распространенными. Различные изотопы элемента обычно имеют одинаковые физические и химические свойства, потому что они имеют одинаковое количество протонов и электронов.
Пример: изотопы водорода
Водород является примером элемента, у которого есть изотопы. На рисунке \(\PageIndex{1}\) смоделированы три изотопа водорода. Большинство атомов водорода имеют только один протон, один электрон и не имеют нейтрона. Эти атомы просто называются водородом. Некоторые атомы водорода также имеют один нейтрон. Эти атомы представляют собой изотоп, названный дейтерием. Другие атомы водорода имеют два нейтрона. Эти атомы представляют собой изотоп по имени тритий.
Рисунок \(\PageIndex{1}\): Три наиболее стабильных изотопа водорода: протий (A = 1), дейтерий (A = 2) и тритий (A = 3).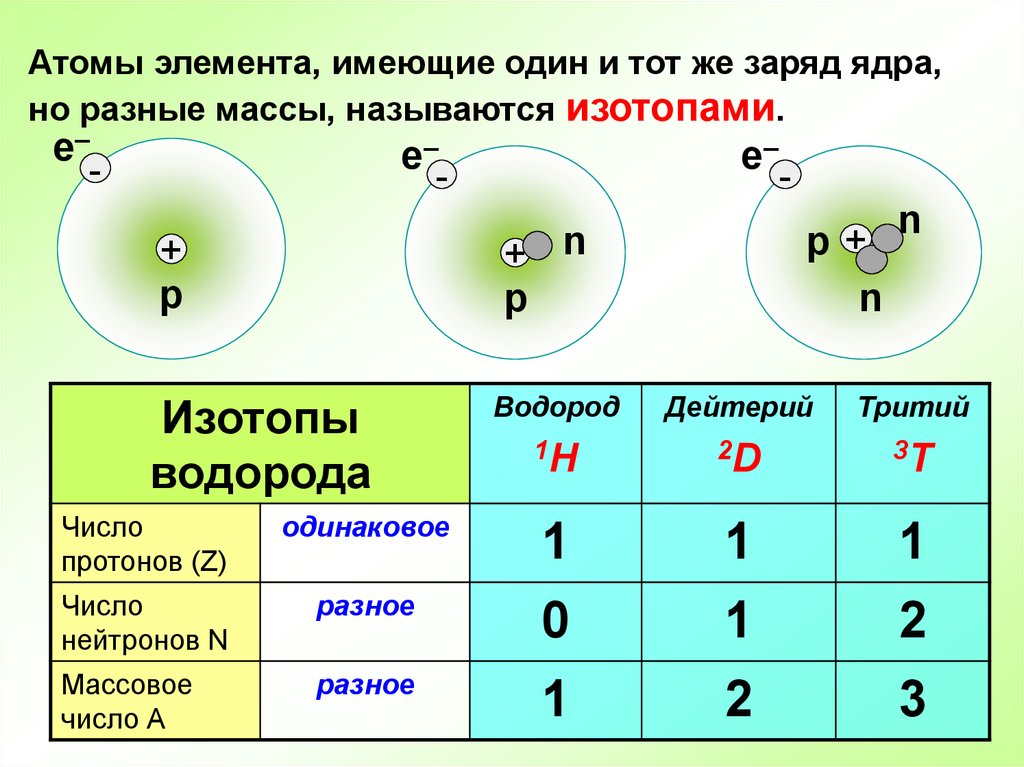 (CC SA-BY 3.0; Баладжиджагадеш через Википедию).
(CC SA-BY 3.0; Баладжиджагадеш через Википедию).Для большинства элементов, кроме водорода, изотопы названы по их массовому числу. Например, атомы углерода с обычными 6 нейтронами имеют массовое число 12 (6 протонов + 6 нейтронов = 12), поэтому их называют углеродом-12. Атомы углерода с 7 нейтронами имеют атомную массу 13 (6 протонов + 7 нейтронов = 13). Эти атомы представляют собой изотоп под названием углерод-13.
Пример \(\PageIndex{1}\): Изотопы лития
- Каков атомный номер и массовое число изотопа лития, содержащего 3 нейтрона?
- Каковы атомный номер и массовое число изотопа лития, содержащего 4 нейтрона?
Решение
Атом лития содержит в своем ядре 3 протона независимо от числа нейтронов или электронов.
а.
\[ \begin{align}\text{атомный номер} = \left( \text{количество протонов} \right) &= 3 \nonumber \\ \left( \text{количество нейтронов} \right) & = 3 \nonumber\end{align} \nonumber \]
\[ \begin{align} \text{массовое число} & = \left( \text{количество протонов} \right) + \left( \text{количество нейтронов} \right) \nonumber\\ \text {массовое число} & = 3 + 3 \nonumber\\ &= 6 \nonumber \end{align}\nonumber \]
b.
\[ \begin{align}\text{атомный номер} = \left( \text{количество протонов} \right) &= 3 \nonnumber\\ \left( \text{количество нейтронов} \right) & = 4\nonumber\end{align}\nonumber \]
\[ \begin{align}\text{массовое число} & = \left( \text{количество протонов} \right) + \left( \text{ количество нейтронов} \right)\nonumber \\ \text{массовое число} & = 3 + 4\nonumber \\ &= 7 \nonumber \end{align}\nonumber \]
Обратите внимание: поскольку атом лития всегда имеет 3 протона, атомный номер лития всегда равен 3. Однако массовое число равно 6 в изотопе с 3 нейтронами и 7 в изотопе с 4 нейтронами. В природе существуют только определенные изотопы. Например, литий существует как изотоп с 3 нейтронами и как изотоп с 4 нейтронами, но не существует как изотоп с 2 нейтронами или изотоп с 5 нейтронами.
Стабильность изотопов
Атомам необходимо определенное соотношение нейтронов и протонов, чтобы иметь стабильное ядро. Слишком много или слишком мало нейтронов по сравнению с протонами приводит к нестабильному или радиоактивному ядру, которое рано или поздно распадется до более стабильной формы. Этот процесс называется радиоактивным распадом. Многие изотопы имеют радиоактивные ядра, и эти изотопы называются радиоизотопами. Когда они разлагаются, они выделяют частицы, которые могут быть вредными. Вот чем опасны радиоактивные изотопы и почему работа с ними требует специальных защитных костюмов. Изотоп углерода, известный как углерод-14, является примером радиоизотопа. Напротив, изотопы углерода, называемые углерод-12 и углерод-13, стабильны.
Этот процесс называется радиоактивным распадом. Многие изотопы имеют радиоактивные ядра, и эти изотопы называются радиоизотопами. Когда они разлагаются, они выделяют частицы, которые могут быть вредными. Вот чем опасны радиоактивные изотопы и почему работа с ними требует специальных защитных костюмов. Изотоп углерода, известный как углерод-14, является примером радиоизотопа. Напротив, изотопы углерода, называемые углерод-12 и углерод-13, стабильны.
Все это обсуждение изотопов возвращает нас к атомной теории Дальтона. По Дальтону, атомы данного элемента идентичны. Но если атомы данного элемента могут иметь разное количество нейтронов, то они могут иметь и разную массу! Как Далтон пропустил это? Оказывается, встречающиеся в природе элементы существуют как постоянные однородные смеси встречающихся в природе изотопов. Другими словами, кусок лития всегда содержит оба типа природного лития (тип с 3 нейтронами и тип с 4 нейтронами). Более того, он всегда содержит их в одинаковых относительных количествах (или «относительном изобилии»). В куске лития \(93\%\) всегда будет литием с 4 нейтронами, а остальные \(7\%\) всегда будут литием с 3 нейтронами.
В куске лития \(93\%\) всегда будет литием с 4 нейтронами, а остальные \(7\%\) всегда будут литием с 3 нейтронами.
Дальтон всегда экспериментировал с большими кусками элемента — кусками, которые содержали все встречающиеся в природе изотопы этого элемента. В результате, когда он проводил свои измерения, он фактически наблюдал усредненные свойства всех различных изотопов в образце. Для большинства наших целей в химии мы будем делать то же самое и иметь дело со средней массой атомов. К счастью, помимо разной массы, большинство других свойств разных изотопов схожи.
Есть два основных способа, которыми ученые часто показывают массовое число интересующего их атома. Важно отметить, что массовое число , а не , указанное в периодической таблице. Эти два способа включают написание ядерного символа или указание имени элемента с написанным массовым числом.
Чтобы написать ядерный символ , массовое число помещается в верхний левый (верхний индекс) химического символа, а атомный номер помещается в нижний левый (нижний индекс) символа. Полный ядерный символ гелия-4 нарисован ниже: 9{238}_{92}U} \nonumber \]
Полный ядерный символ гелия-4 нарисован ниже: 9{238}_{92}U} \nonumber \]
В представленном выше ядре никеля атомный номер 28 указывает на то, что ядро содержит 28 протонов, следовательно, оно должно содержать 31 нейтрон, чтобы иметь массовое число 59. Ядро урана имеет 92 протона, как и все ядра урана; и это конкретное ядро урана имеет 146 нейтронов.
Другой способ представления изотопов — добавление дефиса и массового числа к химическому названию или символу. Таким образом, два ядра будут никелем-59.{40}_{19}\ce{K}\)?
Решение
\[\text{атомный номер} = \left( \text{число протонов} \right) = 19 \nonumber \]
Для всех атомов без заряда число электронов равно количество протонов.
\[\text{число электронов} = 19 \nonumber \]
Массовое число 40 представляет собой сумму протонов и нейтронов.
Чтобы найти количество нейтронов, вычтите количество протонов из массового числа.
\[\text{количество нейтронов} = 40 — 19= 21. \nonumber \]
\nonumber \]
Пример \(\PageIndex{3}\): Цинк-65
Сколько протонов, электронов и нейтронов содержится в атоме цинка-65?
Решение
\[\text{число протонов} = 30 \номер \]
Для всех атомов без заряда число электронов равно числу протонов.
\[\text{число электронов} = 30 \nonumber \]
Массовое число 65 представляет собой сумму протонов и нейтронов.
Чтобы найти количество нейтронов, вычтите количество протонов из массового числа. 9{45}_{20}\ce{Ca}\)
- Ответ a:
- 27 протонов, 27 электронов, 33 нейтрона
- Ответ б:
- 11 протонов, 11 электронов, 13 нейтронов
- Ответ c:
- 20 протонов, 20 электронов, 25 нейтронов
- Ответ д:
- 38 протонов, 38 электронов, 52 нейтрона
Резюме
- Количество протонов всегда одинаково в атомах одного и того же элемента.

- Количество нейтронов может быть разным даже в атомах одного и того же элемента.
- Атомы одного и того же элемента, содержащие одинаковое количество протонов, но разное количество нейтронов, известны как изотопы .
- Изотопы любого данного элемента содержат одинаковое количество протонов, поэтому они имеют одинаковый атомный номер (например, атомный номер гелия всегда равен 2).
- Изотопы данного элемента содержат разное количество нейтронов, поэтому разные изотопы имеют разные массовые числа.
ПОД ЛИЦЕНЗИЕЙ
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Лицензия
- СК-12
- Показать страницу TOC
- № на стр.

- Теги
- автор@Генри Агнью
- автор@Мариса Альвиар-Агнью
- изотопов
- источник@https://www.ck12.org/c/chemistry/
- Стабильность изотопов
Как определить количество нейтронов в атоме? — High School/Honours/AP® Chemistry Resources
Как определить количество нейтронов в данном атоме?
Сначала давайте определим некоторые термины, с которыми вам необходимо ознакомиться.
• Атомный номер атома представляет собой число протонов в ядре этого атома.
• Массовое число (также называемое нуклонным числом) атома равно общему количеству протонов и нейтронов в ядре этого атома.
• Наконец, относительная атомная масса (символ Aᵣ) элемента представляет собой средневзвешенное значение масс атомов каждого изотопа этого элемента .
Единицей этой величины является атомная единица массы (а.е.м.), которая определяется как 1/12 массы атома углерода-12, то есть изотопа углерода с 6 протонами и 6 нейтронами.
Для относительной атомной массы мы должны взять средневзвешенное значение , потому что одних изотопов больше, чем других — это означает, что в природе существует больше некоторых изотопов, поэтому средняя масса атомов этого элемента будет ближе к массе более распространенных изотопов.
Это много информации — давайте рассмотрим в качестве примера хлор.
Хлор имеет два изотопа, которые существуют в значительном количестве, Cl-35 (75%) и Cl-37 (25%).
Помните, что числа над символом являются массовыми числами, поэтому в Cl-35 всего 35 протонов и нейтронов, а в Cl-37 всего 37 протонов и нейтронов.
Поскольку мы знаем, что атомный номер Cl равен 17, мы можем вычислить, что Cl-35 имеет 18 нейтронов, а Cl-37 — 20 нейтронов.
Помните: атомный номер элемента постоянен для всех изотопов, поскольку именно число протонов фактически определяет, к какому элементу относится атом.
Чтобы вычислить относительную атомную массу хлора, мы должны взять средневзвешенное значение, поэтому расчет выглядит следующим образом:
Для хлора, взяв два изотопа Cl-35 и Cl-37, мы получим:
Реальный ответ, 35,45, наблюдаемый в периодической таблице, исходит из всех других второстепенных изотопов, которые мы не знали. не рассматриваю, но 35,5 — достаточно хороший ответ, потому что все эти другие изотопы на самом деле не имеют значения. Вы заметите, что 35,45 в любом случае округляется до 35,5 до трех значащих цифр.
Определение количества нейтронов
А как же нейтроны?
В примере с хлором мы видели, что для определенного изотопа элемента, если мы знаем массовое число этого изотопа, мы можем вычислить число нейтронов в атоме этого изотопа, взяв массовое число (общее число протоны и нейтроны) и вычитание атомного номера (количество протонов). Это оставляет нас с количеством нейтронов в этом изотопе.
Это оставляет нас с количеством нейтронов в этом изотопе.
Но как ученые выясняют, какие изотопы элемента существуют в значительных пропорциях? Ключом является масс-спектрометрия.
Масс-спектрометрия — это способ определения изотопов, присутствующих в данном образце элемента. Если вы возьмете масс-спектр хлора, например, вы получите график, который выглядит следующим образом:
x ось отношение массы к заряду , m/z.
Для этого спектра все заряды равны +1, поэтому эта ось соответствует массе изотопа, дающего каждый сигнал.
Мы знаем, что хлор существует в виде двухатомного газа, Cl 2 , поэтому мы видим сигналы около 70. Наиболее интересны два сигнала на 35 и 37. Они соответствуют атомам хлора, в частности изотопам. Кл-35 и Кл-37.
Соотношение примерно 3:1, и именно так ученый определил бы, какие изотопы существуют и в каких относительных количествах они присутствуют.


