Методы определения концентрации растворов
Концентрацию растворов можно определять различными методами:
1) По плотности раствора, когда не требуется большой точности;
2) Титрованием, если значение концентрации необходимо определить с точностью до 0,01%.
Плотность раствора определяется по формуле:
,
где m – масса раствора, г;
V – объем раствора, мл.
Определение плотности проще всего производить при помощи ареометра. Не существует универсального ареометра. Каждый ареометр предназначен для жидкостей, значения плотностей которых лежат в определенных пределах. Поэтому при выборе ареометра необходимо, чтобы ориентировочное значение плотности данного раствора попадало в интервал шкалы данного ареометра.
Так как плотность
раствора обусловлена его концентрацией,
то измерив ареометром плотность, можно
по таблицам найти массовую долю
растворённого вещества в растворе
(таб.
Титрование – определение неизвестной концентрации одного раствора по известной концентрации другого путем измерения объемов реагирующих растворов.
Согласно закону эквивалентов вещества вступают и образуются в результате реакции в эквивалентных количествах. Следовательно, в процессе титрования νэ(1)=νэ(2). Выразим количества эквивалентов реагирующих веществ через объемы (V) растворов и молярные концентрации их эквивалентов Сэ, тогда
V(1) ∙ Сэ(1) = V(2) ∙ Сэ(2), или (11)
Эти два соотношения называются формулами титрования.
Способы приготовления растворов заданной концентрации
Растворы заданной концентрации можно приготовить различными способами:
1. Растворением вещества в растворителе
Пример 1.
Приготовить 50 г 5% раствора хлорида
натрия NaCl.
Решение. Для этого необходимо рассчитать, какую массу (г) хлорида натрия и массу воды (г) нужно взять для приготовления 50 г 5% раствора.
По определению массовой доли в 100 г 5% раствора содержатся 5 г хлорида натрия, а в 50 г 5% раствора будет содержаться Х г хлорида натрия. Отсюда: Х = = 2,5гNaCl, тогда легко вычислить массу воды:
50г – 2,5г = 47,5г.
Если воспользоваться формулой (2), то решение будет следующим: ω = ∙ 100% →
→ m( р.в. )= ω ∙ m (р-ра) /100% = 5% ∙ 50 г / 100% = 2,5 г
m (H2O) = m (р-ра) – m (р.в.) = 50 г – 2,5 г = 47,5 г
Таким образом,
для приготовления раствора данной
концентрации, необходимо на весах
взвесить 2,5г NaCl
и растворить его в 47,5 мл воды (учитывая,
что плотность воды равна 1 г/мл, объем
воды будет равен ее массе).
Пример 2. Приготовить 100 мл раствора сульфата меди с молярной концентрацией 0,1 моль/л сульфата меди.
Решение. По определению молярной концентрации в 1000 мл раствора содержится 0,1 моль CuSO4, а в 100 мл раствора будет содержаться х моль CuSO4.
х = = 0,01 моль
Из соотношения (4) следует m= ν∙М, т.к. М (CuSO4) = 160 г/моль, то m = 0,01 моль ∙160 г/моль = 1,6 г
Если воспользоваться формулой (5), то решение будет следующим:
С= → m = С ∙ М ∙ V = 0,01моль/л ∙ 160 г/моль ∙ 0,1 л = 1,6 г
Таким образом, для того, чтобы приготовить 100 мл раствора с концентрацией 0,1 моль/л CuSO4, необходимо на весах взвесить 1,6 гCuSO4, перенести в мерную колбу на 100 мл и довести объем раствора в колбе до метки.
Пример 3. Приготовить 200 мл раствора NaОН
с 0,5 молярной концентрацией эквивалента
NaОН.
Приготовить 200 мл раствора NaОН
с 0,5 молярной концентрацией эквивалента
NaОН.
Решение.
Из уравнения (7) находим массу NaОН
Сэ = →m= Сэ ∙ Vэ ∙ Мэ зная, что Мэ (NaОН) = = 40г /моль, тогда m =0,5 моль/л ∙ 0,2 л ∙ 40 г/моль = 4 г
Итак, для приготовления 200 мл раствора с 0,5 молярной концентрацией эквивалента NaОН необходимо взвесить 4 г NaОН, перенести в мерную колбу на 200 мл и довести объем раствора в колбе до метки.
Задачи на концентрацию
- Авторы
- Руководители
- Файлы работы
- Наградные документы
Евсюкова Д.С. 1
1МБОУ «СОШ № 2 ст. Архонская»
Уймина Т.А. 1
1МБОУ «СОШ № 2 ст. Архонская»
Автор работы награжден дипломом победителя III степени
Диплом школьникаСвидетельство руководителя
Текст работы размещён без изображений и формул.
Полная версия работы доступна во вкладке «Файлы работы» в формате PDF
Введение
Задачи на концентрацию являются основными задачами в школьном курсе химии, но различные способы решения таких задач можно рассматривать на уроках математики ещё с шестого класса, используя арифметический способ и понятие процента и десятичной дроби. Затем продолжить в седьмом классе изучив понятие пропорции, а так же умение решать задачи алгебраическим способом, то есть уравнением. И, наконец, в восьмом классе рассмотреть возможность решения таких задач с помощью систем уравнений.
При подготовке ГИА необходимо вспомнить и систематизировать типы и способы решения таких задач.
Арифметический способ
При изучении темы «Проценты» в 6 классе решение задач на концентрацию считаются задачами повышенной сложности и могут быть предложены особо подготовленным учащимся.
Задача 1. Имеется 735 г шестнадцатипроцентного раствора йода в спирте.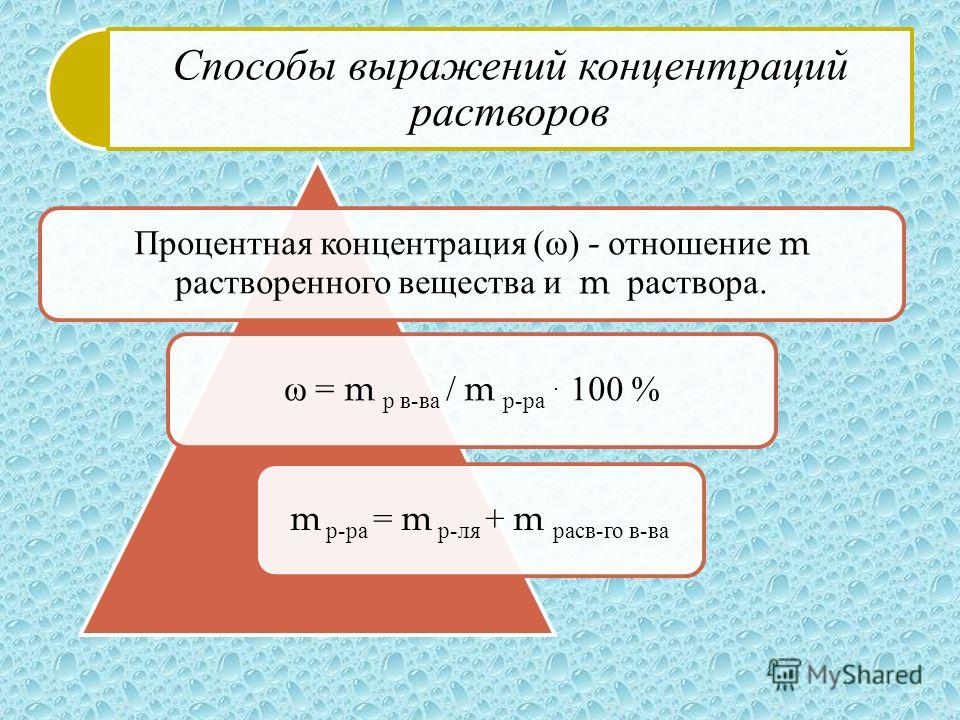 Нужно получить десятипроцентный раствор йода. Сколько граммов спирта нужно долить для этого к уже имеющемуся раствору?
Нужно получить десятипроцентный раствор йода. Сколько граммов спирта нужно долить для этого к уже имеющемуся раствору?
1) Найдем, сколько чистого йода содержится в растворе.
735 · 0,16 = 117,6 (г).
2) В новом растворе йода останется такое же количество, но он будет составлять уже 10 % раствора.
Если 117,6 г – это 10 %, то весь раствор имеет массу 117,6 · 10 = 1176 (г).
3) Найдем, сколько спирта нужно долить для получения нового раствора.
1176 – 735 = 441 (г).
О т в е т: 441 г.
Алгоритм:
Найти массу чистого вещества в растворе. Эта масса будет сохраняться в новом растворе.
Найти массу нового раствора в соответствии с процентным содержанием в нем вещества.
Найти разность масс нового и старого растворов. [3]
Решение с помощью пропорции
Познакомившись с понятием пропорции в 7 классе, подобные задачи можно решать используя это понятие.
Задача 2. К 200 г 30 %-ного раствора соли долили 50 г воды. Какова концентрация полученного раствора?
Р е ш е н и е.
Составим соответствующую пропорцию, приняв за х массу соли в растворе:
200 г – 100 %
х г – 30 % , тогда х = = 60 г соли.
Масса нового раствора 200 + 50 = 250 г, но масса соли в нём не изменилась, т. е. получим
250 г – 100 %
60 г – х % , тогда х = = 24 % концентрация полученного раствора.
О т в е т: получили 24 %-ный раствор.
Задача 3. Смешали 12 л 15 %-ного раствора соляной кислоты и 10 л 10 %-ного раствора. Каково процентное содержание кислоты в полученном растворе? Ответ округлить до 0,1 %.
Р е ш е н и е
С помощью пропорций найдём массу кислоты в каждом растворе:
12 л – 100 %
х л – 15 %, х = = 1,8 л кислоты в первом растворе и
10 л – 100 %
х л – 10 %, х = = 1 л кислоты во втором растворе, всего 2,8 литра.
Так как масса кислоты не меняется, а общая масса растворов 12 + 10 = 22 л, то получим
22 л – 100 %
2,8л – х %, х = ≈ 12,7 %.О т в е т: 12,7 % кислоты.[4]
Алгебраический способ
Задача 4. Сколько граммов воды надо добавить к 50 г раствора, содержащего 8 % соли, чтобы получить 5 %-ный раствор?
Сколько граммов воды надо добавить к 50 г раствора, содержащего 8 % соли, чтобы получить 5 %-ный раствор?
Начнём решение этой задачи не с составления уравнения, а с вопросов, которые помогут уяснить условие и осознанно подойти к ее решению, используем так же при этом понятие пропорции.
Вопросы:
1) Сколько граммов соли содержится в имеющемся растворе?
(50 · 0,08 = 4 г.)
2) Если к имеющемуся раствору добавить воды, изменится ли массовая составляющая соли? (Нет.)
4) Если к имеющемуся раствору добавить х г воды, какова станет масса всего раствора? (50 + х). Сколько граммов соли в нем будет? (4 г.)
5) Каково процентное содержание соли в новом растворе? (5 %. )
)
6) Какую пропорцию, согласно полученным результатам, можно составить?
4 г соли – 5 %
(50 + х) г раствора – 100 %.
Имеем уравнение:
5 (50 + х) = 400, откуда х = 30.
О т в е т: 30 г.
Алгоритм.
Поскольку при добавлении к раствору какого-либо вещества масса другого вещества не изменяется, а меняется его процентное содержание, то сначала необходимо найти массу неизменяющегося вещества.
Затем за х обозначить массу добавляемого вещества и составить пропорцию, в которой масса неизменного вещества будет составлять новое количество процентов, а масса всего раствора 100 %. [2]
Решим данные задачи по составленному выше алгоритму.
Задача 5. Сколько граммов воды нужно выпарить из 80 г 6 %-ного раствора соли, чтобы получить раствор, содержащий 10 % соли?
Сколько граммов воды нужно выпарить из 80 г 6 %-ного раствора соли, чтобы получить раствор, содержащий 10 % соли?
Решение:
Масса соли в имеющемся растворе равна 80 · 0,06 = 4,8 г. В новом растворе соль будет составлять 10 %.
Пусть х г воды нужно выпарить, тогда масса нового раствора будет равна (80 – х) г.
Составим пропорцию:
4,8 г соли – 10 %;
(80 – х) г раствора – 100 %.
Получаем уравнение:
10 (80 – х) = 4,8 · 100, откуда х = 32.
Ответ: 32 г.
Задача 6. Сколько граммов 75%-ного раствора кислоты надо добавить к 30 г 15%-ного раствора этой же кислоты, чтобы получить 50%-ный раствор?
х г — количество 75%-ного раствора кислоты, которое надо добавить;
(30 + х) г — масса получившегося 50%-ного раствора кислоты;
0,75х г — количество кислоты в х г 75%-ного раствора;
0,15 ∙ 30 г — количество кислоты в 30 г 15%-ного раствора;
0,5(30 + х) г — количество кислоты в 50%-ном растворе. Имеем уравнение:
Имеем уравнение:
кол-во кислоты кол-во кислоты кол-во кислоты
в 75%-ном + в 15%-ном = в 50%-ном
растворе растворе растворе
0,75х + 0,15 ∙ 30 = 0,5(30 + х)
0,75х + 0,15 ∙ 30 = 0,5(30 + х), откуда х = 46 г.
Ответ: 46 грамм.[1]
Решение задач с помощью систем уравнений
Задачи такого типа последние годы встречаются на Основном Государственном Экзамене и Едином Государственном Экзамене.
Задача 7. В колбу налили некоторое количество 60% -ного раствора соли и некоторое количество 80%-ного раствора этой же соли. Получили 35 мл раствора, содержащего 72% соли. Сколько миллилитров каждого раствора налили в колбу? Решим задачу, используя следующий план:
Обозначим буквами количество 60%-ного и 80%-ного растворов соли, налитых в колбу.
Запишем уравнение, связывающее эти две величины и общее количество раствора.
Определим количество соли в получившемся растворе.
Запишем уравнение, связывающее количество соли в 60%-ном, 80%-ном и получившемся растворах.
Составим систему и решим ее.
1) Пусть взяли х мл 60 %-ного раствора соли и у мл 80 %-ного раствора.
2) x + у = 35.
3) 0,6x + 0,8у (количество соли в получившемся растворе).
4) 0,6x + 0,8у = 35 ∙ 0,72.
0,6x + 0,8у = 25,2.
5)
Решив эту систему, получим, что х = 14 и у = 21.
Ответ: 14 мл 60 %-ного раствора и 21 мл 80 %-ного раствора.
Рассмотрим арифметический способ, который использовался в старину.
1) Найдем разность между процентным содержанием соли в каждом из имеющихся растворов и полученном растворе:
72 % – 60 % = 12 %;
80 % – 72 % = 8 %.
2) Эти результаты показывают, что 60 %-ного раствора нужно взять 8 частей, а 80 %-ного – 12 частей, то есть растворы должны быть взяты в отношении 2 : 3.
Поскольку в результате получим 35 мл раствора, то 60 %-ного взяли 14 мл, а 80 %-ного – 21 мл. [5]
Задача 8. Сразу после сбора урожая процентное содержание воды в бананах составляет 75%. После их перевозки процентное содержание воды в них становится равным 70%. Сколько килограммов бананов надо приобрести, чтобы после перевозки осталось 2500 кг бананов? [6]
Решение. Определим содержание так называемого «сухого вещества»: после сбора урожая его содержится 25%, после перевозки – 30%. Его масса после перевозки составит 2500 : 100 · 30 = 750 кг, но т. к. она остаётся неизменной и после сбора урожая это 25%, то нужно собрать 3000 кг бананов.
Его масса после перевозки составит 2500 : 100 · 30 = 750 кг, но т. к. она остаётся неизменной и после сбора урожая это 25%, то нужно собрать 3000 кг бананов.
О т в е т: 3000 кг.
Задача 9. Смешав 25-процентныйи и 95-процентный растворы кислоты добавив 20 кг чистой воды, получили 40-процентный раствор кислоты. Если бы вместо 20 кг воды добавили 20 кг 30-процентного раствора той же кислоты, то получили бы 50-процентный раствор кислоты. Сколько килограммов 25-процентного раствора использовали для получения смеси? [7]
Заключение
Задачи, которые мы решили,— это так называемая задача на концентрацию. Концентрацией раствора называют отношение массы содержащегося в нем сухого вещества к массе раствора, выраженное в процентах. С процентами приходится иметь дело и при решении многих других задач, например задач на вычисление прибыли с банковских вкладов, дохода от инвестиций, на расчет объемов выполненных работ. Все такие задачи нетрудно решить, если вы умеете выражать проценты обыкновенной или десятичной дробью и решать главную задачу на проценты — находить процент от заданной величины. Иногда удобно решать их или с помощью пропорции или системой уравнений. И тот и другой способы широко применяются при решении химических задач.
Все такие задачи нетрудно решить, если вы умеете выражать проценты обыкновенной или десятичной дробью и решать главную задачу на проценты — находить процент от заданной величины. Иногда удобно решать их или с помощью пропорции или системой уравнений. И тот и другой способы широко применяются при решении химических задач.
Литература
1. Дорофеев Г. В., Суворова С. Б. и др. Алгебра: учебник для 8 класса общеобразовательных учреждений. — М.: Просвещение, 2010. — 288 с.
2. Дюмина Т. Ю. Алгебра. 8 класс: поурочные планы по учебнику под редакцией Г. В. Дорофеева. I полугодие.— Волгоград: Учитель, 2008. —205 с.
3. Дюмина Т. Ю. Математика. 6 класс: поурочные планы по учебнику Г. В. Дорофеева, С. Б. Суворовой, И. Ф. Шарыгина и др. Часть 1. — Волгоград: Учитель, 2006. — 235 с.
4. Калинина М. Ф. Алгебра. 7 класс: поурочные планы по учебнику под редакцией Г. В. Дорофеева. — Волгоград: Учитель, 2008. — 223 с.
В. Дорофеева. — Волгоград: Учитель, 2008. — 223 с.
5. Дюмина Т. Ю. Алгебра. 8 класс: поурочные планы по учебнику под редакцией Г. В. Дорофеева. II полугодие.— Волгоград: Учитель, 2009. —263 с.
6. Под редакцией Лысенко Ф.Ф. и Калабухова С.Ю. Математика 9 класс. Подготовка к ОГЭ-2016. 40 тренировочных вариантов. – Ростов-на-Дону: Легион, 2015. – 400 с.
7. Под ред. Ященко И.В. ЕГЭ. Математика. Профильный уровень: типовые экзаменационные варианты: 36 вариантов. – М.: Издательство «Национальное образование», 2016. – 256 с.
Просмотров работы: 14985
Концентрация раствора
Водный раствор состоит не менее чем из двух
компоненты, растворитель (вода) и растворенное вещество (вещество, растворенное в
вода). Обычно нужно отслеживать количество растворенного вещества.
в растворе. Мы называем это концентрациями. Можно было бы сделать, сохраняя
отслеживать концентрацию путем определения массы каждого компонента, но
Обычно жидкости легче измерять по объему, а не по массе. Сделать это
обычно используется мера, называемая молярностью. Молярность (M) определяется как число
количество молей растворенного вещества (n), деленное на объем (V) раствора в литрах.
Сделать это
обычно используется мера, называемая молярностью. Молярность (M) определяется как число
количество молей растворенного вещества (n), деленное на объем (V) раствора в литрах.
Важно отметить, что молярность определяется как моль растворенного вещества на литр раствора, а не моль растворенного вещества на литр растворителя. Это потому, что когда вы добавляете вещество, например, соль, к некоторому объему воды объем полученного раствора будет другим чем исходный объем каким-то непредсказуемым образом. Чтобы обойти эту проблему химики обычно готовят растворы в мерных колбах. Это колбы, имеющие длинное горлышко с вытравленной линией, указывающей объем. Сначала в колбу добавляют растворенное вещество (возможно, соль), а затем воду. добавляют до тех пор, пока раствор не достигнет отметки. Колбы имеют очень хорошую калибровку поэтому объемы обычно известны как минимум с четырьмя значащими цифрами.
Пример #1 :
Расчет молярности
Уравнение для расчета молярности по
моли и объем очень прост. Просто разделите моли растворенного вещества на объем
решение.
Просто разделите моли растворенного вещества на объем
решение.
Молярность (M) = моли растворенного вещества / объем раствора (в литрах) |
Какова молярность (с правильными цифрами
значительных
цифры) 0,40 моль NaCl растворить в 0,250 л?
Ответ
Пример #2 :
Разведение
Раствор можно сделать менее концентрированным путем разбавления растворителем. Если раствор разбавить от V 1 до V 2 , молярность
этого решения изменяется согласно уравнению:
M 1 V 1 = M 2 V 2 Моль растворенного вещества в исходном растворе 1 = моли растворенного вещества в разбавленном растворе 2· |
Единицы объема должны быть одинаковыми для обоих томов. в этом уравнении. В общем, М 1 обычно называют начальным
молярность раствора. V 1 относится к объему, который
перенесено. M 2 относится к конечной концентрации раствора
и V 2 — конечный общий объем раствора.
в этом уравнении. В общем, М 1 обычно называют начальным
молярность раствора. V 1 относится к объему, который
перенесено. M 2 относится к конечной концентрации раствора
и V 2 — конечный общий объем раствора.
Помните, что номер молей растворенного вещества не меняется при добавлении к раствору большего количества растворителя. Однако концентрация изменяется при добавлении количества растворителя. (иллюстрация)
Не забывайте об этой концепции. Вы будете использовать его снова в кислотно-щелочном равновесии.
Пример расчета разбавления:
Как приготовить 100 мл 0,40 М MgSO 4 из исходный раствор 2,0 М MgSO 4 ?
Ответ:
Есть два решения
в этой проблеме. Обратите внимание, что вам даны две концентрации, но только
один том. Решение № 1 — это то, для которого у вас есть только концентрация
— решение, которое уже лежит на полке. Решение №2 это
тот, для которого у вас есть и концентрация, и объем — решение, которое
ты собираешься готовиться.
Решение №2 это
тот, для которого у вас есть и концентрация, и объем — решение, которое
ты собираешься готовиться.
По крайней мере, пока вы не почувствуете себя комфортно с этим типом проблемы может быть полезно написать, какие числа идут с какими буквами в нашем уравнении.
М 1 = 2,0 М MgSO 4 ; V 1 = неизвестно
M 2 = 0,40M MgSO 4 ; V 2 = 100 мл
Количественные единицы концентрации
Цель обучения
- Научиться определять конкретные концентрации с помощью нескольких общих единиц.
Вместо качественных терминов (раздел 11.1 «Некоторые определения») нам нужны количественные способы выражения количества растворенного вещества в растворе; то есть нам нужны определенные единицы концентрации. В этом разделе мы представим несколько общих и полезных единиц концентрации.
МолярностьКоличество молей растворенного вещества, деленное на количество литров раствора. (M) определяется как количество молей растворенного вещества, деленное на количество литров раствора:
(M) определяется как количество молей растворенного вещества, деленное на количество литров раствора:
молярность = моли растворенного вещества литры раствора
, который можно упростить как
M=моль л или моль/л
Как и в любом математическом уравнении, если вы знаете любые две величины, вы можете вычислить третью, неизвестную величину.
Например, предположим, что у вас есть 0,500 л раствора, в котором растворено 0,24 моля NaOH. Концентрацию раствора можно рассчитать следующим образом:
молярность = 0,24 моль NaOH 0,500 л = 0,48 моль NaOH
ноль целых сорок восемь молей». Если количество растворенного вещества указано в единицах массы, вы должны преобразовать единицы массы в молярные единицы, прежде чем использовать определение молярности для расчета концентрации. Например, какова молярная концентрация раствора 22,4 г HCl, растворенного в 1,56 л? Сначала переведите массу растворенного вещества в моли, используя молярную массу HCl (36,5 г/моль):
22,4 г HCl×1 моль HCl36,5 г HCl=0,614 моль HCl
Теперь мы можем использовать определение молярности для определения концентрации:
Какова молярность раствора, полученного при растворении 32,7 г NaOH, чтобы получить 445 мл раствора?
Решение
Чтобы использовать определение молярности, обе величины должны быть преобразованы в соответствующие единицы. Сначала переведем единицы объема из миллилитров в литры:
Сначала переведем единицы объема из миллилитров в литры:
445 мл×1 л1000 мл=0,445 л
Теперь переведем количество растворенного вещества в моли, используя молярную массу NaOH, которая составляет 40,0 г/моль:
32,7 г NaOH×1 моль NaOH50,0 г NaOH = 0,818 моль NaOH
Теперь мы можем использовать определение молярности для определения молярной концентрации: раствор, полученный при 66,2 г C 6 H 12 O 6 растворяют, чтобы получить 235 мл раствора?
Ответ
1,57 M
Определение молярности можно использовать для определения количества растворенного вещества или объема раствора, если указана другая информация. Пример 4 иллюстрирует эту ситуацию.
Пример 4
Сколько молей растворенного вещества содержится в 0,108 л 0,887 М раствора NaCl?
Раствор
Мы знаем объем и молярность; мы можем использовать определение молярности для математического определения количества в молях. Подставляя количества в определение молярности:
Подставляя количества в определение молярности:
0,887 М=моль NaCl0,108 л
Мы умножаем 0,108 л на другую часть уравнения и умножаем единицы вместе; «Молярность × литры» равняется молям в соответствии с определением молярности. Итак,
моль NaCl = (0,887 М) (0,108 л) = 0,0958 моль
Проверьте себя
Сколько молей растворенного вещества содержится в 225 мл 1,44 М раствора CaCl 2 ?
Ответ
0,324 моль
Если вам нужно определить объем, помните правило, что неизвестное количество должно быть само по себе и в числителе для определения правильного ответа. Таким образом, требуется изменение определения молярности.
Пример 5
Какой объем 2,33 М раствора NaNO 3 потребуется для получения 0,222 моль растворенного вещества?
Решение
Используя определение молярности, мы имеем
2,33 M=0,222 мольл
слева в числителе. Теперь у нас
Теперь у нас
л = 0,222 моль2,33 М
Разделив, объем 0,0953 л = 95,3 мл.
Проверь себя
Какой объем раствора 0,570 М K 2 SO 4 необходим для получения 0,872 моль растворенного вещества?
Ответ
1,53 л
Аналогичной единицей концентрации является моляльностьКоличество молей растворенного вещества на килограмм растворителя. ( м ), которое определяется как количество молей растворенного вещества на килограмм растворителя, а не на литр раствора:
моляльность = моли солутекилограммы растворителя
Математические операции с моляльностью такие же, как и с молярностью.
Другим способом указания количества является процентный состав по массе. Отношение массы растворенного вещества к общей массе образца, умноженное на 100 (или процент по массе , % по массе). Он определяется следующим образом:
% m/m = масса растворенного вещества, масса всего образца × 100%
Нередко эта единица используется в коммерческих продуктах (рис. 11.1 «Концентрация в коммерческих приложениях»).
11.1 «Концентрация в коммерческих приложениях»).
Пример 6
Какова массовая доля Fe в куске металла с 87,9 г Fe в образце массой 113 г?
Раствор
Используя определение массового процента, мы имеем
% m/m=87,9 г Fe113 г образца × 100%=77,8 % Fe
Проверьте себя процентное содержание
O 2 в растворе с 1,67 г H 2 O 2 в пробе 55,5 г?Ответить
9и частей на миллиард (ppb) Отношение массы растворенного вещества к общей массе образца, умноженное на 1 000 000 000.. Частей на тысячу определяется следующим образом:ppth = масса массы растворенного вещества образца × 1000 частей на миллиард:
частей на миллион = масса растворенного вещества масса образца × 1 000 000 и ppb=масса растворенного веществамасса образца×1 000 000 000
Каждая единица используется для постепенного снижения концентрации. Две массы должны быть выражены в одной и той же единице массы, поэтому могут потребоваться преобразования.
Две массы должны быть выражены в одной и той же единице массы, поэтому могут потребоваться преобразования.
Пример 7
Если в 277 г раствора содержится 0,6 г Pb, какова концентрация Pb в частях на тысячу?
Раствор
Используйте определение частей на тысячу для определения концентрации. Замена
0,6 г Pb277 г раствора × 1000 = 2,17 ppth
Проверьте себя
Если в 348 г раствора содержится 0,551 мг As в 348 г раствора, какова концентрация As в ppm?
Ответ
1,58 ppm
Как и в случае с молярностью и моляльностью, для ответа на некоторые вопросы могут потребоваться алгебраические перестановки.
Пример 8
Концентрация иона Cl – в образце H 2 O составляет 15,0 ppm. Какая масса Cl 9Ион 0340 – присутствует в 240,0 мл H 2 O плотностью 1,00 г/мл?
Раствор
Сначала используйте плотность H 2 O для определения массы образца:
240,0 мл× 1,00 г мл=240,0 г
Теперь мы можем использовать определение 5 ppm3:
0 ppm3 = масса растворенного вещества 240,0 г раствора × 1 000 000
Преобразование для решения для массы растворенного вещества,
масса растворенного вещества = (15,0 частей на миллион) (240,0 г раствора) 1 000 000 = 0,0036 г = 3,6 мг
Проверь себя
Концентрация иона Fe 3+ в образце H 2 O составляет 335,0 ppm. Какая масса иона Fe 3+ содержится в 3450 мл H 2 O плотностью 1,00 г/мл?
Какая масса иона Fe 3+ содержится в 3450 мл H 2 O плотностью 1,00 г/мл?
Ответ
1,16 г
Для ионных растворов необходимо различать концентрацию соли и концентрацию каждого отдельного иона. Поскольку ионы в ионных соединениях движутся своим путем, когда соединение растворяется в растворе, результирующая концентрация иона может отличаться от концентрации полной соли. Например, если был приготовлен 1 М NaCl, раствор также можно было бы описать как раствор 1 М Na + (водн.) и 1 М Cl — (водн.), потому что на формульную единицу соли приходится один ион Na + и один ион Cl — . Однако, если раствор представляет собой 1 М CaCl 2 , на каждую растворенную формульную единицу приходится два иона Cl — (водн.), поэтому концентрация Cl — (водн.) будет 2 М, а не 1 М.
Кроме того, общая концентрация ионов является суммой концентраций отдельных ионов. Таким образом, для 1 М NaCl общая концентрация ионов составляет 2 М; для 1 М CaCl 2 , общая концентрация ионов составляет 3 M.
Таким образом, для 1 М NaCl общая концентрация ионов составляет 2 М; для 1 М CaCl 2 , общая концентрация ионов составляет 3 M.
Ключевые выводы
- Количественные единицы концентрации включают молярность, моляльность, массовый процент, части на тысячу, части на миллион и части на миллиард.
Упражнения
Различают молярность и моляльность.
Различие между массовыми процентами и частями на тысячу.
Какова молярность раствора, полученного путем растворения 13,4 г NaNO 3 в 345 мл раствора?
Какова молярность раствора, полученного путем растворения 332 г C 6 H 12 O 6 в 4,66 л раствора?
Сколько молей MgCl 2 содержится в 0,0331 л 2,55 М раствора?
Сколько молей NH 4 Br содержится в 88,9 мл 0,228 М раствора?
Какой объем 0,556 М NaCl потребуется для получения 0,882 моль NaCl?
Какой объем 3,99 M H 2 SO 4 потребуется для получения 4,61 моль H 2 SO 4 ?
Какой объем 0,333 М Al(NO 3 ) 3 потребуется для получения 26,7 г Al(NO 3 ) 3 ?
Какой объем 1,772 М BaCl 2 необходим для получения 123 г BaCl 2 ?
Каковы концентрации отдельных ионов и общая концентрация ионов в 0,66 М Mg(NO 3 ) 2 ?
Каковы концентрации отдельных ионов и общая концентрация ионов в 1,04 М Al 2 (SO 4 ) 3 ?
Если концентрация ионов C 2 H 3 O 2 – в растворе равна 0,554 М, какова концентрация Ca(C 2 H 3 O 9) 2 ?
Если концентрация ионов Cl − в растворе составляет 2,61 М, какова концентрация FeCl 3 ?
Ответы
Молярность — это количество молей на литр, а моляльность — количество молей на килограмм растворителя.


