«Как изменяется радиус атома в таблице менделеева?» — Яндекс Кью
Популярное
Сообщества
Домашние заданияАтомыТаблица менделеева
Анонимный вопрос
·
251,5 K
Ответить1УточнитьВячеслав Домбровский
Биология
1,9 K
Образование — химфак МГУ; фармакокинетика, биофизика; интересы — Восток, биология… · 14 мая 2021
- Радиус атома — это параметр, который зависит от способа измерения. Чаще всего используют параметры, измеренные для вещества в кристаллическом состоянии. Но есть и другие способы измерения радиусов как атомов, так и ионов. Но закономерности изменения радиуса от номера элемента сохраняются при условии сравнивания величин, полученных одним и тем же методом.
 2, т.е. с ростом расстояния до ядра силы ослабевают и внешний уровень не так сильно притягивается к ядру. Да ещё нижележащие электроны экранируют ядро. Именно из-за этой причины закономерность возрастания радиуса в группе не линейная и не квадратичная, а отражается ломанной кривой. Причём обратите внимание, как слабо изменяется радиус атома от гелия к неону. И как особняком располагается водород. А для цезия и франция рост радиуса сменяется падением. Сложна многоэлектронная система и вовсе не во всех случаях квантовая химия может объяснить закономерности, получаемые экспериментально.
2, т.е. с ростом расстояния до ядра силы ослабевают и внешний уровень не так сильно притягивается к ядру. Да ещё нижележащие электроны экранируют ядро. Именно из-за этой причины закономерность возрастания радиуса в группе не линейная и не квадратичная, а отражается ломанной кривой. Причём обратите внимание, как слабо изменяется радиус атома от гелия к неону. И как особняком располагается водород. А для цезия и франция рост радиуса сменяется падением. Сложна многоэлектронная система и вовсе не во всех случаях квантовая химия может объяснить закономерности, получаемые экспериментально.1 эксперт согласен
28,2 K
Комментировать ответ…Комментировать…
Лия Менделеева
1,7 K
Подготовила к ЕГЭ по химии 5000 учеников. С любого уровня до 100 в режиме онлайн 🙂 · 27 апр 2019 ·
mendo_him
☘️При движении по периоду слева направо радиус атома уменьшается.
 Почему?
🔸Число электронов на внешнем уровне возрастает
P. S. Число электронов равно номеру элемента в таблице Менделеева🙂
🔸Много электронов сильно давят на атомное ядро ➡️атом сжимается➡️радиус уменьшается
☘️По группе сверху вниз радиус возрастает, т. к.
🔸Возрастает число уровней, значит, для… Читать далее
Почему?
🔸Число электронов на внешнем уровне возрастает
P. S. Число электронов равно номеру элемента в таблице Менделеева🙂
🔸Много электронов сильно давят на атомное ядро ➡️атом сжимается➡️радиус уменьшается
☘️По группе сверху вниз радиус возрастает, т. к.
🔸Возрастает число уровней, значит, для… Читать далее108,3 K
Евгений
10 января 2020
Извините, а как электроны, практически не имеющие массы, могут «давить» на ядро? Разве радиус атома сокращается по… Читать дальше
Комментировать ответ…Комментировать…
Александр Лебедев
6
Студент биологического факультета, активист молодежной общественной организации · 27 сент 2021
Лично я пользуюсь своим правилом. Франций (Fr) самый большой, а самый маленький гелий (He). Ну и дальше ориентируйтесь по таблице, что ближе к этим элементам
Дамир Махмутов
25 октября 2021
По периоду уменьшается от щелочного металла к инертному газу, по группе возрастает от легких элементов к тяжелым.

Комментировать ответ…Комментировать…
Сергей Георгиевич
-9
Физик. Темы различны. Это и математика, и физика, и разные языки, и … · 27 нояб 2020
Радиус атома при движении влево по таблице Менделеева уменьшается, т. к. увеличивается заряд ядра и притяжение электронов усиливается, при движении вниз по группе радиус увеличивается, так как растёт число оболочек, экранирующих друг друга от воздействия ядра. Самый большой радиус у атома цезия (точнее — у Франция, но он нестабилен), Самый маленький (кроме Н и Не) у… Читать далее
Комментировать ответ…Комментировать…
Первый
Я парю askudishechku со вкусом йопаний сир · 8 нояб 2021
В пределах подгруппы: Сверху вниз — увеличивается, Снизу вверх — уменьшается. В пределах периода: Слева направо — уменьшается, Справа налево — увеличивается.
 Читать далее
Читать далее10,6 K
Комментировать ответ…Комментировать…
Первый
Натали Мацюк
5
любитель предмета · 19 апр 2020
в периодах слева направо уменьшается,т.к.заряд ядра увеличиваеться и сила притяжения тоже,в группах главных подгрупп сверху вних увеличиваеться,т.к увеличиваеться числро энергитических уровней
15,8 K
Арюна Хабутова
17 июля 2020
Получается S -Al — N ?
Комментировать ответ…Комментировать…
Вы знаете ответ на этот вопрос?
Поделитесь своим опытом и знаниями
Войти и ответить на вопрос
Атомный радиус в современной науке, определение расстояний между атомами в молекуле и ионами в кристалле
Чтобы разобраться в вопросе, что в современной науке называется радиусом атома, вспомним, что из себя представляет сам атом.
 По классическим представлениям в центре атома находится ядро, состоящее из протонов и нейтронов, а вокруг ядра каждый на своей орбите вращаются электроны.
По классическим представлениям в центре атома находится ядро, состоящее из протонов и нейтронов, а вокруг ядра каждый на своей орбите вращаются электроны.Содержание:
- Радиус атома в физике
- Атомный радиус в химии и кристаллографии
- Какие бывают виды
- Как зависит от типа химической связи
- Видео
Радиус атома в физике
Поскольку в данной модели строения атома электроны являются пространственно ограниченными частицами, т. е. корпускулами, логично считать атомным радиусом (а. р.) расстояние от его ядра до самой дальней, или внешней, орбиты, по которой вращаются так называемые валентные электроны.
Однако по современным, квантовомеханическим представлениям, определить данный параметр нельзя так однозначно, как это делается в классической модели. Здесь электроны уже не представляются в виде частиц-корпускул, а получают свойства волн, т. е. пространственно-неограниченных объектов. В такой модели точно определить положение электрона просто невозможно.
 Здесь эта частица уже представляется в виде электронной орбитали, плотность которой меняется, в зависимости от расстояния до ядра атома.
Здесь эта частица уже представляется в виде электронной орбитали, плотность которой меняется, в зависимости от расстояния до ядра атома.Итак, в современной модели строения атома его радиус нельзя определить однозначно. Поэтому в квантовой физике, общей химии, физике твердого тела и других смежных науках эту величину сегодня определяют как радиус сферы, в центре которой находится ядро, внутри которой сосредоточено 90-98% плотности электронного облака. Фактически это расстояние и определяет границы атома.
Если рассмотреть Периодическую таблицу химических элементов (таблицу Менделеева), в которой приведены атомные радиусы, можно увидеть определенные закономерности, которые выражаются в том, что в пределах периода эти числа уменьшаются слева направо, а в пределах группы они увеличиваются сверху вниз. Такие закономерности объясняются тем, что внутри периода при движении слева направо заряд атома возрастает, что увеличивает силу притяжения им электронов, а при движении внутри группы сверху вниз все больше заполняется электронных оболочек.

Атомный радиус в химии и кристаллографии
Какие бывают виды
Данная характеристика сильно варьируется, в зависимости от того, в какой химической связи состоит атом. Поскольку все вещества в природе в подавляющем своем большинстве состоят из молекул, понятие а. р. используют для определения межатомных расстояний в молекуле. А данная характеристика зависит от свойств входящих в молекулу атомов, т. е. их положения в Периодической системе химических элементов. Обладая разными физическими и химическими свойствами, молекулы образуют все огромное разнообразие веществ.
По сути, эта величина очерчивает сферу действия силы электрического притяжения ядра атома и его внешних электронных оболочек. За пределами этой сферы в действие вступает сила электрического притяжения соседнего атома. Существует несколько типов химической связи атомов в молекуле:
- ковалентная;
- ионная;
- металлическая;
- ван-дер-ваальсова.

Соответственно этим связям таким же будет и атомный радиус.
Как зависит от типа химической связи
При ковалентной связи АР определяется как половина расстояния между соседними атомами в одинарной химической связи Х—Х, причем Х — это неметалл, ибо данная связь свойственна неметаллам. Например, для галогенов ковалентный радиус будет равен половине межъядерного расстояния Х—Х в молекуле Х2, для молекул селена Se и серы S — половине расстояния Х—Х в молекуле Х8, для углерода С он будет равен половине кратчайшего расстояния С—С в кристалле алмаза.
Данная химическая связь обладает свойством аддитивности, т. е. суммирования, что позволяет определять межъядерные расстояния в многоатомных молекулах. Если связь в молекуле двойная или тройная, то ковалентный АР уменьшается, т. к. длины кратных связей меньше одинарных.
При ионной связи, образующейся в ионных кристаллах, используют значения ионного АР для определения расстояния между ближайшими анионом и катионом, находящимися в узлах кристаллической решетки.
 Такое расстояние определяется как сумма радиусов этих ионов.
Такое расстояние определяется как сумма радиусов этих ионов.Существует несколько способов определения ионных радиусов, при которых отличаются значения у индивидуальных ионов. Но в результате эти способы дают примерно одинаковые значения межъядерных расстояний. Эти способы или системы были названы в честь ученых, проводивших в этой области соответствующие исследования:
- Гольдшмидта;
- Полинга;
- Белова и Бокия;
- других ученых.
При металлической связи, возникающей в кристаллах металлов, АР принимаются равными половине кратчайшего расстояния между ними. Металлический радиус зависит от координационного числа К. При К=12 его значение условно принимается за единицу. Для координационных чисел 4, 6 и 8 металлические радиусы одного и того же элемента соответственно будут равны 0.88, 0.96 и 0.98.
Если взять два разных металла и сравнить металлические радиусы их элементов, то близость этих значений друг к другу будет означать необходимое, но недостаточное условие взаимной растворимости этих металлов по типу замещения.
 Например, жидкие калий К и литий Li в обычных условиях не смешиваются и образуют два жидких слоя, потому что их металлические радиусы сильно различаются (0.236 нм и 0.155 нм соответственно), а калий К с цезием Cs образуют твердый раствор благодаря близости их радиусов (0.236 нм и 0.268 нм).
Например, жидкие калий К и литий Li в обычных условиях не смешиваются и образуют два жидких слоя, потому что их металлические радиусы сильно различаются (0.236 нм и 0.155 нм соответственно), а калий К с цезием Cs образуют твердый раствор благодаря близости их радиусов (0.236 нм и 0.268 нм).Ван-дер-ваальсовы АР используют для определения эффективных размеров атомов благородных газов, а также расстояний между ближайшими одноименными атомами, принадлежащими разным молекулам и не связанными химической связью (пример — молекулярные кристаллы). Если такие атомы сблизятся на расстояние, меньшее суммы их ван-дер-ваальсовых радиусов, между ними возникнет сильное межатомное отталкивание. Эти радиусы определяют минимально допустимые границы контакта двух атомов, принадлежащих соседним молекулам.
Кроме того, данные АР используют для определения формы молекул, их конформаций и упаковки в молекулярных кристаллах. Известен принцип «плотной упаковки», когда молекулы, образующие кристалл
, входят друг в друга своими «выступами» и «впадинами». На основе этого принципа интерпретируются данные кристаллографии и предсказываются структуры молекулярных кристаллов.
На основе этого принципа интерпретируются данные кристаллографии и предсказываются структуры молекулярных кристаллов.Видео
Это полезное видео поможет вам понять, что такое радиус атома.
Атомный радиус элементов
Корпускуляризм
Корпускуляризм был теорией, предложенной Декартом, согласно которой вся материя состоит из мельчайших частиц.
Рене Декарт
Рене Декарт был известным математиком и философом 16-го века, который выдвинул теорию корпускуляризма об атоме.
Полупроводники
Полупроводники — это термин для описания металлоидов, которые способны проводить ток при подаче электрической энергии за счет движения электронов, но измерения проводимости не такие высокие, как у металлов, из-за меньшего количества электронов, несущих заряд, или менее упорядоченной состав.
Ионное соединение
Ионное соединение представляет собой связь, которая образуется между металлами и неметаллами с образованием большой ионной решетки.
 Атомы водорода под действием большого количества тепла и давления вынуждены объединяться, образуя более крупный атом гелия 9.0003
Атомы водорода под действием большого количества тепла и давления вынуждены объединяться, образуя более крупный атом гелия 9.0003Принцип неопределенности
Принцип неопределенности Гейзенберга используется для описания взаимосвязи между импульсом и положением электрона. Где, если точное положение электрона известно, импульс будет неопределенным.
Гейзенберг
Вернер Гейзенберг был немецким физиком, пионером в области квантовой механики. Он разработал принцип неопределенности относительно импульса и положения электрона.
Лепестки
Лепестки относятся к форме электронных волн и области с наибольшей вероятностью, где этот электрон как частица может быть найден.
Принцип исключения Паули
Исключение Паули относится к теории, согласно которой каждый электрон может иметь только уникальный набор из 4 квантовых чисел, и никакие два электрона не могут иметь одинаковые квантовые числа
Квантовые числа
Квантовые числа — это используемый термин описать присвоение чисел электронам как математическую функцию для описания их импульса и энергии.

Модель Бора
Модель Бора относится к трактовке электронов как частиц, вращающихся вокруг ядра.
Квантовая механика
Термин квантовая механика относится к уровням энергии и теоретической области физики и химии, где математика используется для объяснения поведения субатомных частиц.
Впадина
Впадина — самая нижняя точка поперечной волны.
Пик
Пик — это самая высокая точка поперечной волны.
Колебательные моды
Колебательные моды — это термин, используемый для описания постоянного движения в молекуле. Обычно это вибрации, вращения и перемещения.
Erwin Schrodinger
Эрвин Шредингер был австрийским физиком, который использовал математические модели для усовершенствования модели Бора об электроне и создал уравнение для предсказания вероятности нахождения электрона в заданном положении.
Щелочной металл
Щелочные металлы, находящиеся в группе 1 периодической таблицы (ранее известной как группа IA), настолько реакционноспособны, что обычно встречаются в природе в сочетании с другими элементами.
 Щелочные металлы — это блестящие, мягкие, высокореактивные металлы при стандартной температуре и давлении.
Щелочные металлы — это блестящие, мягкие, высокореактивные металлы при стандартной температуре и давлении.Щелочноземельные металлы
Щелочноземельные металлы являются второй по реакционной способности группой элементов в периодической таблице. Они находятся в группе 2 периодической таблицы (формально известной как группа IIA).
Неизвестные элементы
Неизвестные элементы (или трансактиниды) являются самыми тяжелыми элементами периодической таблицы. Это мейтнерий (Mt, атомный номер 109), дармштадтий (Ds, атомный номер 110), рентгений (Rg, атомный номер 111), нихоний (Nh, атомный номер 113), московий (Mc, атомный номер 115), ливерморий (Lv , атомный номер 116) и теннессин (Ts, атомный номер 117).
Постпереходный металл
Постпереходные металлы находятся между переходными металлами (слева) и металлоидами (справа). К ним относятся алюминий (Al), галлий (Ga), индий (In), таллий (Tl), олово (Sn), свинец (Pb) и висмут (Bi).
Oganesson
Oganesson (Og) — радиоактивный элемент с атомным номером 118 в периодической таблице, его внешний вид полностью неизвестен из-за мизерных количеств, которые он производит.
 Он находится в группе 18. Он имеет символ Og.
Он находится в группе 18. Он имеет символ Og.Теннессин
Теннессин (Ts) — радиоактивный элемент с атомным номером 117 в периодической таблице, его внешний вид полностью неизвестен из-за мизерных количеств, которые он производит. Он находится в группе 17. Он имеет символ Ts.
Ливерморий
Ливерморий (Lv) — радиоактивный элемент с атомным номером 116 в периодической таблице, его внешний вид полностью неизвестен из-за мизерных количеств, которые он производит. Он находится в группе 16. Он имеет символ Lv.
Московий
Московий (Mc) — радиоактивный металл с атомным номером 115 в периодической таблице, его внешний вид полностью неизвестен из-за незначительных количеств его производства. Он находится в группе 15. Он имеет символ Mc.
Флеровий
Флеровий (Fl) — радиоактивный металл с атомным номером 114 в периодической таблице, его внешний вид полностью неизвестен из-за мизерных количеств его производства. Он находится в группе 14. Он имеет символ Fl.

Нихоний
Нихоний (Nh) — радиоактивный металл с атомным номером 112 в периодической таблице, его внешний вид полностью неизвестен из-за незначительных количеств его производства. Он находится в группе 13. Он имеет символ Nh.
Copernicium
Copernicium (Cr) — радиоактивный металл с атомным номером 112 в таблице Менделеева, его внешний вид полностью неизвестен из-за незначительных количеств его производства. Это переходный металл группы 11. Он имеет символ Rg.
Рентгений
Рентгений (Rg) — радиоактивный металл с атомным номером 111 в таблице Менделеева, его внешний вид полностью неизвестен из-за незначительных количеств его производства. Это переходный металл группы 11. Он имеет символ Rg.
Darmstadtium
Darmstadtium (Ds) — радиоактивный металл с атомным номером 110 в таблице Менделеева, его внешний вид полностью неизвестен из-за незначительных количеств его производства. Это переходный металл группы 10. Он имеет символ Ds 9.0003
Мейтнерий
Мейтнерий (Mt) — радиоактивный металл с атомным номером 109 в таблице Менделеева, его внешний вид полностью неизвестен из-за незначительных количеств его производства.
 Это переходный металл группы 9. Он имеет символ Mt
Это переходный металл группы 9. Он имеет символ MtХассий
Хассий (Hs) — радиоактивный металл с атомным номером 108 в периодической таблице, его внешний вид полностью неизвестен из-за ничтожных количеств производится из него. Это переходный металл группы 8. Он имеет символ Hs.
Борий
Борий (Bh) — радиоактивный металл с атомным номером 107 в периодической таблице, его внешний вид полностью неизвестен из-за незначительных количеств его производства. Это переходный металл группы 7. Он имеет символ Bh.
Сиборгий
Сиборгий (Sg) — радиоактивный металл с атомным номером 106 в периодической таблице, его внешний вид полностью неизвестен из-за мизерных количеств его производства. Это переходный металл группы 6. Он имеет символ Sg.
Дубний
Дубний (Db) — радиоактивный металл с атомным номером 105 в периодической таблице, его внешний вид полностью неизвестен из-за незначительных количеств его производства. Это переходный металл группы 5.
 Он имеет символ Db.
Он имеет символ Db.Резерфордий
Резерфордий (Rf) — радиоактивный металл с атомным номером 104 в таблице Менделеева, его внешний вид полностью неизвестен из-за незначительных количеств его производства. Это переходный металл группы 4. Он имеет символ Rf.
Lawrencium
Lawrencium (Lr) — серебристо-белый радиоактивный металл с атомным номером 103 в периодической таблице. Это актиноидный металл с символом Lr.
Нобелий
Нобелий (No) — радиоактивный металл с атомным номером 102 в таблице Менделеева, его внешний вид полностью неизвестен из-за незначительных количеств его производства. Это актиноидный металл с символом №
Менделевий
Менделевий (Md) — радиоактивный металл с атомным номером 101 в таблице Менделеева, его внешний вид полностью неизвестен из-за незначительных количеств его производства. Это актиноидный металл с символом Md. 9.0003
Фермий
Фермий (Fm) — серебристо-белый радиоактивный металл с атомным номером 100 в периодической таблице.
 Это актиноидный металл с символом Fm.
Это актиноидный металл с символом Fm.Эйнштейний
Эйнштейний (Es) — серебристо-белый радиоактивный металл с атомным номером 99 в периодической таблице. Это актиноидный металл с символом Es.
Калифорний
Калифорний (Cf) — серебристо-белый радиоактивный металл с атомным номером 98 в периодической таблице. Это актиноидный металл с символом Cf.
Берклий
Берклий (Bk) — серебристый радиоактивный металл, имеющий атомный номер 97 в периодической таблице. Это актиноидный металл с символом Bk.
Кюрий
Кюрий (Cm) — серебристо-белый радиоактивный металл с атомным номером 96 в периодической таблице. Это актиноидный металл с символом Cm.
Америций
Америций (Am) представляет собой серебристый радиоактивный металл с атомным номером 95 в периодической таблице. Это актиноидный металл с символом Am.
Плутоний
Плутоний (Pu) представляет собой серебристый радиоактивный металл, имеющий атомный номер 94 в периодической таблице.
 Это актиноидный металл с символом Pu.
Это актиноидный металл с символом Pu.Нептуний
Нептуний (Np) — серебристый радиоактивный металл с атомным номером 93 в периодической таблице. Это актиноидный металл с символом Np.
Протактиний
Протактиний (Па) представляет собой блестящий серебристый радиоактивный металл с атомным номером 91 в периодической таблице. Это актиноидный металл с символом Pa.
Торий
Торий (Th) — серебристо-белый радиоактивный металл с атомным номером 90 в периодической таблице. Это актиноидный металл с символом Th.
Актиний
Актиний (Ac) представляет собой серебристый радиоактивный металл с атомным номером 89 в периодической таблице. Это актиноидный металл с символом Ac.
Радий
Радий (Ra) — металл серебристо-белого цвета, имеющий атомный номер 88 в периодической таблице. Это щелочноземельный металл с символом Ra, расположенный во 2-й группе периодической таблицы.
Франций
Франций (Fr) считается металлом серого цвета, имеющим атомный номер 87 в периодической таблице.
 Это щелочной металл с символом Fr, расположенный в группе 1 периодической таблицы.
Это щелочной металл с символом Fr, расположенный в группе 1 периодической таблицы.Радон
Радон (Rn) представляет собой бесцветный радиоактивный газ без запаха, неметалл, имеющий атомный номер 86 в периодической таблице в 18-й группе. Он имеет символ Rn.
Астатин
Астатин (At) — радиоактивный неметалл, имеющий атомный номер 85 в периодической таблице в 17-й группе. Он имеет символ At.
Полоний
Полоний (Po) — серебристо-серый металл с атомным номером 84 в периодической таблице в 16-й группе. Он имеет символ Po.
Висмут
Висмут (Bi) — твердый стальной серый металл, имеющий атомный номер 83 в периодической таблице в 15-й группе. Он имеет символ Bi.
Свинец
Свинец (Pb) — мягкий серый металл, имеющий атомный номер 82 в периодической таблице в 14-й группе. Он имеет символ Pb.
Таллий
Таллий (Tl) — мягкий серый металл, имеющий атомный номер 81 в периодической таблице в 13-й группе. Он имеет символ Tl.

Ртуть
Ртуть (Hg) представляет собой жидкий металл серебристого цвета, имеющий атомный номер 80 в периодической таблице. Это переходный металл группы 12. Он имеет символ Hg.
Золото
Золото (Au) — это мягкий металл золотистого цвета, имеющий атомный номер 79 в периодической таблице. Это переходный металл группы 11. Он имеет символ Au.
Платина
Платина (Pt) — тяжелый белый металл с атомным номером 78 в периодической таблице. Это переходный металл группы 10. Он имеет символ Pt.
Иридий
Иридий (Ir) — тяжелый белый металл с атомным номером 77 в периодической таблице. Это переходный металл группы 9. Он имеет символ Ir.
Осмий
Осмий (Os) представляет собой твердый мелкий черный порошок или бело-голубой металл с атомным номером 76 в периодической таблице. Это переходный металл группы 8. Он имеет символ Os.
Рений
Рений (Re) — металл серебристо-белого цвета, имеющий атомный номер 75 в периодической таблице.
 Это переходный металл группы 7. Он имеет символ Re.
Это переходный металл группы 7. Он имеет символ Re.Вольфрам
Вольфрам (W) — металл серо-стального цвета, имеющий атомный номер 74 в периодической таблице. Это переходный металл группы 6. Он имеет символ W.
Тантал
Тантал (Ta) — металл серого цвета с атомным номером 73 в периодической таблице. Это переходный металл группы 5. Он имеет символ Та.
Гафний
Гафний (Hf) — металл серебристого цвета с атомным номером 72 в периодической таблице. Это переходный металл группы 4. Он имеет символ Hf.
Лютеций
Лютеций (Lu) — металл серебристо-белого цвета, имеющий атомный номер 71 в периодической таблице. Это лантаноидный металл. Он имеет символ Лу.
Иттербий
Иттербий (Yb) представляет собой металл серебристого цвета с атомным номером 70 в периодической таблице. Это лантаноидный металл. Он имеет символ Yb.
Тулий
Тулий (Tm) представляет собой металл серебристого цвета с атомным номером 69 в периодической таблице.
 Это лантаноидный металл. Он имеет обозначение Tm.
Это лантаноидный металл. Он имеет обозначение Tm.Эрбий
Эрбий (Er) — металл серебристого цвета, имеющий атомный номер 68 в периодической таблице. Это лантаноидный металл. Он имеет символ Er.
Гольмий
Гольмий (Но) — металл серебристого цвета, имеющий атомный номер 67 в периодической таблице. Это лантаноидный металл. Он имеет символ Хо.
Диспрозий
Диспрозий (Dy) представляет собой серебристый металл с атомным номером 66 в периодической таблице. Это лантаноидный металл. Он имеет символ Dy.
Тербий
Тербий (Tb) представляет собой металл серебристо-серого цвета, имеющий атомный номер 65 в периодической таблице. Это лантаноидный металл. Он имеет символ Tb.
Гадолиний
Гадолиний (Gd) — металл серебристо-белого цвета, имеющий атомный номер 64 в периодической таблице. Это лантаноидный металл. Он имеет символ Gd.
Европий
Европий (Eu) — металл серебристо-белого цвета, имеющий атомный номер 63 в периодической таблице.
 Это лантаноидный металл. Он имеет символ Eu.
Это лантаноидный металл. Он имеет символ Eu.Самарий
Самарий (Sm) представляет собой металл серебристого цвета с атомным номером 62 в периодической таблице. Это лантаноидный металл. Он имеет символ Sm.
Прометий
Прометий (Pm) — редкий металл с атомным номером 61 в периодической таблице. Это лантаноидный металл. Он имеет символ Pm.
Неодим
Неодим (Nd) — металл серебристо-белого цвета, имеющий атомный номер 60 в периодической таблице. Это лантаноидный металл. Он имеет символ Nd.
Празеодим
Празеодим (Pr) представляет собой серебристо-белый металл с атомным номером 59 в периодической таблице. Это лантаноидный металл. Он имеет обозначение Pr.
Церий
Церий (Ce) представляет собой металл серо-железного цвета, имеющий атомный номер 58 в периодической таблице. Это лантаноидный металл. Он имеет символ Ce.
Лантан
Лантан (La) — мягкий серебристо-белый металл с атомным номером 57 в периодической таблице.
 Это лантаноидный металл. Имеет обозначение La.
Это лантаноидный металл. Имеет обозначение La.Барий
Барий (Ba) — мягкий серебристо-белый металл с атомным номером 56 в периодической таблице. Это щелочноземельный металл, расположенный во 2-й группе периодической таблицы. он имеет символ Ba.
Цезий
Цезий (Cs) — мягкий металл серого цвета, имеющий атомный номер 55 в периодической таблице. Это щелочной металл и находится в группе 1 периодической таблицы. он имеет символ Cs.
Ксенон
Ксенон (Хе) существует в виде бесцветного газа без запаха и химически инертен. Он имеет атомный номер 54 в периодической таблице и принадлежит к группе 18, Благородные газы. Это неметалл с символом Xe.
Йод
Йод (I) представляет собой пурпурно-серый твердый неметалл. Он имеет атомный номер 53 в периодической таблице. Он расположен в группе 17, галогены. Он имеет символ I.
Теллур
Теллур (Te) — серебристо-белый полуметалл с атомным номером 52 в периодической таблице. Он расположен в 16 группе периодической таблицы.
 Он имеет символ Те.
Он имеет символ Те.Сурьма
Сурьма (Sb) представляет собой твердый хрупкий серебристо-белый полуметалл с атомным номером 51 в периодической таблице. Он расположен в 15 группе периодической таблицы. Он имеет символ Sb.
Олово
Олово (Sn) — серебристо-белый металл с атомным номером 50 в периодической таблице. Он расположен в 14 группе периодической таблицы. Он имеет обозначение Sn.
Индий
Индий (In) — серебристо-белый металл с атомным номером 49 в периодической таблице. Он расположен в 13 группе периодической таблицы. Он имеет символ В.
Кадмий
Кадмий (Cd) — бело-голубой металл с атомным номером 48 в периодической таблице. Это переходный металл, расположенный в 12-й группе периодической таблицы. Он имеет обозначение Cd.
Серебро
Серебро (Ag) — металл серебра, имеющий атомный номер 47 в периодической таблице. Это переходный металл, расположенный в 11-й группе периодической таблицы. Он имеет символ Ag.
Палладий
Палладий (Pd) — серебристо-белый металл с атомным номером 46 в периодической таблице.
 Это переходный металл, расположенный в 10-й группе периодической таблицы. Он имеет обозначение Pd.
Это переходный металл, расположенный в 10-й группе периодической таблицы. Он имеет обозначение Pd.Родий
Родий (Rh) — хрупкий серебристо-белый металл с атомным номером 45 в периодической таблице. Это переходный металл, расположенный в группе 9.периодической таблицы. Он имеет обозначение Rh.
Рутений
Рутений (Ru) представляет собой хрупкий металл серебристо-серого цвета, имеющий атомный номер 44 в периодической таблице. Это переходный металл, расположенный в 8-й группе периодической таблицы. Имеет обозначение Ru.
Технеций
Технеций (Tc) представляет собой серебристо-серый металл с атомным номером 43 в периодической таблице. Это переходный металл, расположенный в 7-й группе периодической таблицы. Он имеет символ Tc.
Молибден
Молибден (Мо) — серебристо-белый металл с атомным номером 42 в периодической таблице. Это переходный металл, расположенный в 6-й группе периодической таблицы. Он имеет обозначение Mb.
Ниобий
Ниобий (Nb) — блестящий белый металл с атомным номером 41 в периодической таблице.
 Это переходный металл, расположенный в группе 5 периодической таблицы. Он имеет символ Nb.
Это переходный металл, расположенный в группе 5 периодической таблицы. Он имеет символ Nb.Цирконий
Цирконий (Zr) представляет собой серо-белый металл с атомным номером 40 в периодической таблице. Это переходный металл, расположенный в 4-й группе периодической таблицы. Он имеет символ Zr.
Иттрий
Иттрий (Y) — серебристый металл с атомным номером 39 в периодической таблице. Это переходный металл, расположенный в группе 3 периодической таблицы. Он имеет символ Y.
атомный и ионный радиусы
АТОМНЫЙ И ИОННЫЙ РАДИУС
На этой странице объясняются различные меры атомного радиуса, а затем рассматривается, как он меняется в Периодической таблице — по периодам и низшим группам. Предполагается, что вы понимаете электронные структуры простых атомов, записанных в нотации s, p, d.
Важно! Если вы недовольны электронными структурами, вам следует перейти по этой ссылке, прежде чем двигаться дальше.
АТОМНЫЙ РАДИУС
Измерения атомного радиуса
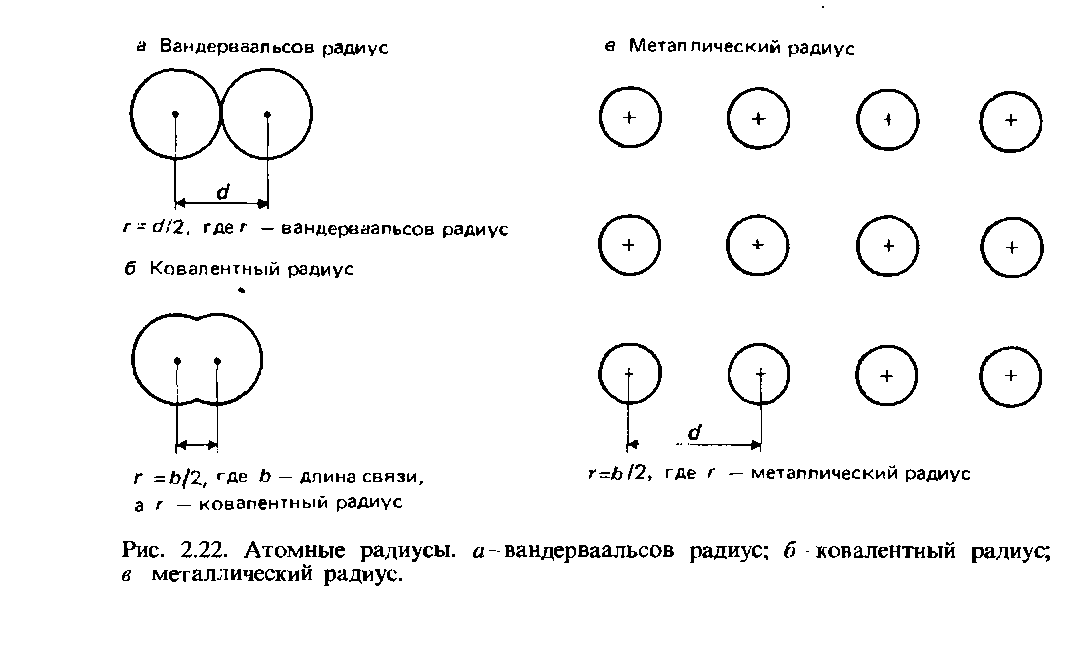
В отличие от шара, у атома нет фиксированного радиуса. Радиус атома можно найти, только измерив расстояние между ядрами двух соприкасающихся атомов, а затем разделив это расстояние вдвое.
Как видно из диаграмм, один и тот же атом может иметь разный радиус в зависимости от того, что его окружает.
На левой диаграмме показаны связанные атомы. Атомы сближены, поэтому измеренный радиус меньше, чем если бы они просто соприкасались. Это то, что вы получили бы, если бы у вас были атомы металла в металлической структуре или атомы, ковалентно связанные друг с другом. Тип измеряемого здесь атомного радиуса называется металлический радиус или ковалентный радиус в зависимости от соединения.
На правой диаграмме показано, что произойдет, если атомы просто соприкоснутся. Силы притяжения намного меньше, и атомы по существу «не раздавлены».
 Эта мера атомного радиуса называется радиусом Ван-дер-Ваальса из-за слабых притяжений, присутствующих в этой ситуации.
Эта мера атомного радиуса называется радиусом Ван-дер-Ваальса из-за слабых притяжений, присутствующих в этой ситуации.
Примечание: Если вы хотите изучить эти различные типы склеивания, эта ссылка приведет вас в меню склеивания.
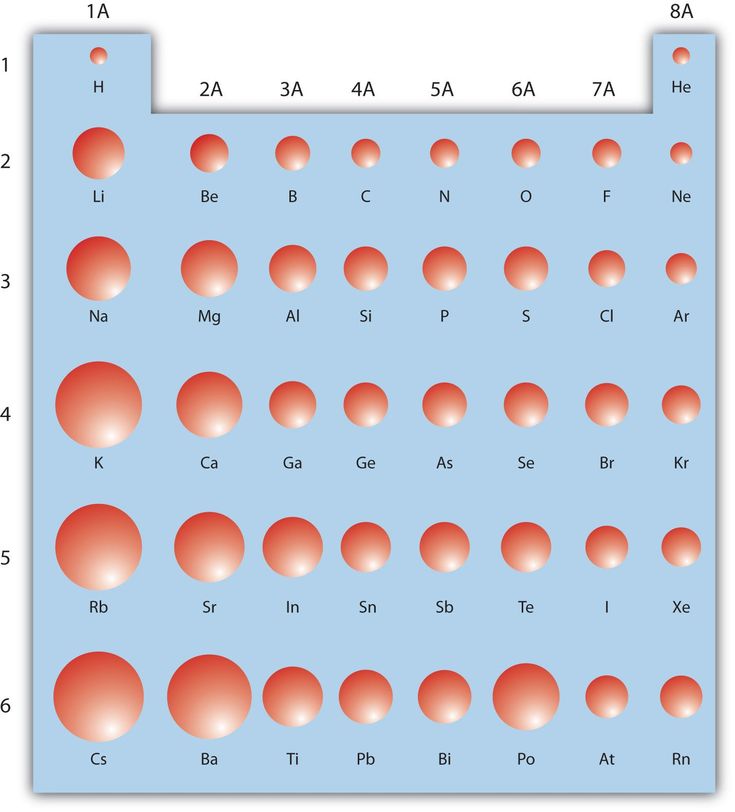
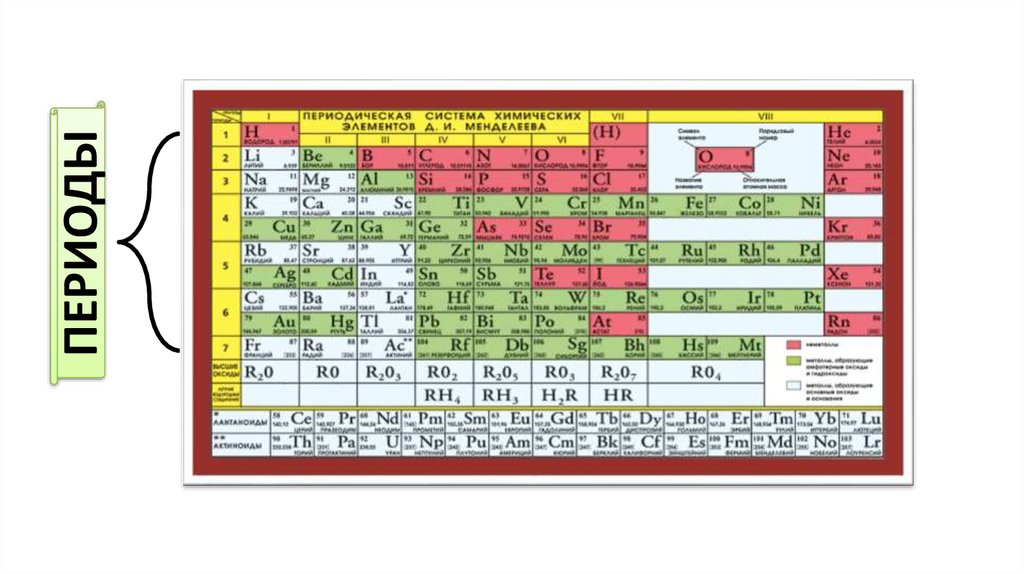
Тенденции атомного радиуса в периодической таблице
Точная картина, которую вы получите, зависит от того, какую меру атомного радиуса вы используете, но тенденции остаются в силе.
На следующей диаграмме используются металлические радиусы для металлических элементов, ковалентные радиусы для элементов, которые образуют ковалентные связи, и радиусы Ван-дер-Ваальса для тех (таких как инертные газы), которые не образуют связей.
Динамика атомного радиуса в периоды 2 и 3
Примечание: Вы можете встретить подобную диаграмму, которая показывает тенденцию к уменьшению за период , включая благородные газы . Вы могли бы получить это, только если бы вычислили радиус для изолированных атомов. Это не учитывает ситуацию в реальном мире, когда вы фактически измеряете радиус так, как мы здесь обсуждаем.
Вы могли бы получить это, только если бы вычислили радиус для изолированных атомов. Это не учитывает ситуацию в реальном мире, когда вы фактически измеряете радиус так, как мы здесь обсуждаем.
Тенденции атомного радиуса вниз по группе
Совершенно очевидно, что атомы становятся больше по мере того, как вы спускаетесь по группам. Причина столь же очевидна — вы добавляете дополнительные слои электронов.
Тенденции атомного радиуса по периодам
Вы должны игнорировать благородный газ в конце каждого периода. Поскольку неон и аргон не образуют связей, вы можете измерить только их ван-дер-ваальсов радиус — случай, когда атом довольно хорошо «несплющен». Все остальные атомы измеряются там, где их атомный радиус уменьшается из-за сильного притяжения. Вы не сравниваете подобное с подобным, если включаете благородные газы.
Не считая благородных газов, атомы становятся меньше по мере прохождения периода. 
Если подумать, металлический или ковалентный радиус будет мерой расстояния от ядра до электронов, образующих связь. (Если вы не уверены, посмотрите на левую часть первой диаграммы на этой странице и представьте, что связывающие электроны находятся на полпути между двумя ядрами.)
От лития до фтора все эти электроны находятся на уровне 2 и экранируются 1s 2 электронами. Увеличение числа протонов в ядре по мере прохождения периода сильнее притягивает электроны. Величина экранирования постоянна для всех этих элементов.
Примечание: Возможно, вы удивитесь, почему вы не получаете дополнительного экранирования от 2s 2 электронов в случаях элементов от бора до фтора, где в связи участвуют p-электроны.В каждом из этих случаев, прежде чем произойдет связывание, существующие s- и p-орбитали реорганизуются (гибридизуются) в новые орбитали равной энергии.
 Когда эти атомы связаны, нет 2s-электронов как таковых.
Когда эти атомы связаны, нет 2s-электронов как таковых.Если вы не знаете о гибридизации, просто проигнорируйте этот комментарий — он вам все равно не понадобится для целей уровня UK A.
В период от натрия к хлору происходит то же самое. Размер атома контролируется связывающими электронами 3-го уровня, которые притягиваются ближе к ядру за счет увеличения числа протонов — в каждом случае экранируются электронами 1-го и 2-го уровней.
Тренды в переходных элементах
Хотя в начале ряда наблюдается небольшое сжатие, все атомы имеют примерно одинаковый размер.
Размер определяется 4s электронами. Притяжение растущего числа протонов в ядре более или менее компенсируется дополнительным экранированием из-за увеличения числа 3d-электронов.
Примечание: 4s-орбиталь имеет более высокую энергию, чем 3d в переходных элементах. Это означает, что это 4s-электрон, который теряется из атома, когда он образует ион. Это также означает, что 3d-орбитали немного ближе к ядру, чем 4s, и поэтому обеспечивают некоторое экранирование.
Это означает, что это 4s-электрон, который теряется из атома, когда он образует ион. Это также означает, что 3d-орбитали немного ближе к ядру, чем 4s, и поэтому обеспечивают некоторое экранирование.Как ни странно, это несовместимо с тем, что мы говорим, когда используем принцип Ауфбау для определения электронных структур атомов.
Я подробно обсуждал это на странице о порядке заполнения 3d и 4s орбиталей.
Если вы учитель или очень уверенный в себе ученик, вы можете пройти по этой ссылке.
Если вы не так уверены в себе или делаете это впервые, я предлагаю вам не обращать на это внимания. Помните, что принцип Ауфбау (который использует предположение, что 3d-орбитали заполняются после 4s) — это просто полезный способ определения структуры атомов, но что в реальных атомах переходных металлов 4s на самом деле является внешней орбиталью с более высокой энергией.
ИОННЫЙ РАДИУС
Внимание!
Ионные радиусы трудно измерить с какой-либо степенью уверенности, и они варьируются в зависимости от окружения иона.
 Например, имеет значение, какова координация иона (сколько противоположно заряженных ионов соприкасается с ним) и что это за ионы.
Например, имеет значение, какова координация иона (сколько противоположно заряженных ионов соприкасается с ним) и что это за ионы.Существует несколько различных единиц измерения ионных радиусов, и все они отличаются друг от друга на разную величину. Это означает, что если вы собираетесь проводить надежные сравнения с использованием ионных радиусов, они должны исходить из одного и того же источника.
Вы должны помнить, что существуют довольно большие погрешности в использовании ионных радиусов, и что попытки объяснить вещи в мельчайших деталях затрудняются этими неопределенностями. Нижеследующее будет достаточно для уровня UK A (и его различных эквивалентов), но подробные объяснения слишком сложны для этого уровня.
Тенденции изменения ионного радиуса в Периодической таблице
Тенденции ионного радиуса вниз по группе
Это самое простое! Когда вы добавляете дополнительные слои электронов по мере продвижения вниз по группе, ионы неизбежно становятся больше.
 Две приведенные ниже таблицы показывают этот эффект в группах 1 и 7.
Две приведенные ниже таблицы показывают этот эффект в группах 1 и 7.electronic structure
of ionionic radius (nm) Li + 2 0.076 Na + 2, 8 0,102 K + 2, 8, 8 0.138 Rb + 2, 8, 18, 8 0.152 Cs + 2, 8, 18, 18, 8 0,167 электронная структура
ионаионный радиус (нм) F — 2, 8 0.  133
133Cl — 2, 8, 8 0.181 Br — 2, 8, 18, 8 0.196 I — 2, 8, 18, 18, 8 0,220
Примечание: Все эти цифры взяты из базы данных ионных радиусов Имперского колледжа Лондона. Я преобразовал их из ангстремов в нм (нанометры), которые чаще используются в таблицах данных, с которыми вы, вероятно, столкнетесь.Если вам интересно, 1 Ангстрем равен 10 -10 м; 1 нм = 10 -9 м. Чтобы перевести ангстрем в нм, нужно разделить на 10, чтобы 1,02 ангстрема стало 0,102 нм. Вы также можете встретить таблицы со значениями в пм (пикометрах), которые составляют 10 -12 м. Значение в pm будет выглядеть, например, для хлора как 181 pm, а не 0,181 нм. Не волнуйтесь, если вы найдете это запутанным.
 Просто используйте значения, которые вам даны, в любых единицах, которые вам даны.
Просто используйте значения, которые вам даны, в любых единицах, которые вам даны.Для сравнения все значения относятся к 6-координированным ионам (такое же расположение, как, например, в NaCl). CsCl на самом деле кристаллизуется в структуре с координацией 8:8, поэтому вы не можете точно использовать эти значения для CsCl. 8-координатный ионный радиус для Cs составляет 0,174 нм, а не 0,167 для 6-координатной версии.
Тренды ионного радиуса за период
Давайте посмотрим на радиусы простых ионов, образованных элементами при переходе через Период 3 периодической таблицы — элементы от Na до Cl.
NA + MG 2+ AL 3+ . . . . . 
. .0637 Cl — no of protons 11 12 13 15 16 17 electronic structure of ion 2,8 2,8 2,8 2,8,8 2,8,8 2,8,8 ionic radius (nm) 0.102 0.072 0,054 (0,212) 0,184 0,181
Примечание: В таблице отсутствует кремний, который не образует простой ион. Радиус фосфид-иона указан в скобках, потому что он получен из другого источника данных, и я не уверен, безопасно ли его сравнивать. Значения ионов сульфида и хлорида совпадают в разных источниках, так что, вероятно, это нормально. Значения снова относятся к 6-координации, хотя я не могу гарантировать этого для числа фосфидов.
Значения снова относятся к 6-координации, хотя я не могу гарантировать этого для числа фосфидов.
Во-первых, обратите внимание на большой скачок ионного радиуса, как только вы попадаете в отрицательные ионы. Это удивительно? Вовсе нет — вы только что добавили целый дополнительный слой электронов.
Обратите внимание, что в рядах положительных ионов и рядах отрицательных ионов ионные радиусы уменьшаются по мере прохождения периода. Нам нужно смотреть на положительные и отрицательные ионы отдельно.
Положительные ионы
В каждом случае ионы имеют одинаковую электронную структуру — говорят, что они изоэлектронны . Однако число протонов в ядрах ионов увеличивается. Это будет притягивать электроны все больше и больше к центру иона, вызывая падение ионных радиусов. Это довольно очевидно!
Отрицательные ионы
Здесь происходит то же самое, за исключением того, что у вас есть дополнительный слой электронов.
 Однако необходимо прокомментировать, насколько похожи по размеру ион сульфида и ион хлорида. Дополнительный протон здесь почти ничего не меняет.
Однако необходимо прокомментировать, насколько похожи по размеру ион сульфида и ион хлорида. Дополнительный протон здесь почти ничего не меняет.Разница между размерами аналогичных пар ионов на самом деле становится еще меньше по мере того, как вы спускаетесь в группы 6 и 7. Например, ион Te 2- всего на 0,001 нм больше, чем ион I — .
Насколько мне известно, для этого нет простого объяснения — уж точно такого, которое можно было бы использовать на этом уровне. Это хорошая иллюстрация того, что я сказал ранее — подробное объяснение вещей, связанных с ионными радиусами, иногда очень сложно.
Тенденции изменения ионного радиуса для некоторых изоэлектронных ионов
На самом деле это всего лишь вариация того, о чем мы только что говорили, но она объединяет отрицательные и положительные изоэлектронные ионы в один и тот же ряд результатов. Помните, что все изоэлектронные ионы имеют точно такое же расположение электронов.

N 3- O 2- F — Na 0541 +Mg 2+ Al 3+ no of protons 7 8 9 11 12 13 electronic structure of ion 2, 8 2, 8 2, 8 2, 8 2, 8 2, 8 ionic radius (nm) (0.171) 0.140 0.133 0.102 0.072 0.054
Примечание: Значение нитрид-иона указано в скобках, потому что оно получено из другого источника, и я не знаю наверняка, относится ли оно к той же 6-координации, что и остальные ионы. Это важно. Мой основной источник дал только 4-координатное значение для нитрид-иона, и это было 0,146 нм.
Это важно. Мой основной источник дал только 4-координатное значение для нитрид-иона, и это было 0,146 нм.Вам также может быть любопытно, как нейтральный атом неона вписывается в эту последовательность. Его радиус Ван-дер-Ваальса составляет 0,154 или 0,160 нм (в зависимости от того, в каком источнике вы смотрите значение) — больше, чем у иона фтора. Вы не можете действительно разумно сравнивать радиус Ван-дер-Ваальса с радиусом связанного атома или иона.
Вы можете видеть, что по мере увеличения числа протонов в ядре иона электроны притягиваются ближе к ядру. Таким образом, радиусы изоэлектронных ионов попадают в этот ряд.
Вопросы для проверки вашего понимания
Если это первый набор вопросов, который вы задали, пожалуйста, прочтите вводную страницу, прежде чем начать. Вам нужно будет использовать КНОПКУ НАЗАД в браузере, чтобы вернуться сюда позже.

вопроса об атомном и ионном радиусе
ответы
Нет вопросов для тестирования остальной части этой страницы.
Относительные размеры ионов и атомов
Вы, вероятно, не заметили, но нигде из того, что вы читали до сих пор, не было необходимости говорить об относительных размерах ионов и атомов, из которых они произошли. Также (насколько я могу судить по программам) ни один из текущих экзаменов в Великобритании для 16–18-летних не требует этого специально в своих программах.
Однако очень часто встречаются утверждения об относительных размерах ионов и атомов. Я совершенно убежден, что эти утверждения ошибочны, и я хотел бы заняться проблемой в лоб, а не просто игнорировать ее.
Важно!
В течение 10 лет, пока я не переписал этот раздел об ионном радиусе в августе 2010 года, я включал то, что находится в рамке ниже. Вы найдете ту же самую информацию и объяснение во всевозможных книгах и на любом количестве веб-сайтов, предназначенных для этого уровня.
 По крайней мере, в одной учебной программе уровня A за пределами Великобритании есть заявление, в котором конкретно содержится просьба об этом.
По крайней мере, в одной учебной программе уровня A за пределами Великобритании есть заявление, в котором конкретно содержится просьба об этом.Ионы не такого размера, как атомы, из которых они произошли. Сравните размеры ионов натрия и хлора с размерами атомов натрия и хлора.
Положительные ионы
Положительные ионы меньше, чем атомы, из которых они происходят. Натрий 2,8,1; Na + составляет 2,8. Вы потеряли целый слой электронов, а оставшиеся 10 электронов втягиваются всей силой 11 протонов.
Отрицательные ионы
Отрицательные ионы больше, чем атомы, из которых они получены. хлор 2,8,7; Cl — — 2,8,8. Хотя все электроны все еще находятся на уровне 3, дополнительное отталкивание, создаваемое прилетающим электроном, заставляет атом расширяться. Протонов по-прежнему всего 17, но теперь им приходится удерживать 18 электронов.

Тем не менее, опытный учитель задал мне вопрос об объяснении отрицательных ионов, и это впервые заставило меня тщательно обдумать это. Теперь я убежден, что факты и объяснения, касающиеся отрицательных ионов, просто нелогичны.
Насколько я могу судить, ни в одной учебной программе Великобритании не упоминаются относительные размеры атомов и ионов (по состоянию на август 2010 г.), но вы должны проверить прошлые работы и отметить схемы, чтобы увидеть, не появились ли вопросы.
Остальная часть этой страницы обсуждает проблемы, которые я вижу, и действительно предназначена для учителей и других, а не для студентов.
Если вы являетесь студентом , внимательно изучите свой учебный план, прошлые экзаменационные вопросы и схемы оценок, чтобы выяснить, нужно ли вам об этом знать. Если вам не нужно знать об этом, прекратите читать сейчас (если, конечно, вы не заинтересованы в полемике!).
Если вам это нужно знать, то вам придется узнать, что в коробке, даже если, как я считаю, это неправильно.
 Если вы хотите, чтобы ваша химия была простой, игнорируйте остальную часть страницы, потому что вы рискуете запутаться в том, что вам нужно знать.
Если вы хотите, чтобы ваша химия была простой, игнорируйте остальную часть страницы, потому что вы рискуете запутаться в том, что вам нужно знать.Если вы обладаете экспертными знаниями по этой теме и можете найти какие-либо недостатки в том, что я говорю, то, пожалуйста, свяжитесь со мной по адресу, указанному на странице об этом сайте.
Выбор правильного атомного радиуса для сравнения с
В этом суть проблемы.
Диаграммы в рамке выше и аналогичные, которые вы найдете в других местах, используют металлический радиус в качестве меры атомного радиуса для металлов и ковалентный радиус для неметаллов. Я хочу сосредоточиться на неметаллах, потому что именно в них заключается основная проблема.
Вы, конечно, совершенно вольны сравнивать радиус иона с любой мерой атомного радиуса, которую вы выберете. Проблема заключается в том, чтобы связать ваш выбор атомного радиуса с «объяснением» различий.
Совершенно верно, что отрицательные ионы имеют радиусы, значительно превышающие ковалентный радиус рассматриваемого атома.
 Затем аргументируется, что причина этого в том, что если вы добавите к атому один или несколько дополнительных электронов, межэлектронное отталкивание заставит атом расширяться. Следовательно, отрицательный ион больше атома.
Затем аргументируется, что причина этого в том, что если вы добавите к атому один или несколько дополнительных электронов, межэлектронное отталкивание заставит атом расширяться. Следовательно, отрицательный ион больше атома.Это кажется мне совершенно непоследовательным. Если вы добавляете один или несколько дополнительных электронов к атому, вы не добавляете их к ковалентно связанному атому. Например, вы не можете просто добавить электроны к ковалентно связанному атому хлора — существующие электроны хлора реорганизовались в новые молекулярные орбитали, которые связывают атомы вместе.
В ковалентно-связанном атоме просто нет места для добавления дополнительных электронов.
Итак, если вы хотите использовать объяснение отталкивания электронов, подразумевается, что вы добавляете дополнительные электроны к необработанному атому с простым некомбинированным расположением электронов.
Другими словами, если вы говорите, скажем, о хлоре, вы добавляете дополнительный электрон к хлору с конфигурацией 2,8,7 — , а не к ковалентно связанным атомам хлора, в котором расположение электронов был изменен путем обмена.

Это значит, что сравнивать надо не с укороченным ковалентным радиусом, а с гораздо большим радиусом Ван-дер-Ваальса — единственной доступной мерой радиуса несвязанного атома.
Так что же произойдет, если вы сделаете такое сравнение?
Группа 7
0.04150.133 Cl 0.175 0.181 Br 0.185 0.196 I 0.198 0.220 Группа 6
vdW радиус (нм) ионный радиус X 2- (нм) O 0.140 S 0.  180
1800.184 Se 0.190 0.198 Te 0.206 0.221 Группа 5
vdW радиус (нм) ионный радиус X 3- (нм) N 0,171 Р 0,180 0,212 Как мы уже говорили выше, измерения ионных радиусов полны неопределенностей. Это также верно для радиусов Ван-дер-Ваальса. В таблице используется один конкретный набор значений для целей сравнения. Если вы используете данные из разных источников, вы обнаружите различия в закономерностях, в том числе в том, какой из видов (ион или атом) больше.

Эти значения ионного радиуса относятся к 6-координированным ионам (с небольшим знаком вопроса над цифрами нитрид- и фосфид-ионов). Но вы, возможно, помните, что я сказал, что ионный радиус изменяется в зависимости от координации. Азот является особенно хорошим примером этого.
4-координированных иона нитрида имеют радиус 0,146 нм. Другими словами, если вы посмотрите на одну из координаций, ион нитрида больше, чем атом азота; в другом случае он меньше. Сделать общее утверждение о том, что нитрид-ионы больше или меньше атомов азота, невозможно.
Так что можно с уверенностью сказать о фактах?
Для большинства , но не всех, отрицательных ионов радиус иона больше, чем у атома, но разница не так велика, как показано, если неправильно сравнивать ионные радиусы с ковалентными радиусами. Есть и важные исключения.
Я не понимаю, как можно делать какие-то реальные обобщения по этому поводу, учитывая неопределенность данных.

И что можно с уверенностью сказать по поводу объяснения?
Если и есть какие-то дополнительные электрон-электронные отталкивания при добавлении дополнительных электронов, то они должны быть достаточно малы. Это особенно видно, если рассмотреть некоторые пары изоэлектронных ионов.
Вы могли бы подумать, что если бы отталкивание было важным фактором, то радиус, скажем, сульфид-иона с двумя отрицательными зарядами был бы значительно больше, чем у хлорид-иона только с одним. На самом деле разница должна быть еще более заметной, потому что электроны сульфида удерживаются только 16 протонами, а не 17 в случае хлора.
Согласно этой теории отталкивания, ион сульфида должен быть не просто немного больше, чем ион хлорида, он должен быть намного больше. Такой же эффект проявляют селенид- и бромид-ионы, теллурид- и иодид-ионы. В последнем случае практически нет разницы в размерах 2- и 1-ионов.
Так что, если в этом и есть какое-то отвращение, то, конечно, не похоже, что оно играет большую роль.

Как насчет положительных ионов?
Независимо от того, решите ли вы использовать радиусы Ван-дер-Ваальса или металлические радиусы в качестве меры атомного радиуса, для металлов ионный радиус меньше, чем любой из них, поэтому проблема не существует в той же степени. Это правда, что ионный радиус металла меньше его атомного радиуса (как бы расплывчато вы ни давали это определение).
Объяснение (по крайней мере, пока вы рассматриваете только положительные ионы из групп 1, 2 и 3) с точки зрения потери полного слоя электронов также приемлемо.
Заключение
Мне кажется, что для отрицательных ионов совершенно нелогично сравнивать ионные радиусы с ковалентными радиусами, если вы хотите использовать объяснение отталкивания электронов.
Если вы сравните ионные радиусы отрицательных ионов с ван-дер-ваальсовыми радиусами атомов, из которых они происходят, неопределенность в данных очень затрудняет какие-либо надежные обобщения.


 2, т.е. с ростом расстояния до ядра силы ослабевают и внешний уровень не так сильно притягивается к ядру. Да ещё нижележащие электроны экранируют ядро. Именно из-за этой причины закономерность возрастания радиуса в группе не линейная и не квадратичная, а отражается ломанной кривой. Причём обратите внимание, как слабо изменяется радиус атома от гелия к неону. И как особняком располагается водород. А для цезия и франция рост радиуса сменяется падением. Сложна многоэлектронная система и вовсе не во всех случаях квантовая химия может объяснить закономерности, получаемые экспериментально.
2, т.е. с ростом расстояния до ядра силы ослабевают и внешний уровень не так сильно притягивается к ядру. Да ещё нижележащие электроны экранируют ядро. Именно из-за этой причины закономерность возрастания радиуса в группе не линейная и не квадратичная, а отражается ломанной кривой. Причём обратите внимание, как слабо изменяется радиус атома от гелия к неону. И как особняком располагается водород. А для цезия и франция рост радиуса сменяется падением. Сложна многоэлектронная система и вовсе не во всех случаях квантовая химия может объяснить закономерности, получаемые экспериментально. Почему?
🔸Число электронов на внешнем уровне возрастает
P. S. Число электронов равно номеру элемента в таблице Менделеева🙂
🔸Много электронов сильно давят на атомное ядро ➡️атом сжимается➡️радиус уменьшается
☘️По группе сверху вниз радиус возрастает, т. к.
🔸Возрастает число уровней, значит, для… Читать далее
Почему?
🔸Число электронов на внешнем уровне возрастает
P. S. Число электронов равно номеру элемента в таблице Менделеева🙂
🔸Много электронов сильно давят на атомное ядро ➡️атом сжимается➡️радиус уменьшается
☘️По группе сверху вниз радиус возрастает, т. к.
🔸Возрастает число уровней, значит, для… Читать далее
 Читать далее
Читать далее По классическим представлениям в центре атома находится ядро, состоящее из протонов и нейтронов, а вокруг ядра каждый на своей орбите вращаются электроны.
По классическим представлениям в центре атома находится ядро, состоящее из протонов и нейтронов, а вокруг ядра каждый на своей орбите вращаются электроны. Здесь эта частица уже представляется в виде электронной орбитали, плотность которой меняется, в зависимости от расстояния до ядра атома.
Здесь эта частица уже представляется в виде электронной орбитали, плотность которой меняется, в зависимости от расстояния до ядра атома.

 Такое расстояние определяется как сумма радиусов этих ионов.
Такое расстояние определяется как сумма радиусов этих ионов.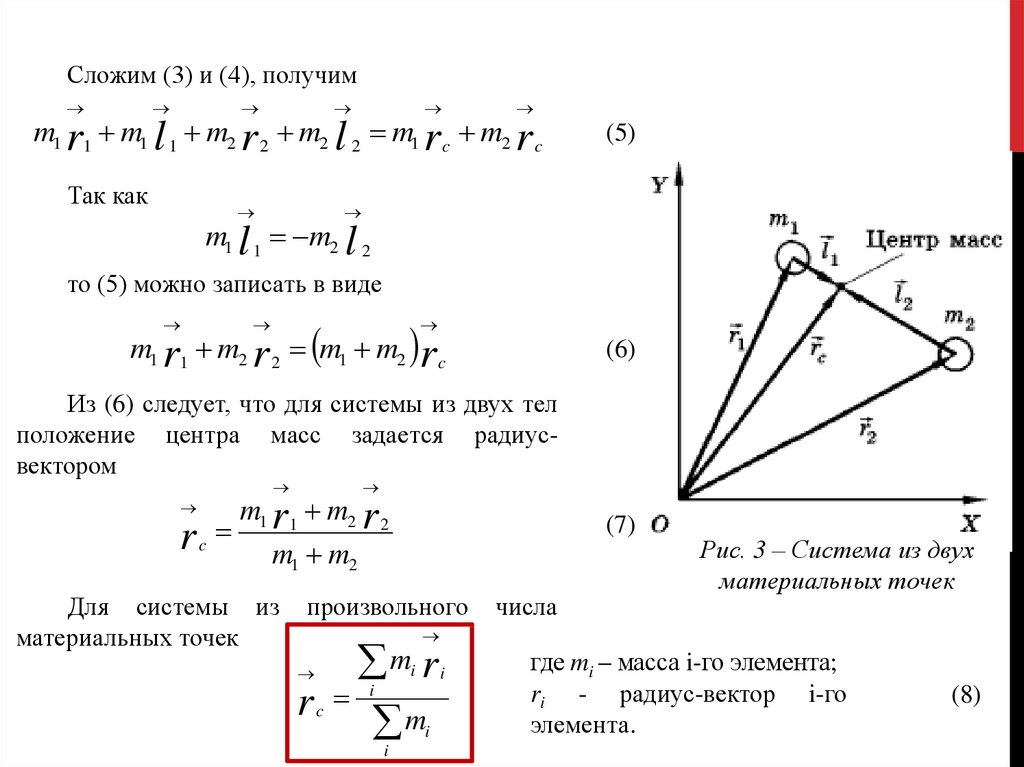 Например, жидкие калий К и литий Li в обычных условиях не смешиваются и образуют два жидких слоя, потому что их металлические радиусы сильно различаются (0.236 нм и 0.155 нм соответственно), а калий К с цезием Cs образуют твердый раствор благодаря близости их радиусов (0.236 нм и 0.268 нм).
Например, жидкие калий К и литий Li в обычных условиях не смешиваются и образуют два жидких слоя, потому что их металлические радиусы сильно различаются (0.236 нм и 0.155 нм соответственно), а калий К с цезием Cs образуют твердый раствор благодаря близости их радиусов (0.236 нм и 0.268 нм).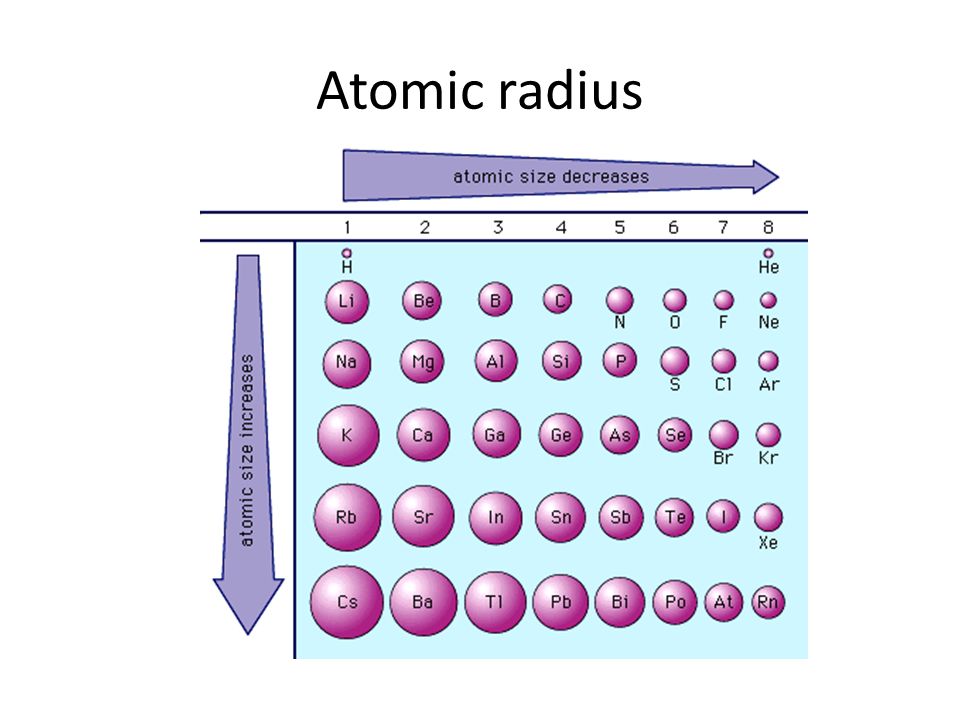 На основе этого принципа интерпретируются данные кристаллографии и предсказываются структуры молекулярных кристаллов.
На основе этого принципа интерпретируются данные кристаллографии и предсказываются структуры молекулярных кристаллов. Атомы водорода под действием большого количества тепла и давления вынуждены объединяться, образуя более крупный атом гелия 9.0003
Атомы водорода под действием большого количества тепла и давления вынуждены объединяться, образуя более крупный атом гелия 9.0003
 Щелочные металлы — это блестящие, мягкие, высокореактивные металлы при стандартной температуре и давлении.
Щелочные металлы — это блестящие, мягкие, высокореактивные металлы при стандартной температуре и давлении. Он находится в группе 18. Он имеет символ Og.
Он находится в группе 18. Он имеет символ Og.
 Это переходный металл группы 9. Он имеет символ Mt
Это переходный металл группы 9. Он имеет символ Mt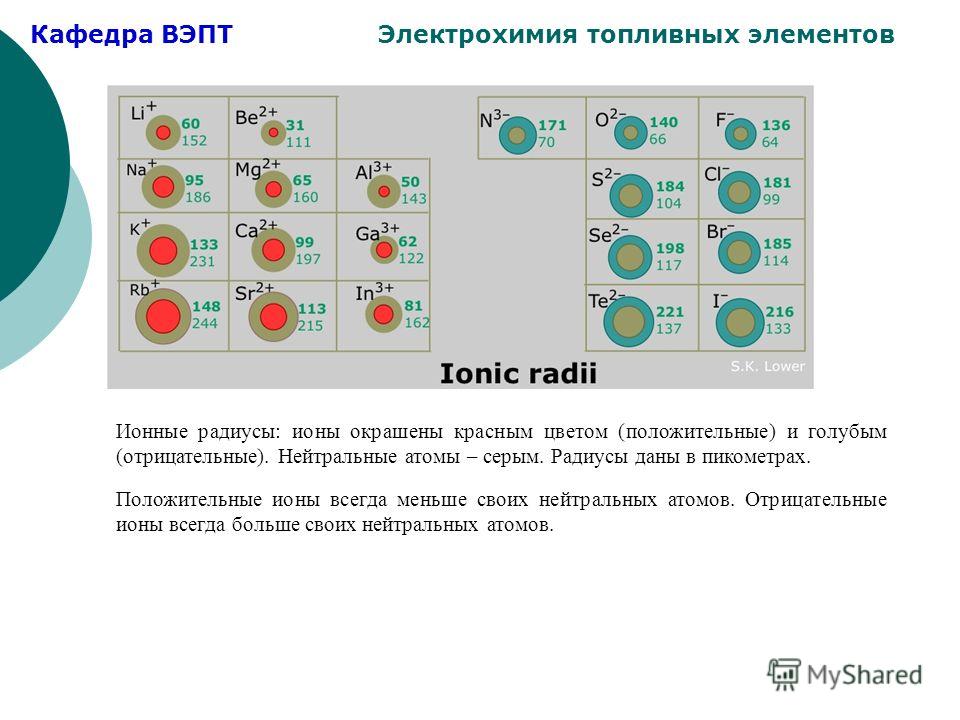 Он имеет символ Db.
Он имеет символ Db. Это актиноидный металл с символом Fm.
Это актиноидный металл с символом Fm. Это актиноидный металл с символом Pu.
Это актиноидный металл с символом Pu. Это щелочной металл с символом Fr, расположенный в группе 1 периодической таблицы.
Это щелочной металл с символом Fr, расположенный в группе 1 периодической таблицы.
 Это переходный металл группы 7. Он имеет символ Re.
Это переходный металл группы 7. Он имеет символ Re. Это лантаноидный металл. Он имеет обозначение Tm.
Это лантаноидный металл. Он имеет обозначение Tm. Это лантаноидный металл. Он имеет символ Eu.
Это лантаноидный металл. Он имеет символ Eu. Это лантаноидный металл. Имеет обозначение La.
Это лантаноидный металл. Имеет обозначение La. Он имеет символ Те.
Он имеет символ Те. Это переходный металл, расположенный в 10-й группе периодической таблицы. Он имеет обозначение Pd.
Это переходный металл, расположенный в 10-й группе периодической таблицы. Он имеет обозначение Pd.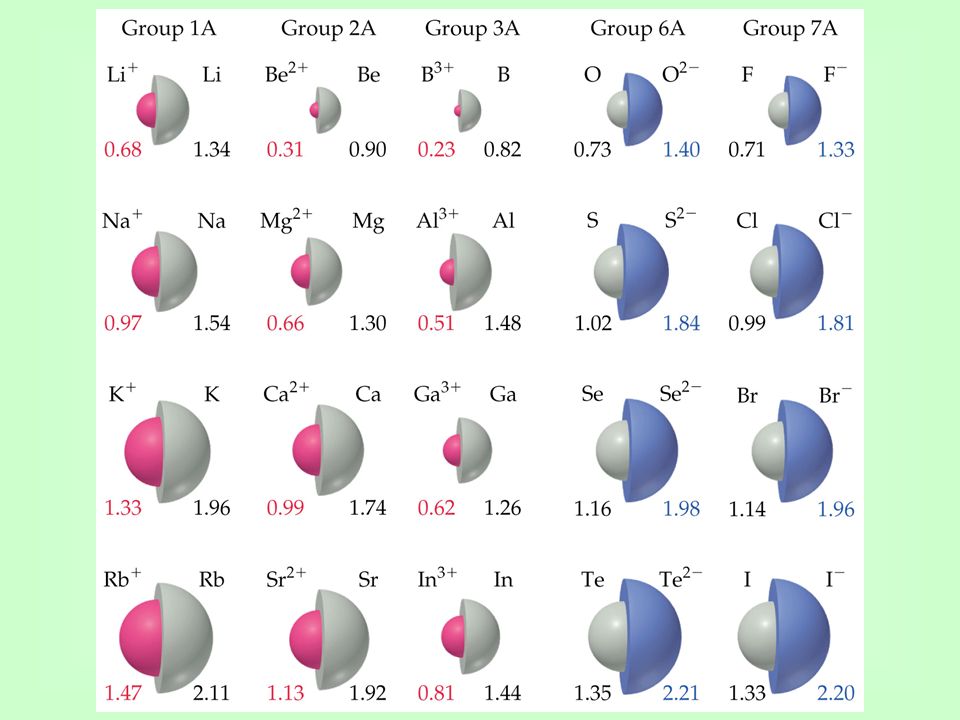 Это переходный металл, расположенный в группе 5 периодической таблицы. Он имеет символ Nb.
Это переходный металл, расположенный в группе 5 периодической таблицы. Он имеет символ Nb.
 Эта мера атомного радиуса называется радиусом Ван-дер-Ваальса из-за слабых притяжений, присутствующих в этой ситуации.
Эта мера атомного радиуса называется радиусом Ван-дер-Ваальса из-за слабых притяжений, присутствующих в этой ситуации.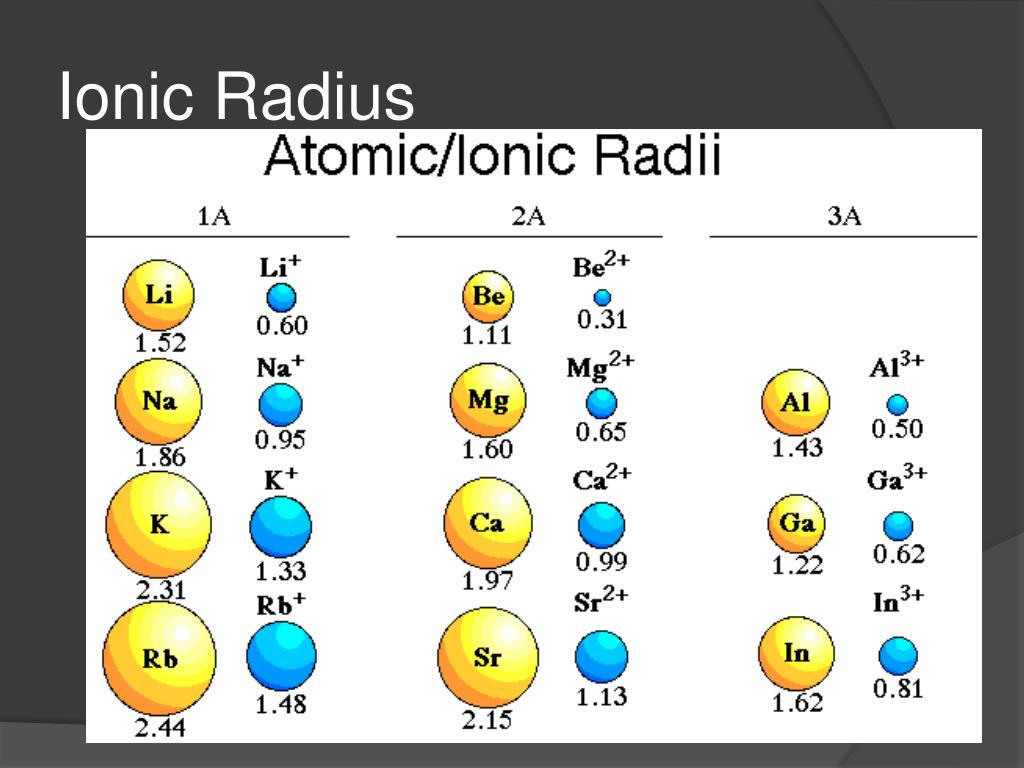 Вы могли бы получить это, только если бы вычислили радиус для изолированных атомов. Это не учитывает ситуацию в реальном мире, когда вы фактически измеряете радиус так, как мы здесь обсуждаем.
Вы могли бы получить это, только если бы вычислили радиус для изолированных атомов. Это не учитывает ситуацию в реальном мире, когда вы фактически измеряете радиус так, как мы здесь обсуждаем. 
 Когда эти атомы связаны, нет 2s-электронов как таковых.
Когда эти атомы связаны, нет 2s-электронов как таковых. Это означает, что это 4s-электрон, который теряется из атома, когда он образует ион. Это также означает, что 3d-орбитали немного ближе к ядру, чем 4s, и поэтому обеспечивают некоторое экранирование.
Это означает, что это 4s-электрон, который теряется из атома, когда он образует ион. Это также означает, что 3d-орбитали немного ближе к ядру, чем 4s, и поэтому обеспечивают некоторое экранирование.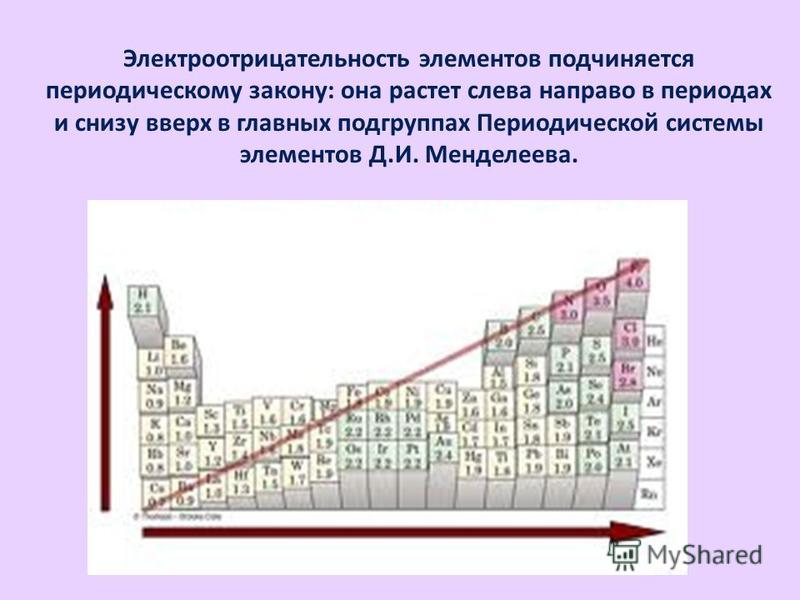 Например, имеет значение, какова координация иона (сколько противоположно заряженных ионов соприкасается с ним) и что это за ионы.
Например, имеет значение, какова координация иона (сколько противоположно заряженных ионов соприкасается с ним) и что это за ионы.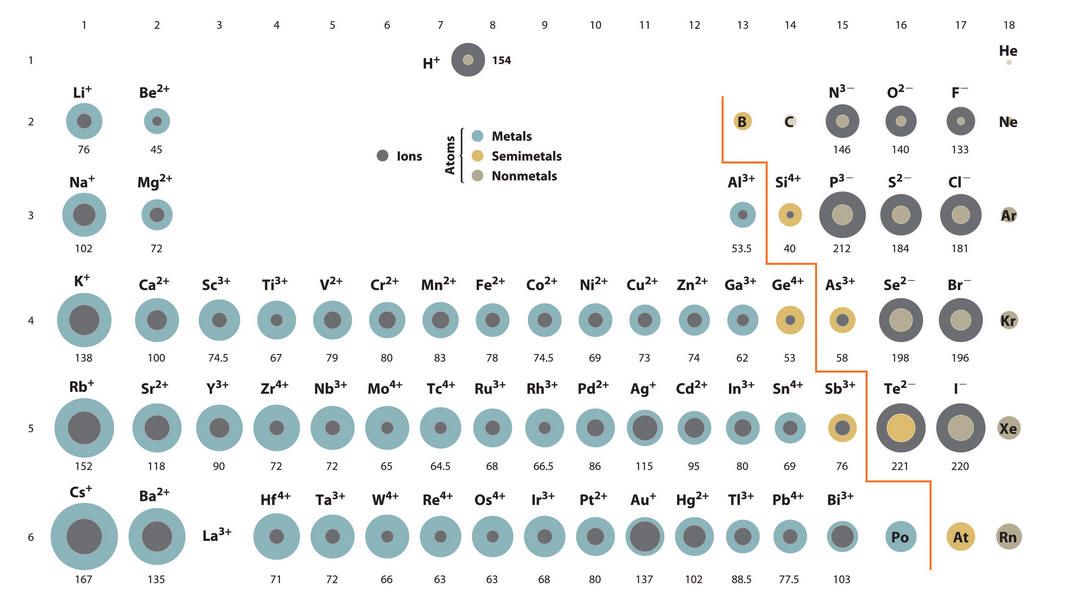 Две приведенные ниже таблицы показывают этот эффект в группах 1 и 7.
Две приведенные ниже таблицы показывают этот эффект в группах 1 и 7. 133
133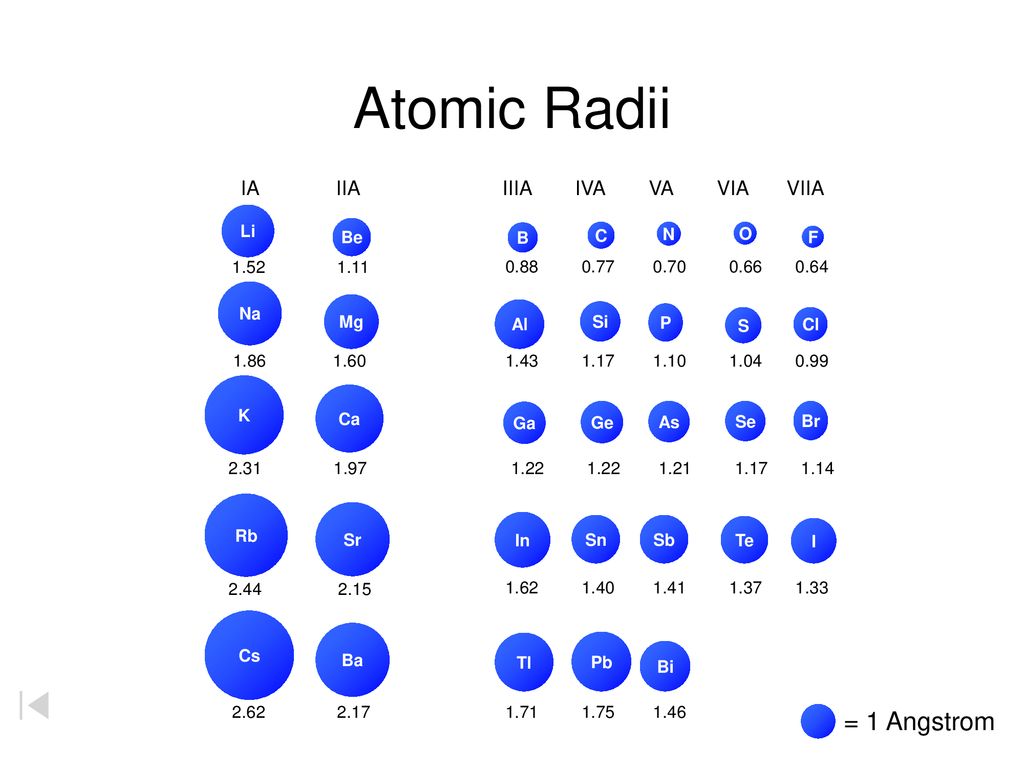 Просто используйте значения, которые вам даны, в любых единицах, которые вам даны.
Просто используйте значения, которые вам даны, в любых единицах, которые вам даны.
 Значения снова относятся к 6-координации, хотя я не могу гарантировать этого для числа фосфидов.
Значения снова относятся к 6-координации, хотя я не могу гарантировать этого для числа фосфидов.  Однако необходимо прокомментировать, насколько похожи по размеру ион сульфида и ион хлорида. Дополнительный протон здесь почти ничего не меняет.
Однако необходимо прокомментировать, насколько похожи по размеру ион сульфида и ион хлорида. Дополнительный протон здесь почти ничего не меняет.
 Это важно. Мой основной источник дал только 4-координатное значение для нитрид-иона, и это было 0,146 нм.
Это важно. Мой основной источник дал только 4-координатное значение для нитрид-иона, и это было 0,146 нм.
 По крайней мере, в одной учебной программе уровня A за пределами Великобритании есть заявление, в котором конкретно содержится просьба об этом.
По крайней мере, в одной учебной программе уровня A за пределами Великобритании есть заявление, в котором конкретно содержится просьба об этом.
 Если вы хотите, чтобы ваша химия была простой, игнорируйте остальную часть страницы, потому что вы рискуете запутаться в том, что вам нужно знать.
Если вы хотите, чтобы ваша химия была простой, игнорируйте остальную часть страницы, потому что вы рискуете запутаться в том, что вам нужно знать.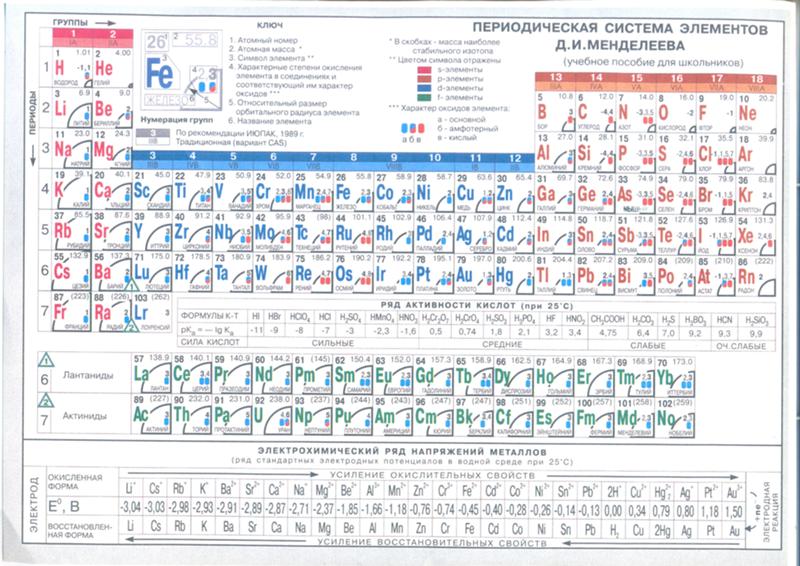 Затем аргументируется, что причина этого в том, что если вы добавите к атому один или несколько дополнительных электронов, межэлектронное отталкивание заставит атом расширяться. Следовательно, отрицательный ион больше атома.
Затем аргументируется, что причина этого в том, что если вы добавите к атому один или несколько дополнительных электронов, межэлектронное отталкивание заставит атом расширяться. Следовательно, отрицательный ион больше атома.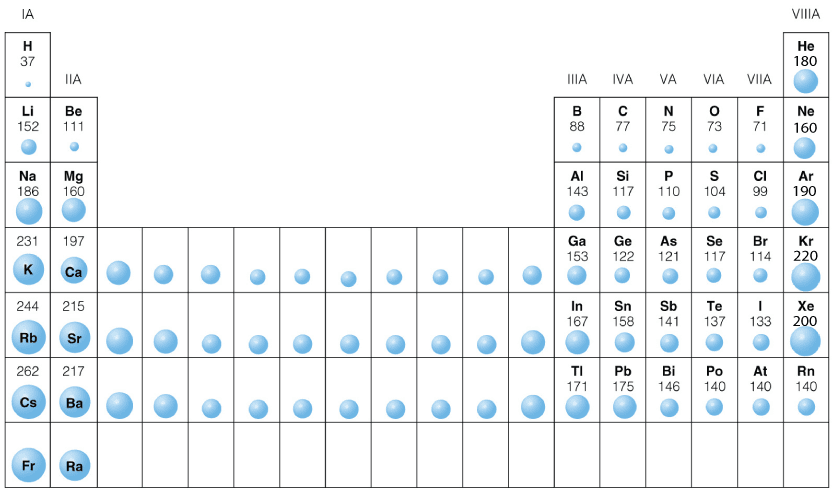
 180
180