Страница не найдена | Международная олимпиада школьников «Туймаада»
XXIX Международная олимпиада школьников
«ТУЙМААДА»
По математике, физике, химии и информатике
30 июня — 10 июля 2022, г. Якутск
Программа
| Дата | Наименование |
| 30 июня | Прибытие и заезд участников, экспертов. Аккредитация. Тестирование системы «Прокторинг» |
| 1 июля | Установочный семинар, ознакомление с регламентом. Торжественная церемония открытия II Международных интеллектуальных игр (с трансляцией). |
| 2 июля | 1 тур Олимпиады |
| 3 июля | 2 тур Олимпиады. Проверка работ. |
| 4 июля | Проверка работ. Ранний отъезд участников. |
| 5 июля | Проверка работ. |
| 6 июля | Проверка работ. Апелляция. |
| 7 июля | Предварительные итоги. |
| 8 июля | Подведение итогов. |
| 9 июля | Торжественное закрытие II Международных интеллектуальных игр (с трансляцией). |
| 10 июля | Отъезд участников |
Новости
Об олимпиаде
Основными целями и задачами Олимпиады являются стимулирование развития интеллектуального потенциала школьников и молодежи, привлечение к занятию фундаментальными науками, расширение форм международного сотрудничества и общения.
Учредителем Олимпиады является Министерство образования и науки Республики Саха (Якутия).
Организаторами Олимпиады являются:
- Министерство образования и науки Республики Саха (Якутия)
- ГАУ ДО РС(Я) «Малая академия наук Республики Саха (Якутия)»
- ФГАУ ОУ ВО «Северо-Восточный федеральный университет имени М.К. Аммосова»
- АО РС(Я) ДПО «Институт развития образования и повышения квалификации им.С.Н.Донского-II»
- Региональный научно-образовательный математический центр «Дальневосточный центр математических исследований»
Партнеры олимпиады:
- НО «Целевой фонд будущих поколений РС(Я)»
- Детское издательство «Кэскил» им.
 Н.Е.Мординова-Амма Аччыгыйа
Н.Е.Мординова-Амма Аччыгыйа
В 2022 году олимпиада пройдет по четырем предметам «Математика», «Физика», «Информатика» и «Химия» в смешанном формате (очно — дистанционный), с применением средств удаленного контроля в системе Прокторинг.
Организаторы
Министерство образования и науки Республики Саха (Якутия)
Государственное автономное учреждение дополнительного образования Республики Саха (Якутия) «Малая академия наук Республики Саха (Якутия)
Федеральное государственное автономное образовательное учреждение высшего образования «Северо-Восточный федеральный университет имени М.К. Аммосова»
Автономное образовательное учреждение Республики Саха (Якутия) дополнительного профессионального образования «Институт развития образования и повышения квалификации им.С.Н.Донского II»
Документы
Все вопросы необходимо направить по электронной почте [email protected]
Форма для заявки — скачать здесь.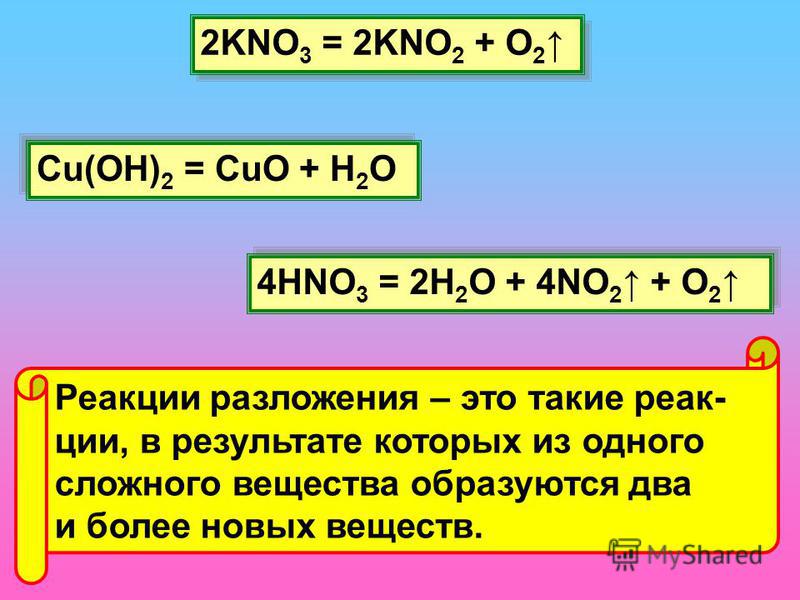
Положение международной олимпиады школьников «Туймаада» по математике, физике, химии, информатике
Регламент проведения Международной олимпиады школьников «Туймаада» по математике, физике, химии и информатике в рамках II Международных интеллектуальных игр
ПРОГРАММА Олимпиады по местному времени
ПРОГРАММА Олимпиады по Московскому времени
Технический регламент международной олимпиады школьников «Туймаада-2022»
Технический регламент олимпиады по физике
Технический регламент олимпиады по математике
Технический регламент олимпиады по информатике
Технический регламент олимпиады по химии
Инструкция по использованию системы видеонаблюдения (прокторинг) для участников МОШ «Туймаада-2022»
Фамилия, имя, отчество *
Химическое равновесие. Азот (продолжение). 9 класс
Похожие презентации:
Азот: кислородные соединения. Особенности химии фосфора и элементов его подгруппы
Химический элемент таблицы Менделеева — Азот
Оксиды азота
5-я группа элементов
Химия элементов VA группы (пниктогены или пникти́ды)
Оксиды. Химические свойства и получение оксидов
Химические свойства и получение оксидов
Кислоты. Химические свойства кислот
Оксиды азота (II и IV). Азотная кислота. Строение молекулы
Химическое равновесие. Азот и Фосфор. 9 класс
Соединения азота. Оксиды азота
Урок 9 класса
Химическое равновесие.
Азот (продолжение)
12.12.2016
7е занятие 2го триместра
Азот
Оксиды азота:
Степени окисления N в оксидах: +1, +2, +3, +4, +5.
N2O, NO — бесцветные газы.
NO2 — бурый газ или «лисий хвост».
N2O3, N2O5 – прозрачные кристаллы.
Азот +1
N2O – веселящий газ, закись азота, не солиобразующий.
Вызывает конвульсивный смех, в медицине используют для
ингаляционного наркоза.
Получение:
Nh5NO3 N2O + 2h3O
Me + HNO3 (разб) N2O + h3O + Mey(NO3)x
Свойства:
Может поддерживать горение серы, углерода, фосфора, за
счет свойств окислителя:
P4 + 10N2O = P4O10 + 10N2
2N2O=2N2 + O2
Азот +2
NO – несолеобразующий оксид азота, химические активен.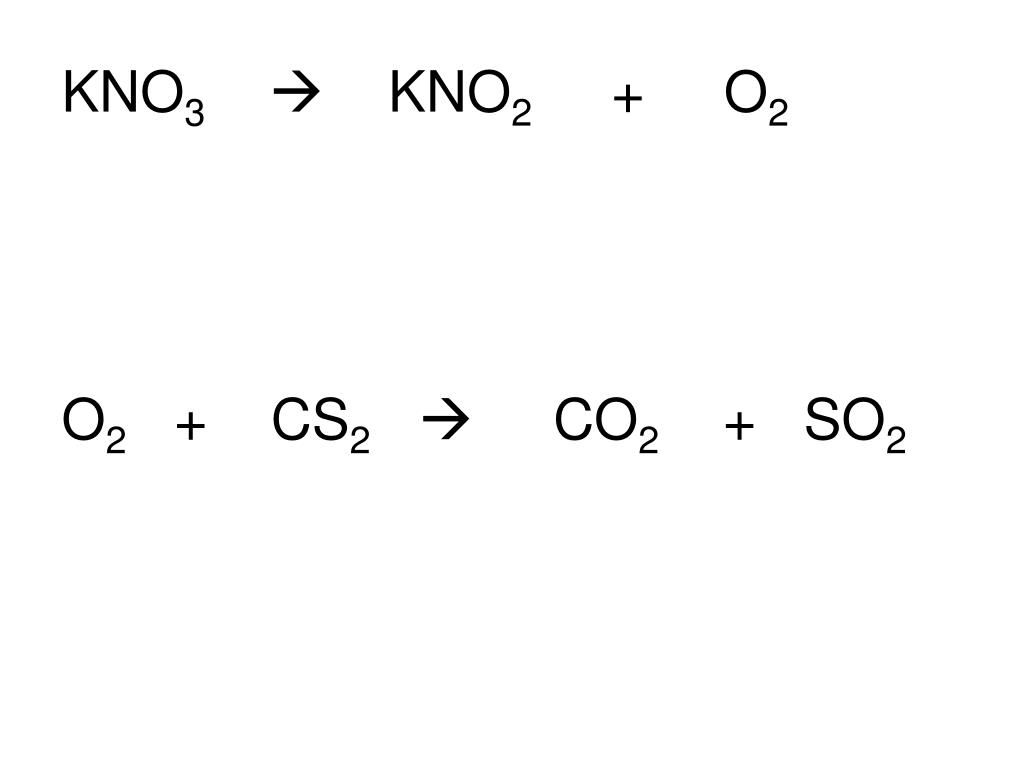
Получение:
N2 + O2 N2O + 2h3O
Me + HNO3 (50%) N2O + h3O + Mey(NO3)x
Свойства:
Окисляется на воздухе:
2NO + О2 = 2NО2
Азот +3
N2O3 – ангидрит азотистой кислоты.
Получение:
NО + NO2 N2O3
As2O3 + HNO3 (50%) NO2 + NO +2HAsO3
Мышьяковая к-та
Свойства:
Образует азотистую кислоту:
N2O3+ h3O = 2НNО2
И соответствующие соли:
2NaOH+N2O3= 2NaNO2+h3O
Применяется только в лабораторном синтезе.
Азот +4
NO2 – бурый газ.
Часто образует димеры: N2O4.
Получение:
Me + HNO3 (>50%) NO2 + h3O + Mey(NO3)x
Свойства:
Диспропорционирует:
2NO3+ h3O = НNО2 + НNО3
Или при нагревании:
3NO3+ h3O = 2НNО 3 + NО
Окислительно-восстановительаня функция
2NO2 + 2KOH KNO3 + KNO2 + h3O
Реакция используемая для получения азотной кислоты:
4NO2 + 2h3O + O2 4HNO3
Азот +5
HNO3 – азотная кислота, в чистом виде – жидкость с
удушливым запахом.
Может образовываться в грозу по реакции:
4NO2 + 2h3O + O2 4HNO3
Азотная кислота – одна из наиболее сильных кислот, а так

Азот +5
HNO3 – азотная кислота, в чистом виде – жидкость с
удушливым запахом.
Может образовываться в грозу по реакции:
4NO2 + 2h3O + O2 4HNO3
Азотная кислота – одна из наиболее сильных кислот, а так
же сильный окислитель.
Азот +5
Растворение золота в царской водке:
Au + HNO3 + 3HCl AuCl3 + NO + 2h3O
Если взять соляную кислоту в избытке:
Au + HNO3 + 4HCl H[AuCl4] + NO + 2h3O
Золотохлороводородная
кислота
Азот +3
HNO2 – азотистая кислота, крайне слабая. Существует
только в слабых растворах:
2HNO2 <-> NO + NO2 + h3O
Соли – нитриты.
Азотистая кислота имеет азот с промежуточной степенью
окисления:
Фосфор
Фосфор – важный для жизни элемент, он входит в состав
всех живых организмов.
Имеет множество аллотропных модификаций, самые
важные из них: белый, красный и черный фосфор.
Белый фосфор – Р4
Красный фосфор – Рn
Белый фосфор
Для белого фосфора характерна повышенная химическая
активность, при комнатной температуре:
Р4 + 5О2 P4O10 (ангидрид фосфорной кислоты)
При недостатке кислорода:
Р4 + 3О2 2Р2О3 (ангидрид двухосновной фосфористой
кислоты)
Реакции с галогенами:
Р4 + 6Сl2 4PCl3
Р4 + 10Сl2 4PCl5
Красный и черный фосфор участвуют в таких же реакциях,
но при большей температуре.

Фосфор
Фосфор реагирует с металлами, образуя фосфиды:
6Mg + P4 2Mg3P2
Mg3P2 + 6h3O 3Mg(OH)2 + 2Ph4
2AlP + 6HCl 2AlCl3 + 2Ph4
Получение фосфора.
Фосфор получают при восстановлении фосфата кальция в
электрической печи без доступа воздуха и в присутствии
SiO2, который вводят для связывания СаО:
Ca3(PO4) + 3SiO2 + 5C = 2P + 5CO + 3CaSiO3
Фосфор
Водородное соединение фосфора – фосфин Ph4.
чрезвычайно ядовитым газом.
Фосфин сильный восстановитель:
Ph4 + 2O2 h4PO4 / 4Nh4 + 3O2 =2N2 + 6h3O
Фосфор
Галогениды фосфора.
Они широко используются в органической химии, как
хлорирующие реагенты.
PCl3 + 3h3O h4PO4 + 3HCl
PCl5 + 4h3O h4PO4 + 5HCl
Фосфор
Фосфорный ангидрид – P2O5 или P4O10
Фосфористый ангидрид – P2O3 или P4O6.
Фосфор
Фосфорный ангидрид – P2O5 или P4O10
Фосфористый ангидрид – P2O3 или P4O6.
P4O6 + 6h3O Ph4 + 3h4PO4
P4O10 + h3O HPO3/h4PO4/h5P2O7
English Русский Правила
неорганическая химия — Что заставляет KNO3 разлагаться на KNO2 и кислород в порохе?
спросил
Изменено 4 года, 11 месяцев назад
Просмотрено 9к раз
$\begingroup$Я изучал фейерверки и насколько я понимаю:
$\ce{KNO3}$ разлагается с образованием газа $\ce{KNO2}$ и $\ce{O2}$, и этот свободный кислород реагирует с углеродом, реагируя с углеродом и серой с образованием $\ce{CO2} Газы $ и $\ce{SO2}$ в экзотермических реакциях.
Чего я не понимаю: что вызывает разложение $\ce{KNO3}$, какова цель использования $\ce{KNO3}$ в порохе?
- неорганическая химия
- окислительно-восстановительные
- взрывчатые вещества
$\endgroup$
1
$\begingroup$
KNO3 (нитрат калия) представляет собой молекулу, которая используется в пиротехнике и обычно смешивается с углеродом и серой в качестве топлива.
При термическом разложении нитрата калия образуется нитрит калия и кислород. $$\ce{2KNO3 -> 2KNO2 + O2}$$
По этой причине нитрат калия известен как окислитель (он обеспечивает реакцию кислородом). Затем этот свободный кислород вступает в реакцию с источниками топлива при сгорании, создавая экзотермическую реакцию. Углерод обычно является основным источником топлива, а сера добавляется для снижения температуры воспламенения, необходимой для начала сгорания углеродсодержащего топлива.
Если бы у вас была смесь нитрата калия и сахарозы (столового сахара), вы бы увидели что-то вроде этого: $$\ce{5C12h32O11 + 48KNO3 -> 24K2CO3 + 36CO2 + 55h3O +24N2}$$
Где вы можете увидеть, что происходит сгорание двух реагентов (после термического разложения нитрата калия он обеспечивает необходимый кислород для начала сгорания), в результате чего образуются продукты сгорания, углекислый газ и вода, а также побочные продукты газообразного азота и карбоната калия.
$\endgroup$
Зарегистрируйтесь или войдите в систему
Зарегистрируйтесь с помощью Google
Зарегистрироваться через Facebook
Зарегистрируйтесь, используя электронную почту и пароль
Опубликовать как гость
Электронная почта
Требуется, но никогда не отображается
Опубликовать как гость
Электронная почта
Требуется, но не отображается
Нажимая «Опубликовать свой ответ», вы соглашаетесь с нашими условиями обслуживания, политикой конфиденциальности и политикой использования файлов cookie
.
Использование мочи для производства нитрата калия « SurvivalSchool.com-Midwest Native Skills Institute
Моча — отличная штука; это отходы, которые не должны быть потрачены впустую. Хотя моча в основном состоит из воды (95%), она также содержит важные химические вещества, которые можно использовать для изготовления пороха и удобрений. Остальные химические вещества в моче:
- Мочевина (органическое соединение на основе азота)
- Хлорид
- Натрий
- Калий
- Креатинин
- Различные небольшие количества ионов и микроэлементов
В этом эксперименте мы сосредоточимся на калии, но можно использовать многие другие компоненты, даже воду. Этот эксперимент покажет вам, как получить нитрат калия или KNO3. K — это химический символ калия, N — азот, а O — кислород. Итак, вы видите, что нитрат калия представляет собой смесь этих трех элементов.
Получение нитрата калия
Калийная селитра является одним из основных ингредиентов пороха, поэтому при ШТФ знание того, как это сделать, вполне может пригодиться.
 Другими ингредиентами пороха являются сера и древесный уголь. Для производства нитрата калия традиционным способом требуется много навоза (для снабжения бактериями), много мочи (для снабжения калием) и около 10 месяцев для его просачивания.
Другими ингредиентами пороха являются сера и древесный уголь. Для производства нитрата калия традиционным способом требуется много навоза (для снабжения бактериями), много мочи (для снабжения калием) и около 10 месяцев для его просачивания.Как сделать нитрат калия:
- Соберите немного навоза в большой контейнер (требуется какой-либо способ слива жидкости, например, кран или забитое отверстие)
- Добавлять древесную золу в навоз
- Смешайте немного соломы (это помогает проветривать)
- Добавляйте мочу в большом количестве в смесь древесной золы со временем
- .Время от времени перемешивать
В конце процесса (около 10 месяцев) добавить достаточное количество воды и слить, собрав раствор
Что происходит?
Этап 1: Раствор нитрата калия
Мочевина и метаболизированный аммиак окисляются бактериями в навозе до нитрата, который реагирует с карбонатом калия (в древесной золе). Это образует смесь растворимого нитрата калия и нерастворимых карбонатов кальция и магния. Затем растворимый нитрат калия может быть извлечен из смеси в жидкости.
Это образует смесь растворимого нитрата калия и нерастворимых карбонатов кальция и магния. Затем растворимый нитрат калия может быть извлечен из смеси в жидкости.
Шаг 2: Кристаллизация нитрата калия
Чтобы получить твердую форму нитрата калия, используемую в порохе, вам необходимо кристаллизовать нитрат калия из раствора.
Для этого:
- Вскипятите ликер, полученный из смеси, с углем. Это удаляет цвет
- .Отфильтруйте уголь через ткань
- Теперь доведите жидкость до кипения, слегка кипя. Вы увидите, как жидкость уменьшится в объеме.
- Начинайте охлаждать, когда объем уменьшится примерно на ¾.
- Используя (в идеале) стеклянную палочку или длинный кусок стекла, погрузите его в раствор, вытащите и, когда он остынет, если вы увидите, что образуются белые кристаллы, вы знаете, что это насыщенный раствор
- .Охладите это как можно больше (окружите контейнер льдом, если он у вас есть)
- Профильтруйте насыщенный раствор через тонкую ткань, например марлю (или фильтровальную бумагу, если она у вас есть).


 Н.Е.Мординова-Амма Аччыгыйа
Н.Е.Мординова-Амма Аччыгыйа Другими ингредиентами пороха являются сера и древесный уголь. Для производства нитрата калия традиционным способом требуется много навоза (для снабжения бактериями), много мочи (для снабжения калием) и около 10 месяцев для его просачивания.
Другими ингредиентами пороха являются сера и древесный уголь. Для производства нитрата калия традиционным способом требуется много навоза (для снабжения бактериями), много мочи (для снабжения калием) и около 10 месяцев для его просачивания.