Молярность | Задача 1 — 3
Молярность (molarity) — способ выражения концентрации, показывающей количество растворенного вещества (n, моль) в единице объема раствора (1 литр). В отличие от массовой и мольной доли, молярность имеет единицы измерения. В случае использования в качестве меры объема литров, молярность измеряется в «моль/литр»1. Обозначается молярность — «См».
Для вычисления молярной концентрации раствора (молярности) используется формула:
Задача 1.
24 г чистой серной кислоты растворили в 85 г воды. Определить молярную концентрацию серной кислоты в полученном растворе, если его плотность составляет 1,155 г/мл.
Дано:
масса серной кислоты: m(Н2SО4) = 24 г;
масса воды: m(Н2О) = 85 г;
плотность раствора: рр-ра = 1,155 г/мл.
Найти:
молярную концентрацию серной кислоты в растворе.
Решение:
Для определения молярной концентрации необходимо вычислить количество (п, моль) растворенного вещества (Н2SО4) и объем раствора.
Схематично алгоритм решения можно представить следующим образом:
1. Определим количество вещества серной кислоты:
2. Определим объем раствора:
Объем, выраженный в других единицах, для определения молярной концентрации всегда необходимо переводить в литры.
Подставим в формулу для вычисления молярной концентрации полученные данные:
CМ = n(H2SO4)/V(p-pa) = 0,245/0,09437 = 2,6 моль/л.
Ответ: СМ(Н2SO4) = 2,6 моль/л.
Задача 2.
Определить массу гидроксида натрия в 700 г 14,ЗМ раствора NаОН в воде (рр-ра = 1,43 г/мл).
Дано:
масса раствора гидроксида натрия в воде : mр-ра = 700 г;
молярная концентрация гидроксида натрия в растворе: См(NаОН) = 14,3 моль/л,
плотность раствора: рр-ра= 1,43 г/мл.

Найти:
массу гидроксида натрия.
Решение:
Схематично алгоритм решения можно представить так:
1. Определим объем 700 г раствора
Обращайте, пожалуйста, внимание на согласованность единиц измерения величин, подставляемых в формулу. Если плотность выражена в г/мл или г/см3, то объем необходимо использовать в миллилитрах, а массу в граммах. Для использования молярной концентрации объем необходимо переводить в литры.
2. Используя соотношение для молярной концентрации, определим количество вещества NаОН в 0,4895 л раствора.
3. Определим массу 7 моль NаОН:
m(NaOH) = n(NaOH) . M(NaOH) = 7 .40 =280 г.
Ответ: m(NaOH) = 280 г.
Задача 3.
3 г поваренной соли (NаС1) растворили в 200 г воды. Определить молярную концентрацию полученного раствора.
Дано:
масса поваренной соли: m(NаС1) = 3 г;
масса воды: m(Н2О) = 200 г.
Найти:
молярную концентрацию поваренной соли в растворе.
Решение:
Схематично алгоритм решения можно представить следующим образом:
1 . Определяем количество вещества NаС1:
2. Для вычисления молярной концентрации необходимо знать объем раствора. Но по данным из условия задачи, возможно определить только его массу:
mр-ра = m(NаС1) + mН 2О) = 3 + 200 = 203 г.
3. Для нахождения объема раствора требуется плотность. При необходимости очень точного расчета можно воспользоваться справочником физико-химических величин. В случае решения обычной задачи разумно принять плотность разбавленного водного раствора равной плотности воды2.
Определим молярную концентрацию NаС1 в растворе:
Ответ: 0,24моль/л.
Комментарии:
1Иногда для сокращения записи после значения молярной концентрации вместо размерности записывают заглавную букву (М). Например, запись « 0.03М раствор NаОН в воде» следует понимать так: молярная концентрация NаОН в воде равна 0,03 моль/л.
Например, запись « 0.03М раствор NаОН в воде» следует понимать так: молярная концентрация NаОН в воде равна 0,03 моль/л.
2Справочное значение плотности данного раствора равно 1,009 г/мл.
Способы выражения концентраций
1 Что такое раствор
2 Способы выражения концентрации растворов
2.1 Молярная концентрация растворов (молярность)
2.2 Молярная концентрация эквивалента или нормальная концентрация растворов (нормальность).
2.3 Процентная концентрация раствора или массовая доля
2.4 Моляльная концентрация раствора
2.5 Титр раствора
2.6 Мольная или молярная доля
2.7 Пример перевода процентной концентрации в молярную, нормальную концентрацию, моляльность, титр
Существует множество способов измерить концентрацию раствора. Это так называемые способы выражения концентрации раствора.
Концентрация раствора — это количество вещества, находящегося в единице объема или массы раствора.
Что такое раствор
Среди окружающих нас веществ, лишь немногие представляют собой чистые вещества. Большинство являются смесями, состоящими из нескольких компонентов, которые могут находиться в одном или различных фазовых состояниях.
Смеси, имеющие однородный состав являются гомогенными, неоднородный состав – гетерогенными.
Иначе, гомогенные смеси, называют растворами, в которых одно вещество полностью растворяется в другом (растворителе). Растворитель – это тот компонент раствора, который при образовании раствора сохраняет свое фазовое состояние. Он обычно находится в наибольшем количестве.
Существуют растворы газовые, жидкие и твердые. Но более всего распространены жидкие растворы, поэтому, в данном разделе, именно на них мы сосредоточим свое внимание.
Концентрацию раствора можно охарактеризовать как:
- качественную
- количественную.

Качественная концентрация характеризуется такими понятиями, как разбавленный и концентрированный раствор.
С этой точки зрения растворы можно классифицировать на:
- Насыщенные – растворы с максимально возможным количеством растворенного вещества. Количество растворяемого вещества, необходимое для получения насыщенного раствора определяет растворимость этого вещества.
- Ненасыщенные – любые растворы, которые все еще могут растворять введенное вещество.
- Пересыщенные – растворы, в которых растворено больше вещества, чем максимально возможное. Такие растворы очень нестабильны и в определенных условиях растворенное вещество будет выкристаллизовываться из него, до тех пор, пока не образуется насыщенный раствор.
Количественная концентрация выражается через молярную, нормальную (молярную концентрацию эквивалента), процентную, моляльную концентрации, титр и мольную долю.
Способы выражения концентрации растворов
Молярная концентрация растворов (молярность)
Наиболее распространенный способ выражения концентрации растворов – молярная концентрация или молярность. Она определяется как количество молей n растворенного вещества в одном литре раствора V. Единица измерения молярной концентрации моль/л или моль ·л-1:
См = n/V
Раствор называют молярным или одномолярным, если в 1 литре раствора растворено 1 моль вещества, децимолярным – растворено 0,1 моля вещества, сантимолярным — растворено 0,01 моля вещества, миллимолярным — растворено 0,001 моля вещества.
Термин «молярная концентрация» распространяется на любой вид частиц.
Вместо обозначения единицы измерения — моль/л, возможно такое ее обозначение – М, например, 0,2 М HCl.
Молярная концентрация эквивалента или нормальная концентрация растворов (нормальность).

Понятие эквивалентности мы уже вводили. Напомним, что эквивалент – это условная частица, которая равноценна по химическому действию одному иону водорода в кислотоно-основных реакциях или одному электрону в окислительно – восстановительных реакциях.
Например, эквивалент KMnO4 в окислительно – восстановительной реакции в кислой среде равен 1/5 (KMnO4).
Еще одно необходимое понятие — фактор эквивалентности – это число, обозначающее, какая доля условной частицы реагирует с 1 ионом водорода в данной кислотоно-основной реакции или с одним электроном в данной окислительно – восстановительной реакции.
Он может быть равен 1 или быть меньше 1. Фактор эквивалентности, например, для KMnO4 в окислительно – восстановительной реакции в кислой среде составляет fэкв(KMnO4) = 1/5.
Следующее понятие – молярная масса эквивалента вещества х. Это масса 1 моля эквивалента этого вещества, равная произведению фактора эквивалентности на молярную массу вещества х:
Мэ = fэкв· М(х)
Молярная концентрация эквивалента (нормальность) определяется числом молярных масс эквивалентов на 1 литр раствора.
Эквивалент определяется в соответствии с типом рассматриваемой реакции. Единица измерения нормальной концентрации такая же как и у молярной концентрации — моль/л или моль·л-1
Сн = nэ/V
Для обозначения нормальной концентрации допускается сокращение «н» вместо «моль/л».
Процентная концентрация раствора или массовая доля
Массовая концентрация показывает сколько единиц массы растворенного вещества содержится в 100 единицах массы раствора.
Это отношение массы m(х) вещества x к общей массе m раствора или смеси веществ:
ω(х) = m(х)/m
Массовую долю выражают в долях от единицы или процентах.
Моляльная концентрация раствора
Моляльная концентрация раствора b(x) показывает количество молей n растворенного вещества х в 1 кг. растворителя m. Единица измерения моляльной концентрации — моль/кг :
b(x) = n(x)/m
Титр раствора
Титр раствора показывает массу растворенного вещества х, содержащуюся в 1 мл. раствора. Единица измерения титра — г/мл:
раствора. Единица измерения титра — г/мл:
Т(х) = m(х)/V,
Мольная или молярная доля
Мольная или молярная доля α(х) вещества х в растворе равна отношению количества данного вещества n(х) к общему количеству всех веществ, содержащихся в растворе Σn:
α(х) = n(х)/Σn
Между приведенными способами выражения концентраций существует взаимосвязь, которая позволяет, зная одну единицу измерения концентрации найти (пересчитать) ее в другие единицы. Существуют формулы, позволяющие провести такой пересчет, которые, в случае необходимости, вы сможете найти в сети. В разделе задач показано, как произвести такой пересчет, не зная формул.
Пример перевода процентной концентрации в молярную, нормальную концентрацию, моляльность, титр
Дан раствор объемом 2 л с массовой долей FeSO
Решение.
1. Рассчитать молярную массу FeSO4:
M (FeSO4) = 56+32+16·4 = 152 г/моль
2. Рассчитать молярную массу эквивалента:
Мэ = fэкв· М(FeSO4) = 1/2·152 = 76 г/моль
3. Найдем m раствора объемом 2 л
m = V·ρ = 2·10-3 ·1029 = 2,06 кг
4. Найдем массу 2 % раствора по формуле:
m(FeSO4) = ω(FeSO4) · mр-ра
m(FeSO4) = 0,02·2,06 = 0,0412 кг = 41,2 г
5. Найдем молярность
, которая определяется как количество молей растворенного вещества в одном литре раствора:n = m/М
n = 41,2/152 = 0,27 моль
См = n/V
См = 0,27/2 = 0,135 моль/л
6. Найдем нормальность:
Найдем нормальность:
nэ = m/Мэ
nэ = 41,2/76 = 0,54 моль
Сн = nэ/V
Сн = 0,54/2 = 0,27 моль/л
7. Найдем моляльность раствора. Моляльная концентрация равна:
b (x) = n(x)/m
Масса растворителя, т.е. воды в растворе равна:
mh3O = 2,06-0,0412 = 2,02 кг
b (FeSO4) = n(FeSO4)/m = 0,27/2,02 = 0,13 моль/кг
8. Найдем титр раствора, который показывает какая масса вещества содержится в 1 мл раствора:
Т(х) = m (х)/V
Т(FeSO4) = m (FeSO4)/V = 41,2/2000 = 0,0021 г/мл
Еще больше задач приведены в разделе Задачи: Концентрация растворов, Правило креста
Категории ОБЩАЯ ХИМИЯ, РастворыОбъяснение урока: Молярные концентрации | Nagwa
В этом объяснителе мы узнаем, как рассчитать молярную концентрацию
раствора от объема и массы растворителя или
моль растворенного
растворенный.
Растворы часто используются в химической лаборатории. Решение – это гомогенная смесь, состоящая из одного или нескольких растворенных веществ, растворенных в растворителе. На рисунке ниже показаны четыре раствора красного красителя в воде.
При визуальном осмотре растворов мы можем сказать, что наибольшее количество красителя было растворено в крайнем левом растворе, и наименьшее количество красителя было растворяется в крайнем правом растворе. Можно сказать, что самое левое решение концентрированный, содержащий большое количество растворенного вещества, и самый правый раствор разбавленный, содержащий небольшое количество растворенного вещества. Условия концентрированный и разбавленный являются качественными и не указывают фактическое количество растворенного вещества, присутствующего в решение.
Существует множество способов выразить количественное количество растворенного вещества в
решение. Концентрация раствора показывает количество химического вещества.
Одним из часто рассчитываемых типов концентрации является молярная концентрация, также называемая молярностью или количественной концентрацией. Молярность раствор представляет собой отношение моль растворенного вещества на литр раствора. Моляр концентрацию иногда называют просто концентрацией, хотя термин концентрация может относиться к другим величинам.
Определение: Молярность
Молярность – это число моли растворенного вещества на литр раствора. Молярность также называется молярной концентрацией.
Молярность можно рассчитать по уравнению
𝑐=𝑛𝑉
или
𝑛=𝑐𝑉,
где 𝑐 —
молярная концентрация, 𝑛 –
количество молей
растворенного вещества, а 𝑉 — общий объем раствора.
Уравнение: Молярность (c)
Для определения молярности раствора можно использовать следующее уравнение: 𝑛=𝑐𝑉, где 𝑛 — количество растворенного вещества в родинки, 𝑐 — молярная концентрация обычно в моль на литр (моль/л) и 𝑉 — объем раствора, обычно литров.
Пример 1: Расчет молярной концентрации из Родинки и Объем
0,80-литровый раствор содержит 0,40 моль уксусной кислоты. Что моляр концентрация уксусной кислоты в этом растворе?
Ответ
Молярная концентрация – это особый тип концентрации, определяемый как
количество молей
растворенного вещества на литр раствора. Его можно рассчитать
используя уравнение молярности
𝑛=𝑐𝑉,
где 𝑛 — количество растворенного вещества в
родинки,
𝑐 это
молярная концентрация в
моль на литр,
𝑉 — объем раствора в
литров.
Мы можем заменить количество уксусной кислоты в родинки и объем решение в литров в уравнение, 0,40=𝑐⋅0,80,мольл и переставить, чтобы решить для молярная концентрация: 0,400,80=𝑐0,5/=𝑐.моль/моль/л
Единицы моль/л и M может использоваться взаимозаменяемо при сообщении молярная концентрация. Молярная концентрация уксусной кислоты в раствор 0,5 моль/л или 0,5 М.
При использовании уравнения молярности может потребоваться преобразование между массой и моли или между различными единицами объема. Мы можем преобразовать между массой и родинки используя следующее уравнение: 𝑛=𝑚𝑀, где 𝑛 количество в молях, 𝑚 масса в грамм, а 𝑀 — это моляр масса в граммах на моль.
Для преобразования между различными единицами объема важно распознавать следующие отношения: 1000=1=1=1000.mLLdmcm
Пример 2: Расчет концентрации в Грамм на кубический дециметр из массы и объема
Студент растворяет
25 г
MgCl2 в воду, чтобы получить раствор объемом
500 см 3 .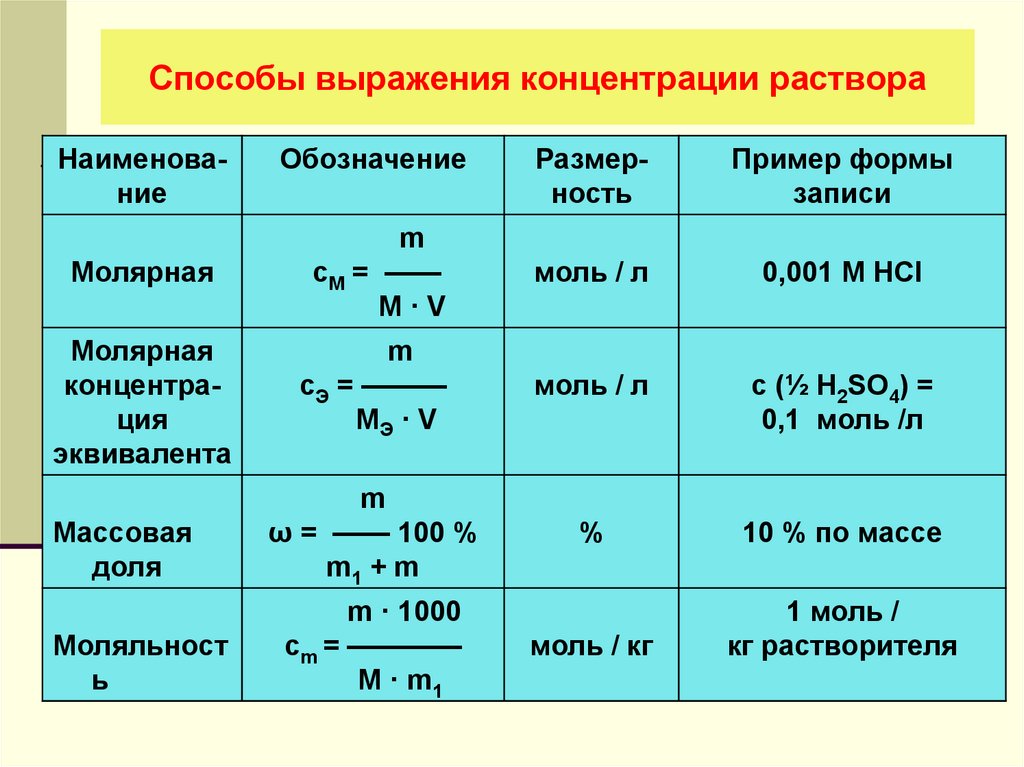 Какова концентрация раствора в
моль на кубический дециметр? Дайте ответ с точностью до 2 знаков после запятой. [Mg = 24 г/моль,
Cl = 35,5 г/моль]
Какова концентрация раствора в
моль на кубический дециметр? Дайте ответ с точностью до 2 знаков после запятой. [Mg = 24 г/моль,
Cl = 35,5 г/моль]
Ответ
Концентрация раствора или молярная концентрация представляет собой отношение количество растворенного вещества в моль на объем раствора, и его можно рассчитать по следующему уравнению: 𝑐=𝑛𝑉, где 𝑐 — молярная концентрация, 𝑛 это количество растворенного вещества в родинки и 𝑉 – объем раствора.
Количество MgCl2, растворенного вещества, указано в грамм, но должен превратиться в моли. Мы можем выполнить это преобразование, используя следующее уравнение: 𝑛=𝑚𝑀, где 𝑛 — количество в родинки, 𝑚 — масса в граммах, а 𝑀 это молярная масса в грамм на моль.
Молярная масса
MgCl2 можно рассчитать, просуммировав среднее
молярные массы составляющих атомов:
𝑀=𝑀+(2×𝑀)𝑀=24/+(2×35,5/)𝑀=95/. (MgCl)(Mg)Cl(MgCl)(MgCl)222gmolgmolgmol
(MgCl)(Mg)Cl(MgCl)(MgCl)222gmolgmolgmol
Масса, указанная в вопросе и молярную массу можно подставить в уравнение 𝑛=2595/гмоль определить количество MgCl2 в родинки быть 𝑛=0,26316….моль
Объем указан в кубических сантиметрах, но вопрос требует концентрация в моль на кубический дециметр. Это означает, что объем в кубических сантиметрах необходимо перевести в кубических дециметров. Есть 1 000 кубических сантиметров на кубический дециметр. Мы можем умножить объем в кубических сантиметрах на один кубический дециметр за 1 см3, 500×11000, смдмсм определить объем в кубических дециметрах 0,5 дм
Затем мы можем подставить количество MgCl2 в
родинки и
объем раствора в кубических дециметрах
в уравнение молярности,
𝑐=0,263160,5, молдм
и рассчитать концентрацию раствора
0,52632… моль/дм 3 . Округление нашего ответа до 2 знаков после запятой дает нам концентрацию
0,53 моль/дм 3 .
Округление нашего ответа до 2 знаков после запятой дает нам концентрацию
0,53 моль/дм 3 .
Пример 3. Расчет массы растворенного вещества, необходимого для приготовления раствора желаемой концентрации и объема
Студент хочет подготовить 0,1 М раствор нитрат серебра (AgNO3) в объемном колба, вмещающая 100 мл воды. Сколько нитрата серебра нужно растворить студенту? Дайте ответ с точностью до 1 знака после запятой. [N = 14 г/моль, О = 16 г/моль, Ag = 108 г/моль]
Ответ
Моляр (М) — единица молярной концентрации и может использоваться вместо моль на литр (Молл). Уравнение для молярной концентрации: 𝑛=𝑐𝑉, где 𝑛 — количество растворенного вещества в родинки, 𝑐 — молярная концентрация обычно в моль на литр, а 𝑉 — объем раствора, обычно литров.
Этот вопрос требует от нас определить количество (𝑛) нитрата серебра,
растворенное вещество. Указаны молярная концентрация и объем раствора. Тем не менее, объем должен быть преобразован в
литров, прежде чем это может быть
подставить в уравнение.
Указаны молярная концентрация и объем раствора. Тем не менее, объем должен быть преобразован в
литров, прежде чем это может быть
подставить в уравнение.
В одном 1 000 миллилитров литр. Мы можем умножить объем в миллилитрах на единицу. литр на 1 000 миллилитров, 100×11000=𝑉, млLмл определить объем в литрах 0,1 л
Затем мы можем заменить концентрацию раствора и объем решение в литров в уравнение концентрации, 𝑛=0,1/⋅0,1,мольLL определить необходимое количество азотнокислого серебра. 𝑛=0,01.моль
Студент не может измерить
моль вещества в
лаборатория. Таким образом, нам нужно будет преобразовать количество серебра
нитрат в
родинки
грамм. Можно использовать следующее уравнение:
𝑛=𝑚𝑀,
где 𝑛 количество в молях,
𝑚 — масса в граммах,
и 𝑀 это
молярная масса в
грамм на моль.
Молярная масса нитрата серебра может быть рассчитывается путем суммирования среднего молярные массы составляющих атомов: 𝑀=𝑀+𝑀+(3×𝑀)𝑀=108/+14/+(3×16/)𝑀=170/.(AgNO)(Ag)(N)(O)(AgNO)(AgNO)333гмолгмолгмолгмоль
Затем мы можем подставить сумму в родинки и молярную массу в уравнение 0,01=𝑚170/мольгмоль и переставить, чтобы найти массу нитрата серебра в грамм: 170/×0,01=𝑚1,7=𝑚.gmolmolg
Студент должен будет раствориться 1,7 грамма нитрат серебра для производства 100 мл 0,1 М раствор нитрат серебра.
Как и молярная концентрация, мы также можем выразить состав раствора как массовая концентрация, где 𝑛 в уравнениях 𝑐=𝑛𝑉 и 𝑛=𝑐𝑉 представляет собой количество растворенного вещества в грамм вместо родинки.
Пример 4: Расчет массы на объем из Моли на объем
Какова массовая концентрация хлороводорода в
2,0 М соляная
кислота? Дайте ответ до ближайшего целого числа. [H = 1 г/моль,
Cl = 35,5 г/моль]
[H = 1 г/моль,
Cl = 35,5 г/моль]
Ответ
Молярный (М) — единица молярной концентрации и может использоваться вместо моль на литр (Молл). Уравнение для молярная концентрация может быть выражена как 𝑐=𝑛𝑉, где 𝑛 — количество растворенного вещества в родинки, 𝑐 – молярная концентрация в моль на литр, 𝑉 — объем раствора в литров.
Если молярная концентрация раствора 2,0 моль/л, мы можем выразить эту концентрацию в виде следующей дроби: 𝑐=2.01.molL
Это говорит нам о том, что мы можем считать 𝑛 равным 2,0 моля и 𝑉 будет 1 литр.
Вопрос просит нас определить массовую концентрацию водорода хлорида (HCl) в этом растворе. Уравнение для массовой концентрации то же, что и уравнение для молярной концентрации, за исключением 𝑛 должно быть в граммах.
Мы можем преобразовать 2,0 моля хлороводорода в
грамм водорода
хлорида по следующему уравнению:
𝑛=𝑚𝑀,
где 𝑛 — количество в
родинки,
𝑚 — масса в граммах,
а 𝑀 – молярная масса в
грамм на моль.
Молярная масса водорода хлорид может быть рассчитан путем суммирования среднего молярные массы составляющих атомов: 𝑀=𝑀+𝑀𝑀=1/+35,5/𝑀=36,5/.(HCl)(H)(Cl)(HCl)(HCl)гмольгмольгмоль
Затем мы можем подставить количество хлористого водорода в родинки и молярную массу в уравнение 2,0=𝑚36,5/мольгмоль и переставить, чтобы найти массу хлористого водорода: 36,5/×2,0=𝑚73=𝑚.гмольмольг
Масса хлористого водорода в каждом литр раствора это 73 грамма. Мы можем подставьте количество в граммах и объем 1 литр в уравнение концентрации, 𝑐=731,гЛ определить массовую концентрацию раствора, 𝑐=73/.gL
Массовая концентрация хлороводорода в 2,0 М соляная кислота 73 г/л.
Изменение количества растворенного вещества, объема растворителя или общего объема раствора
изменит концентрацию. Рассмотрим раствор глюкозы
(CHO6126) в воде.
Если к этому раствору добавить больше глюкозы, но общий объем останется постоянным, растворенного вещества будет больше в том же объеме, что и исходный решение. Таким образом, концентрация увеличится.
Мы также можем увидеть этот эффект, взглянув на уравнение концентрации: 𝑐=𝑛𝑉.
Добавление большего количества растворенного вещества увеличит значение 𝑛. В уравнение, увеличение значения числителя увеличит результирующее отвечать. Таким образом, увеличение количества растворенного вещества в растворе приведет к увеличению концентрация.
Теперь давайте рассмотрим, что произойдет, если к исходному раствору добавить больше воды. решение. Количество молекул глюкозы останется прежним, но молекулы будут распределяться по большему общему объему. Таким образом, концентрация уменьшится.
Мы также можем увидеть этот эффект, взглянув на уравнение концентрации: 𝑐=𝑛𝑉.
Добавление большего количества растворителя увеличит общий объем раствора, 𝑉. В
уравнения, увеличение значения знаменателя приведет к уменьшению результирующего
отвечать. Таким образом, увеличение количества растворителя в растворе приведет к уменьшению
концентрация.
В
уравнения, увеличение значения знаменателя приведет к уменьшению результирующего
отвечать. Таким образом, увеличение количества растворителя в растворе приведет к уменьшению
концентрация.
Пример 5. Определение влияния увеличения концентрации растворенного вещества и растворителя на концентрацию раствора
1 М раствор CuSO4 получают растворением 159,5 г CuSO4 в воде для получения 1 литр решения. [O = 16 г/моль, S = 32 г/моль, Cu = 63,5 г/моль]
- Что произойдет с концентрацией, если количество воды
увеличился настолько, что общий объем раствора увеличился вдвое?
- Концентрация останется прежней.
- Концентрация удвоится.
- Концентрация уменьшится вдвое.
- Что произойдет с концентрацией, если количество
CuSO4 используется для
приготовление раствора было удвоено?
- Концентрация останется прежней.

- Концентрация уменьшится вдвое.
- Концентрация удвоится.
- Концентрация останется прежней.
Ответ
Часть 1
В этом растворе растворителем является вода. При увеличении количества растворителя частицы растворенного вещества смогут распространяться дальше. Меньше растворенных частиц в том же объеме указывает на то, что концентрация уменьшится. Мы можем количественно подтверждают это предположение.
Коренной зуб (М) — единица молярной концентрации и может использоваться вместо моль на литр (Молл). Уравнение для молярной концентрации может быть выражено как 𝑐=𝑛𝑉, где 𝑐 — молярная концентрация обычно в моль на литр, 𝑛 — количество растворенного вещества в молях, а 𝑉 — объем раствора обычно в литров. Количество растворенное вещество CuSO4 указывается в граммах, но его необходимо преобразовать в родинки.
Мы можем превратить 159,5 г сульфата меди(II) в
родинки через следующие
уравнение:
𝑛=𝑚𝑀,
где 𝑛 количество в молях,
𝑚 — масса в граммах,
и 𝑀 это
молярная масса в граммах на моль.
Молярная масса сульфата меди(II) может быть рассчитана путем суммирования среднего молярные массы составляющих атомов: 𝑀=𝑀+𝑀+(4×𝑀)𝑀=63,5/+32/+(4×16/)𝑀=159,5/.(CuSO)(Cu)(S)(O)(CuSO)(CuSO)444гмольгмолгмолгмоль
Тогда мы можем подставить массу сульфата меди(II) и молярная масса в уравнение 𝑛=159,5159,5/ггмоль и найти количество сульфата меди(II) в родинки: 𝑛=1.mol
Общий объем раствора удвоился по сравнению с от 1 литра до 2 литра. Мы можем заменить количество растворенного вещества в родинки и новый объем раствора в уравнение концентрации, 𝑐=12,мольл определить новую концентрацию раствора, 𝑐=0,5/моль
Исходная концентрация была 1 М. Добавляя добавление воды и удвоение общего объема раствора, концентрация уменьшилась вдвое до 0,5 М. Правильный ответ ответ выбор C.
Часть 2
CuSO4 является растворенным веществом в этом растворе. Удвоив растворенное вещество,
в новом растворе будет в два раза больше растворенных частиц
как было в исходном решении. Это соответствует
увеличение концентрации. Мы можем количественно подтвердить это
предположение.
Удвоив растворенное вещество,
в новом растворе будет в два раза больше растворенных частиц
как было в исходном решении. Это соответствует
увеличение концентрации. Мы можем количественно подтвердить это
предположение.
Мы снова воспользуемся уравнением 𝑐=𝑛𝑉.
Общий объем раствора все равно будет 1 литр. Однако, масса растворенного в растворе сульфата меди(II) равна удвоился до 319 граммов. Мы можем превратить 319 граммов сульфата меди(II) в родинки через следующее уравнение: 𝑛=𝑚𝑀, где 𝑛 — количество в родинки, 𝑚 — масса в граммах, а 𝑀 это молярная масса в грамм на моль. Молярная масса сульфата меди (II) равна 1590,5 г/моль в виде рассчитано в части 1.
Можно заменить массу сульфата меди(II) и
молярная масса в уравнение
𝑛=319159,5/ггмоль
и найти количество сульфата меди(II) в
родинки:
𝑛=2.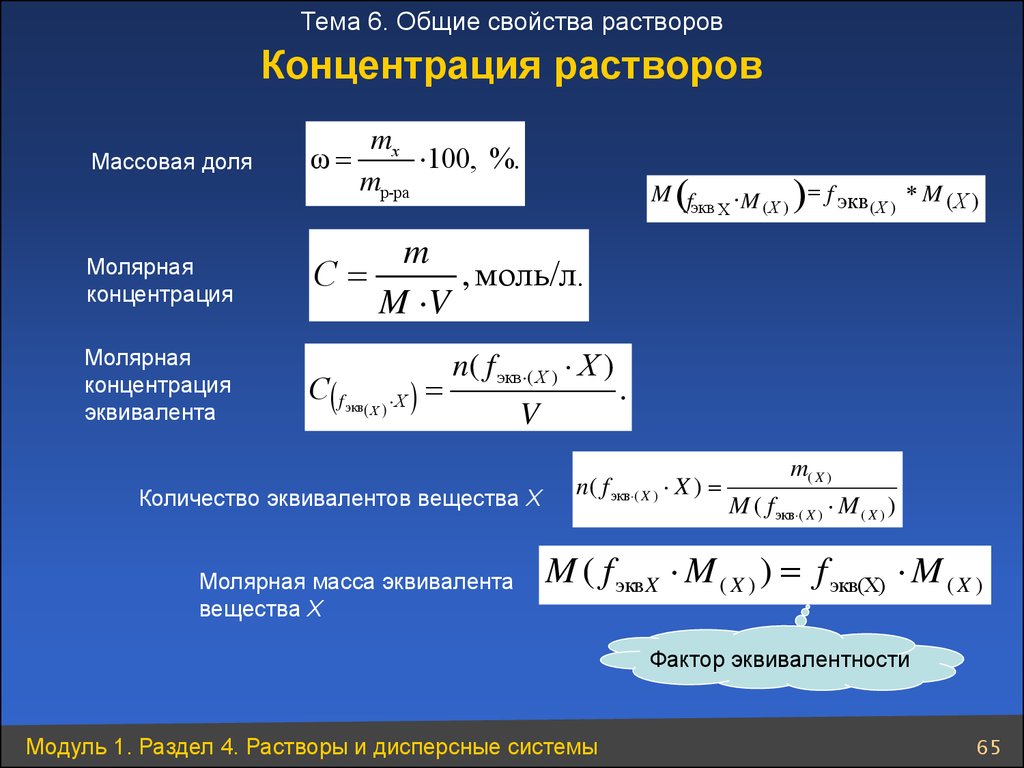 mol
mol
Затем мы можем подставить новое количество растворенного вещества в родинки и объем раствора в уравнение концентрации, 𝑐=21,мольл определить новую концентрацию раствора, 𝑐=2/.моль
Исходная концентрация составляла 1 М. При удвоении растворенного вещества концентрация удваивалась до 2 M. Правильный ответ – вариант ответа C.
Молярная концентрация чаще всего используется в химии лаборатория. Однако, когда мы хотим узнать состав решение, в котором задействованы изменения температуры, мы не можем использовать молярность. Вместо этого мы сообщаем состав, используя моляльность (𝑚). Моляльность раствора – это отношение родинки растворенного вещества на килограмм растворителя.
Определение: моляльность (𝑚)
моляльность – это число родинки растворенного вещества на килограмм растворителя.
Уравнение: моляльность (𝑚)
Для определения моляльности раствора можно использовать следующее уравнение:
𝑚=𝑛,м
где 𝑚 — моляльность, 𝑛 —
количество растворенного вещества в
родинки,
m – масса растворителя в
килограммы.
Поскольку моляльность рассчитывается путем деления количества растворенного вещества на родинки масса растворителя в килограммах, поэтому единица моляльности будет моль/кг, моль⋅кг −1 , или просто 𝑚, читается как «моляль».
Мы можем рассчитать моляльность раствора, полученного путем растворения 28 г калия гидроксид (KOH) в 250 г воды. Моляльность раствора можно рассчитать, используя 𝑚=𝑛,м где 𝑚 — моляльность, 𝑛 — количество растворенного вещества в родинки, m – масса растворителя в килограммы.
Сначала нам нужно рассчитать количество молей гидроксида калия, используя уравнение 𝑛=𝑚𝑀, где 𝑛 — количество в родинки, 𝑚 — масса в граммах, а 𝑀 это молярная масса в грамм на моль.
Молярная масса гидроксида калия может быть рассчитана путем суммирования
средние молярные массы составляющих атомов:
𝑀=𝑀+𝑀+𝑀𝑀=39/+16/+1/𝑀=56/. (KOH)(K)(O)(H)(KOH)(KOH)gmolgmolgmolgmol
(KOH)(K)(O)(H)(KOH)(KOH)gmolgmolgmolgmol
Затем мы можем заменить массу калия гидроксид и молярная масса в уравнение 𝑛=2856/гмоль и найти количество гидроксида калия в родинки: 𝑛=0.5.mol
Далее нам нужна масса растворителя, не забывая переводить единицы измерения в килограммы: 250×11000=0,25.гкгггкг
Теперь мы можем рассчитать моляльность раствора: 𝑚=𝑛𝑚=0,50,25 ммолькг
Таким образом, моляльность раствора равна 2 моль/кг.
Ключевые моменты
- Концентрация раствора – это отношение количества компонента на количество раствора.
- Молярная концентрация – это отношение количества растворенного вещества в родинки на объем раствора в литрах.
- Уравнение для молярной концентрации: 𝑛=𝑐𝑉, где 𝑛 — количество растворенного вещества в моли, 𝑐 — молярная концентрация, а 𝑉 — объем раствора в литрах.
- Мы можем преобразовать единицы объема, используя следующие
отношения:
1000=1=1=1000.
 mLLdmcm
mLLdmcm - Увеличение количества растворенного вещества увеличивает концентрацию, при увеличении количества растворителя снижается концентрация.
- Моляльность (𝑚) определяется как количество родинки растворенного вещества на килограмм растворителя, и он используется для представления состав раствора при изменении температуры.
Как найти молярную концентрацию
Обновлено 04 марта 2020 г.
Автор: Riti Gupta
Умение рассчитать концентрацию раствора является одним из основных навыков, необходимых ученому. Не зная, с каким количеством вещества вы работаете, вы не можете контролировать реакции, которые вы проводите.
Концентрация раствора: определение
Концентрация раствора в основном выражается в молярности или молях на литр. Сокращение для молярности M и единицами концентрации являются моль/л .
Определение молярности означает, что вы можете найти молярность раствора, если знаете общее число молей растворенного вещества и общий объем раствора. Итак, чтобы рассчитать концентрацию раствора (в молярности), нужно моль растворенного вещества разделить на общий объем.
Формула концентрации: Чтобы найти молярную концентрацию раствора, просто разделите общее количество молей растворенного вещества на общий объем раствора в литрах.
Расчет молярной концентрации раствора
Допустим, у вас есть 10 моль NaCl, а общий объем раствора равен 5 л. Чтобы найти молярность этого раствора, вам нужно разделить общее количество молей растворенного вещества (NaCl ) по общему объему:
Это означает, что ваш 5-литровый раствор, содержащий 10 молей NaCl, представляет собой 2-молярный раствор NaCl. Здесь «М» произносится вслух как «моляр».
Что делать, если у вас есть раствор, содержащий 10 грамм NaCl в 5 л раствора?
Чтобы найти концентрацию этого нового раствора, вам нужно перевести граммы в моли . Это требует использования молярной массы (данной в граммах/моль) NaCl. Молярная масса вещества находится путем сложения молярных масс отдельных компонентов. Для NaCl двумя компонентами являются натрий и хлорид.
Это требует использования молярной массы (данной в граммах/моль) NaCl. Молярная масса вещества находится путем сложения молярных масс отдельных компонентов. Для NaCl двумя компонентами являются натрий и хлорид.
Чтобы найти молярную массу любого из них, вам нужно посмотреть под их символами в периодической таблице. Молярная масса натрия 22,99 г/моль, а молярная масса хлора 35,45 г/моль. В сумме это дает молярную массу NaCl, которая составляет 58,44 г/моль.
Теперь вы можете найти концентрацию 5-литрового раствора, содержащего 10 граммов NaCl.
Начните с преобразования граммов в моли:
Затем вам нужно разделить количество молей на общий объем, чтобы найти концентрацию:
Это означает, что если у вас есть 10 граммов NaCl в 5 л раствора, вы есть 0,034 М раствор NaCl.
Что делать, если у вас есть раствор, содержащий 1000 миллиграммов NaCl в 5 л раствора?
В этом случае нужно сначала перевести миллиграммы в граммы. В 1 грамме 1000 миллиграммов.




 mLLdmcm
mLLdmcm