«Как определить число нейтронов?» — Яндекс Кью
ПопулярноеСообщества
Домашние заданияЗадания по химииНейтроны
Анонимный вопрос
·
284,7 K
Ответить1УточнитьИлья Лаврёнов
272
Популяризатор науки, знаток химии и биологии, ценитель искусства. Меланхолик. Изучаю… · 10 нояб 2020 ·
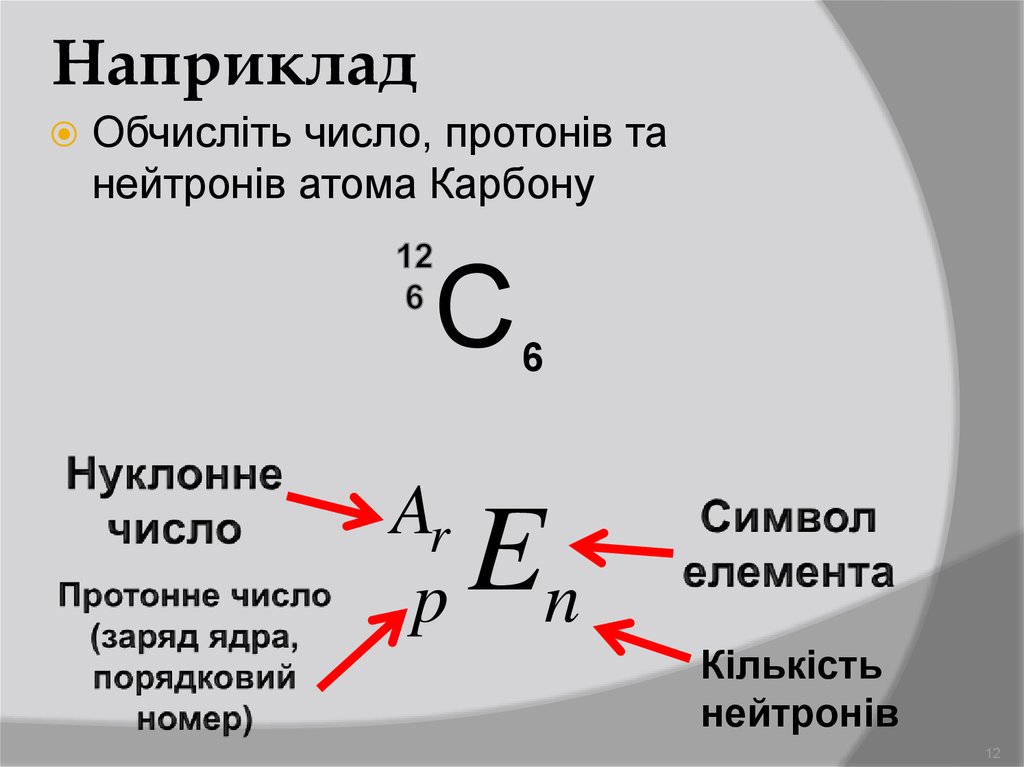
Число нейтронов определяется по формуле
N = A – Z, где N — кол-во нейтронов, A — атомная масса элемента, Z — кол-во протонов. Нейтроны и протоны составляют ядро, а масса электронов (e) не учитывается из-за ничтожного значения. Так, мы должны выяснить массу нейтронов, а она равна их количеству, так как масса частиц ядра равна 1.
Важно: масса не имеет единиц измерения.
Протоны и нейтроны имеют постоянную массу, но количество нейтронов может изменяться в зависимости от изотопа. В таких случаях меняется масса атома. Для атомов водорода такие изменения наиболее значимы, поэтому разделяется три изотопа: H, D, T — протий, дейтерий и тритий.
29,1 K
Вячеслав Домбровский
13 мая 2021
> Важно: масса не имеет единиц измерения. Это неверно. Масса вполне измеряется в граммах или их производными, но в… Читать дальше
Комментировать ответ…Комментировать…
Григорий Партин
95
Химик. · 4 апр 2019
Как известно, атом любого химического элемента состоит из положительно заряженного ядра и отрицательно заряженных электронов. Ядро атома в свою очередь состоит из положительно заряженных протонов и имеющих нулевой заряд нейтронов.
133,3 K
Виктория Клягинчева
1 сентября 2019
А откуда электроны в ядре атома?
Комментировать ответ…Комментировать…
Первый
Александр Лебедев
6
Студент биологического факультета, активист молодежной общественной организации · 27 сент 2021
Число нейтронов = массовое число (атомная масса) — число протонов (число электронов). В таблице Менделеева число протонов определяется по заряда ядра, т.е. по номеру элемента
1 эксперт согласен
Комментировать ответ…Комментировать…
Слава Динозавров
14
ОПИСАНИЕ ПРОФИЛЯ · 3 февр 2021
рядом с символом элемента указывается не атомная масса изотопа а средняя масса изотопов по элементу.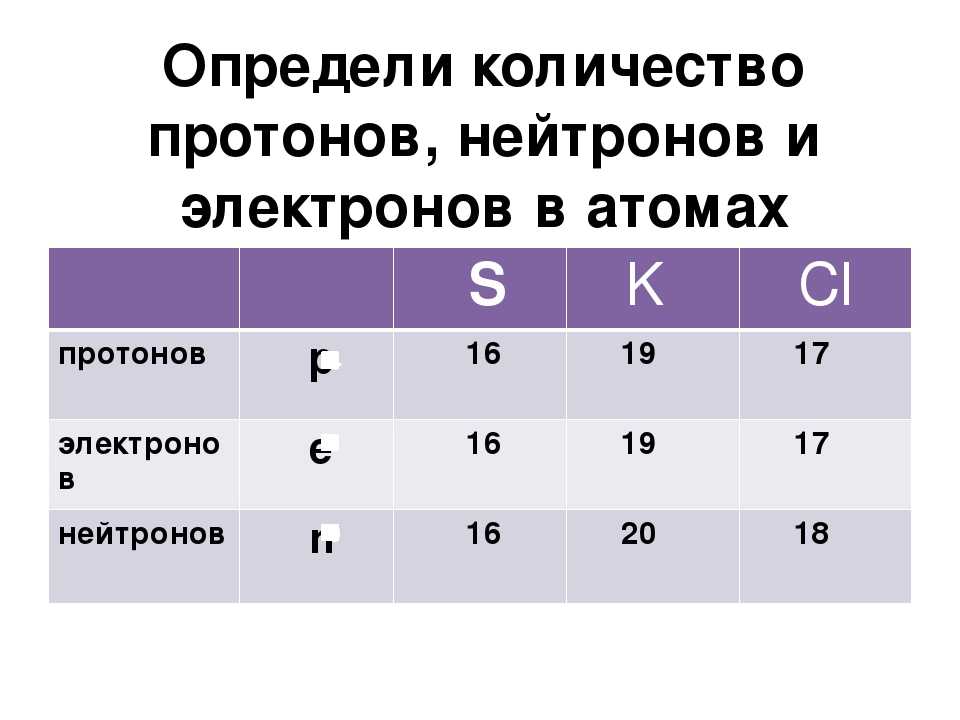 для никеля например указано масса 58,693, что вы подразумеваете как 59, но нет стабильного природного изотопа никеля-59. есть только 58,60,61,62,64. а 59 это стабильный изотоп кобальта! то же самое наблюдается с Cu,Zn,Ga,Se и другими элементами.
крч надо иметь под… Читать далее
для никеля например указано масса 58,693, что вы подразумеваете как 59, но нет стабильного природного изотопа никеля-59. есть только 58,60,61,62,64. а 59 это стабильный изотоп кобальта! то же самое наблюдается с Cu,Zn,Ga,Se и другими элементами.
крч надо иметь под… Читать далее
Надежда Купаева
14 апреля 2021
Нужно вычесть число протонов из относительной атомной массы
Комментировать ответ…Комментировать…
Первый
zenzen. science
Ученица 11 класса · 2 нояб 2021
Число нейтронов в атоме элемента условно обозначают латинской Z. Z(Э) = Ar(Э) — p(Э), где p — число протонов (p=порядковому номеру элемента в системе Менделеева), Ar — относительная атомная масса элемента. Например: Z(О) = 16-8 = 8, значит атом кислорода содержит 8 нейтронов; Z(S) = 32-16 = 16, атом серы содержит 16 нейтронов; Z(V) = 51-23 = 28, атом ванадия содержит… Читать далее
Ekaterina Raksha
29 марта
Тупо взвесить и поделить
Комментировать ответ…Комментировать…
Вы знаете ответ на этот вопрос?
Поделитесь своим опытом и знаниями
Войти и ответить на вопрос
1 ответ скрыто(Почему?)
| Массовое числоMass number Массовое число – суммарное число протонов и нейтронов в атомном ядре. См. также
|
Как найти количество протонов, нейтронов и электронов
Учебные пособия
- Сообщение от Райли Мазиек
22 Апр
Основные понятия
В этом уроке вы узнаете, как найти и рассчитать количество протонов, нейтронов и электронов в атоме или элементе. Кроме того, вы узнаете о различных субатомных частицах. Если вам понравился этот урок, обязательно ознакомьтесь с другими!
Описано в других статьях
- Структура атома
- Что такое элемент?
- Как читать Периодическую таблицу
- Статьи об элементах
- Открытие электрона
- Электронные орбитали и формы орбит
Словарь:
- Протоны: положительно заряженные субатомные частицы, находящиеся в ядре.

- Нейтроны: нейтрально заряженные субатомные частицы, расположенные в ядре атома.
- Электроны: Отрицательно заряженные субатомные частицы, расположенные на орбиталях, окружающих ядро.
- Атомная масса: Средневзвешенное число нейтронов и протонов, присутствующих во всех изотопах.
- Атомный номер: Количество протонов, присутствующих в атоме.
- Элемент: Чистое вещество, которое нельзя разложить химическим путем на более простое вещество.
Как найти атомный номер
Атомный номер элемента — это просто число протонов в его ядре. Самый простой способ найти атомный номер — посмотреть в периодической таблице, атомный номер находится в верхнем левом углу или является самым большим числом на квадрате.
Определение количества протонов
Количество протонов в атоме равно атомному номеру элемента. Например, возьмем кислород. Согласно периодической таблице кислород имеет атомный номер восемь. Атомный номер расположен над символом элемента. Поскольку кислород имеет атомный номер восемь, всего должно быть восемь протонов. Более того, количество протонов никогда не меняется для элемента.
Поскольку кислород имеет атомный номер восемь, всего должно быть восемь протонов. Более того, количество протонов никогда не меняется для элемента.
Определение количества нейтронов
Количество нейтронов в атоме можно рассчитать, вычитая атомный номер из атомной массы. Оба этих числа можно найти в периодической таблице. Атомный номер указан над символом элемента, тогда как массовое число помещено ниже. Давайте продолжим использовать кислород в качестве нашего примера. Его атомная масса равна 15,9.99 атомных единиц массы (а.е.м.), а его атомный номер равен 8. Когда мы вычтем 8 из 15,999, мы получим 8. Также следует отметить, что количество нейтронов для элемента может варьироваться. У некоторых элементов есть изотопы, которые имеют разную массу и, следовательно, разное количество нейтронов.
Определение количества электронов
Количество электронов в атоме равно порядковому номеру элемента для нейтрально заряженных частиц. Это означает, что количество электронов и количество протонов в элементе равны.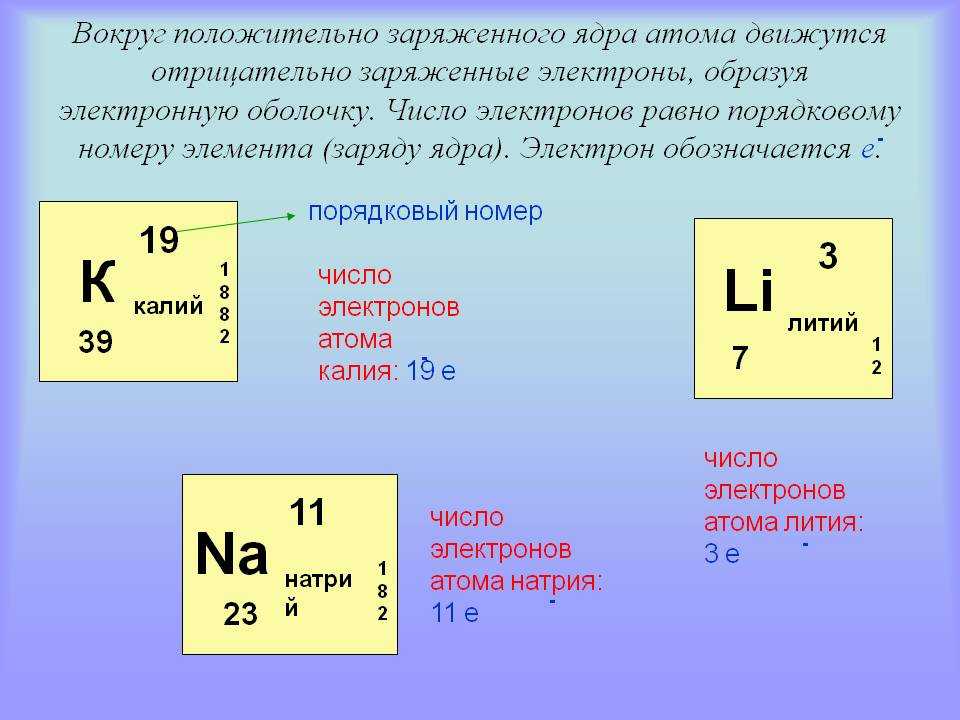 Следовательно, количество электронов в кислороде равно 8. Более того, поскольку эти две субатомные частицы, электроны и протоны, имеют противоположные заряды, они компенсируются и сохраняют атом нейтральным.
Следовательно, количество электронов в кислороде равно 8. Более того, поскольку эти две субатомные частицы, электроны и протоны, имеют противоположные заряды, они компенсируются и сохраняют атом нейтральным.
Сводная сумма Таблица
| Количество протонов = | Atomic Number |
| Номер нейтронов = | ATOMIC MASS-ATOMIC NUMPLAY |
НОМ ЭЛЕКТАМИЧЕСКОЙ МАССА-Атом. В этой химической реакции, известной как реакция Бриггса-Раушера, количество протонов и нейтронов в каждом атоме не меняется. Однако электроны перемещаются между атомами, вызывая образование различных ионов и вызывая изменение цвета. Подписывайтесь на наш канал на YouTube, впереди еще много потрясающих видео!Лучшая периодическая таблица в миреКомпания ChemTalk, по нашему скромному мнению, разработала лучшую в мире интерактивную периодическую таблицу. Познакомьтесь с нашей периодической таблицей здесь. Дополнительная литература
Как найти число нейтронов в атоме Обновлено 06 ноября 2018 г. Общая масса атома равна сумме всех его протонов, нейтронов и электронов, но электроны настолько легки, что для всех практических целей они не имеют значения. Это означает, что масса элемента равна сумме масс его нуклонов. Количество протонов одинаково для каждого атома определенного элемента, а протоны и нейтроны имеют одинаковую массу, поэтому все, что вам нужно сделать, это вычесть количество протонов из атомной массы, измеренной в атомных единицах массы (а.е.м.). и у вас осталось число нейтронов. TL;DR (слишком длинный; не читал)TL;DR (слишком длинный; не читал) Атомная масса равна количеству протонов плюс количество нейтронов, поэтому вы находите число нейтронов путем вычитания числа протонов (то есть атомного номера) из атомной массы (в единицах атомной массы). Использование периодической таблицыВ периодической таблице все элементы перечислены в порядке возрастания количества протонов, поэтому место, которое элемент занимает в таблице, автоматически сообщает вам, сколько протонов содержится в его ядре. Это атомный номер элемента, и он отображается прямо под символом элемента. Рядом с ним находится еще одно число, обозначающее атомную массу. Это число всегда больше, чем его атомный номер, и часто содержит дробь, потому что это среднее значение атомных масс всех встречающихся в природе изотопов этого элемента. Вы можете использовать его, чтобы определить среднее количество протонов в ядре этого элемента. Процедура не может быть проще. Округлите атомную массу до ближайшего целого числа, затем вычтите из нее атомный номер элемента. Разница равна количеству нейтронов. Пример1. Каково среднее число нейтронов в ядре урана? Уран занимает 92-е место в таблице Менделеева, поэтому его атомный номер 92 и 92 протона в ядре. В периодической таблице указана атомная масса 238,039 а.е.м. Округлите атомную массу до 238, вычтите атомный номер, и у вас останется 146 нейтронов. У урана большое количество нейтронов по отношению к количеству протонов, поэтому все его изотопы радиоактивны. Количество нейтронов в изотопеКоличество нейтронов в ядре определенного элемента может варьироваться, и каждая версия элемента с характерным для него числом нейтронов называется изотопом. Все элементы, кроме 20, имеют более одного изотопа, а некоторые — много. Олово (Sn) возглавляет список с десятью изотопами, за ним следует ксенон (Xe) с девятью изотопами. Каждый изотоп элемента состоит из целого числа протонов и нейтронов, поэтому его атомная масса представляет собой простую сумму этих нуклонов. |

 Боттомоний
Боттомоний Чармоний
Чармоний Как известно атомное
ядро состоит из протонов и нейтронов – элементарных частиц, имеющих очень
близкие массы (≈1.67·10-24 г) и объединяемых термином
“нуклоны”. Если число протонов в ядре обозначить буквой Z, а число нейтронов
— буквой N, то массовое число (или число нуклонов) А = Z + N. Термин “массовое
число” связан с тем, что именно количество нуклонов (протонов и нейтронов)
в ядре практически полностью (с точностью обычно не хуже 1%) определяет
массу атомного ядра и атома. Знание массового числа позволяет оценить массу
ядра и атома. Если известно массовое число, то масса М атома и его ядра
оценивается из следующего соотношения М ≈ А·mN,
где mN — масса нуклона, т.е. протона или нейтрона. Например,
в состав атома алюминия и его ядра входит 27 нуклонов (13 протонов и 14
нейтронов). Его масса ≈ 27·1.67·10-24 г ≈ 4.5·10-23 г. Если необходимо получить массу ядра с большей точностью, то нужно
учесть, что нуклоны в ядре связаны силами ядерного притяжения, и поэтому
в соответствии с соотношением E = mc2 масса ядра уменьшается.
Как известно атомное
ядро состоит из протонов и нейтронов – элементарных частиц, имеющих очень
близкие массы (≈1.67·10-24 г) и объединяемых термином
“нуклоны”. Если число протонов в ядре обозначить буквой Z, а число нейтронов
— буквой N, то массовое число (или число нуклонов) А = Z + N. Термин “массовое
число” связан с тем, что именно количество нуклонов (протонов и нейтронов)
в ядре практически полностью (с точностью обычно не хуже 1%) определяет
массу атомного ядра и атома. Знание массового числа позволяет оценить массу
ядра и атома. Если известно массовое число, то масса М атома и его ядра
оценивается из следующего соотношения М ≈ А·mN,
где mN — масса нуклона, т.е. протона или нейтрона. Например,
в состав атома алюминия и его ядра входит 27 нуклонов (13 протонов и 14
нейтронов). Его масса ≈ 27·1.67·10-24 г ≈ 4.5·10-23 г. Если необходимо получить массу ядра с большей точностью, то нужно
учесть, что нуклоны в ядре связаны силами ядерного притяжения, и поэтому
в соответствии с соотношением E = mc2 масса ядра уменьшается.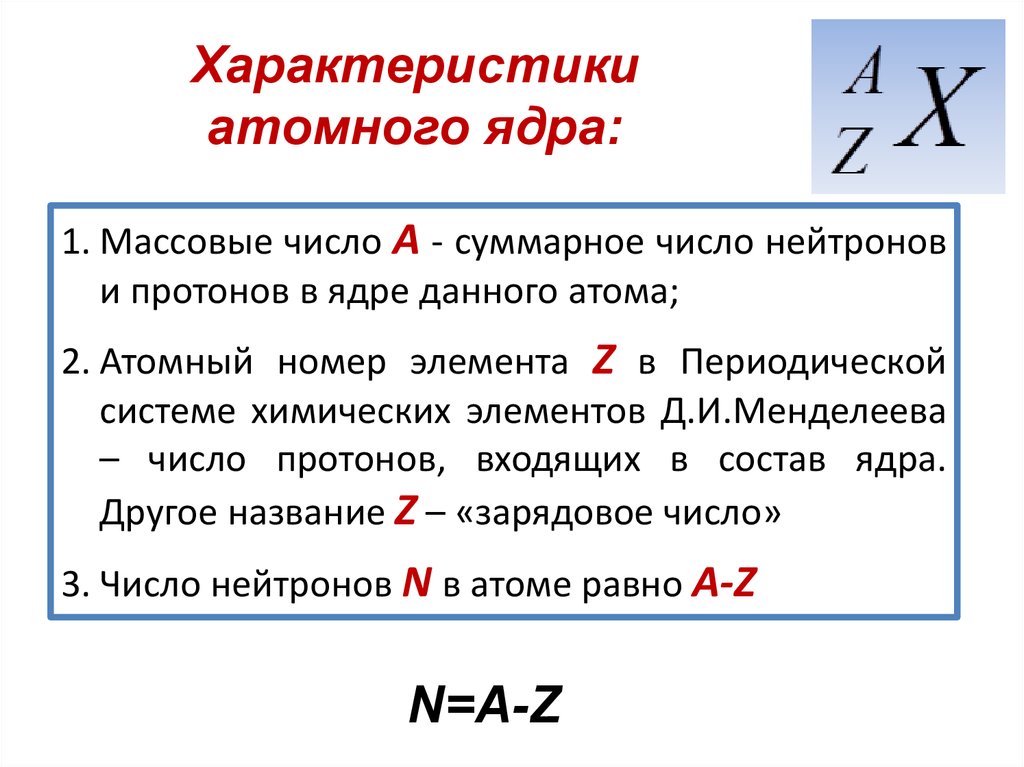 В массу атома также следует добавить суммарную массу электронов на орбитах
вокруг ядра. Однако все эти поправки не превышают 1%.
В массу атома также следует добавить суммарную массу электронов на орбитах
вокруг ядра. Однако все эти поправки не превышают 1%.
 содержит как протоны, так и нейтроны. Ядра слишком малы, чтобы их можно было увидеть даже в микроскоп, а нуклоны (это общий термин для протонов и нейтронов) еще меньше. Это позволяет считать количество нейтронов, но ученые все еще знают, сколько их в ядрах каждого изотопа каждого элемента. Откуда они знают? Они используют такие методы, как масс-спектрометрия, для измерения общей массы атомов определенного элемента. Как только они узнают общую массу, остальное легко.
содержит как протоны, так и нейтроны. Ядра слишком малы, чтобы их можно было увидеть даже в микроскоп, а нуклоны (это общий термин для протонов и нейтронов) еще меньше. Это позволяет считать количество нейтронов, но ученые все еще знают, сколько их в ядрах каждого изотопа каждого элемента. Откуда они знают? Они используют такие методы, как масс-спектрометрия, для измерения общей массы атомов определенного элемента. Как только они узнают общую массу, остальное легко. Округлите атомную массу до ближайшего целого числа, чтобы найти количество нейтронов в наиболее распространенном изотопе.
Округлите атомную массу до ближайшего целого числа, чтобы найти количество нейтронов в наиболее распространенном изотопе.