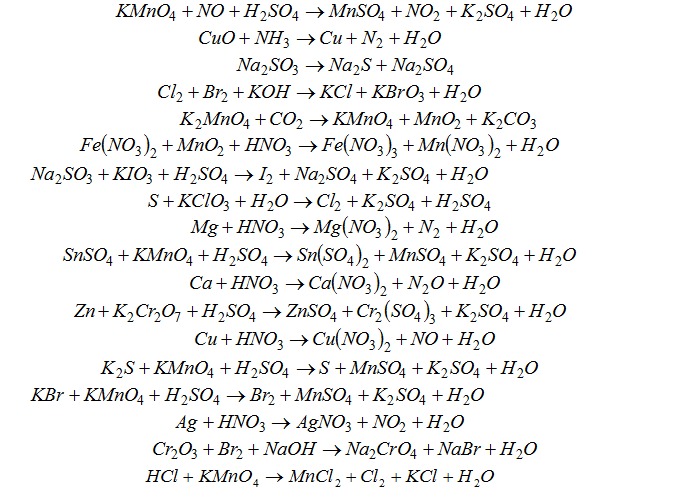Лучший ответ по мнению автора | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||
|
|
| |||||||||||||||||||||||||||||||||||||||||||||||||||
Посмотреть всех экспертов из раздела Учеба и наука > Химия
Пользуйтесь нашим приложением
Вторая лабораторка
Цель работы:
Ознакомиться с процессами окисления и восстановления, составить уравнения химических реакций и подобрать коэффициенты к ним различными способами.
Теоретическая часть:
ОВ
реакциями называют реакции, сопровождающиеся
переходом электронов от одних атомов
или ионов к другим.
Вещества, атомы или ионы которых принимают электроны, называются окислителями, а отдающие — восстановителями. Таким образом, окислитель восстанавливается, а восстановитель окисляется.
Наиболее употребимые окислители:
1)Галогены и их кислородные соединения
2)Азотная кислота и её соли
3)Соли марганцевой и хромовой кислот
4)Пероксиды(если в растворе нет более сильного окислителя)
Наиболее употребимые восстановители:
1)Свободные металлы
2)Сероводородная кислота и её соли
3)Водород
4)Углерод
5)Моноксид углерода
Коэффициенты в ОВР можно вычислить несколкими способами:
Составление схем перехода электронов на основе изменения степени окисления атомов или ионов.
1)Определяем степени окисления элементов, участвующих в реакции
2)Подсчитываем число отданных и принятых электронов и находим наименьшее кратное и дополнительные множители
3)Переносим
основные коэфициенты в уравнение реакции
и подсчитываем остальные атомы,
участвующие в реакции.
Метод электронно-ионных уравнений ОВ реакций
При составлении электронно-ионных схем следует учитывать изменение не только заряда ионов, но и их состава. Во взаимодействии с ионами или молекулами окислителя и восстановителя могут вступать или, наоборот, быть продуктами реакции:
а)в кислой среде — молекулы воды и ионы Н+
б)в щелочной среде — молекулы воды и ионы ОН-
в)в нейтральной среде молекулы воды и ионы Н+ и ОН-
При выводе молекулярно-ионных уравнений ОВР следует следовать той же форме записи, которая принята для уравнений реакции обменного характера:
Малорасстворимые, малодиссициированные и летучие соединения следует писать вместе.
Алгебраический метод расчёта коэффициентов
Метод основан на составлении балансов отдельных элементов в составе различных молекул, участвующих в реакции. Метод применим как для расчетов ОВР, так и для реакций, не сопровождающихся передачей электронов.
Полученные
уравнения баланса по отдельным элементам
представляют собой систему линейных
уравнений, решение которых можно
осуществить обычным алгебраическим
способом.
Практическая часть:
ОПЫТ I. Перманганат калия как окислитель в кислой среде.
Ход работы:
В пробирку налил 2-3мл раствора КMnO4, подкислил раствором Н2SO4(1-2мл) и добавил раствор Na2SO3 до обесцвечивания.
Наблюдения:
После смешивания всех данных веществ Полученная смесь в результате химической реакции обесцветилась.
Уравнение химической реакции:
Вывод:
Изучены химические свойства перманганата калия в кислой среде.Перманганат калия проявляет окислительные свойства в кислой среде и реагирует с данными веществами, в результате чего смесь обесцвечивается.
ОПЫТ II. Перманганат калия как окислитель в нейтральной среде.
Ход работы:
Налил
в пробирку 2-3мл раствора КМnO4,
разбавил водой вдвое и добавил 2-3мл
Na2SO3 до исчезновения фиолетовой окраски и
появления бурого осадка.
Наблюдения:
Mn+7 восстанавливается в нейтральной среде до Mn+4 и выпадает бурый осадок MnO(OH)2.
Уравнение химической реакции:
2KMnO4 + 3Na2SO3 + 3H2O -> 2MnO(OH)2 + 2KOH + 3Na2SO4
Mn+7 + 3e -> Mn+4 |2 ок-ль
S+4 — 2e -> S+6 |3 вос-ль
(MnO4)- + 3h3O + 3e -> Mn+4O(OH)2 + 4OH- |2
(SO3)- + h3O — 2e -> (SO4)2- + 2H+ |3
Вывод:
Изучены химические свойства перманганата калия в нейтральной среде. Перманганат калия проявляет окислительные свойства в нейтральной среде и реагирует с данными веществами, в результате чего выпадает бурый осадок.
ОПЫТ III. Перманганат калия в сильно щелочной среде.
Ход работы:
Налил
в пробирку 1-2мл раствора KMnO4, прибавил
4-5мл раствора KOH и добавил раствор Na2SO3
до появления зелёного цвета.
Наблюдения:
В результате смешения данных веществ полученная смесь приобрела зелёный цвет.
Уравнение химической реакции:
2KMnO4 + 2KOH + Na2SO3 -> 2K2MnO4 + Na2SO4 + h3O
Mn+7 + e -> Mn+6 |2 ок-ль
S+4 — 2e -> S+2 |1 вос-ль
(MnO4)- + e -> (Mn04)2- |2
(SO3)2- + OH- — 2e -> (SO4)2- + 2h3O |1
Вывод:
Изучены химические свойства перманганата калия в сильно щелочной среде. Перманганат калия проявляет окислительные свойства в сильно щелочной среде и реагирует с данными веществами, в результате чего полученная смесь приобретает зелёный цвет.
ОПЫТ IV. Реакция самоокисления и самовосстановления(диспропорционирования) йода.
Ход работы: Налил в пробирку по 1мл раствора KJ, KJO3, раствор подкислил соляной кислотой. Убедился в образовании свободного йода, прибавив 2-3 капли полученного раствора в пробирку с раствором крахмала.
Наблюдения:
В
результате смешивания раствора крахмала
и полученного раствора произошло
изменение окраски(фиолетовый цвет).
Уравнение химической реакции:
5KJ + KJO3 + 6HCl = 3J2 + 3h3O + 6HCl
J-1 — 1e -> J0 |5 вос-ль
J+5 + 5e -> J2 |1 ок-ль
5J-1 + (JO3)- + HCl -> KCl + 3J2 + h3O
Вывод:
Изучил явление диспропорционирования йода.В результате смешивания раствора крахмала и полученного раствора произошло изменение окраски(фиолетовый цвет), что свидетельствует о наличии свободного йода.
ОПЫТ VI. Перекись водорода как восстановитель.
Ход работы:
Налил в пробирку 2мл KMnO4, подкислил раствором h3SO4 и добавил раствор h3O2 до обесцвечивания.
Наблюдения:
Полученная смесь обесцветилась.
Уравнение химической реакции:
h3O2 + 2KMnO4 + 3h3SO4 -> 2h3SO4 + K2SO4 + 4h3O + 3O2
Mn+7 +5e -> Mn+2 |2
2O-1 — 2e -> O20 |5
2(MnO4)- + 6H+ + 12O- -> 2Mn2+ + 8h3O +3O2
5h3O2 + 2KMnO4 + 3h3SO4 -> 2MnSO4 + 8h3O + K2SO4 + 5O2
Вывод:
Изучил
восстановительные свойства перекиси
водорода. Перекись водорода имеет
свойства восстановителя.
Перекись водорода имеет
свойства восстановителя.
ОПЫТ VIII Селитра как окислитель.
Ход работы:
В сухой пробирке, укреплённой вертикально в штативе, расплавил 1-2г нитрата калия и бросил кусочек древесного угля, после чего он вспыхнул и из пробирки повалил дым. Пробирку охладил, долил в неё воды и соляной кислоты.
Наблюдения:
После того, как расплавили 1-2г нитрата калия и бросили кусочек древесного угля,уголь вспыхнул и из пробирки повалил дым.После охлаждения пробирки и доливания соляной кислоты и воды произошло выделение газа CO2.
Уравнения химических реакций:
1)4KNO3 + 5C -> 3CO2 + 2N2 + 2K2CO3
2N+5 + 10e -> N2 |4 oк-ль
C0 — 4e -> C+4|5 вос-ль
4K+ + 4(NO3)- + 5C -> 3CO2 + 2N2 + 2(CO3)2-
2)K2CO3 + HCl -> 2KCl + h3O + CO2
Вывод:
Изучил свойства селитры как окислителя. Селитра проявляет окислительные свойства.
Общий вывод:
Процессы
окисления и восстановления проходят с
изменением степени окисления элементов
в соединениях. ОВ реакции сопровождаются
переходом электронов от одних атомов
или ионов к другим. Восстановителями
называют вещества, атомы или ионы которых
отдают электроны, а окислителями —
вещества, атомы или ионы которых принимают
электроны. Коэффициенты в ОВР реакциях
можно вычислить составлением схем
перехода электронов на основе изменения
степени окисления атомов или ионов,
методом электронно-ионных уравнений
ОВ реакций и алгебраическим методом
расчета коэффициентов.
ОВ реакции сопровождаются
переходом электронов от одних атомов
или ионов к другим. Восстановителями
называют вещества, атомы или ионы которых
отдают электроны, а окислителями —
вещества, атомы или ионы которых принимают
электроны. Коэффициенты в ОВР реакциях
можно вычислить составлением схем
перехода электронов на основе изменения
степени окисления атомов или ионов,
методом электронно-ионных уравнений
ОВ реакций и алгебраическим методом
расчета коэффициентов.
Контрольные вопросы:
KMnO4 + h3O2 + h3SO4 = O2 + MnSO4 + K2SO4 + h3O
12 июня 2018 г. Туба для обучения Химическая реакция
Пероксид калия и серная кислота (kmno4 h3o2 h3so4) доступны почти во всех химических лабораториях по всему миру. KMnO4 и h3O2 реагируют преимущественно в среде h3SO4. Чтобы сбалансировать окислительно-восстановительную реакцию, мы используем ионно-электронную технику.
Реакция пероксида водорода с перманганатом калия и серной кислотой (KMnO4 h3O2 h3SO4)
Реакция представляет собой реакцию обмена электронами. Реагенты в этой реакции отдают и забирают определенное количество электронов, чтобы получить некоторый продукт. Здесь в этой химической реакции основную роль играют KMnO4 и h3O2, так как они обмениваются электронами. С другой стороны, серная кислота (h3SO4) создает подходящую реакционную среду. Поскольку происходит электронный обмен, мы можем понять, что степень окисления реагентов должна измениться. Следовательно, рассматриваемое уравнение реакции представляет собой уравнение реакции окисления-восстановления.
Реагенты в этой реакции отдают и забирают определенное количество электронов, чтобы получить некоторый продукт. Здесь в этой химической реакции основную роль играют KMnO4 и h3O2, так как они обмениваются электронами. С другой стороны, серная кислота (h3SO4) создает подходящую реакционную среду. Поскольку происходит электронный обмен, мы можем понять, что степень окисления реагентов должна измениться. Следовательно, рассматриваемое уравнение реакции представляет собой уравнение реакции окисления-восстановления.
h3O2 + h3SO4 + KMnO4 = O2 + h3 + MnSO4 + K2SO4
или, После уравновешивания окислительно-восстановительной реакцией
5H
2 O 2 + 3 H 2 SO 4 + 2KMnO 4 = 5O 2 + 8H 2 O + 2MnSO 4 + K 2 SO 4 Как мы говорили выше, реакция является окислительно-восстановительной. , поэтому с помощью ино- электронным методом мы можем легко уравновесить эту реакцию.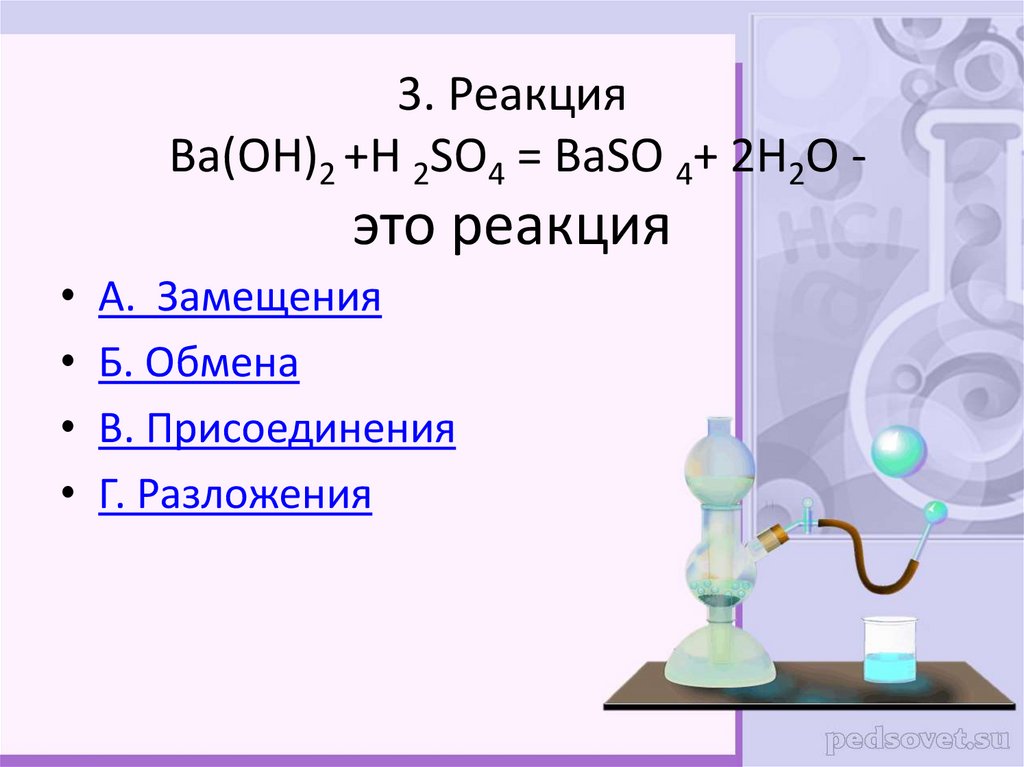
Уравновешивание окислительно-восстановительной реакции ионно-электронным методом
Скелетная реакция окислительно-восстановительной реакции пероксида водорода перманганата калия и серной кислоты (kmno4 h3o2 h3so4) –
H
2 O 9002 1 2 + КМnО 4 + H 2 SO 4 = O 2 + H 2 O + MnSO 4 + K 2 SO 4Если мы внимательно посмотрим на приведенную выше реакцию, один из реагентов Н 2 O 2 высвобождает электрон, а другой реагент KMnO 4 принимает электрон. Следовательно, в этой реакции H 2 O 2 действует как восстановитель, с другой стороны, KMnO 4 действует как окислитель.
Здесь,
Окислитель: KMnO 4 или после исключения иона спектратора, MnO 4 -1
900 17 Восстановитель: H 2 O 2 или после исключения иона-спектатора, O -1
Половина реакции восстановления
Окислитель, KMnO нет 4 -1 занимает пять электронов, которые высвобождаются восстановителем, H 2 O 2 , или после исключения иона-спектатора, O -1 , агента, присутствующего в реакции. После принятия электронов окислителем KMnO 4 восстанавливается восстановителем, H 2 O 2 .
После принятия электронов окислителем KMnO 4 восстанавливается восстановителем, H 2 O 2 .
⇒ MnO 4 -1 + 8H + +5e – = 4H 2 O + Mn 2- … …. … … (1)
Полуреакция окисления
Как мы все знаем, окислительно-восстановительная реакция является одновременным процессом, что означает, что когда происходит полуреакция восстановления, одновременно происходит и полуреакция окисления. Здесь в этой реакции восстановитель H 2 O 2 высвобождает по одному электрону на каждый атом кислорода и окисляется окислителем KMnO 4 .
⇒ 2O -1 – 2e – = O 2 … … … … (2)
Теперь в полуреакции восстановления расходуется пять электронов, а в половине реакции окисления В результате реакции высвобождается два электрона, образуя молекулу кислорода. Чтобы получить сбалансированную полную реакцию окисления-восстановления, мы должны умножить полуреакцию окисления и полуреакцию восстановления на соответствующее число и сложить их вместе.
Итак, уравнение (1)x2 + (2)x5,
2MnO 4 -1 + 16H + +10e – = 8 H 2 O + 2Mn 2-
10 O -1 – 10e – = 5O 2
⇒ 2MnO 4 -1 + 10 O -1 + 16H + = 2Mn 2- + 8H 2 O +5O 2
На этом этапе мы добавляем необходимые ионы и радикалы к вышеуказанной ионной форме полной окислительно-восстановительной реакции,
⇒ 5H 2 O 2 + 3H 2 SO 4 + 2KMnO 4 = 5O 90 021 2 + 8H 2 O + 2MnSO 4 + K 2 SO 4
Следовательно, сбалансированная окислительно-восстановительная реакция:⇒ 5H
2 O 2 + 3H 2 SO 4 + 2KMnO 4 = 5O 2 + 8H 2 O + 2MnSO 4 + K 2 SO 4Следуйте за нами на Twitter, Facebook, Linkedin и Tumbler = Cr2(SO4)3 + Fe2(SO4)3 + K2SO4 + h3O
FeSO4 + KMnO4 + h3SO4 = Fe2(SO4)3 + MnSO4 + h3O + K2SO4
NaCl + KMnO4 + h3SO4 = Cl2 + MnSO4 + Na2SO4 + K2SO4 + h3O
Реакция между перекисью водорода и перманганатом калия — полезна ли она?
Перекись водорода — первое, что приходит на ум, когда вы читаете слово «окисление». Это один из самых популярных агентов на рынке с глубокими последствиями. Превосходные дезинфицирующие и отбеливающие свойства перекиси водорода не имеют себе равных.
Это один из самых популярных агентов на рынке с глубокими последствиями. Превосходные дезинфицирующие и отбеливающие свойства перекиси водорода не имеют себе равных.
Тем не менее, перманганат калия является еще одним окислителем, который может составить конкуренцию перекиси водорода. Это наиболее используемый окислитель в органической химии, а также в промышленности. Более того, некоторые даже ходят и используют марганцовку для обработки ран и дезинфекции.
Так что же произойдет, если объединить этих двух агентов? Уничтожают ли они друг друга в решающей битве или работают вместе в гармонии для достижения более глубоких результатов?
Давайте углубимся в химию обоих соединений, чтобы лучше понять, как они работают и каковы их последствия.
Химическая реакция между перекисью водорода и перманганатом калия
Перекись водорода и перманганат калия являются двумя наиболее широко используемыми окислителями. Оба они обладают отличными окислительными свойствами, что делает их важным инструментом как в промышленности, так и в домашнем хозяйстве.
Однако что произойдет, если столкнутся два этих окисляющих титана? Кто кого окисляет, и плодотворна ли химическая реакция?
Перманганат калия является одним из самых сильных окислителей в неорганической химии. Это свойство можно отнести к сильно электроположительному манганат-иону. Основной марганец имеет степень окисления +7, когда он присутствует в соединении перманганата калия, что является максимально возможной степенью окисления для одиночного элемента.
Таким образом, при смешивании перекиси водорода и перманганата калия первый действует как восстановитель, а второй — как окислитель.
Имея это в виду, давайте углубимся в суть химических реакций!
Природа и механизм химической реакции
Нами установлено, что при смешивании перекиси водорода и перманганата калия происходит реакция. Но какова природа этой химической реакции? И есть ли какие-то особые условия, которые вызывают эту реакцию?
Природа Подсказка о природе реакции перекиси водорода и перманганата калия заключается в их свойствах. Как и во многих других реакциях, один субстрат действует как окислитель, а другой — как восстановитель. Такие типы реакций называются окислительно-восстановительными реакциями.
Как и во многих других реакциях, один субстрат действует как окислитель, а другой — как восстановитель. Такие типы реакций называются окислительно-восстановительными реакциями.
Точно так же в этой реакции перманганат калия действует как окислитель, что означает потерю кислорода и снижение степени окисления манганат-иона. С другой стороны, ион перекиси водорода получает атом кислорода и действует как восстановитель. Окислительное состояние кислорода в этом случае становится более положительным.
МеханизмПерекись водорода и перманганат калия вступают в окислительно-восстановительную реакцию в кислой среде. Чаще всего кислая среда обеспечивается серной кислотой (из которой получают сульфат-ион сульфата марганца).
В кислой среде перманганат калия может получить пять электронов, образуя ион оксида марганца. Более того, ион перекиси теряет два своих электрона, образуя кислород.
Манганат-ион реагирует со свободными ионами сульфата в растворе (из-за кислотности) и образует сульфат марганца.
Конечными продуктами, полученными в результате этой окислительно-восстановительной реакции, являются гидроксид калия, сульфат марганца, кислород и вода.
При этом степень окисления марганца снижается с +7 в перманганате до +2 в сульфатной форме. Поэтому говорят, что ион восстановлен.
Аналогичным образом степень окисления кислорода увеличивается от -1 в перекиси водорода до 0 (нейтральная) в форме молекулярного кислорода. Поэтому говорят, что ион окисляется.
Что касается использования образующихся продуктов, то кислород и марганец широко используются в промышленности! Сульфат марганца широко используется в производстве удобрений в качестве добавки для растений, которым не хватает марганца. Этот элемент вносит основной вклад в процесс фотосинтеза растений, а также в фиксацию азота и дыхание.
Сульфат марганца в дальнейшем используется в качестве сырья для производства глазурей, лаков, керамики и даже фунгицидов!
Большая часть молекулярного кислорода, образующегося в результате окислительно-восстановительной реакции перекиси водорода и перманганата калия, выделяется в газообразной форме. Однако при правильном обращении его можно использовать в качестве окислителя.
Однако при правильном обращении его можно использовать в качестве окислителя.
Как выполнить эту реакцию с надлежащими мерами предосторожности?
Вы можете изучить действие перекиси водорода и перманганата калия в лабораторных условиях. Для этого наберите в пробирку немного пурпурной марганцовки и заполните ее на четверть длины. Убедитесь, что вы надели надлежащие перчатки и защитные очки, так как эти химические вещества могут вызывать коррозию и вредить вашей коже в более высоких концентрациях.
Перед добавлением перекиси водорода обязательно налейте в пробирку немного концентрированной серной кислоты. Вот где требуется тщательный уход. Серная кислота в больших количествах обладает сильным коррозионным и разрушительным действием. Если вы не умеете обращаться с лабораторным оборудованием, мы рекомендуем экспериментировать под наблюдением эксперта.
Теперь самое интересное начинается. Возьмите в пипетку немного перекиси водорода и начните вливать ее в фиолетовое вещество в пробирке. Вы сразу начнете замечать явление пузырения. Это кислород, высвобождающийся в результате реакции двух химических веществ. Затем начните смешивать химикаты с помощью мешалки и обратите внимание, как фиолетовый цвет начинает разбавляться.
Вы сразу начнете замечать явление пузырения. Это кислород, высвобождающийся в результате реакции двух химических веществ. Затем начните смешивать химикаты с помощью мешалки и обратите внимание, как фиолетовый цвет начинает разбавляться.
Если в пробирку налить перекись водорода соответствующей концентрации, пурпурный цвет исчезнет. Это указывает на то, что перманганат калия полностью прореагировал с пероксидом водорода и образовал сульфат марганца, гидроксид калия и кислород.
Это явление также известно как метод титрования на языке систематической химии. И это обычный эксперимент в лабораториях, где нужно наблюдать за работой манганата калия.
Какой окислитель лучше – перекись водорода или перманганат калия?
Из реакций перекиси водорода и перманганата калия можно сделать вывод, что, поскольку последний действует как окислитель против первого, он является лучшим из двух окислителей. Однако это точно не так!
Когда речь идет об окислительных свойствах, необходимо учитывать множество факторов. Во-первых, вы не можете использовать сильнодействующий окислитель на коже. Мягкий окислитель также неэффективен в промышленных условиях. Поэтому при объявлении окислителя «лучшим» следует сначала уточнить ситуацию.
Во-первых, вы не можете использовать сильнодействующий окислитель на коже. Мягкий окислитель также неэффективен в промышленных условиях. Поэтому при объявлении окислителя «лучшим» следует сначала уточнить ситуацию.
Тем не менее, перманганат калия действительно является более сильным окислителем, чем перекись водорода. Однако окислительные свойства перманганата калия могут быть разрушительными, что делает его выгодным сырьем в промышленности. В некоторых случаях также можно взять разбавленный раствор перманганата калия, очищая раны или дезинфицируя поверхности.
Тем не менее, перекись водорода является гораздо более популярным средством, когда речь идет об использовании человеком и в быту. Он обладает всеми необходимыми свойствами, которые нужны хорошему чистящему средству. Там, где перманганат калия может очищать и дезинфицировать раны, он выделяет ненужные побочные продукты. Но с перекисью водорода это не так. После распада перекись водорода выделяет кислород и воду. Оба этих химических вещества совершенно безопасны для человека, что делает перекись водорода лучшим выбором.
Таким образом, если вы ищете промышленную установку, где требуется интенсивное окисление, перманганат калия — ваш выбор. Тем не менее, для домашнего и человеческого использования перекись водорода — это то, что нужно!
Некоторые совместные применения перекиси водорода и перманганата калия
Перекись водорода и перманганат являются превосходными окислителями с множеством применений. Однако что произойдет, если вы объедините их оба?
Ниже перечислены некоторые из наиболее распространенных применений перекиси водорода и раствора перманганата:
1. Лекарства от дерматита
Под дерматитом понимается воспаление кожи и связанные с ним симптомы. Как правило, этот термин охватывает распространенные раздражения кожи, которые включают зуд, сухость кожи или сыпь. Кроме того, при дерматите также могут наблюдаться такие состояния, как волдыри, выделения, корки или шелушение.
Существует три распространенных типа дерматита: атопический (экзема), себорейный и контактный дерматит.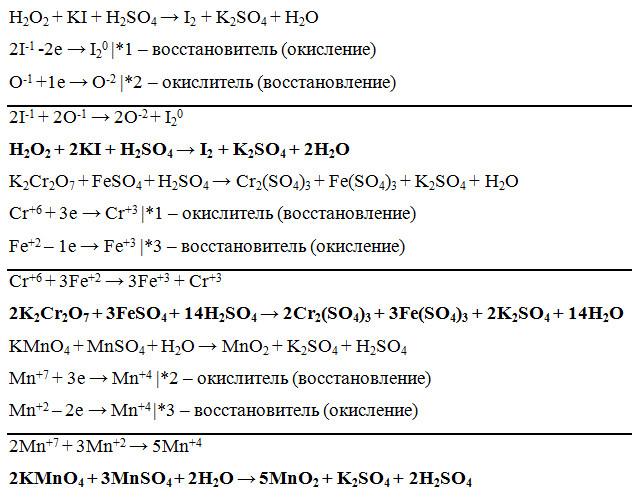 Атопический и контактный дерматит возникают как аллергическая реакция на чужеродные раздражители, тогда как себорейный дерматит относится к перхоти и шелушащимся пятнам на коже головы.
Атопический и контактный дерматит возникают как аллергическая реакция на чужеродные раздражители, тогда как себорейный дерматит относится к перхоти и шелушащимся пятнам на коже головы.
Во всех этих случаях перекись водорода просто необходима. Согласно различным исследованиям, перекись водорода имеет клеточные механизмы, которые подавляют иммунный ответ, уменьшая выработку связанных цитокинов (химических веществ, усиливающих иммунный ответ). Более того, смешивая перекись водорода с перманганатом калия, можно получить более сильное окисляющее действие.
Однако настоятельно рекомендуется проконсультироваться с врачом перед нанесением смеси непосредственно на лицо.
2. Для очистки ран
Перекись водорода классически известна для очистки ран. Его использовали для очистки ран с тех пор, как люди себя помнят. Пузырьковое действие перекиси водорода — это история каждого домашнего хозяйства, что делает ее верным спутником в вашем наборе инструментов для оказания первой помощи!
Очищающие свойства перекиси водорода объясняются выделением свободного кислорода. Кислород — одно из самых необычных лекарственных средств, которыми мы располагаем. Он может окислять клеточную стенку бактерий, которая в основном состоит из простых жирных кислот и липидов. Это изменение состава клеточной стенки позволяет кислороду без разбора убивать практически все виды бактерий и патогенов.
Кислород — одно из самых необычных лекарственных средств, которыми мы располагаем. Он может окислять клеточную стенку бактерий, которая в основном состоит из простых жирных кислот и липидов. Это изменение состава клеточной стенки позволяет кислороду без разбора убивать практически все виды бактерий и патогенов.
Объедините это действие с мощными окисляющими свойствами перманганата калия, и вы получите боеголовку против условно-патогенных бактерий и патогенов!
Кроме того, перекись водорода в более низких концентрациях, таких как 3% перекись водорода, полностью безопасна для человека. Однако нужно вовремя смывать раствор перекиси водорода и перманганата калия, чтобы избежать нежелательных раздражений. Нельзя допускать контакта смеси с кожей более 5-10 минут.
3. Дезинфицирующее средство
Аналогичные принципы можно применять против бактерий и патогенов, находящихся на поверхностях. Каждый день миллионы бактерий проникают в наши дома и покидают их. А некоторые из них могут прилипать к различным предметам и размножаться. Это явление в основном наблюдается в недавнем коронавирусе, который может сохраняться на поверхности до 3 дней!
Это явление в основном наблюдается в недавнем коронавирусе, который может сохраняться на поверхности до 3 дней!
Поэтому возникает потребность в дезинфицирующих средствах. И не любое дезинфицирующее средство, а органическое, способное очищать поверхности, не удаляя ядовитые побочные продукты. И перекись водорода ставит все галочки! Это не только просто и экономично, но и очень безопасно. Таким образом, для таких поверхностей, как кухонные столешницы, перекись водорода становится фаворитом, поскольку дезинфицирующие средства, такие как отбеливатель, могут отравить вашу пищу.
Смешивание перекиси водорода с перманганатом калия является эффективной стратегией усиления дезинфицирующих свойств. Кроме того, это позволяет им обоим высвобождать свой кислород, который, как мы знаем, является мощным противомикробным средством!
4. Окисление
До сих пор свойства перекиси водорода, которые мы обсуждали, в некоторой степени были связаны с очищающими и дезинфицирующими свойствами, вызываемыми ее кислородом. Однако окислительные свойства перекиси водорода и перманганата калия могут предложить гораздо больше!
Однако окислительные свойства перекиси водорода и перманганата калия могут предложить гораздо больше!
Такие окислительные свойства в основном проявляются при удалении неприятных запахов с поверхностей. В частности, те, которые вызваны бактериями и запахами скунса. Как вы, возможно, знаете, запахи скунса печально известны своей заразительностью и упрямством. Перекись водорода и перманганат калия могут обеспечить раствор. Самый неприятный запах скунса — это продукты гидросульфата и альдегида, которые не приятны для носа. Перекись водорода и перманганат калия могут окислить эти химические вещества в продукты без запаха или даже со сладким запахом, тем самым избавив вас от этой проблемы!
Другие последствия окислительных свойств перекиси водорода и перманганата калия можно увидеть в промышленности. Азотная кислота и серная кислота являются двумя наиболее важными химическими веществами в современной промышленности. Они оба требуют интенсивного окисления во время их производства (процессы Оствальда и Контакта). Таким образом, перекись водорода и перманганат калия являются выбором для многих отраслей промышленности, поскольку они быстро высвобождают необходимый кислород.
Таким образом, перекись водорода и перманганат калия являются выбором для многих отраслей промышленности, поскольку они быстро высвобождают необходимый кислород.
Другим важным кандидатом на окислительные свойства перекиси водорода и перманганата калия является горнодобывающая промышленность. Минералы, полученные из Земли, нечисты и химически связаны с сульфидами и оксидами. Перекись водорода и перманганат особенно могут реагировать с этими примесями и давать чистый минерал!
5. Лечение бактериальных и грибковых инфекций
Вот где многие антибиотики и дезинфицирующие средства не действуют. От бактериальных и грибковых инфекций избавиться сложно. Это потому, что они могут выработать иммунитет против применяемого агента и со временем стать устойчивыми.
Конкретным примером является золотистый стафилококк, который после интенсивного лечения антибиотиками трансформировался в MRSA. Этот возбудитель исключительно заразен и трудно поддается лечению, и для борьбы с ним требуются высокоспецифичные антибиотики.
С другой стороны, верный флакон с перекисью водорода вечен! Из-за своих окислительных свойств MRSA или любые другие бактерии не могут так легко выработать иммунитет, поскольку он нацелен на наиболее функциональные компоненты бактерий, их клеточную стенку и клеточную мембрану. Подобные окислительные свойства наблюдаются и при обработке перманганатом калия.
Грибы — неприятный класс организмов, от которых очень трудно избавиться. Но, как вы уже могли догадаться, перекись водорода и перманганат калия также очень эффективны для нейтрализации этих упрямых организмов. Клеточная стенка грибов состоит из хитина, который представляет собой сложную форму углеводов. А кислород может легко вступить в реакцию и изменить состав этой клеточной стенки, тем самым удалив инфекционные грибки.
Некоторые распространенные грибковые инфекции, такие как стригущий лишай, эпидермофития стопы, зуд спортсмена и дрожжевые инфекции, легко лечатся окисляющими свойствами перекиси водорода и перманганата калия.
6. Лечение дерматита
Как упоминалось выше, дерматит — это аллергическая реакция, возникающая на коже. Они могут варьироваться от небольших зудящих пятен до полномасштабных волдырей и сыпи.
Показано, что кислород перекиси водорода ингибирует образование митохондриальных цитокинов, подавляющих иммунный ответ на аллерген, тем самым уменьшая воспаление и покраснение.
Если вы регулярно болеете дерматитом, возможно, вы захотите использовать кремы и мази, в состав которых входят перекись водорода и перманганат калия.
7. Стерилизующее оборудование
В больницах, особенно в хирургических отделениях, для осмотра и операций пациентов используются сотни видов оборудования. И чаще всего они покрыты несметным числом микробов и бактерий, которые могут привести к тяжелым осложнениям при непосредственном контакте с внутренними частями тела.
Поэтому перед операцией на пациенте необходимо удалить все виды бактерий и микробов с оборудования. И вы должны убедиться, что оборудование полностью очищено от микробов.
И вы должны убедиться, что оборудование полностью очищено от микробов.
Вместо того, чтобы покупать новое оборудование, каждый раз, когда врачи работают, они внедрили эффективную систему, которая может убить почти все микробы. Он включает в себя обработку оборудования органическими дезинфицирующими средствами, такими как перекись водорода и перманганат калия. А затем кипятить их при высоких температурах, чтобы обеспечить тщательную очистку
С помощью этого метода больницы экономят миллионы долларов и обеспечивают чистоту и безопасность оборудования!
Некоторые общие меры предосторожности, которые необходимо соблюдать при работе с едкими химическими веществами
При проведении титрования перманганатом калия и перекисью водорода необходимо соблюдать крайние меры предосторожности при работе с концентрированной серной кислотой, используемой в эксперименте. Серная кислота является чрезвычайно агрессивным химическим веществом. Поэтому, если вы не имеете большого опыта обращения с оборудованием, лучше всего выполнять его под наблюдением специалиста.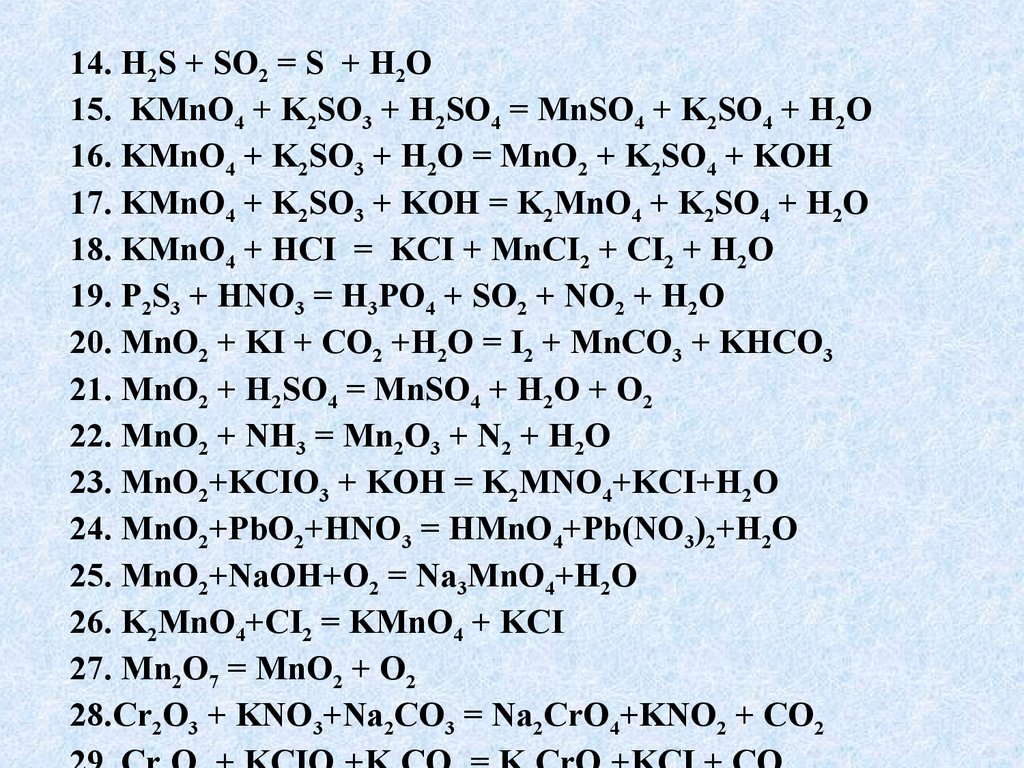
Кроме того, не забудьте надеть перчатки и защитные очки на протяжении всего эксперимента. Перекись водорода и перманганат калия сами по себе обладают раздражающими кожу свойствами, если они могут оставаться там в течение более длительного времени.
В дополнение к вышеупомянутым пунктам убедитесь, что поверхность, на которую вы наносите перекись водорода, не имеет темного цвета. Перекись водорода обладает отбеливающими свойствами и может вызвать обесцвечивание поверхности и ковров, если ее применять без предварительного тестирования. Он идеально подходит для проверки поверхности, на которую вы наносите перекись водорода, с помощью капли и проверки на любые обесцвечивания.
Окончательный вердикт
Перекись водорода и перманганат калия являются отличными окислителями, дающими выдающиеся результаты. Однако для тех применений, о которых мы упоминали в статье, достаточно только перекиси водорода.
Сочетание перманганата калия с перекисью водорода делает процесс довольно сложным и дает в лучшем случае аналогичные результаты.

 11.14
11.14