Метод полуреакций | Дистанционные уроки
09-Июл-2012 | комментариев 207 | Лолита Окольнова
Решаем Часть С задание №1
Дано уравнение:
h3S + K2Cr2O7 + h3SO4 → …
Как решать такие окислительно-восстановительные реакции?
Уравнивание окислительно-восстановительных реакций
Во-первых, давайте определимся, в каких случаях лучше использовать метод полуреакций:
- реакция происходит в растворе
- в реакции принимают участие больше чем 2 реагента, да и продуктов реакции больше, чем 2
Правила метода полуреакций
(проще всего будет объяснить их сразу на примере)
h3S + K2Cr2O7 + h3SO4 → …
1. Определяем участников окислительно-восстановительного процесса:
K2Cr2O7 — Сr находится в высшей степени окисления — +6, значит бихромат калия будет окислителем, т.
Давайте думать логически.
Допустим, у нас образовался оксид, один из реагентов это серная кислота . Будет она реагировать с оксидом? Конечно! Мы получим Cr3+
Второй реагент — h3S. Сера находится в минимальной степени окисления — -2. Значит, она будет окисляться. До S°.
2. Выписываем участников овр в ионной форме (!) (Т.е., те вещества. которые нельзя разбить на ионы, пишем в том виде, в каком они представлены)
Сr2O7(2)- → Cr(3+)
S(2-) → S(0)
3. Уравниваем количество атомов:
Сr2O7(2-) → 2Cr3(+)
S(2- ) → S(0)
4. Определяем среду реакции. У нас один из реагентов — серная кислота, значит, среда у нас однозначно кислая.
Определяем среду реакции. У нас один из реагентов — серная кислота, значит, среда у нас однозначно кислая.
В кислой среде раствора уравнивание недостающих атомов идет по схеме:
h3O → H(+)
Причем, воду мы прибавляем в ту часть уравнения, где недостаток кислорода (!)
Сr2O7(2-) → 2Cr(3+) + 7h3O
теперь у нас изменилось количество водорода, надо его уравнять
Сr2O7(2-) +14H(+) → 2Cr(3+) + 7h3O
5. Уравниваем заряды:
Сr2O7(2)- +14H(+) → 2Cr(3+) + 7h3O
Сr2O7(2-) +14H(+) + 6е- → 2Cr(3+) + 7h3O
S2- → S°
-2 0
S(2-) -2е- → S(0)
6. Теперь надо уравнять реакции восстановления и окисления между собой ( чтобы “количество принятых электронов было равно количеству отданных”)
Теперь надо уравнять реакции восстановления и окисления между собой ( чтобы “количество принятых электронов было равно количеству отданных”)
Сr2O7(2)- +14H(+) +6e- → 2Cr(3+) + 7h3O |*1
S(2- ) -2е- → S(0 ) |*3
7. Выписываем все реагенты с учетом коэффициентов и все продукты овр:
Сr2O7(2-) +14H(+) + 3S(2-) → 2Cr(3+) + 7h3O + 3S(0)
8. Дописываем к каждому иону его “половинку” с учетом коэффициентов и сочетаем продукты реакции:
Сr2O7(2-) +14H(+) + 3S(2-) → 2Cr(3+) + 7h3O + 3S(0)
+2K(+) +7SO4(2-) + 6H(+) → +2K(+) +7SO4(2-) + 6H(+)
____________________________________________
K2Cr2O7 + 7h3SO4 + 3h3S → Cr2(SO4)3 + 7h3O + 3S + K2SO4 + 3h3SO4
9. Сокращаем одинаковые молекулы слева и справа:
Сокращаем одинаковые молекулы слева и справа:
K2Cr2O7 + 4h3SO4 + 3h3S → Cr2(SO4)3 + 3S + K2SO4 + 7h3O
Метод полуреакций удобен тем, что можно легко предсказать продукты реакции и сочетания ионов. Да и уравнивать таким способом легче.
Естественно, этот метод подходит только для водных растворов.
Для решения овр такого типа нужно просто натренироваться, для этого предлагаю вам решить следующие овр методом полуреакций:
- MnO2 + O2 + KOH → …
- Cl2 + NaOH → NaClO3 + …
- CrCl3 + H2O2 + KOH → …
Как всегда, в заданиях такого типа (часть С №1) нужно предсказать продукты реакции и уравнять. Если что-то не будет получаться или возникнут вопросы, пишите в комментариях — обсудим.
Как решать окислительно-восстановительные реакции в кислой среде раствора мы разобрали, в щелочной — смотрите << здесь >>
- в ЕГЭ это вопрос C1 — примеры окислительно-восстановительных реакций
- Подписка на рассылку
(Правила комментирования)
Подготовка к ЕГЭ: составление уравнений реакций методом электронного баланса.
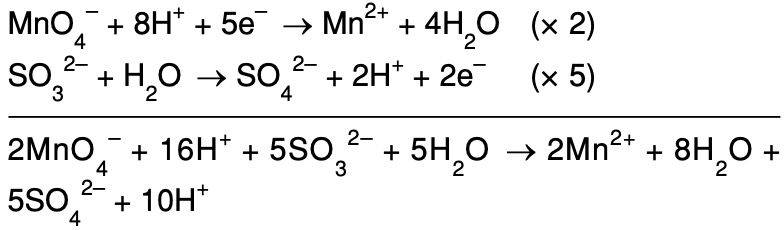
Задания С1
Используя метод электронного баланса, составьте уравнения реакций, укажите окислитель и восстановитель:
1.Cr2(SO4)3 +… + NaOH → Na2CrO4 + NaBr + … + h3O
2.Si + HNO3 + HF → h3SiF6 + NO + …
3.P + HNO3 + … → NO + …
4.K2Cr2O7 + … + h3SO4 → I2 + Cr2(SO4)3 + … + h3O
5.P + HNO3 + … → NO2 + …
6.K2Cr2O7 + HCl → Cl2 + KCl + … + …
7.B + HNO3 + HF → HBF4 + NO2 + …
8.KMnO4 + h3S + h3SO4 → MnSO4 + S + …+ …
9.KMnO4 + … → Cl2 + MnCl2 + … + …
10. h3S + HMnO4 → S + MnO2 + …
11. KMnO4 + KBr + h3SO4 → MnSO4 + Br2 + … + …
12. KClO + … → I2 + KCl + …
13. KNO2 + … + h3SO4 → NO + I2 + … + …
14. NaNO2 + … + h3SO4 → NO + I2 + … + …
15. HCOH + KMnO4 → CO2 + K2SO4 + … + …
16. Ph4 + HMnO4 → MnO2 + … + …
Ph4 + HMnO4 → MnO2 + … + …
17. P2O3 + HNO3 + … → NO + …
18. Ph4 + HClO3 → HCl + …
19. Zn + KMnO4 + … → … + MnSO4 + K2SO4 + …
20.FeCl2 + HNO3 (конц.) → Fe(NO3)3 + HCl + … + …
Задания C1
(решения и ответы)
1.Cr2(SO4)3 + 3Br2 + 16NaOH = 2Na2CrO4 + 6NaBr + 3Na2SO4 + 8h3O
2 Cr+3 — 3ē → Cr+6
3 Br20 + 2ē → 2Br-1
Cr2(SO4)3 (Cr+3) – восстановитель, Br2 – окислитель
2.3Si + 4HNO3 + 18HF = 3h3SiF6 + 4NO + 8h3OSi0 — 4ē → Si+4
N+5 + 3ē → N+2 3
4
Si – восстановитель, HNO3(N+5) – окислитель
3.3P + 5HNO3 + 2h3O = 3h4PO4 + 5NOP0 — 5ē → P+5
N+5 + 3ē → N+2 3
5
P – восстановитель, HNO3 (N+5) – окислитель
4. K2Cr2O7 + 6KI + 7h3SO4 = 3I2 + Cr2(SO4)3 + 4K2SO4 + 7h3Cr+6 + 3ē → Cr+3
K2Cr2O7 + 6KI + 7h3SO4 = 3I2 + Cr2(SO4)3 + 4K2SO4 + 7h3Cr+6 + 3ē → Cr+3
2I- — 2ē → I2 2
3
KI (I-) – восстановитель, K2Cr2O7 (Cr+6) – окислитель
5.P + 5HNO3 = h4PO4 + 5NO2 + h3OP0 — 5ē → P+5
N+5 + 1ē → N+4 1
5
P – восстановитель, HNO3 (N+5) – окислитель
6.K2Cr2O7 + 14HCl = 3Cl2 + 2KCl + 2CrCl3 + 7h3Cr+6 + 3ē → Cr+3
2Cl- — 2ē → Cl2 2
3
K2Cr2O7 (Cr+6) – окислитель, HCl (Cl-) – восстановитель
7.B + 3HNO3 + 4HF = HBF4 + 3NO2 + 3h3OB0 — 3ē → B+3
N+5 + 1ē → N+4 1
3
B – восстановитель, HNO3 (N+5) – окислитель
8.2KMnO4 + 5h3S + 3h3SO4 = 2MnSO4 + 5S + K2SO4 + 8h3OMn+7 + 5ē → Mn+2
S-2 — 2ē → S 2
5
h3S (S-2) – восстановитель, KMnO4 (Mn+7) – окислитель
9. 2KMnO4 + 16HCl = 5Cl2 + 2MnCl2 + 2KCl + 8h3OMn+7 + 5ē → Mn+2
2KMnO4 + 16HCl = 5Cl2 + 2MnCl2 + 2KCl + 8h3OMn+7 + 5ē → Mn+2
2Cl- — 2ē → Cl2 2
5
KMnO4 (Mn+7) – окислитель, HCl (Cl-) – восстановитель
10.3h3S + 2HMnO4 = 3S + 2MnO2 + 4h3OS-2 — 2ē → S
Mn+7 + 3ē → Mn+4 3
2
h3S (S-2) – восстановитель, HMnO4 (Mn+7) – окислитель
11.2KMnO4 + 10KBr + 8h3S04 = 2MnSO4 + 5Br2 + 6K2SO4 + 8h3O2Br- — 2ē → Br2
Mn+7 + 5ē → Mn+2 5
2
KMnO4 (Mn+7) – окислитель, KBr (Br-) – восстановитель
12.KClO + 2HI = I2 + KCl + h3OCl+1 + 2ē → Cl-1
2I- — 2ē → I2 1
1
KClO (Cl+1) – окислитель, HI (I-) – восстановитель
13.KNO2 + 2HI + h3SO4 = 2NO + I2 + K2SO4 + 2h3ON+3+1ē → N+2
2I- — 2ē → I2 2
1
KNO2 (N+3) – окислитель, HI (I-) – восстановитель
14. 2NO + 3KClO + 2KOH = 2KNO3 + 3KCl + h3ON+2 — 3ē → N+5
2NO + 3KClO + 2KOH = 2KNO3 + 3KCl + h3ON+2 — 3ē → N+5
Cl+1+2ē → Cl-1 2
3
NO (N+2) – восстановитель, KClO (Cl+1) – окислитель
15.5HCOH + 4KMnO4 + 6h3SO4 = 5CO2 + 2K2SO4 + 4MnSO4 + 11h3OMn+7 + 5ē → Mn+2
C0 — 4ē → C+4 4
5
HCOH – восстановитель, KMnO4 (Mn+7) – окислитель
16.3Ph4 + 8HMnO4 = 3h4PO4 + 8MnO2 + 4h3OP-3 — 8ē → P+5
Mn+7 + 3ē → Mn+4 3
8
KMnO4 (Mn+7) – окислитель, Ph4 (P-3) – восстановитель
17.3P2O3 + 4HNO3 + 7h3O = 4NO + 6h4PO4N+5+ 3ē → N+2
2P+3 — 4ē → 2P+5 4
3
P2O3 (P+3) – восстановитель, HNO3 (N+5) – окислитель
18.3Ph4+ 4HClO3 = 4HCl + 3h4PO4P-3 — 8ē → P+5
Cl+5 + 6ē → Cl-1 3
4
Ph4 (P-3) – восстановитель, HClO3 (Cl+5) – окислитель
19.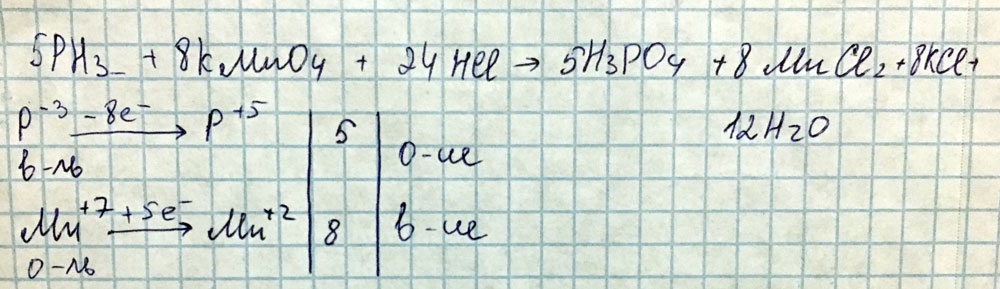 5Zn + 2KMnO4 + 8h3SO4 = 5ZnSO4 + 2MnSO4 + K2SO4 + 8h3OMn+7 + 5ē → Mn+2
5Zn + 2KMnO4 + 8h3SO4 = 5ZnSO4 + 2MnSO4 + K2SO4 + 8h3OMn+7 + 5ē → Mn+2
Zn0 — 2ē → Zn+2 2
5
Zn0 — восстановитель, KMnO4 (Mn+7) — окислитель
20.FeCl2 + 4HNO3 = Fe(NO3)3 + 2HCl + NO2 + h3OFe+2 — 1ē → Fe+3
N+5 + 1ē → N+4 1
1
FeCl2 (Fe+2) – восстановитель, HNO3(N+5) — окислитель
Задания С2
Даны вещества: магний аммиак, азот, азотная кислота (разб.). Напишите уравнения четырех возможных реакций между этими веществами.
Даны вещества: кальций, фосфор, азотная кислота. Напишите уравнения четырех возможных реакций между этими веществами.
Даны вещества: сульфит натрия, вода, гидроксид калия, перманганат калия, фосфорная кислота. Напишите уравнения четырех возможных реакций между этими веществами.
Даны вещества: медь, азотная кислота, сульфид меди (II), оксид азота (II).

Напишите уравнения четырех возможных реакций между этими веществами.
Даны вещества: сера, сероводород, азотная кислота (конц.), серная кислота (конц.). Напишите уравнения четырех возможных реакций между этими веществами.
Даны водные растворы: хлорида железа (III), иодида натрия, бихромата натрия, серной кислоты и гидроксида цезия. Напишите уравнения четырех возможных реакций между этими веществами.
Даны вещества: алюминий, хлор, йодид калия, серная кислота (конц.).
Напишите уравнения четырех возможных реакций между этими веществами.
Даны вещества: углерод, водород, серная кислота (конц.), дихромат калия. Напишите уравнения четырех возможных реакций между этими веществами.
Даны вещества: кремний, соляная кислота, едкий натр, гидрокарбонат натрия. Напишите уравнения четырех возможных реакций между этими веществами.
Даны вещества: алюминий, вода, разбавленная азотная кислота, концентрированный раствор гидроксида натрия.
 Напишите уравнения четырех возможных реакций.
Напишите уравнения четырех возможных реакций.Даны водные растворы: сульфида натрия, сероводорода, хлорида алюминия, хлора. Напишите уравнения четырех возможных реакций между этими веществами.
Даны вещества: оксид натрия, оксид железа (III), иодоводород, углекислый газ. Напишите уравнения четырех возможных реакций между этими веществами.
Даны водные растворы: гексагидроксоалюмината калия, хлорида алюминия, сероводорода, гидроксида рубидия. Напишите уравнения четырех возможных реакций между этими веществами
Даны вещества: карбонат калия (раствор), гидрокарбонат калия (раствор), углекислый газ, хлорид магния, магний. Напишите уравнения четырех возможных реакций между этими веществами.
Даны вещества: нитрат натрия, фосфор, бром, гидроксид калия (раствор). Напишите уравнения четырех возможных реакций между этими веществами.
Задания С2 (решения и ответы)
1. 3Mg + N2 =Mg3N2
3Mg + 2Nh4= Mg3N2 + 3h3
4Mg + 10HN03 = 4Mg(NO3)2 + N2O + 5h3O
Nh4 + HNO3= Nh5NO3
2. 4Ca + 10HNO3(конц) = 4Сa(NO3)2 + N2O + 5h3O
4Ca + 10HNO3(конц) = 4Сa(NO3)2 + N2O + 5h3O
4Ca + 10HNO3(разб)= 4Сa(NO3)2 + Nh5NO3 + 3h3O
P + 5HNO3 = h4PO4 + 5NO2 + h3O
3Ca + 2P = Ca3P2
3. Na2SO3 + 2KMnO4 + 2KOH = Na2SO4 + 2K2MnO4 + h3O
3Na2SO3 + 2KMnO4 + h3O = 3Na2SO4 + 2MnO2 + 2KOH
Na2SO3 + h4PO4 = Nah3PO4 + NaHSO3
3KOH + h4PO4= K3PO4 + 3h3O
4. Cu + 4HNO3(конц) = Cu(NO3)2 + 2NO2 + 2h3O
3Cu + 8HNO3(разб) = 3Cu(NO3)2 + 2NO + 4h3O
CuS + 8HNO3(конц) = CuSO4+ 8NO2 + 4h3O
2Cu + 2NO = 2CuO + N2
5. S + 6HNO3(конц) = h3SO4 + 6NO2 + 2h3O
S + 2h3SO4(конц) = 3SO2 + 2h3O
h3S + 2HNO3(конц) = S + 2NO2 + 2h3O
h3S + 3h3SO4(конц) = 4SO2 + 4h3O
6. 2FeCl3 + 2NaI = 2NaCl + 2FeCl2 + I2
FeCl3 + 3CsOH = Fe(OH)3↓ + 3CsCl
h3SO4 + 2CsOH = Cs2SO4 + 2h3O
Na2Cr2O7 + 2CsOH = Na2CrO4 + Cs2CrO4 + h3O
Na2Cr2O7 + 6NaI + 7h3SO4 = Cr2(SO4)3 + 3I2 + 4Na2SO4 + 7h3O
7. 2Al + 3Cl2 = 2AlCl3
2KI + Cl2 = I2 + 2KCl
2KI + 2h3SO4(конц) = I2 + K2SO4 + SO2 + 2h3O
t
2Al + 6h3SO4(конц) = Al2(SO4)3 + 3SO2 + 6h3O
8.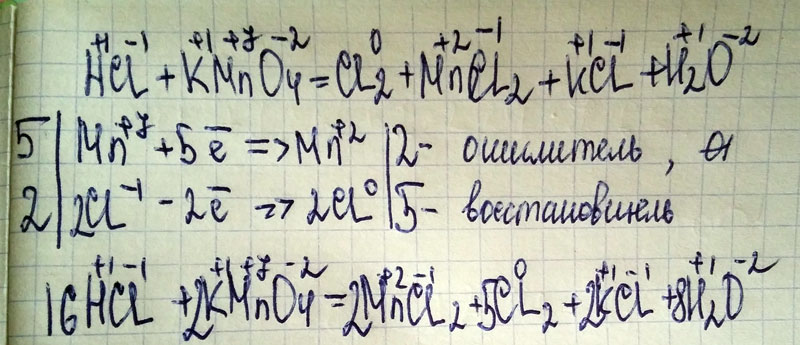 C + 2h3SO4(конц)= CO2 + 2SO2 + 2h3O
C + 2h3SO4(конц)= CO2 + 2SO2 + 2h3O
3C + 8h3SO4 + 2K2Cr2O7 = 3CO2 + 2Cr2(SO4)3 + 2K2SO4 + 8h3O
C + 2h3 = Ch5
K2Cr2O7 + 2h3SO4 = 2KHSO4 + 2CrO3 + h3O
9. NaOH + HCl = NaCl + h3O
NaHCO3 + HCl = NaCl + CO2 + h3O
NaHCO3 + NaOH = Na2CO3 + h3O
Si + 4NaOH = Na4SiO4 + 2h3↑
10. 2Al(безокс.пя) + 6h3O = 2Al(OH)3 + 3h3↑
NaOH + HNO3 = NaNO3 + h3O
8Al + 30HNO3 = 8Al(NO3)3 + 3Nh5NO3 + 9h3O
2Al + 2NaOH + 6h3O = 2Na[Al(OH)4] + 3h3↑
(Допустимо Na3[Al(OH)6])
11. Na2S + h3S = 2NaHS
3Na2S + 2AlCl3 +6h3O = 3h3S + 2Al(OH)3 +6NaCl
Na2S + Cl2 = 2NaCl + S
h3S + Cl2 = 2HCl + S
12. Na2O +Fe2O3 = 2NaFeO2
2HI + Na2O = 2NaI + h3O
Na2O + CO2 = Na2CO3
Fe2O3 + 6HI = 2FeI2 + I2 + 3h3O
13. K3[Al(OH)6] + AlCl3 = 2Al(OH)3 + 3KCl
K3[Al(OH)6] + 3h3S = Al(OH)3 + 3KHS + 3h3O
h3S + 2RbOH = Rb2S + 2h3O
AlCl3 + 3RbOH = Al(OH)3 + 3RbCl
14. K2CO3 + CO2 + h3O = 2KHCO3
2K2CO3 + h3O + MgCl2 = (MgOH)2CO3 + CO2 + 4KCl
2KHCO3 + MgCl2 = MgCO3 + 2KCl + CO2 + h3O
CO2 + 2Mg = C + 2MgO
15. 5NaNO3 + 2P = 5NaNO2 + P2O5
5NaNO3 + 2P = 5NaNO2 + P2O5
5Br2 + 2P = 2PBr5
4P + 3KOH + 3h3O = 3Kh3PO4 + Ph4
Br2 + 2KOH(хол) = KBrO + KBr + h3O
3Br2 + 6KOH(гор) = 5KBr + KBrO3 + 3h3O
Задания С3
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
t, Сакт. Ch4Cl, AlCl3 Сl2, УФ КОН водн.,t
1. Этин → Х1 → толуол → Х2 → Х3 → С6Н5-СН2-ООСН
h3SO4 разб. h3SO4 конц. t Br2 KOH, h3O, t
2. Калий → этилат калия → Х1 → СН2 = СН2 → Х2 → Х3
Н2О 1200 t, кат. СН3Cl, AlCl3Cl2,УФ
3. Карбид алюминия → Х1 → Х2 → бензол → Х3 → Х4
KMnO4, H+CaCO3 t
4. CaC2 → этин → этаналь → Х1 → Х2 → Х3
СН3Cl, AlCl3 СН3ОН, Н+
5. Метан → Х1 → бензол → Х2 → бензойная кислота → Х3
Br2, свет КОН(спирт.) HBrNa
6. СН3-СН2-СН(СН3)-СН3 → Х1 → Х2 → Х1 → Х3 → СО2
NaMnO4, NaOH электролиз Cl2, светKOH, h3Oh3SO4, t
7. СН3СНО → Х1 → С2Н6 → Х2 → Х3 → (С2Н5)2О
h3O, Hg2+ KMnO4, H+ NaOH Ch4I h3O, H+
8. С2Н2 → Х1 → СН3СООН → Х2 → Х3 → уксусная кислота
С2Н2 → Х1 → СН3СООН → Х2 → Х3 → уксусная кислота
Н2, кат. Na HCl KMnO4, h3SO4
9. СН4 → НСНО→ Х1 → Х2 → Х1 → Х3
С, t Br2 ,hνKOH(спирт.)KMnO4, h3O
10. С2Н2 → Х1 → С6Н5С2Н5 → Х2 → Х3 → Х4
[Ag(Nh4)2]OHCl2,hνNaOH(спирт.) СН3ОН, Н+ полимеризация
11. СН3-СН2-СНО → Х1 → Х2 → Х3 → Х4 → Х5
h3SO4, 200Cкат., t[Ag(Nh4)2]OH HCl KMnO4, h3O
12. Этанол → Х1 → Х2 → Ag2C2→ Х2 → Х3
Cакт., tCl2, FeCl3,tKMnO4
13. С2Н2 → Х1 → Х2 → С6Н5СН3 → СН3-С6Н4-NO2 → Х3
электролиз Cl2, hνNaOH, h3Oh3SO4 (конц), t ‹ 140
14. СН3СООН→ Х1 → С2Н6 → Х2 → Х3 → Х4
Н2, Ni, t HBr [Ag(Nh4)2]OH
15. СН3СНО → Х1 → Х2 → этилен → СН3СНО → Х3
Задания С3
(решения и ответы)1. Cакт., t
1) 3C2h3→ C6H6
AlCl3
2) C6H6 + Ch4Cl → C6H5Ch4 + HCl
hν
3) C6H5Ch4 + Cl2 → C6H5Ch3Cl + HCl
h3O
4) C6H5Ch3Cl + KOH → C6H5Ch3OH + KCl
h3SO4, t
5) C6H5Ch3OH + HCOOH → C6H5Ch3OOCH + h3O
2. 1) 2K + 2C2H5OH → 2C2H5OK + h3
1) 2K + 2C2H5OH → 2C2H5OK + h3
2) C2H5OK + h3SO4 → C2H5OH + K2SO4
h3SO4, t
3) C2H5OH → C2h5 + h3O
4) Ch3=Ch3 + Br2 → Ch3Br-Ch3Br
h3O
5) Ch3Br-Ch3Br + 2KOH → Ch3OH-Ch3OH + 2KBr
3. 1) Al4C3 + 12h3O → 3Ch5 + 4Al(OH)3
t
2) 2Ch5 → C2h3 + 3h3
Cакт., t
3) 3C2h3 → C6H6
AlCl3
4) C6H6 + Ch4Cl → C6H5Ch4 + HCl
hν
5) C6H5Ch4 + Cl2 → C6H5Ch3Cl + HCl
4. 1) CaC2 + 2h3O → Ca(OH)2 + C2h3
Hg2+
2) C2h3 + h3O → Ch4CHO
3) 5Ch4CHO+ 2KMnO4 + 3h3SO4 → 5Ch4COOH + K2SO4 + 2MnSO4 + 3h3O
4) 2Ch4COOH + CaCO3 → (Ch4COO)2Ca + h3O + CO2
t
5) (Ch4COO)2Ca → CaCO3 + Ch4-CO-Ch4
5. t
1) 2Ch5 → C2h3 + 3h3
Cакт., t
2) 3C2h3 → C6H6
AlCl3
3) C6H6 + Ch4Cl → C6H5Ch4 + HCl
4) 5C6H5Ch4 + 6KMnO4 + 9h3SO4 →
5Ch4COOH + 3K2SO4 + 6MnSO4 + 14h3O
h3SO4, t
5) Ch4COOH + Ch4OH → Ch4COOCh4 + h3O
6. 1) Ch4-Ch3-CH(Ch4)-Ch4 + Br2 → Ch4-Ch3-CBr(Ch4)-Ch4 + HBr
2) Ch4-Ch3-CBr(Ch4)-Ch4 + KOH(спирт. ) → Ch4-CH=C(Ch4)-Ch4 + h3O + KBr
) → Ch4-CH=C(Ch4)-Ch4 + h3O + KBr
3) Ch4-CH=C(Ch4)-Ch4 + HBr →Ch4-Ch3-CBr(Ch4)-Ch4
t
4) 2Ch4-Ch3-CBr(Ch4)-Ch4 + 2Na → Ch4-Ch3-C(Ch4)2-C(Ch4)2-Ch3-Ch4 + 2NaBr
t
5) 2C10h32+ 31O2 → 20CO2↑ + 22h3O
7. 1) Ch4CHO + 2NaMnO4 + 3NaOH → Ch4COONa + 2Na2MnO4 + 2h3O
эл.ток
2) 2Ch4COONa → C2H6 + 2NaHCO3 + h3↑
hν
3) C2H6 + Cl2 → C2H5Cl + HCl
h3O
4) C2H5Cl + KOH → C2H5OH + NaCl
h3SO4, t
5) 2C2H5OH → C2H5-O-C2H5 + h3O
8. Hg2+
1) C2h3 + h3O → Ch4COH
2) 5Ch4CHO + 2KMnO4 + 3h3SO4 → 5Ch4COOH + K2SO4 + 2MnSO4 + 3h3O
3) Ch4COOH + NaOH → Ch4COONa + h3O
4) Ch4COONa + Ch4I → Ch4COOCh4 + NaI
H+
5) Ch4COOCh4 + h3O → Ch4COOH + Ch4OH
9. t, кат.
1) Ch5 + O2 →HCHO + h3O
t, кат.
2) HCHO + h3 → Ch4OH
3) 2Ch4OH + 2Na → 2Ch4ONa + h3↑
4) Ch4ONa + HCl → 2Ch4OH + NaCl
5) 5Ch4OH + 6KMnO4 + 9h3SO4 → 5CO2↑ + 6MnSO4 + 3K2SO4 + 19h3O
10. 1) 3C2h3 → C6H6
AlCl3
2) C6H6 + C2H5Cl → C6H5C2H5 + HCl
hν
3) C6H5C2H5 + Br2 → C6H5-CHBr-Ch4 + HBr
4) C6H5-CHBr-Ch4 + KOH(спирт. ) → C6H5-CH=Ch3+KBr + h3O
) → C6H5-CH=Ch3+KBr + h3O
5) 3C6H5-CH=Ch3 + 2KMnO4 + 4h3O → 3C6H5-CH(OH)-Ch3OH + 2MnO2 + 2KOH
11. t
1) Ch4-Ch3-CHO + 2[Ag(Nh4)2]OH → Ch4-Ch3-CHOOH + 2Ag + 4Nh4 + h3O
hν
2) Ch4-Ch3-CHOOH + Cl2 → Ch4-CHCl-COOH + HCl
3) Ch4-CHCl-COOH + NaOH(спирт.) → Ch3=CH-COOH + NaCl + h3O
h3SO4, t
4) Ch3=CH-COOH + Ch4OH → Ch3=CH-COOCh4 + h3O
t,кат.
5) nCh3=CH-COOCh4 → (-Ch3-CH-)n
|
COOCh4
12. h3SO4, 200C
1) C2H5OH → Ch3=Ch3 + h3O
t, Pt
2) Ch3=Ch3 → C2h3 + h3
3) C2h3 + 2[Ag(Nh4)2]OH → C2Ag2↓+ 4Nh4 + 2h3O
4) C2Ag2 + 2HCl → C2h3 + 2AgCl
5) 3C2h3 + 8KMnO4 → 3K2C2O4 + 2KOH + 8MnO2 + 2h3O
13. Cакт., t
1) 3C2h3→ C6H6
FeCl3, t
2) C6H6 + Cl2 →C6H5Cl + HCl
t
3) C6H5Cl + Ch4Cl + 2Na → C6H5-Ch4 + 2NaCl
h3SO4, t
4) C6H5-Ch4 + HO-NO2 → Ch4-C6h5-NO2 + h3O
5) 5Ch4-C6h5-NO2 + 6KMnO4 + 9h3SO4 →
5HOOC-C6h5-NO2 + 6MnSO4 + 3K2SO4 + 14h3O
14. 1) Ch4СОOH + NaOH → Ch4СОONa + h3O
1) Ch4СОOH + NaOH → Ch4СОONa + h3O
эл. ток
2) 2Ch4СОONa + 2h3O → C2H6 + 2NaHCO3+ h3↑
hν
3) C2H6 + Cl2 → C2H5Cl + HCl
h3O
4) C2H5Cl + NaOH → C2H5OH + NaCl
h3SO4, t
5) 2C2H5OH → C2H5-O-C2H5 + h3O
15. t, кат.
1) Ch4CHO + h3 → C2H5OH
h3SO4
2) C2H5OH + HBr → C2H5Br + h3O
3) C2H5Br + KOH(спирт.) → C2h5 + KBr + h3О
t, Pd2+
4) 2C2h5 + O2 → 2Ch4CHO
t
5) Ch4CHO + 2[Ag(Nh4)2]OH → Ch4COOH + 2Ag↓ + 4Nh4 + h3O
Задания С5
Масса неизвестного объема воздуха равна 0,123 г, а масса такого же объема газообразного алкана 0,246 г (при одинаковых условиях). Определите молекулярную формулу алкана.
Органическое вещество массой 1,875 г занимает объем 1 л (н.у.). При сжигании 4,2 г этого вещества образуется 13,2 г СО2 и 5,4 г воды. Определите молекулярную формулу вещества.
Установите молекулярную формулу предельного третичного амина, содержащего 23,73% азота по массе.

Предельную одноосновную карбоновую кислоту массой 11 г растворили в воде. Для нейтрализации полученного раствора потребовалось 25 мл раствора гидроксида натрия, молярная концентрация которого 5 моль/л. Определите формулу кислоты.
Установите молекулярную формулу дибромалкана, содержащего 85,11% брома.
Установите молекулярную формулу алкена, если известно, что одно и то же количество его, взаимодействуя с галогенами, образует, соответственно, или 56,5 г дихлорпроизводного или 101 г дибромпроизводного.
При сгорании 9 г предельного вторичного амина выделилось 2,24 л азота и 8,96 л (н.у.) углекислого газа. Определите молекулярную формулу амина.
При взаимодействии 0,672 л алкена (н.у.) с хлором образуется 3,39 г его дихлорпроизводного. Определите молекулярную формулу алкена, запишите его структурную формулу и название.
При полном сжигании вещества, не содержащего кислорода, образуется азот и вода.
 Относительная плотность паров этого вещества по водороду равна 16. Объем необходимого на сжигание кислорода равен объему выделившегося азота. Определите молекулярную формулу соединения.
Относительная плотность паров этого вещества по водороду равна 16. Объем необходимого на сжигание кислорода равен объему выделившегося азота. Определите молекулярную формулу соединения.При взаимодействии 11,6 г предельного альдегида с избытком гидроксида меди (II) при нагревании образовался осадок массой 28,8 г. Выведите молекулярную формулу альдегида.
Установите молекулярную формулу алкена и продукта взаимодействия его с 1 моль бромоводорода, если это монобромпроизводное имеет относительную плотность по воздуху 4,24. Укажите название одного изомера исходного алкена.
При взаимодействии одного и того же количества алкена с различными галогеноводородами образуется, соответственно, 7,85 г хлорпроизводного или 12,3 г бромпроизводного. Определите молекулярную формулу алкена.
При взаимодействии 1,74 г алкана с бромом образовалось 4,11 г монобромпроизводного. Определите молекулярную формулу алкана.
При сгорании 9 г первичного амина выделилось 2,24 л азота (н.
 у.). Определите молекулярную формулу амина, приведите его название.
у.). Определите молекулярную формулу амина, приведите его название.На полное сгорание 0,2 моль алкена израсходовано 26,88 л кислорода (н.у.). Установите название, молекулярную и структурную формулы алкена.
При взаимодействии 25,5 г предельной одноосновной кислоты с избытком раствора гидрокарбоната натрия выделилось 5,6 л (н.у.) газа. Определите молекулярную формулу кислоты.
Массовая доля кислорода в предельной одноосновной кислоте составляет 43,24 %. Определите молекулярную формулу этой кислоты.
Задания С5
(решения и ответы)
1. n(возд.) = n(Cnh3n+2)
M(Cnh3n+2) = 14n+2
0,123 / 29 = 0,246 / (14n+2)
n = 4, C4h20
2. M = 1,875 г/л . 22,4 л/моль= 42 г/моль
n(CO2) = 13,2 г / 44 г/моль= 0,3 моль
n(C) = 0,3 моль
m(C) = 0,3 моль . 12 г/моль = 3,6г
n(h3O) = 5,4 г / 18 г/моль = 0,3 моль
n(H) = 0,6 моль
m(H) = 0,6 моль . 1 г/моль = 0,6 г
4,2 г – (3,6г + 0,6г) = 0, кислорода нет.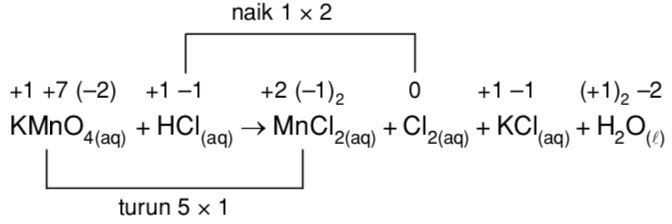
n(C) : n(H) = 0,3 : 0,6 = 1 :2
Ch3 – простейшая формула
42 / 14 = 3, С3Н6
3. R1 – N – R3
|
R2
Mr(амина) = Ar(N) / ω(N) = 14 / 0,2373 = 59
59 – 14 = 45 (R1, R2, R3)
45 / 3 = 15 Ch4 – все радикалы.
(СН3)3N — триметиламин
4. Сnh3n+1COOH + NaOH = Cnh3n+1COONa + h3O
n(NaOH) = 5 моль/л . 0,025 л = 0,125 моль
n(кислоты) = 0,125 моль
М(кислоты) = 11г / 0,125 моль = 88 г/моль
М(Cnh3n+1COOH) = 12n + 2n + 1 + 45 = 14n +46
14n + 46 = 88
n = 3, C3H7COOH
5. Cnh3пBr2
Mr(Cnh3Br2) = 160 / 0,8511 = 188
12n + 2n + 160 = 188
n = 2, C2h5Br2 — дибромэтан
6. Cnh3n + Cl2 → Cnh3nCl2
Cnh3n + Br2 → Cnh3nBr2
n(Cnh3nCl2) = n(Cnh3nBr2)
M(Cnh3nCl2) = 14n + 71
M(Cnh3nBr2) = 14n + 160
56,5 / (14n+71) = 101 / (14n+160)
n = 3, C3H6
7. R1 – NH – R2
n(N2) = 2,24 л / 22,4л/моль = 0,1 моль
n(N2) = 0,2моль
n(CO2) = 8,96л / 22,4л/моль = 0,4 моль
n(C) = 0,4 моль
n(N) : n(C) = 0,2 : 0,4 = 1 : 2
Следовательно, атомов С – 2
Ch4 – NH – Ch4 — диметиламин
8. Cnh3n + Cl2 = Cnh3nCl2
Cnh3n + Cl2 = Cnh3nCl2
n(Cnh3n) = 0,672 л / 22,4л/моль = 0,03 моль
n(Cnh3nCl2) = 0,03моль
М(Сnh3nCl2) = 3,39 г / 0,03 моль = 113 г/моль
12n + 2n + 71 = 113
n = 3, C3H6, Ch4 – CH = Ch3 — пропен
9. NxHy + 0,5xO2 → 0,5xN2 + 0,5yh3O
0,5x . 2 = 0,5y x : y = 1 : 2 Nh3 – простейшая формула
М(NxHy) = 16 . 2 г/моль = 32г/моль
32 / 16 = 2, N2h5 – гидразин
2 способ:
М(NxHy) = 16 . 2г/моль = 32 г/моль,
т.к. вещество содержит только N и H, то атомов N – 2
(14 . 2 = 28), а атомов H – 4 (32 – 28 = 4), N2h5
10. Cnh3n+1CHO + 2Cu(OH)2 → Cnh3n+1COOH + Cu2O↓ + 2h3O
n(Cu2O) = 28,8 г / 144г/моль = 0,2 моль
n(альдегида) = 0,2 моль
М(альдегида) = 11,6 г / 0,2 моль = 58 г/моль
12n + 2n + 1 + 12 + 1 + 16 = 58
14n + 30 = 58
n=2, Ch4 – Ch3 – CHO — пропионовый альдегид
11. Cnh3n + HBr → Cnh3n+1Br
М(Cnh3n+2) + Br2 → Cnh3n+1Br + HBr
M = 29 г/моль . 4,24 = 123г/моль
14n + 81 = 123
n = 3, C3H7Br – бромпропан, C3H6 – пропен
Изомер – циклопропан
12. Сnh3n+ HCl → Cnh3n+1Cl
Сnh3n+ HCl → Cnh3n+1Cl
Cnh3n + HBr → Cnh3n+1Br
n(Cnh3n+1Cl) = n(Cnh3n+1Br)
7,85 / (14n+36,5) = 12,3 / (14n+81)
n = 3, C3H6 — пропен
13. Сnh3n+2 + Br2 → Cnh3n+1Br + HBr
n(Cnh3n+2) = n(Cnh3n+1Br)
1,74 / (14n+2) = 4,11 / (14n+81)
n = 4, C4h20
14. R – Nh3 + O2 → CO2 + h3O + N2
2R – Nh3 → N2
n(N2) = 2,24 л / 22,4 л/моль = 0,1 моль
n(R – Nh3) = 0,2 моль
М(R – Nh3) = 9г / 0,2 моль = 45г/моль
45 – (14+2) = 29 R – C2H5 C2H5Nh3 – этиламин
15.Сxh3x + 1,5xO2 → xCO2 + xh3O
n(O2) = 26,88 л / 22,4 л/моль = 1,2 моль
0,2 моль Cxh3x – 1,2 моль О2
1 моль Сxh3x – 1,5х моль О2
х = 4, C4H8
16.Cnh3n+1COOH + NaHCO3 → Сnh3n+1COONa + h3O + CO2
n(CO2) = 5,6л / 22,4л/моль = 0,25 моль
n(Cnh3n+1COOH) = 0,25 моль
М(Cnh3n+1COOH) = 25,5 г / 0,25моль = 102 г/моль
12n + 2n + 1 + 45 = 102
n = 4, C4H9COOH
17. Cnh3n+1COOH
Mr = 16 . 2 / 0,4324 = 74
12n + 2n + 1 + 45 = 74
14n = 28, n = 2, Ch4 – Ch3 – COOH — пропионовая кислота
Баланс KMnO4 + HCl + FeCl2 = FeCl3 + MnCl2 + KCl + h3O
15 августа 2020 г.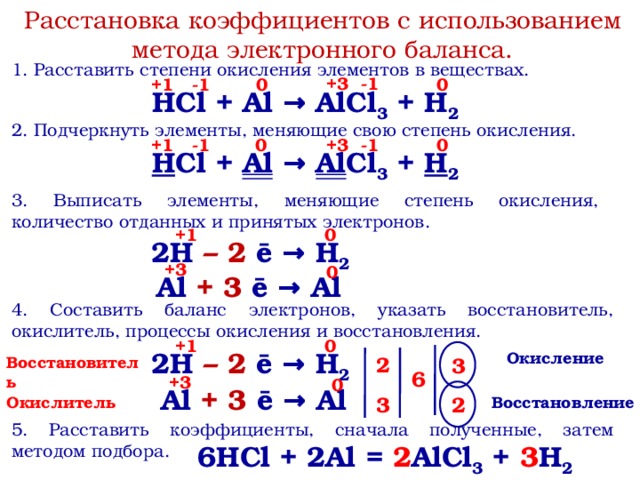
KMnO4, HCl и FeCl2 являются реагентами вышеуказанной реакции. Но мы должны знать, что HCl в этой реакции создает кислую среду для реакции. Если мы рассмотрим степень окисления каждого из реагентов вышеупомянутой реакции, мы можем заметить, что между ионами реагентов происходит обмен электронами. Давайте сначала разберемся.
Обмен электронами между KMnO4, HCl и FeCl2
Реакция –
KMnO 4 + HCl + FeCl 2 = KCl + MnCl 2 + H 3 90 FeCl +5 2 6
Если ориентироваться на степень окисления Mn (марганец) и Fe (железо),
KMn (7+) O 4 + HCl + Fe (2+) Cl1 6 =5 25 25 KCl + Mn (2+) Cl 2 + H 2 O + Fe (3+) Cl 3
Здесь Mn отдает 5 электронов, а Fe принимает только один электрон. Что это значит? Вы можете ответить на него? Да, ты прав. Реакция представляет собой реакцию электронного обмена, е.и. это окислительно-восстановительная реакция (окислительно-восстановительная реакция). Этот тип реакции очень легко уравновешивается ионно-электронным методом. Теперь мы узнаем, как использовать ионно-электронный метод для балансировки реакции.
Реакция представляет собой реакцию электронного обмена, е.и. это окислительно-восстановительная реакция (окислительно-восстановительная реакция). Этот тип реакции очень легко уравновешивается ионно-электронным методом. Теперь мы узнаем, как использовать ионно-электронный метод для балансировки реакции.
Реагенты реакции
Названия химических реагентов для окислительно-восстановительной реакции, о которой идет речь в этом посте, еще ниже.0007
- KMnO 4 = Перманганат калия , который является окислителем (как ион MnO 4 -1 4 )
- FeCl 2 = Хлорид железа(II) Восстановитель (в виде иона Fe 2+ )
- HCl = Соляная кислота (создает кислую среду)
Перманганат калия реагирует в
соляной кислоте с железом(II) хлоридСкелетная реакция Перманганат калия и Железа(II) хлорид в Соляная кислота ( KMnO4 + HCl + FeCl2 ) –
KMnO + FeCl
2 = KCl + MnCl 2 + H 2 O + FeCl 3Половина реакции окисления
Здесь Fe (2+) отдает один электрон, поэтому степень окисления железа становится +3. Отдача электрона химическим веществом называется реакцией окисления. Таким образом, полуреакция окисления для приведенной выше реакции должна быть следующей:0007
Отдача электрона химическим веществом называется реакцией окисления. Таким образом, полуреакция окисления для приведенной выше реакции должна быть следующей:0007
⇒ Fe 2+ – e – = Fe 3+ … … … (1)
Полуреакция восстановления
5Mn (7+ 0016 принимает пять электронов от восстановителя и в реакции превращается в Mn (2+) . Так как окисление происходит одновременно с реакцией восстановления в любой окислительно-восстановительной реакции. Поэтому тот же самый электрон, который отдает железо, Mn принимает. Следовательно, полуреакция восстановления равна-
⇒ MnO 4 -1 + 5e – + 8H + = 4H 2 O + Mn 2- … …. …. …. (3)
Теперь окислитель высвобождает 5 электронов, с другой стороны, восстановитель принимает только один электрон за раз. Таким образом, восстановитель FeCl 2 Хлорид железа (II) требуется в пять раз больше, чем окислитель KMnO 4 (перманганат калия) . Это означает уравнение (1)x5.
Это означает уравнение (1)x5.
После этого мы добавляем обе полуреакции ( Уравнение полуреакции окисления 1 и Уравнение полуреакции восстановления 2 ), чтобы получить полную реакцию окисления-восстановления (редокс) реакцию.
MnO 4 -1 +5e – + 8H + = Mn 2- + 4H 2 0 O 0 2 5Fe 2+ – 5e – = 5Fe 3+
MnO 4 -1 + 8H + + 5Fe 2+ = Mn 2- + 5Fe 3+ + 4H 2 O Вы помните, что мы исключили
0030 +
и Кл – ионов для нашего расчета? В этот момент мы должны добавить ионы, чтобы выполнить сбалансированную окислительно-восстановительную реакцию.
Добавление
необходимых ионов и радикаловKMnO 4 + 8HCl + 5FeCl 2 = KCl + MnCl 2 + 5FeCl 3 + 4H 2 O
Следуйте за нами на Twitter, Facebook, Linkedin и Tumbler Подробнее
07 050
What, How to Balance & FAQs —
Debashruti Bandyopadhyay
Соляная кислота (HCl) — сильная кислота, а перманганат калия (KMnO 4 ) — кристаллическая соль. Обсудим некоторые интересные факты о реакциях HCl и KMnO 4 .
Обсудим некоторые интересные факты о реакциях HCl и KMnO 4 .
Соляная кислота также называется соляной кислотой. Являясь сильной кислотой, она растворяется в воде и диссоциирует на ионы Н + и Cl — соответственно. Он появляется в жидкой форме и имеет молярную массу 36,458 г/моль. KMnO 4 также известен как перманганат калия. Растворяется в воде и диссоциирует на ионы K + и MnO 4 – .
В этой статье мы сосредоточимся на различных аспектах «HCl + KMnO 4 ” реакция, как продукт, тип реакции, уравновешивание реакции и т. д.
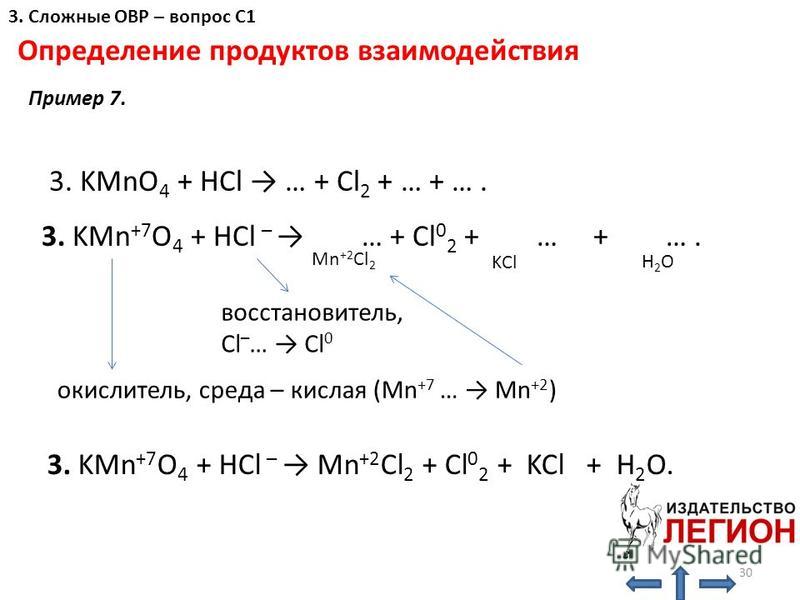
Что является продуктом HCl и KMnO 4 ?Соляная кислота (HCl) реагирует с перманганатом калия (KMnO 4 ) с образованием хлорида калия (KCl), хлорида марганца (MnCl 2 ), хлора (Cl 2 ) и воды (H 2 ). О) как побочный продукт.
2KMnO 4 + 16HCl → 2KCl + 2MnCl 2 + 8H 2 O + 5Cl 2
Какой тип реакции HCl + KMnO 4 0 ? HCl + KMnO 4 представляет собой окислительно-восстановительную реакцию . Потому что в этой реакции KMnO 4 является окислителем , который окисляет HCl до Cl 2 , восстанавливаясь до MnCl 2 . Степень окисления Mn снижается с +7 до +2.
Потому что в этой реакции KMnO 4 является окислителем , который окисляет HCl до Cl 2 , восстанавливаясь до MnCl 2 . Степень окисления Mn снижается с +7 до +2.
Чтобы сбалансировать уравнение, выполните следующие шаги:
Шаг 1: Определите атомы
Сначала определите атомы, участвующие в реакции. В данном случае это атомы K, Mn, O, H и Cl.
Шаг 2: Найдите коэффициент атомов
Необходимо найти коэффициенты атомов или соединений, участвующих в реакции, и изменить их, чтобы сбалансировать уравнение.
Этап 3. Сбалансируйте реакцию
Чтобы получить сбалансированное уравнение, коэффициенты атомов или соединений должны быть одинаковыми в обеих частях реакции.
После выполнения вышеперечисленных шагов окончательная реакция будет следующей 015 2 О + 5Cl 2
HCl + KMnO 4 титрование HCl и KMnO 4 нельзя титровать вместе, так как HCl будет реагировать с KMnO 4 с образованием Cl 2 . Кроме того, Cl 2 будет мешать титрованию .
Кроме того, Cl 2 будет мешать титрованию .
Общая реакция разделена на ионные реакции, где реагенты представлены в виде соответствующих ионов. Далее все ионные реакции уравновешиваются. Это можно объяснить следующей реакцией.
Ионное уравнение HCl + KMnO 4 сопряженных парHCl, будучи кислотой, имеет сопряженное основание. Но KMnO 4 как окислитель не имеет сопряженной пары. Сопряженная пара
HCl и KMnO 4 Межмолекулярные силы- Межмолекулярные силы между двумя молекулами HCl равны Лондонским дисперсионным силам и диполь-дипольные взаимодействия .

- В KMnO 4 межмолекулярная сила, присутствующая между двумя молекулами, представляет собой ионно-дипольную силу .
Энтальпия реакции HCl + KMnO 4 не может быть предсказана.
Является ли HCl + KMnO 4 буферным раствором ?Буферный раствор для этих двух растворенных веществ невозможен, поскольку HCl не является слабой кислотой. Для буферного раствора требуется комбинация слабой кислоты и сопряженного с ней основания.
Является ли HCl + KMnO 4 полной реакцией ?HCl + KMnO 4 представляет собой полную окислительно-восстановительную реакцию.
Является ли HCl + KMnO 4 экзотермической или эндотермической реакцией ? Невозможно предсказать, будет ли HCl + KMnO 4 реакция является экзотермической или эндотермической.

 Напишите уравнения четырех возможных реакций.
Напишите уравнения четырех возможных реакций.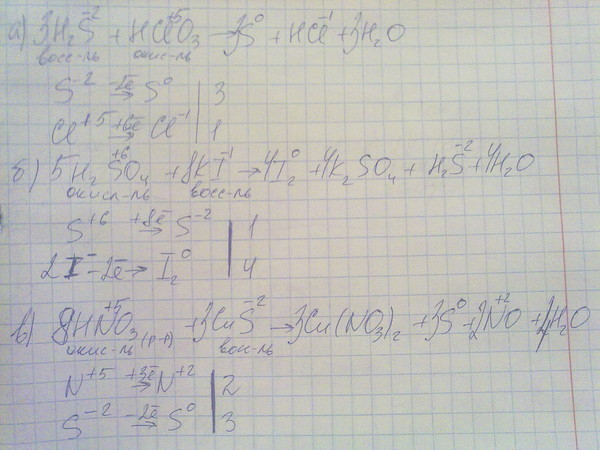
 Относительная плотность паров этого вещества по водороду равна 16. Объем необходимого на сжигание кислорода равен объему выделившегося азота. Определите молекулярную формулу соединения.
Относительная плотность паров этого вещества по водороду равна 16. Объем необходимого на сжигание кислорода равен объему выделившегося азота. Определите молекулярную формулу соединения. у.). Определите молекулярную формулу амина, приведите его название.
у.). Определите молекулярную формулу амина, приведите его название.