Десятичные логарифмы | Справочник по математике
В дальнейшем десятичный логарифм именуется просто логарифмом.
Логарифм единицы равен нулю.
Логарифмы чисел 10, 100, 1000 и т.д. равны 1,2,3 и т.д., т.е. имеют столько положительных единиц, сколько нулей стоит после единицы.
Логарифмы чисел 0,1; 0,01; 0,001 и т.д. равны -1, -2, -3 и т.д., т.е. имеют столько отрицательных единиц, сколько нулей стоит перед единицей (считая и нуль целых).
Логарифмы остальных чисел имеют дробную часть, именуемую мантиссой. Целая часть логарифма называется характеристикой.
Числа, большие единицы, имеют положительные логарифмы. Положительные числа, меньшие единицы1, имеют отрицательные логарифмы.
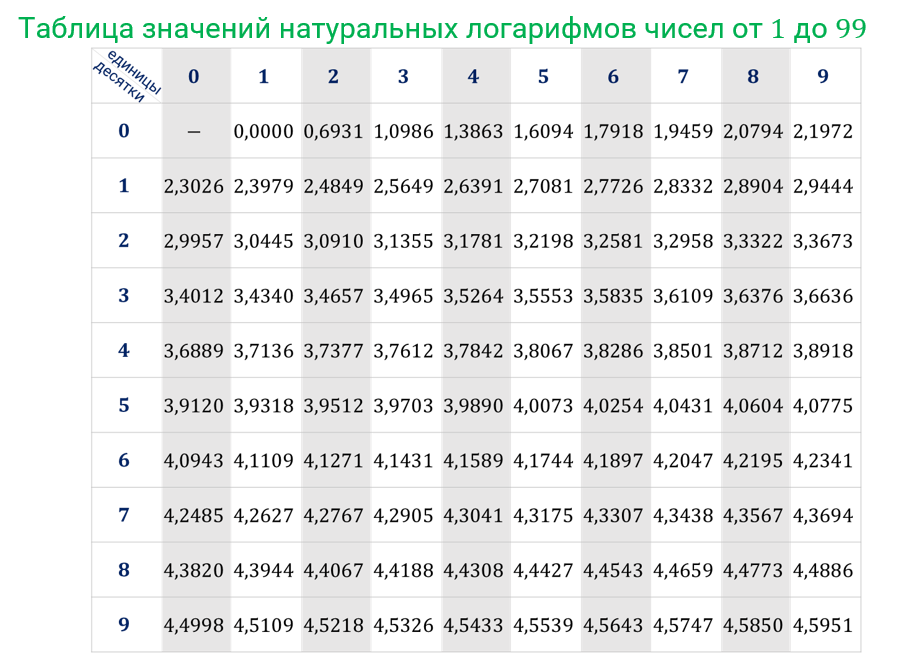
Например2, lg0,5=-0,30103, lg0,005=-2,30103.
Отрицательные логарифмы для большего удобства нахождения логарифма по числу и числа по логарифму представляются не в вышеприведенной “естественной” форме, а в “искусственной“. Отрицательный логарифм в искусственной форме имеет положительную мантиссу и отрицательную характеристику.
Например, lg0,005=3,69897. Эта запись означает, что lg0,005=-3+0,69897=-2,30103.
Чтобы перевести отрицательный логарифм из естественной формы в искусственную, нужно:
1. На единицу увеличить абсолютную величину его характеристики;
2. Полученное число снабдить знаком минус сверху;
3. Все цифры мантиссы, кроме последней из цифр, не равных нулю, вычитать из девяти; последнюю, не равную нулю цифру вычитать из десяти. Получаемые разности записываются на тех же местах мантиссы, где стояли вычитаемые цифры. Нули на конце остаются нетронутыми.
Пример 1. lg0,05=-1,30103 привести к искусственной форме:
lg0,05=-1,30103 привести к искусственной форме:
1. Абсолютную величину характеристики 1 увеличиваем на 1; получаем 2;
2. Пишем характеристику искусственной формы в виде 2 и отделяем ее запятой;
3. Вычитаем первую цифру мантиссы 3 из 9; получаем 6; записываем 6 на первом месте после запятой. Таким же образом на следующих местах появляются цифры 9(=9-0), 8(=9-1), 9(=9-0) и 7(=10-3).
В результате получаем:
-1,30103=2,69897.
Пример 2. -0,18350 представить в искусственной форме:
1. Увеличиваем 0 на 1, получаем 1;
2. Имеем 1;
Имеем 1;
3. Вычитаем цифры 1,8,3 из 9; цифру 5 из 10; нуль на конце остается не тронутым.
В результате получаем:
-0,18350=1,81650.
Чтобы перевести отрицательный логарифм из искусственной формы в естественную, нужно:
1. На единицу уменьшить абсолютную величину его характеристики;
2. Полученное число снабдить знаком минус слева;
3. С цифрами мантиссы поступать, как в случае перехода от естественной формы к искусственной.
Пример 3. 4,689 00 представить в естественной форме:
1. 4-1=3;
2. Имеем -3;
3. Вычитаем цифры из мантиссы 6,8 и 9; цифру 9 из 10; два нуля остаются не тронутыми.
В результате получаем:
4,689 00=-3,311 00.
1Отрицательные числа вовсе не имеют действительных логарифмов.
2Все дальнейшие равенства – приближенные с точностью до половины единицы последнего выписанного знака.
Ионное произведение воды. Водородный показатель
Теоретическое введение
Примеры решения задач
Задачи для самостоятельного решения
Равновесие процесса диссоциации воды:
Н2О ↔ Н+ + ОН—
описывается константой Кw, которая носит название “ионное произведение воды”. Ионное произведение воды равно:
Кw = [Н+] [ОН— ] (1)
Для разбавленных водных растворов ионное произведение воды не зависит от состава раствора и постоянно при данной температуре. Так, Кw=10— 14 для воды, миллимолярных растворов К2SO4, H2SO4 и KOH при Т=298 К. Строго говоря, постоянство Кw справедливо в случае, когда аналитические концентрации ионов заменены их активностями (лишь для малых концентраций Н
Так, Кw=10— 14 для воды, миллимолярных растворов К2SO4, H2SO4 и KOH при Т=298 К. Строго говоря, постоянство Кw справедливо в случае, когда аналитические концентрации ионов заменены их активностями (лишь для малых концентраций Н
Процесс диссоциации Н2О идет с поглощением теплоты, поэтому при повышении температуры в интервале от 0 до 100оС величина Кw увеличивается.
Для практических целей удобно пользоваться не концентрацией ионов водорода, а её водородным показателем – отрицательным десятичным логарифмом – рН. Величина рН равна:
рН = — lg[H+]. (2)
Как выше отмечалось, более строгим является уравнение рН = – lg aН+, где aН+ – активность ионов водорода. Однако для практических целей при расчете рН разбавленных растворов обычно используется уравнение (2).
Однако для практических целей при расчете рН разбавленных растворов обычно используется уравнение (2).
При этом:
рН + рОН = 14, (3)
где рОН = — lg[ОH—].
Для нейтральных растворов рН = 7, для кислых растворов рН < 7, а для щелочных растворов рН > 7. В аналитической практике редко приходится работать с растворами, рН которых выходит из интервала 0 ÷14. Тем не менее, в сильнощелочной среде рН может быть немного больше 14, а в очень кислой среде может принимать отрицательные значения.
Задача 1. Вычислите рН 0,001М растворов HСl и КОН.
Решение. HСl и КОН являются сильными электролитами и в разбавленных растворах практически полностью диссоциируют на ионы. В растворе НСl: [Н+] = 0,001 моль/л.
рН = –lg [H+] = –lg 0,001 = 3
В растворе КОН: [ОН–] = 0,001 моль/л. рОН = –lg [ОH—] = –lg 0,001 = 3. рН=14 – 3 = 11.
рН=14 – 3 = 11.
Задача 2. Рассчитайте рН раствора КОН, 350 мл которого содержат 0,0035 моль КОН.
Решение.
КОН → К+ + ОН—
См(КОН) = 0,0035:0,35 = 0,01М. см(КОН) = [ОН–].
рОН = –lg [ОH—] = –lg 0,01 = 2.
рОН + рН = 14. рН = 14 – 2 = 12
или [Н+] = 10–14/[ОН–] = 10–14/0,01 = 10–12 моль/л.
рН = –lg 10–12 = 12.
Задача 3. Вычислите молярную концентрацию раствора Ba(OH)2, если рН раствора составляет 12 при 298 К.
Решение.
Ba(OH)2 → Ва2+ + 2ОН–
рОН = 14 – 12 = 2
-lg [ОH–] = 2, откуда [ОH–] = 0,01 М.
Cм(Ba(OH)2) = [ОH—]/2 = 0,01/2 = 0,005М.
Задача 4. Рассчитайте степень диссоциации и рН 0,01 М водного раствора аммиака при 298 К, если константа диссоциации NH4OH при указанной температуре равна 1,76·10–5.
Решение.
NH3 H2O ⇔ NH4+ + OH— или упрощенно: NH4ОH ⇔ NH4+ + OH—
KД = [NH4+]·[OH–]/[NH4OH],
Поскольку [NH4+]=[OH–] и Cм(NH4OH) ≈ [NH4OH], то
KД = [OH–]2/Cм(NH4OH)
[OH–] = √(KД·Cм(NH4OH)) = 4,2·10-4 моль/л.
[Н+] = 10-14/[ОН—] = 10
рН = –lg [H+] = –lg 2,4·10–11 = 10,6.
или 4,2 %.
Задача 5. К 1 л 0,01М раствора CH3CОOH добавили 6 г СН3СООNa. Определите рН полученного раствора при Т = 298 К, если при указанной температуре Кд(CH3CОOH) = 1,75·10–5.
Решение.
Присутствие в растворе CH3CОOH сильного электролита СН3СООNa приводит к сдвигу равновесия диссоциации уксусной кислоты влево в силу действия принципа Ле Шателье. В результате степень диссоциации уксусной кислоты уменьшается.
n(СН3СООNa) = 6:82 = 0,073 моль.
См(СН3СООNa) = 0,073/1 = 0,073 М
(считаем, что объем раствора после добавления 6 г СН3СООNa не изменился).
Ацетат–ионы в растворе образуются как за счет диссоциации уксусной кислоты:
CH3CОOH ⇔ СН3СОО– + Н+,
так и за счет диссоциации СН3СООNa:
СН3СООNa → СН3СОО— + Na+
Поскольку СН3СООNa в растворе диссоциирует полностью, то концентрацией ацетат-ионов, образующихся при диссоциации уксусной кислоты можно пренебречь, так как она мала по сравнению с величиной 0,073 моль/л. Принимаем, что:
Принимаем, что:
См(CH3CОONa) = [CH3CОO—];
[CH3CОOH] = См(CH3CОOН).
Cледовательно,
[H+] = Кд · См(CH3CОOН) / [CH3CОO—]
[H+] = 1,75·10–5 · 0,01 / 0,073 = 2,4·10
рН = –lg2,4·10–6 = 5,6.
1. Определите величину рН 0,0001 М раствора HCl.
2. Определите рН 0,01 М раствора KOH.
3. рН раствора гидроксида бария равен 11. Определите концентрацию этого раствора.
4. Степень диссоциации в 0,01 М растворе муравьиной кислоты при некоторой температуре составляет 10 %. Определите рН этого раствора.
5. Рассчитайте рН 1 М раствора азотной кислоты. Степень диссоциации кислоты примите равной 100 %.
6. Определите, сколько граммов Ba(OH)2 необходимо растворить в 5 л воды, чтобы рН раствора стал равен 10.
7. Определите рН раствора H2SO4, титр которого равен 0,005 г/см3. Степень диссоциации серной кислоты примите равной 100 % по двум ступеням.
14.8. Степень диссоциации муравьиной кислоты в 0,34 М растворе составляет 2,3 %. Определите константу диссоциации HCOOH и рН этого раствора.
9. Вычислите рН 0,01М раствора NH4OH, содержащего в 1 л 0,02 моль NH4Cl при 298 К, если при указанной температуре Кд(NH4OH) = 1,76·10–5.
10. Как изменится рН, если к 0,2М раствору циановодородной (синильной) кислоты добавить 5 мл 1 мас.% раствора KCN, плотность которого равна 1,01 г/см3? Константа диссоциации HCN при 298 К составляет 4,9·10–10.
Понравилось это:
Нравится Загрузка…
Flex · Начальная загрузка
Быстро управляйте макетом, выравниванием и размером столбцов сетки, навигацией, компонентами и многим другим с помощью полного набора гибких утилит flexbox. Для более сложных реализаций может потребоваться пользовательский CSS.
Включить гибкое поведение
Применить утилиты display для создания контейнера flexbox и преобразования прямых дочерних элементов в flex-элементы. Flex-контейнеры и элементы могут быть изменены с помощью дополнительных flex-свойств.
Я флексбокс-контейнер!
Я контейнер flexbox!
Я встроенный контейнер flexbox!
Я встроенный контейнер flexbox!
Адаптивные варианты также существуют для .d-flex и .d-inline-flex .
-
.д-флекс -
.d-inline-flex -
.d-sm-flex -
.d-sm-inline-flex -
.d-md-flex -
.d-md-inline-flex -
.d-lg-flex -
.d-lg-inline-flex -
.d-xl-flex -
.d-xl-inline-flex
Направление
Установите направление flex-элементов в flex-контейнере с помощью утилит направления. В большинстве случаев вы можете опустить здесь горизонтальный класс, поскольку по умолчанию в браузере используется строка  Однако вы можете столкнуться с ситуациями, когда вам нужно явно установить это значение (например, адаптивные макеты).
Однако вы можете столкнуться с ситуациями, когда вам нужно явно установить это значение (например, адаптивные макеты).
Используйте .flex-row , чтобы установить горизонтальное направление (браузер по умолчанию), или .flex-row-reverse , чтобы начать горизонтальное направление с противоположной стороны.
Flex item 1
Flex item 2
Flex item 3
Flex item 1
Flex item 2
Flex item 3
<дел>Элемент Flex 1Элемент Flex 2Элемент Flex 3


 Выберите из
Выберите из  justify-content-sm-между
justify-content-sm-между  Выберите из
Выберите из  align-items-sm-stretch
align-items-sm-stretch  Выберите один из тех же параметров, что и
Выберите один из тех же параметров, что и  align-self-базовый уровень
align-self-базовый уровень  align-self-xl-базовый уровень
align-self-xl-базовый уровень  В приведенном ниже примере элементы
В приведенном ниже примере элементы 
 Дополнительные сведения см. в этом ответе StackOverflow.
Дополнительные сведения см. в этом ответе StackOverflow. Выберите полное отсутствие переноса (по умолчанию в браузере) с
Выберите полное отсутствие переноса (по умолчанию в браузере) с  ..
..
 Поскольку
Поскольку  заказ-см-0
заказ-см-0  order-md-12
order-md-12  заказ-xl-11
заказ-xl-11  ..
..  ..
..  4 Tiger Algebra Solver 94)=0
4 Tiger Algebra Solver 94)=0
 00
00 1626
1626  1743 2x
1743 2x  00
00
 1 Произведение нескольких членов равно нулю.
1 Произведение нескольких членов равно нулю. Из-за этой симметрии линия симметрии, например, будет проходить через середину двух точек пересечения x (корней или решений) параболы. То есть, если парабола действительно имеет два действительных решения.
Из-за этой симметрии линия симметрии, например, будет проходить через середину двух точек пересечения x (корней или решений) параболы. То есть, если парабола действительно имеет два действительных решения. 4 Решение x 2 +x+2 = 0, заполнив квадрат .
4 Решение x 2 +x+2 = 0, заполнив квадрат . 4.1
4.1  5 Решение x 2 +x+2 = 0 по квадратичной формуле .
5 Решение x 2 +x+2 = 0 по квадратичной формуле .