Помощь студентам в учёбе от Людмилы Фирмаль
Здравствуйте!
Я, Людмила Анатольевна Фирмаль, бывший преподаватель математического факультета Дальневосточного государственного физико-технического института со стажем работы более 17 лет. На данный момент занимаюсь онлайн обучением и помощью по любыми предметам. У меня своя команда грамотных, сильных бывших преподавателей ВУЗов. Мы справимся с любой поставленной перед нами работой технического и гуманитарного плана. И не важно: она по объёму на две формулы или огромная сложно структурированная на 125 страниц! Нам по силам всё, поэтому не стесняйтесь, присылайте.
Срок выполнения разный: возможно онлайн (сразу пишите и сразу помогаю), а если у Вас что-то сложное – то от двух до пяти дней.
Для качественного оформления работы обязательно нужны методические указания и, желательно, лекции. Также я провожу онлайн-занятия и занятия в аудитории для студентов, чтобы дать им более качественные знания.
Моё видео:
youtube.com/embed/4sKc0lcxi7g» frameborder=»0″ allow=»accelerometer; autoplay; encrypted-media; gyroscope; picture-in-picture» allowfullscreen=»»/>Вам нужно написать сообщение в Telegram . После этого я оценю Ваш заказ и укажу срок выполнения. Если условия Вас устроят, Вы оплатите, и преподаватель, который ответственен за заказ, начнёт выполнение и в согласованный срок или, возможно, раньше срока Вы получите файл заказа в личные сообщения.
Сколько может стоить заказ?Стоимость заказа зависит от задания и требований Вашего учебного заведения. На цену влияют: сложность, количество заданий и срок выполнения. Поэтому для оценки стоимости заказа максимально качественно сфотографируйте или пришлите файл задания, при необходимости загружайте поясняющие фотографии лекций, файлы методичек, указывайте свой вариант.
Какой срок выполнения заказа?Минимальный срок выполнения заказа составляет 2-4 дня, но помните, срочные задания оцениваются дороже.
Сначала пришлите задание, я оценю, после вышлю Вам форму оплаты, в которой можно оплатить с баланса мобильного телефона, картой Visa и MasterCard, apple pay, google pay.
Какие гарантии и вы исправляете ошибки?В течение 1 года с момента получения Вами заказа действует гарантия. В течении 1 года я и моя команда исправим любые ошибки в заказе.
Качественно сфотографируйте задание, или если у вас файлы, то прикрепите методички, лекции, примеры решения, и в сообщении напишите дополнительные пояснения, для того, чтобы я сразу поняла, что требуется и не уточняла у вас. Присланное качественное задание моментально изучается и оценивается.
Теперь напишите мне в Telegram или почту и прикрепите задания, методички и лекции с примерами решения, и укажите сроки выполнения. Я и моя команда изучим внимательно задание и сообщим цену.
Если цена Вас устроит, то я вышлю Вам форму оплаты, в которой можно оплатить с баланса мобильного телефона, картой Visa и MasterCard, apple pay, google pay.
Мы приступим к выполнению, соблюдая указанные сроки и требования. 80% заказов сдаются раньше срока.
После выполнения отправлю Вам заказ в чат, если у Вас будут вопросы по заказу – подробно объясню. Гарантия 1 год. В течении 1 года я и моя команда исправим любые ошибки в заказе.
youtube.com/embed/g4ioDc7sLwU» frameborder=»0″ allow=»accelerometer; autoplay; encrypted-media; gyroscope; picture-in-picture» allowfullscreen=»»/>
youtube.com/embed/zW5JhiZ4140″ frameborder=»0″ allow=»accelerometer; autoplay; encrypted-media; gyroscope; picture-in-picture» allowfullscreen=»»/>
Можете смело обращаться к нам, мы вас не подведем. Ошибки бывают у всех, мы готовы дорабатывать бесплатно и в сжатые сроки, а если у вас появятся вопросы, готовы на них ответить.
Ошибки бывают у всех, мы готовы дорабатывать бесплатно и в сжатые сроки, а если у вас появятся вопросы, готовы на них ответить.
В заключение хочу сказать: если Вы выберете меня для помощи на учебно-образовательном пути, у вас останутся только приятные впечатления от работы и от полученного результата!
Жду ваших заказов!
С уважением
Пользовательское соглашение
Политика конфиденциальности
LiOH+h3SO4=Li2SO4+h3O+Q… -reshimne.ru
Новые вопросы
Ответы
h3SO4 + 2 LiOH = Li2SO4 + 2 h3O
Похожие вопросы
Приготовить 200 грамм 5% настоя пустырника…
Пассчитать относительную плотность соляной кислоты по азоту.help me, please.))…
В двух сосудах находятся пропан и пропилен. C помощью каких реакций можно различить эти газы?Напишите уравнения реакций…
C помощью каких реакций можно различить эти газы?Напишите уравнения реакций…
Написать уравнение электрической диссоциацииCr2(SO4)3,Mg3(PO4)2,MgCl2,CaSO4…
ПОМОГИТЕ ПОЖАЛУЙСТА!!!…
1. Сколько литров кислорода при (н.у.) потребуется для сгорания 3 кг угля
2. Охарактеризуйте элемент 38 (положение в таблице, строение атома, формулы высшего оксида и гидроксида)
3. Напишите уравнения реакция в результате которых можно получить сероводород
4. В трех пробирках прозрачные растворы иоида калия, бромида калия, хлорида калия…
Математика
Литература
Алгебра
Русский язык
Геометрия
Английский язык
Химия
Физика
Биология
Другие предметы
История
ОбществознаниеОкружающий мир
География
Українська мова
Українська література
Қазақ тiлi
Беларуская мова
Экономика
Музыка
Право
Французский язык
Немецкий язык
МХК
ОБЖ
Психология
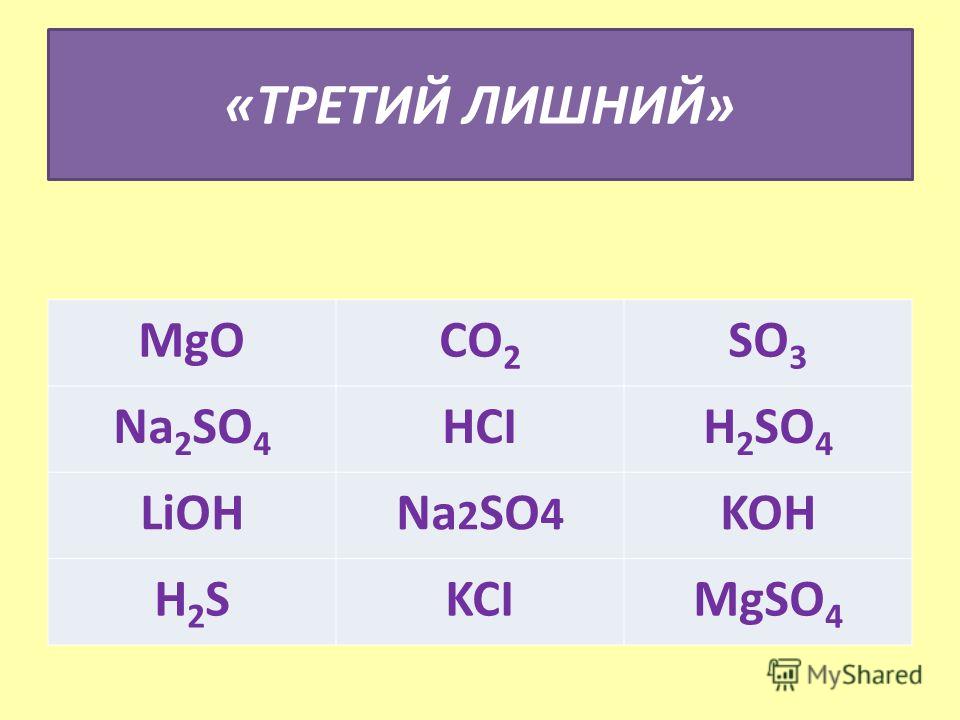
Из формул выписать формулы оснований и назвать их h3o cuco3 lioh h3so4 p2o5 mg(oh)2 hci koh
Математика, 20.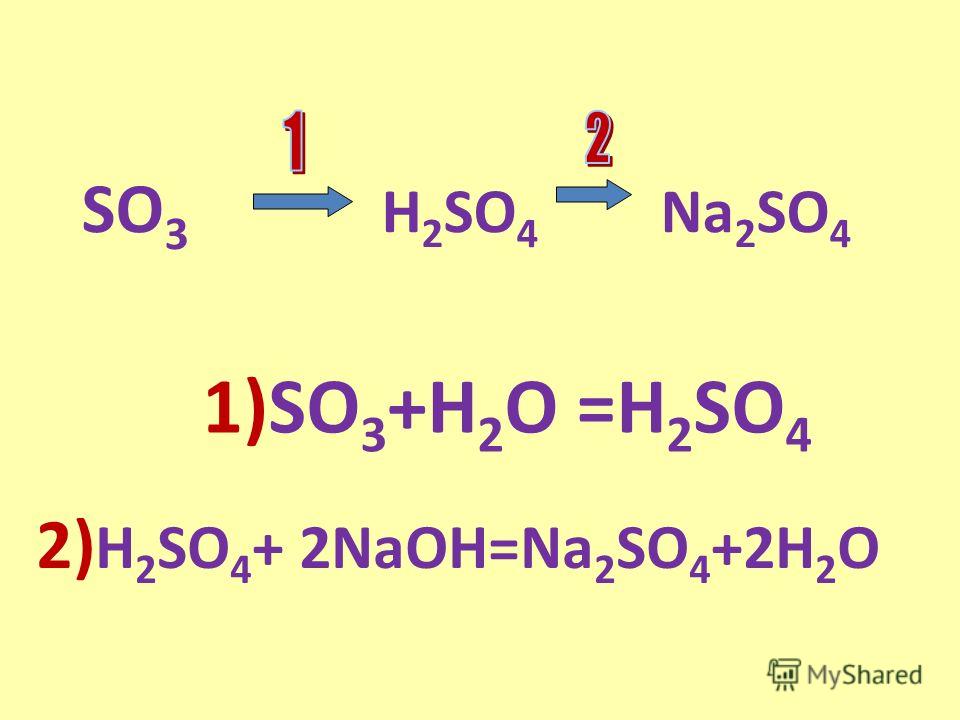 06.2019 17:40, Slava1000190
06.2019 17:40, Slava1000190
Ответ разместил: АлёнаDances5943
Lioh-гидроксид лития mg(oh)2-гидроксид магния koh-гидроксид калия(едкий)
Спасибо
Ответ разместил: Гость
Знаходимо масу міді у зливку: 1000 г — 700 г=300 г знаходимо різницю мас срібла та міді: 700 г — 300 г=400 г відповідь: у зливку срібла більше ніж міді на 400 грамів
Ответ разместил: Гость
пусть жуков было х, тогда пауков 8-х.
6*х+8(8-х)=54
6х+64-8х=54
2х=10
х=5-жуков было 5.
8-5=3-3паука.
Другие вопросы по: Математика
Твір-мініатюра за поданим прислів`ям: «книга вчить як на світі жить»…
Опубликовано: 27.02.2019 18:30
Ответов: 2
.(Масса сушеных грибов составляет 14% массы свежих. сколько сушеных грибов можно получить из 35 кг свежих? сколько свежих грибов нодо взять чтобы получить 2,8 кг сушеных?)….
Опубликовано: 28. 02.2019 06:30
02.2019 06:30
Ответов: 2
.(Спишите слова, распределяя их на группы в зависимости от способа образования.(1способ суфиксальный,2способ приставачный,3 способ с соединяющей гласной) слова:голосовать, водянист…
Опубликовано: 28.02.2019 16:20
Ответов: 2
Коля поймал 1,4 кг. рыбы. из двух седьмых сварили уху. а 80% оставшейся поджарили. сколько рыбы поджарили?…
Опубликовано: 01.03.2019 02:10
Ответов: 3
Решите 4 номера) №116, №117, №118, №119 №116 докажите что в равнобедренном треугольнике все углы равны №117 на рисунке 67 ab=bc, сd=de. докажите, что угол bac= углу ced №118 на осн…
Опубликовано: 01.03.2019 14:30
Ответов: 3
Ввставьте пропущеные буквы и раскройте скобки. укажите вид, лицо, и число разноспрягаемых глаголов хотеть, бежать. оброзец: хочет оконьчание ет (несов. вид,3 л. ед. ч.) 1. бужешь с…
оброзец: хочет оконьчание ет (несов. вид,3 л. ед. ч.) 1. бужешь с…
Опубликовано: 03.03.2019 01:50
Ответов: 1
Знаешь правильный ответ?
Из формул выписать формулы оснований и назвать их h3o cuco3 lioh h3so4 p2o5 mg(oh)2 hci koh…
Популярные вопросы
.(Как отмерить 15 минут, имея под рукой 7 и 11 минутные песочные часы?)….
Опубликовано: 28.02.2019 12:00
Ответов: 1
Найдите координаты точек . в которых прямая mn, где м(2; 4)и n(5; -2) пересекает координатные оси….
Опубликовано: 28.02.2019 22:10
Ответов: 1
При каких значениях m и n векторы ав(вектор) и сд(вектор) коллинеарны, если а(1; 0; 2), в(3; n; 5),с(2; 2; 0),д(5; 4; m)?…
Опубликовано: 01.03.2019 02:40
Ответов: 1
Какому азимуту соответствует направление на вюв? 1) 135градусов 2) 292,5 гр 3) 112,5гр 4) 202,5 гр.
Опубликовано: 01.03.2019 06:40
Ответов: 1
Почему в южной и юго-восточной азии плотность населения наиболее велика в долинах и дельтах рек…
Опубликовано: 02.03.2019 05:00
Ответов: 1
1) масса осадка, образовавшегося в результате взаимодействия 5,2 г. хлорида бария с раствором серной кислоты, взятой в избытке? 2 ) количество вещества гидроксида натрия, образова…
Опубликовано: 02.03.2019 20:50
Ответов: 2
Плоскость α и β параллельны причем плоскость α пересекает прямую а. докажите, что и плоскость β пересекает прямую а….
Опубликовано: 02.03.2019 23:10
Ответов: 3
Выписать примеры олицетворения где неодушивленные предметы действуют как живые к красну солнцу наконец обратился молодец. «свет наш солнышко! ты ходишь круглый год по небу, своди…
«свет наш солнышко! ты ходишь круглый год по небу, своди…
Опубликовано: 04.03.2019 08:20
Ответов: 3
Как 0,25+1цел.35 шестидесятых (60) =…
Опубликовано: 04.03.2019 11:00
Ответов: 1
Вкниге 320 страниц. маша прочитала первую главу и вторую. ей осталось прочитать ещё 120 страниц. сколько страниц во второй главе, если в первой главе 78 страниц?…
Опубликовано: 06.03.2019 23:00
Ответов: 1
Больше вопросов по предмету: Математика Случайные вопросы
Титрование сильной кислоты сильным основанием
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 366
Титрование сильной кислоты сильным основанием является самым простым из четырех типов титрования, поскольку оно включает сильную кислоту и сильное основание, которые полностью диссоциируют в воде, что приводит к реакции нейтрализации сильной кислоты и сильного основания.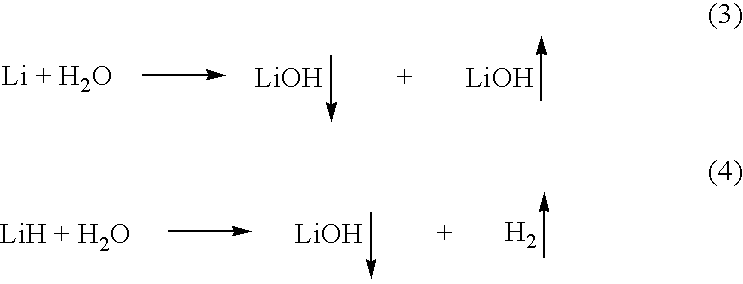 Это титрование требует использования бюретки для дозирования сильного основания в емкость с сильной кислотой или наоборот, чтобы определить точку эквивалентности.
Это титрование требует использования бюретки для дозирования сильного основания в емкость с сильной кислотой или наоборот, чтобы определить точку эквивалентности.
Введение
Целью титрования сильной кислоты сильным основанием является определение концентрации кислого раствора путем титрования его щелочным раствором известной концентрации или наоборот до тех пор, пока не произойдет нейтрализация. Поскольку и кислота, и основание являются сильными (высокие значения K a и K b ), они полностью диссоциируют, что означает, что все молекулы кислоты или основания полностью разделятся на ионы. В точке эквивалентности равные количества H + и ионы OH — объединятся с образованием H 2 O, что приведет к pH 7,0 (нейтральный). pH в точке эквивалентности для этого титрования всегда будет 7,0, обратите внимание, что это верно только для титрования сильной кислоты сильным основанием. Кроме того, анион (отрицательный ион), образующийся при диссоциации кислоты, соединяется с катионом (положительный ион), образующийся при диссоциации основания, с образованием соли . Следовательно, реакция между сильной кислотой и сильным основанием приведет к образованию воды и соли.
Следовательно, реакция между сильной кислотой и сильным основанием приведет к образованию воды и соли.
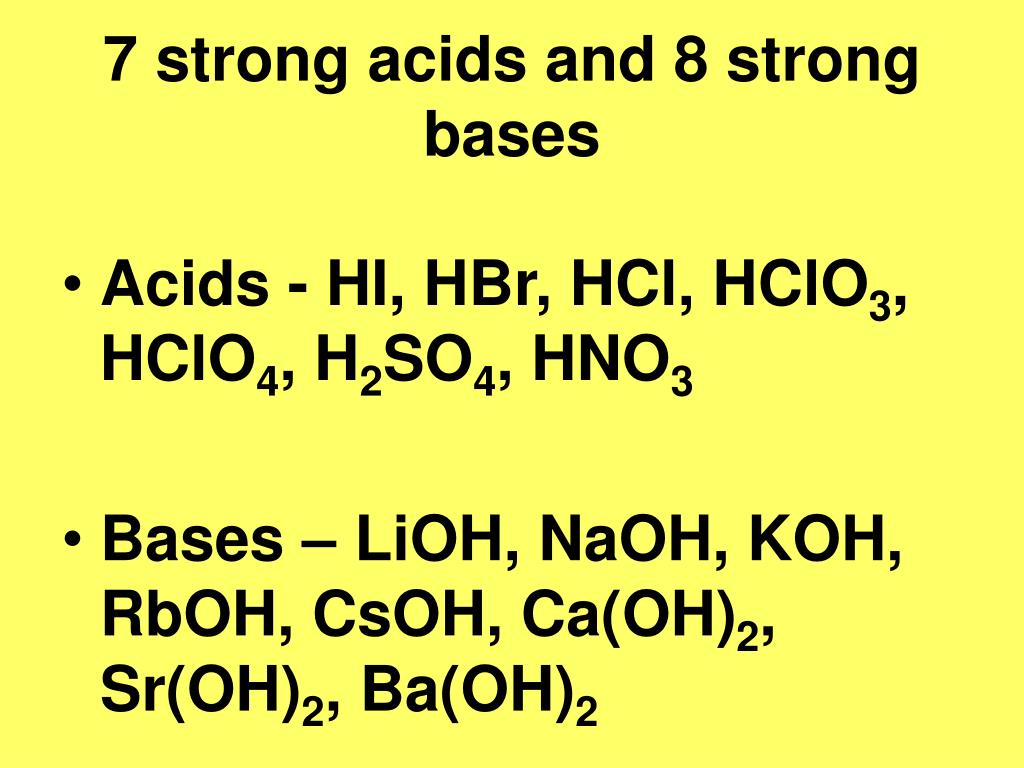
Сильные кислоты и основания
| Кислоты | Основания |
|---|---|
| HCl | ЛиОН |
| HBr | NaOH |
| Привет | КОН |
| HClO 4 | РбОН |
| ГНО 3 | CsOH |
| H 2 SO 4 | Мг(ОН) 2 |
| Са(ОН) 2 | |
| Ср(ОН) 2 | |
| Ва (ОН |
В таблице \(\PageIndex{1}\) перечислены распространенные сильные кислоты и сильные основания. Целесообразно запомнить эту таблицу, так как она будет полезна при решении задач титрования. Кислоты и основания, не указанные в этой таблице, можно считать слабыми. Обратите внимание, что сильные основания состоят из иона гидроксида (OH 9-\;(aq)\]
Целесообразно запомнить эту таблицу, так как она будет полезна при решении задач титрования. Кислоты и основания, не указанные в этой таблице, можно считать слабыми. Обратите внимание, что сильные основания состоят из иона гидроксида (OH 9-\;(aq)\]
OH представляет собой гидроксид, а X представляет собой сопряженную кислоту (катион) основания.
Написание реакции
Первым шагом в написании кислотно-щелочной реакции является определение того, являются ли участвующие кислота и основание сильными или слабыми, поскольку это определяет, как будут выполняться расчеты. Для реакций с сильной кислотой и сильным основанием результирующее ионное уравнение всегда будет одинаковым, поскольку кислота и основание полностью диссоциируют, а образующаяся соль также диссоциирует. В результате конечным продуктом остается просто вода, это показано в следующем примере с участием соляной кислоты (HCl) и гидроксида натрия (NaOH). Из таблицы \(\PageIndex{1}\) видно, что HCl — сильная кислота, а NaOH — сильное основание. Поэтому реакция между HCl и NaOH изначально записывается следующим образом:
Поэтому реакция между HCl и NaOH изначально записывается следующим образом:
\[HCl\;(водн.) + NaOH\;(водн.) \rightarrow H_2O\;(л) + NaCl \; (водн.) \]
Поскольку HCl и NaOH полностью диссоциируют на свои ионные компоненты вместе с хлоридом натрия (NaCl), мы можем переписать уравнение как: (водн.) + Na + (водн.) + OH — (водн.) —> H 2 O (л) + Na + Пример \(\PageIndex{1}\) Запишите суммарные ионные уравнения реакций: РАСТВОР Из таблицы \(\PageIndex{1}\) видно, что HI и KOH являются сильной кислотой и сильным основанием соответственно. Следовательно: \[ HI\;(водн.) + KOH\;(водн.) \rightarrow H_2O\;(l) + KI\; (водн.) \] H + (aq) + I — (aq) + K + (aq) + OH — (aq) —> H 2 O (L) + K + (aq) + I — (AQ) H + (AQ) + I — (AQ) + K + 333333333 (AQ) + I — (AQ) + K + + 3333333 (AQ). H + (водн.) + OH — (водн.) —> H 2 O (л) (окончательный ответ) C 2 O4 является слабой кислотой, поскольку ее нет в таблице. Следовательно, это реакция слабой кислоты и сильного основания, которая объясняется по ссылке, титрование слабой кислоты сильным основанием. Титрование – это процедура проведения химической реакции между двумя растворами путем контролируемого добавления из бюретки одного раствора в другой. Метод, такой как индикатор, должен использоваться в титровании, чтобы найти точка эквивалентности . При титровании либо кислоту можно добавить к основанию, либо основание можно добавить к кислоте, и то, и другое приведет к точке эквивалентности, то есть к условию, при котором реагенты находятся в стехиометрических пропорциях. Точка эквивалентности – это часть титрования, когда к кислоте было добавлено достаточное количество основания (или кислоты, добавленной к основанию), что концентрация [H + ] в растворе равна концентрации [ ОН 9-\; (aq) \rightarrow H_2O,.(l) \] В результате этой реакции образуется вода с нейтральным pH 7,0. pH в точке эквивалентности равен 7,0, потому что раствор содержит только воду и нейтральную соль. Поскольку в растворе не остается ни молекул Н + , ни молекул ОН — , можно сделать вывод, что в точке эквивалентности реакции сильная кислота — сильное основание рН всегда равно 7,0. Дальнейшее добавление кислоты или основания после достижения точки эквивалентности понизит или повысит pH соответственно. Пример \(\PageIndex{2}\) Сколько литров 3,4 М HI потребуется для достижения точки эквивалентности с 2,1 л 2,0 М КОН? РЕШЕНИЕ Зная молярность сильной кислоты и сильного основания, а также объем основания, мы можем найти объем кислоты. \[ HI(водн.) + KOH(водн.) \rightarrow H_2O\;(ж) + KI \;(водн.) \] Мы видим, что мольное соотношение, необходимое для HI для нейтрализации КОН — 1:1; поэтому нам нужно, чтобы количество молей HI было равно количеству КОН, присутствующему в растворе. Чтобы найти количество молей KOH, умножьте молярность KOH на объем KOH, обратите внимание, как литры сокращаются: Поскольку моли КОН = молям HI в точке эквивалентности, мы имеем 4,2 моля HI. Чтобы найти объем раствора HI, мы используем молярность HI (3,4 М) и тот факт, что у нас есть 4,2 моля HI: Разделив на 3,4 моль HI/л в обе стороны, получим: Остается X = 1,2 л. (3,4 М)(V 1 ) = (2,1 л)(2,0 М) V 1 = (2,1 л)(2,0 М) / (3,4 М) = 1,2 Ниже приведены примеры титрования сильной кислотой и сильным основанием, при которых pH и pOH определяются в определенных точках титрования. 9- \; (aq) \rightarrow H_2O(l) \] Исходное количество молей H + в растворе: молей OH — добавлено: 48,00 x 10 -3 L x 0,100 м OH — = 0,0048 моли , что приводит к: 0,005-0,0048 = .0002 моли водный) Общий объем раствора равен 0,048 л + 0,05 л = 0,098 л [H + ]= (0,0002/098L) = 2,0 x 10 -3 pH= 2,69 0,45 М раствор серной кислоты (H 2 SO 4 ) титруют 2,3 л 1,2 М раствора гидроксида лития (LiOH)? РЕШЕНИЕ Чтобы решить эту задачу, мы должны сначала определить количество молей ионов H + , образованных сильной кислотой, и количество молей OH — 9. Кислота: (Поскольку один моль H 2 SO 4 дает два моля H 2 , мы получаем отношение (2 моль H + / 1 моль H 2 SO ) Основание: Так как моль H + больше, чем моль OH — , то надо найти моль избытка H + : 4,5 моль — 2,8 моль = 9003 3 H 1,70 38 1,70 моль — 2,8 моль сверх нормы. Поскольку pOH = -log[OH — ], нам нужно сначала преобразовать моли H + в пересчете на молярность (концентрацию). Далее нам нужно определить концентрацию OH — по концентрации H + . Общий объем: 2,3 л + 5,0 л = 7,3 л Используя общий объем, мы можем рассчитать молярность H + : Далее, с нашей молярностью H + , у нас есть два способа определить рОН: [0. [OH — ] = 1 * 10 -14 / 0.23 = 4.35 * 10 -14 pOH = -log[OH — ] = -log(4,35 * 10 -14 ) = 13,4 2. pOH = 14 — pH = 14 — ( -log[H + Ответ равен 13,4 в обоих методах. В приведенных выше примерах миллилитры конвертируются в литры, поскольку используются моли. Чтобы уменьшить количество преобразований единиц и сложность, более простым методом является использование миллимолей, а не молей, поскольку количество кислоты и основания при титровании обычно составляет тысячные доли моля. Миллимоль — это одна тысячная часть моля, поэтому это облегчит расчеты. Молярность будет выражена в миллимолях, чтобы проиллюстрировать этот принцип: Молярность = моль/л = ммоль/мл Рисунок \(\PageIndex{1}\): На этом рисунке простыми словами показаны этапы решения задачи титрования сильной кислоты и сильного основания задач, обращайтесь к ним при решении различных задач сильные кислоты-сильные основания. Пример \(\PageIndex{5}\) Сколько литров 3,4 М HNO 3 потребуется для достижения точки эквивалентности с 5,0 л 3,0 М RbOH? Чему равен рН в точке эквивалентности? РАСТВОР. 3 — (водн.) + Rb + (водн.) + OH — (водн.) —> H 2 O (л) + Rb + (водн.) + NO 9 3 — (водн.) = H + (водн.) + OH — (водн.) —> H 2 O (л) M 9 1 В 1 = М 2 В 2 М 1 = 3,4 М В 1 M 2 = 3,0 м V 2 = 5,0 л (3,4 м) ( V 1 ) = (3,0 м) (5,034 V 1 ) = (3,0 м) (5,034 10023 1 ) = (3,0 м) (5,034 V 1 ) = (3,4 м) (5,034 V 1 ) = (3,4 м) ( V 1 ) = (3,4 м) ( V 1 ). V 1 = 4,4 л HNO 3 требуется. рН в точке эквивалентности 7,0 , потому что в этой реакции участвуют сильная кислота и сильное основание. В растворе остается только соль RbNO 3 , что приводит к нейтральному pH. Пример \(\PageIndex{6}\): Найдите рН в следующих точках при титровании 30 мл 0,05 М HClO 4 0,1 М КОН. A.) Перед добавлением любого KOH РАСТВОР pH = -log[H + ] Мы знаем, что изначально имеется 0,095 М HClO0028 4 , а так как КОН еще не добавлялся, то значение pH равно: pH = -log[0,05 M] pH = 1,30 B.) Когда 5 мл 0,1 M KOH добавлено Раствор 30 мл 0,05 М HClO 4 = (30 мл)(0,05 М) = 1,5 ммоль Н + 5 мл (5 М 90,231 90,231 90,5 мл HClO) 0,1 М) = 0,5 ммоль ОН — Напишите реакцию между HClO 4 и КОН: HClO 4 (водн. = H + (водн.) + ClO 4 4 водн.) + K + (водн.) + OH — (водн.) —> H 2 O (л) + K + (водн.) + ClO 4 — (водн.) 3 результирующее ионное уравнение = H + (водн.) + OH — (водн.) —> H 2 O (л) На основании этого уравнения можно сказать, что: 1 mol HClO 4 = 1 mol H + 1 mol KOH = 1 mol OH — 1 mol of H + reacts with 1 mol OH — Мы вычитаем 0,5 ммоль из обоих, потому что OH — действует как ограничивающий реагент, оставляя избыток 1 ммоль H + . Помните, что: Молярность = ммоль/мл У нас уже есть ммоль, поэтому, чтобы найти мл, все, что мы делаем, это добавляем объем HClO 4 и KOH: Общий объем = мл HClO 4 + мл KOH = 30 мл + 5 мл = 35 мл So, Молярность H + = (1 ммоль)/(35 мл) = 0,029 M pH = -log[H + ] = -log [0,029] pH = 1,54 * Обратите внимание, что pH увеличивается по мере добавления основания C.) Когда добавляется 15 мл 0,1 м KOH Раствор 30 мл 0,05 м HCLO 4 = 1,5 мл 3 15 Mlo 4 = 1,5 мл 3 15 мл. Помните, что когда [H + ] = [OH — ] , это точка эквивалентности. Мы знаем, что в точке эквивалентности титрования сильной кислоты сильным основанием pH = 7,0 So, pH = 7,0 Пример \(\PageIndex{7}\): Определите pH в следующих точках титрования 10 мл 0,1 М HBr 0,1 М CsOH, когда: A.) При добавлении 8 мл CsOH РАСТВОР ммоль HBr = ммоль H + = (10 мл)(0,1 М) = 1 ммоль H + ммоль — = (8 мл)(0,1 М) = 0,8 ммоль ОН — H + (водн.) + OH — (водн.) —> H 2 O (л) * * Помните, что это всегда будет результирующее ионное уравнение для сильной кислоты- титрования сильными основаниями. У нас есть 0,2 ммоль H + , поэтому для определения молярности нам нужен общий объем. Общий объем = 10 мл H + + 8 мл OH — = 18 мл Молярность = (0,2 ммоль)/(18 мл) = 0,01 М Мы знаем pH = -log[H + ], поэтому, pH = — log[0.01 M] pH = 2.0 B.) When 10 mL CsOH is added SOLUTION mmol HBr = 1.0 mmol H + mmol CsOH = (10 мл)(0,1 М) = 1,0 ммоль ОН — С [H + ] = [OH — ] , this is the equivalence point and thus, pH = 7.0 C.) When 15 mL CsOH is added SOLUTION ммоль HBr = 1,0 ммоль H + ммоль CsOH = (15 мл)(0,1 М) = 1,5 ммоль OH — У нас есть 0,5 ммоль OH — поэтому мы можем вычислить молярность OH — , затем найти pOH и затем использовать pOH для определения pH, потому что: pOH = 14 — pH 9 Всего Объем = 10 мл H + + 15 мл OH — = 25 мл Молярность = (0,5 ммоль)/(25 мл) = 0,02 М Теперь, pOH = -log[OH — ] = -log[0,02 М] = 1,70 pH = 14 — 1,70 pH = 12,30 Пример \(\PageIndex{9}\) Определите рН в каждой из следующих точек при титровании 15 мл 0,1 М HI 0,5 М LiOH РЕШЕНИЕ Решение задачи 4 представлено в виде видео и было создано Manpreet Kaur Пример \(\PageIndex{10}\) Определите рН в каждой из следующих точек при титровании 10 мл 0,05 М раствора Ba(OH) 2 0,1 М HNO 3 РЕШЕНИЕ Решение задачи 5 представлено в виде видео и было создано Manpreet Kaur Кривая pH реакции сильной кислоты и сильного основания На приведенной ниже диаграмме кривой pH показано титрование сильной кислоты сильным основанием: Когда мы добавляем сильное основание к сильной кислоте, pH увеличивается медленно, пока мы не приблизимся к точке эквивалентности, где pH резко возрастает при небольшом увеличении объема добавляемого основания. Учебники
/
Химия
/
Введение в химию 5
/
Глава 7
/
Задача 98П 4
5
1
378
Отзывы Проблема 98P Предскажите продукты каждой реакции и напишите сбалансированные полные ионные уравнения и суммарные ионные уравнения для каждой. (а) \(\mathrm{H}_{2} \mathrm{SO}_{4}(a q)+\mathrm{HNO}_{3}(a q) \rightarrow\) (b) NaOH (водн.) + LiOH (водн.) ⟶ (c) \(\mathrm{Cr}\left(\mathrm{NO}_{3}\right)_{3}(a q)+\mathrm{LiOH} (a q) \rightarrow\) (d) \(\mathrm{HCl}(a q)+\mathrm{Hg}_{2}\left(\mathrm{NO}_{3}\right)_{2 }(a q) \rightarrow\) Транскрипция уравнения: Транскрипция текста: H_2 SO_4 (водн.) + HNO_3 (водн.) ) HCl (водн.) + Hg_2 (NO_3)_2 (водн.) Пошаговое решение: Шаг 1 из 3 Раствор 98P (a) h3SO4(водн.) + HNO3(водн.) → Нет реакции (b) NaOH(водн.) + LiOH(водн.) → Нет реакции (c) Cr(NO3)3(водн. Сбалансированное ионное уравнение будет Cr3+ (водн.)+ 3NO3-(водн.) + 3Li+(водн.) +3OH- (водн.) —> Cr(OH)3(s) + 3NO3-(водн.) + 3Li+ (водн.) исключая спектаторные ионы, NO3-(водн.) и K+, с обеих сторон мы получаем результирующее ионное уравнение, которое выглядит следующим образом: Cr3+(водн.)+ 3OH-(водн.) —> Cr(OH)3( s) (d)HCl(водн.) + Hg2(NO3)2(водн.) →Hg2Cl2(тв)+2HNO3(водн.)являются продуктами реакции Сбалансированное ионное уравнение будет 2H+ (водн.) + 2Cl-(водн.) +2 Hg2+ (водн.)+ 2NO3-(водн.) —> Hg2Cl2(тв)+2NO3-(водн.) + 2H+(водн.) После удаления спектаторных ионов, NO3- и H+, мы получаем результирующее ионное уравнение: 2Cl-(водн.)
Шаг 2 из 3 Шаг 3 из 3 106P: Какой раствор можно добавить к каждой смеси катионов, чтобы осадить один. Химия
Введение в химию
5 издание 3 / 5
из 9 отзывов Посмотреть весь материал исчисление: ранние трансцендентальные функции:
Предварительный просмотр Calculus Исчисление: ранние трансцендентальные функции:
Натуральная логарифмическая функция: интегрирование Исчисление: ранние трансцендентальные функции:
Объем: метод оболочки Исчисление: ранние трансцендентные функции:
Силовая серия 9{3}\). Статистика: обоснованные решения с использованием данных:
Предвзятость при составлении выборки Статистика: обоснованные решения с использованием данных:
Сравнение трех или более средних значений (однофакторный дисперсионный анализ) Статистика: обоснованные решения с использованием данных:
Двусторонний дисперсионный анализ Химия: Центральная наука:
Электронная структура атомов Химия: центральная наука:
Электронная структура атомов 9{-} \лонграйтарро 16BSC: Анализ лечения назонексом Назонекс — это назальный спрей, используемый для лечения… Статистика
Элементарная статистика
12 издание 3 / 5
из 6 отзывов Просмотреть весь материал 2E: «Нарисуйте график функции, для которой вывод теории Ролля… Исчисление
Исчисление: ранние трансцендентальные
1 издание 4 / 5
из 4 отзывов Посмотреть весь материал 86AE: «Когда спектр солнечного света исследуется в высоком разрешении. Химия
Химия: центральная наука
12 издание 3 / 5
из 4 отзывов Посмотреть весь материал 25E: Что такое квантово-механическая орбиталь? Химия
Химия: молекулярный подход
3 издание 4 / 5
из 4 отзывов Посмотреть весь материал 15PE: планетарная модель атома изображает электроны, вращающиеся вокруг атома. Физика
Физика: принципы с приложениями
6 издание 5 / 5
из 5 отзывов Посмотреть весь материал 2E: Что такое домен многочлена? Исчисление
Исчисление: ранние трансцендентальные
1 издание 4 / 5
из 3 отзывов Посмотреть весь материал Глава 5: Введение в химию | 5-е издание Химия
Введение в химию
5 издание 3 / 5
из 99 отзывов Посмотреть весь материал Глава 3: Органическая химия | 8-е издание Химия
Органическая химия
8 издание 5 / 5
из 89 отзывов Посмотреть весь материал Глава 21: Концептуальная физика | 12-е издание Физика
Концептуальная физика
12 издание 5 / 5
из 73 отзывов Посмотреть весь материал Глава 5. Статистика
Статистика для инженеров и ученых
4 издание 4 / 5
из 46 отзывов Посмотреть весь материал Глава 5.3: Статистика для инженеров и ученых | 4-е издание Статистика
Статистика для инженеров и ученых
4 издание 4 / 5
из 46 отзывов Посмотреть весь материал Глава 18: Университетская физика | 13-е издание Физика
Университетская физика
13 издание 4 / 5
из 68 отзывов Посмотреть весь материал Разблокировать учебник Решение Нет, спасибо, мне не нужна помощь О нас Команда Карьера Блог Школы Субъекты Учебник по выживанию Элитные регистраторы Реферальная программа Координаторы по маркетингу кампуса Стипендии Контакт Часто задаваемые вопросы Карта сайта Как сбалансировать h3SO4 + LiOH = Li2SO4 + h3O (серная кислота + гидроксид лития) Как написать суммарное ионное уравнение для h3SO4 + LiOH = Li2SO4 + h3O LiOH+h3SO4 Реакция титрования h3SO4 и LiOH Как сбалансировать h3SO4+LiOH=Li2SO4+h3O|Химическое уравнение h3SO4+LiOH=Li2SO4+h3O|h3SO4+LiOH=Li2SO4+h3O Структура Льюиса LiOH, гидроксид лития LIOH Реакция с CO2 — Химия 4. Уравнение для LiOH + h3O (гидроксид лития + вода) Как написать суммарное ионное уравнение для HF + LiOH = LiF + h3O Wei Li Кристалл комплекса целлюлозы h3SO4 в процессе набухания при низкой температуре Как написать результирующее ионное уравнение для HCl + LiOH = LiCl + h3O Тип реакции для HCl + LiOH = LiCl + h3O Как написать суммарное ионное уравнение для Li + h3O = LiOH + h3 Как сбалансировать Li + h3O = LiOH + h3 (литий плюс вода) Является ли LiOH (гидроксид лития) электролитом или неэлектролитом? Как сбалансировать h4PO4 + LiOH = h3O + Li3PO4 (фосфорная кислота + гидроксид лития) Сколько мл 1M h3SO4 необходимо для нейтрализации 10 мл 1M Mg(OH)2? Как написать суммарное ионное уравнение для LiOH + Ch4COOH = LiCh4COO + h3O Как сбалансировать Li3N + h3O = LiOH + Nh4 (нитрид лития + вода) Sulaiman Cakap dengan Hud-Hud Guna Bahasa Apa? Как нарисовать точечную структуру Льюиса для LiOH: гидроксид лития Как написать суммарное ионное уравнение для HI + LiOH = LiI + h3O Li+h3O=LiOH+h3 сбалансируйте уравнение @My документальный фильм. Как написать результирующее ионное уравнение для Fe(NO3)3 + LiOH = LiNO3 + Fe(OH)3 Как найти количество атомов в LiOH (гидроксид лития) Молярная масса / молекулярный вес LiOH: Гидроксид лития Определение содержания соли в HNO3 и LiOH Титрование HCl против LiOH Как сбалансировать Li + h3O — LiOH + h3 Процесс титрования (добавка HCl к LIOH) Mg(OH)2+h3SO4=MgSO4+h3O сбалансируйте химическое уравнение @My документальный фильм. мг(о)2+h3so4=mgso4+h3o Как сбалансировать h3S2O7 + h3O = h3SO4 (пиросерная кислота + вода) Тип реакции для SO2 + O2 + h3O = h3SO4 LiOH растворим или нерастворим в воде? Лио 2день рождения 4 Короткометражный фильм о бурундуке || Бурундук Лио Как сбалансировать LiOH + CO2 = Li2CO3 + h3O | Гидроксид лития + диоксид углерода Napisz równania reakcji otrzymywania soli, jeżeli: a) субстратами на LiOH и N2O5 b) единым из . Balanceo de Ecuaciones Método Algebraico No 3 Уравновешивание уравнения Li + NaOH = LiOH + Na (и тип реакции) Реакция лития в воде ЩЕЛОЧНЫЕ МЕТАЛЛЫ || ВОДА || ЛИОХ Как сбалансировать h3SO4 + Pb(OH)2 = PbSO4 + h3O Лиох 🔴РЕДОКС🔴Тентукан реакси берикут терголонг реакси редокс атау букан редокс! деньган чаранья. а. 2 NaOH (UFF) О гидроксид лития, LiOH, por seu baixo peso molly, tem sido utilizado for renovação Balanceo de Ecuaciones Método Algebraico No 4 Как написать результирующее ионное уравнение для HNO3 + LiOH = LiNO3 + h3O Тип реакции для Li + h3O = LiOH + h3 загрузки Lioh h3so4 неограниченно Фильмы и видео Скачать Здесь.Lioh h3so4 Hd,3gp. mp4 320p и другие видео, которые вы можете легко скачать. — (водный) 9+ \) ), которые соединяются с ионами ОН — из сильного основания с образованием воды. Следует отметить, что анион нашей кислоты HCl был Cl — (водн.), который сочетался с катионом нашего основания NaOH, Na + (водн.). Это образовало соль NaCl (водн.), которая не показана в чистом ионном уравнении, поскольку она диссоциирует. Однако важно помнить, что реакция сильная кислота/сильное основание действительно образует соль.  Чистое ионное уравнение реакции сильной кислоты и сильного основания всегда имеет вид: 9-\;(водный) \rightarrow H_2O\; (l) \]
Чистое ионное уравнение реакции сильной кислоты и сильного основания всегда имеет вид: 9-\;(водный) \rightarrow H_2O\; (l) \] ) + OH — (водн.) —> H 2 O (л) + K + (водн.) + I — (водн.)
) + OH — (водн.) —> H 2 O (л) + K + (водн.) + I — (водн.) Титрование
 Они поглощают друг друга, и ни один из реагентов не находится в избытке.
Они поглощают друг друга, и ни один из реагентов не находится в избытке. Точка эквивалентности
 Уравнение реакции выглядит следующим образом:
Уравнение реакции выглядит следующим образом: 2,0 моль KOH 2,1 л = 4,2 моль КОН Литр 3,4 моль HI х = 4,2 моль HI Литр Х = 4,2 моль HI = 1,2 литра 3,4 моль HI/литр 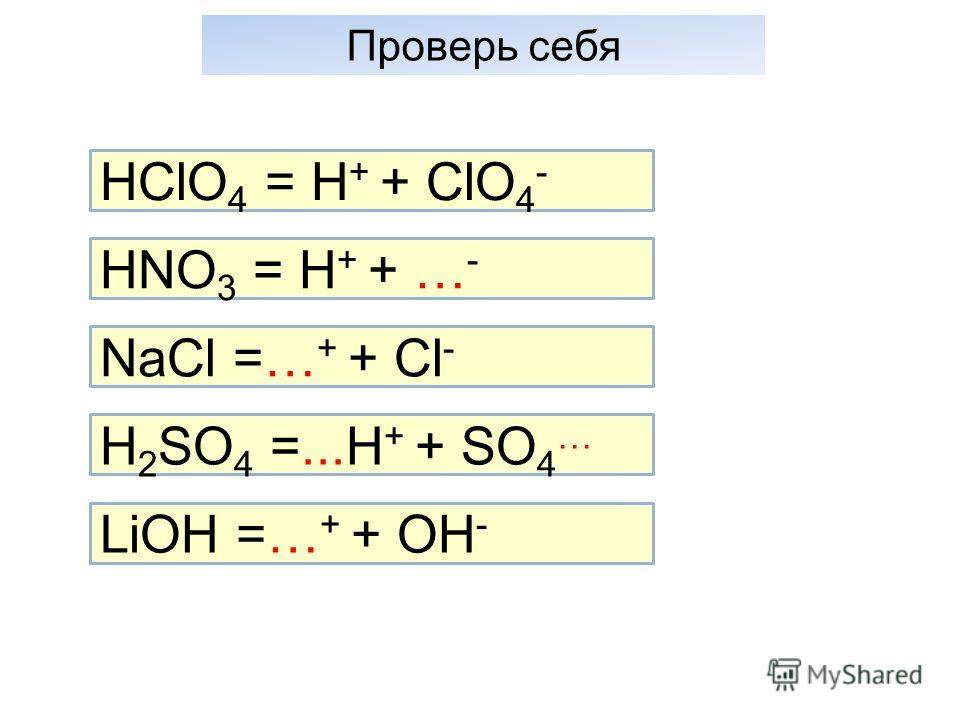 Ответ: 1,2 л 3,4 М HI, необходимое для достижения точки эквивалентности с 2,1 л 2,0 М КОН.
Ответ: 1,2 л 3,4 М HI, необходимое для достижения точки эквивалентности с 2,1 л 2,0 М КОН. Проблемы, связанные с pH
 0033 ионы сильного основания соответственно:
0033 ионы сильного основания соответственно: 0,45 моль H 2 SO 4 5,0 литр 2 моль H + = 4,5 моль H + Литр 1 моль H 2 SO 4 1,2 моль LiOH 2,3 литра 1 моль ОН — = 2,8 моль ОН — Литр 1 моль LiOH 
1,7 моль H + 33333397777 1.7 моль H + 33333333397 1,7 моль H + 33333333333397 1,7 моль H + 33333333333397 1,7 моль. = 0,23 М В + 7,3 л  23][OH — ] = 1 * 10 -14
23][OH — ] = 1 * 10 -14 Миллимоль для решения задач
Этапы решения проблемы
 (создано Manpreet Kaur)-
(создано Manpreet Kaur)-
 ) + KOH (водн.) —> H 2 O (л) + KClO 4
) + KOH (водн.) —> H 2 O (л) + KClO 4 H + + OH — H 2 O Начальный 1,5 ммоль 0,5 ммоль — Смена -0,5 ммоль -0,5 ммоль — Окончательный 1 ммоль 0 ммоль — 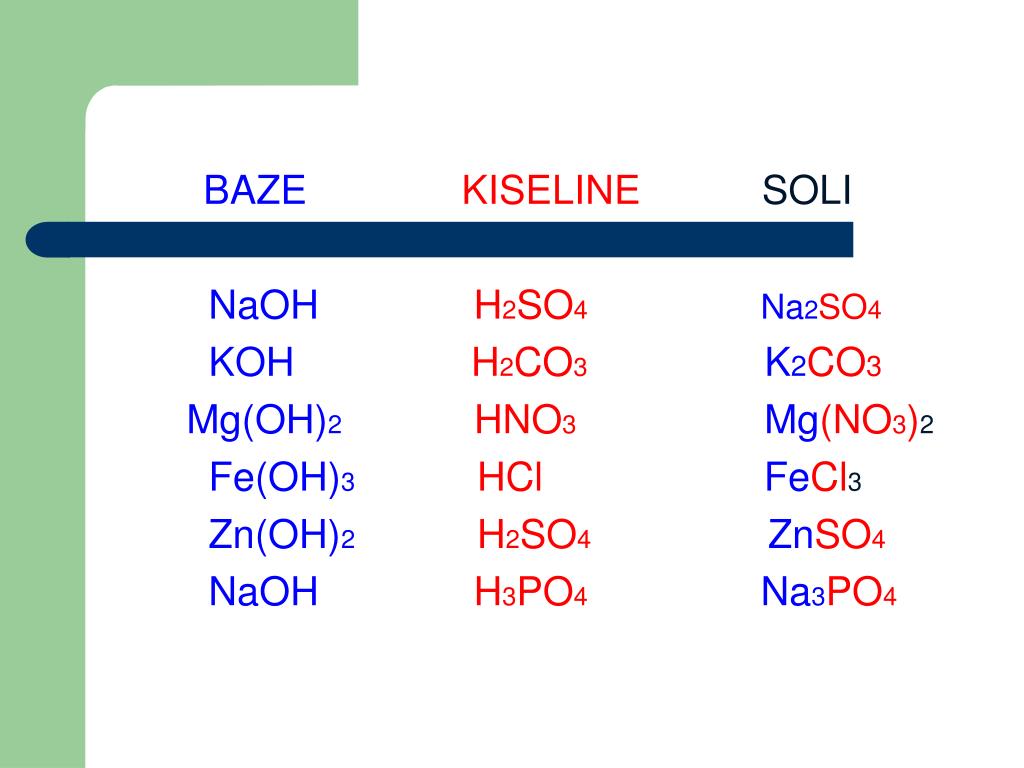
H + + OH — H 2 O Начальный 1,5 ммоль 1,5 ммоль — Смена -1,5 ммоль -1,5 ммоль — Окончательный 0 ммоль 0 ммоль — 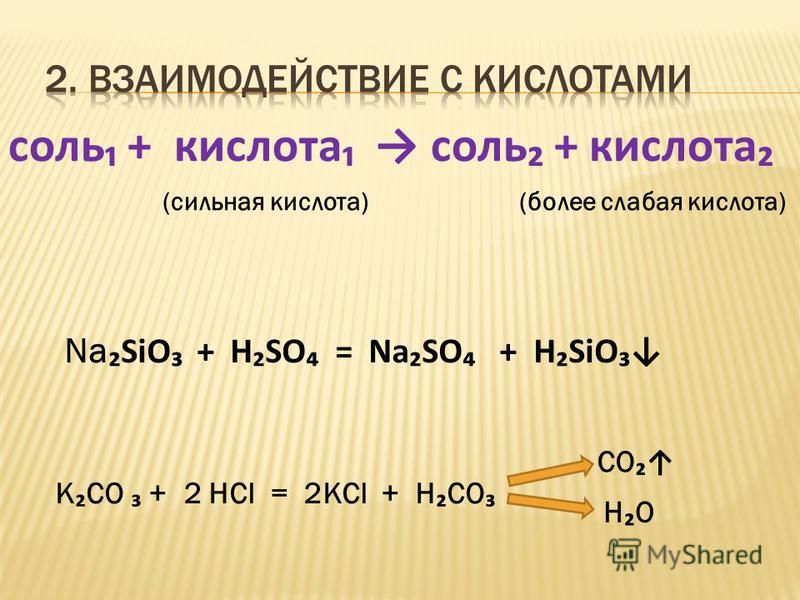
H + + OH — H 2 O Начальный 1,0 ммоль 0,8 ммоль — Смена -0,8 ммоль -0,8 ммоль — Окончательный 0,2 ммоль 0 ммоль — 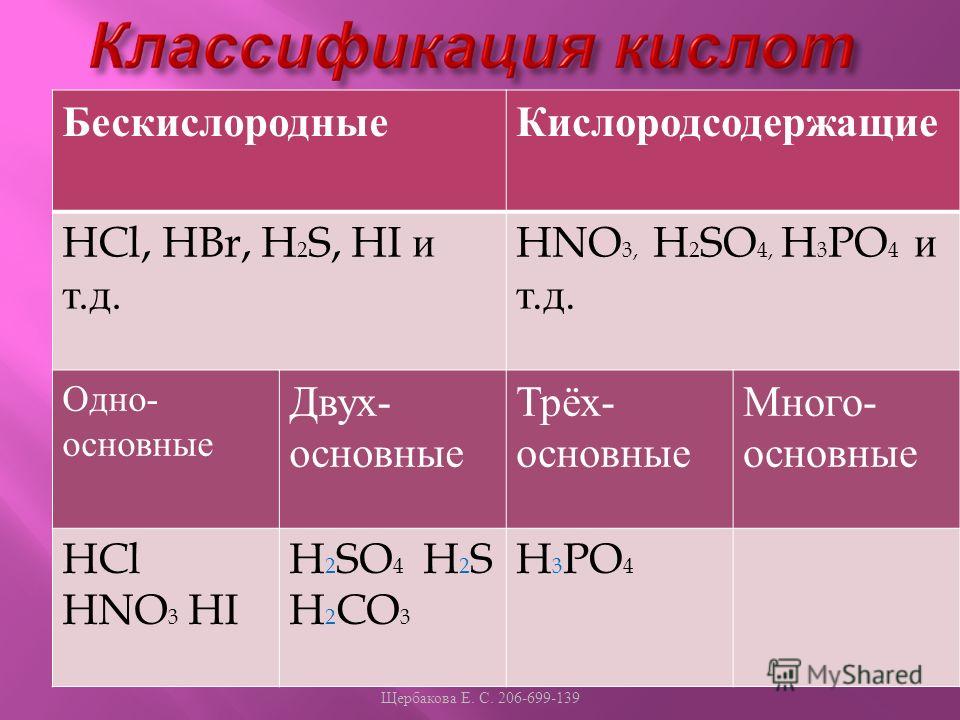
93047 90
H + + OH — H 2 О Начальный 1,0 ммоль 1,5 ммоль — Смена -1,0 ммоль -1,0 ммоль — Окончательный 0 ммоль ,5 ммоль —  Это связано с логарифмической природой системы pH (pH = -log [H + ]). В точке эквивалентности pH, как и ожидалось, составляет 7,0. Преодоление точки эквивалентности путем добавления большего количества основания сначала резко увеличивает рН и, в конечном итоге, снижается.
Это связано с логарифмической природой системы pH (pH = -log [H + ]). В точке эквивалентности pH, как и ожидалось, составляет 7,0. Преодоление точки эквивалентности путем добавления большего количества основания сначала резко увеличивает рН и, в конечном итоге, снижается. Ссылки
Внешние ссылки
Авторы
На этой странице нет тегов.

Получить ответ: Предсказать продукты каждой реакции и написать сбалансированную полную ионную и
 Если реакции нет, напишите НЕТ РЕАКЦИИ.
Если реакции нет, напишите НЕТ РЕАКЦИИ. ) + LiOH(водн.) →Cr(OH)3(т)+Li(NO3)3(водн.) являются продуктами реакции
) + LiOH(водн.) →Cr(OH)3(т)+Li(NO3)3(водн.) являются продуктами реакции Глава 7, проблема 98P решена
Посмотреть полное решение Другие растворы
 ..
..
?Secant Lines Рассмотрим функцию \(е(х)=\sqrt{х}\) А точка P(4, 2) на графике f. (a) График f и секанс l
?В упражнениях 1-26 найдите неопределенный интеграл. \(\int \frac{1}{x+1} d x\) 9{3}} д х\)
?Нахождение объема твердого тела В упражнениях 1-14 используйте метод оболочки для настройки и вычисления интеграла, который дает объем сгенерированного твердого тела (a
(a
?Формулировка вопросов опроса Напишите вопрос опроса, содержащий строгие формулировки, и один, который содержит сдержанные формулировки. Разместите каждый вопрос в Интернете
?Время реакции В психологическом онлайн-эксперименте, спонсируемом Университетом Миссисипи, исследователи попросили участников исследования ответить на различные вопросы.0024
?Влияние фактора А представляет собой изменение переменной отклика в результате изменения уровня фактора А. Влияние фактора В представляет собой изменение i
Укажите значения n, l и ml для
(a) каждая орбиталь в подоболочке 2p,
(б) каждая орбиталь в подоболочке 5d.
Люди также купили
 ..
.. ..
.. Родственные разделы
 1: Статистика для инженеров и ученых | 4-е издание
1: Статистика для инженеров и ученых | 4-е издание Lioh h3so4 Смотреть HD Mp4 Видео Скачать Бесплатно
 22а | Полная и уравновешенная: к раствору LiOH добавляют раствор HClO4.
22а | Полная и уравновешенная: к раствору LiOH добавляют раствор HClO4. li+h3o=lioh+h3 баланс химическое уравнение
li+h3o=lioh+h3 баланс химическое уравнение ..
..
