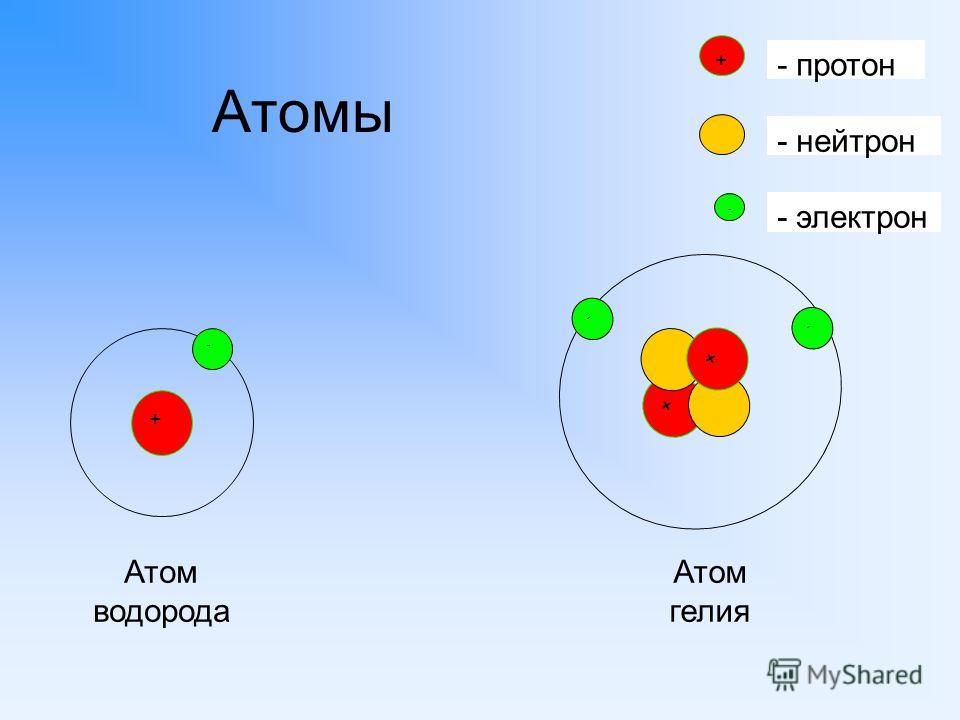
| 1 | Найти число нейтронов | H | |
| 2 | Найти массу одного моля | H_2O | |
| 3 | Баланс | H_2(SO_4)+K(OH)→K_2(SO_4)+H(OH) | |
| 4 | Найти массу одного моля | H | |
| 5 | Найти число нейтронов | Fe | |
| 6 | Найти число нейтронов | Tc | |
| 7 | Найти конфигурацию электронов | H | |
| 8 | Найти число нейтронов | Ca | |
| 9 | Баланс | CH_4+O_2→H_2O+CO_2 | |
| 10 | Найти число нейтронов | C | |
| 11 | Найти число протонов | H | |
| 12 | Найти число нейтронов | O | |
| 13 | Найти массу одного моля | CO_2 | |
| 14 | Баланс | C_8H_18+O_2→CO_2+H_2O | |
| 15 | Найти атомную массу | H | |
| 16 | Определить, растворима ли смесь в воде | H_2O | |
| 17 | Найти конфигурацию электронов | Na | |
| 18 | Найти массу одного атома | H | |
| 19 | Найти число нейтронов | Nb | |
| 20 | Найти число нейтронов | Au | |
| 21 | Найти число нейтронов | Mn | |
| 22 | Найти число нейтронов | Ru | |
| 23 | Найти конфигурацию электронов | ||
| 24 | Найти массовую долю | H_2O | |
| 25 | Определить, растворима ли смесь в воде | NaCl | |
| 26 | Найти эмпирическую/простейшую формулу | H_2O | |
| 27 | Найти степень окисления | H_2O | |
| 28 | Найти конфигурацию электронов | K | |
| 29 | Найти конфигурацию электронов | Mg | |
| 30 | Найти конфигурацию электронов | Ca | |
| 31 | Найти число нейтронов | Rh | |
| 32 | Найти число нейтронов | Na | |
| 33 | Найти число нейтронов | Pt | |
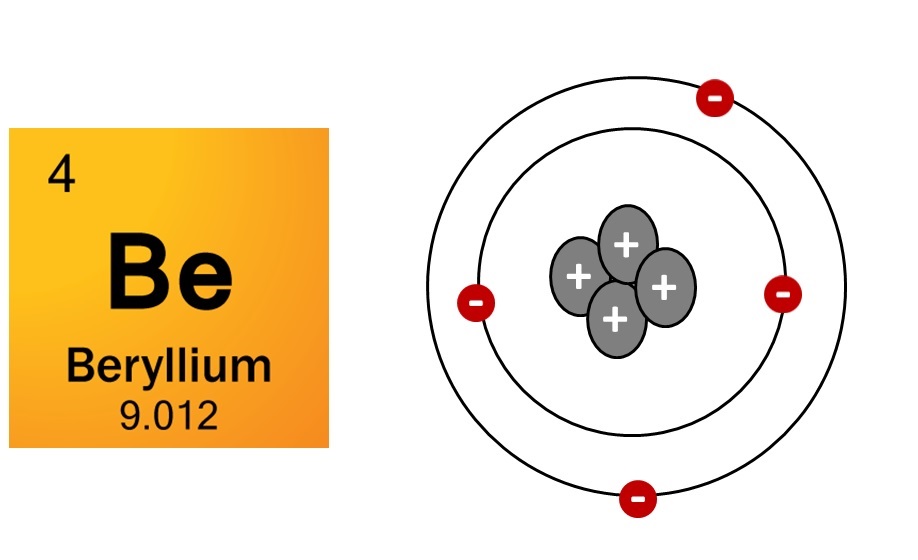
| 34 | Найти число нейтронов | Be | Be |
| 35 | Найти число нейтронов | Cr | |
| 36 | Найти массу одного моля | H_2SO_4 | |
| 37 | Найти массу одного моля | HCl | |
| 38 | Найти массу одного моля | Fe | |
| 39 | Найти массу одного моля | C | |
| 40 | Найти число нейтронов | Cu | |
| 41 | Найти число нейтронов | S | |
| 42 | Найти степень окисления | H | |
| 43 | Баланс | CH_4+O_2→CO_2+H_2O | |
| 44 | Найти атомную массу | O | |
| 45 | Найти атомное число | H | |
| 46 | Найти число нейтронов | Mo | |
| 47 | Найти число нейтронов | Os | |
| 48 | Найти массу одного моля | NaOH | |
| 49 | Найти массу одного моля | O | |
| 50 | Найти конфигурацию электронов | Fe | |
| 51 | Найти конфигурацию электронов | C | |
| 52 | Найти массовую долю | NaCl | |
| 53 | Найти массу одного моля | ||
| 54 | Найти массу одного атома | Na | |
| 55 | Найти число нейтронов | N | |
| 56 | Найти число нейтронов | Li | |
| 57 | Найти число нейтронов | V | |
| 58 | Найти число протонов | N | |
| 59 | Упростить | H^2O | |
| 60 | Упростить | h*2o | |
| 61 | Определить, растворима ли смесь в воде | H | |
| 62 | Найти плотность при стандартной температуре и давлении | H_2O | |
| 63 | Найти степень окисления | NaCl | |
| 64 | Найти атомную массу | He | He |
| 65 | Найти атомную массу | Mg | |
| 66 | Найти число электронов | H | |
| 67 | Найти число электронов | O | |
| 68 | Найти число электронов | S | |
| 69 | Найти число нейтронов | Pd | |
| 70 | Найти число нейтронов | Hg | |
| 71 | Найти число нейтронов | B | |
| 72 | Найти массу одного атома | Li | |
| 73 | Найти эмпирическую формулу | H=12% , C=54% , N=20 | , , |
| 74 | Найти число протонов | Be | Be |
| 75 | Найти массу одного моля | Na | |
| 76 | Найти конфигурацию электронов | Co | |
| 77 | Найти конфигурацию электронов | S | |
| 78 | Баланс | C_2H_6+O_2→CO_2+H_2O | |
| 79 | Баланс | H_2+O_2→H_2O | |
| 80 | Найти конфигурацию электронов | P | |
| 81 | Найти конфигурацию электронов | Pb | |
| 82 | Найти конфигурацию электронов | Al | |
| 83 | Найти конфигурацию электронов | Ar | |
| 84 | Найти массу одного моля | O_2 | |
| 85 | Найти массу одного моля | H_2 | |
| 86 | Найти число нейтронов | K | |
| 87 | Найти число нейтронов | P | |
| 88 | Найти число нейтронов | Mg | |
| 89 | Найти число нейтронов | W | |
| 90 | Найти массу одного атома | C | |
| 91 | Упростить | na+cl | |
| 92 | Определить, растворима ли смесь в воде | H_2SO_4 | |
| 93 | Найти плотность при стандартной температуре и давлении | NaCl | |
| 94 | Найти степень окисления | C_6H_12O_6 | |
| 95 | Найти степень окисления | Na | |
| 96 | Определить, растворима ли смесь в воде | C_6H_12O_6 | |
| 97 | Найти атомную массу | Cl | |
| 98 | Найти атомную массу | Fe | |
| 99 | Найти эмпирическую/простейшую формулу | CO_2 | |
| 100 | Найти число нейтронов | Mt |
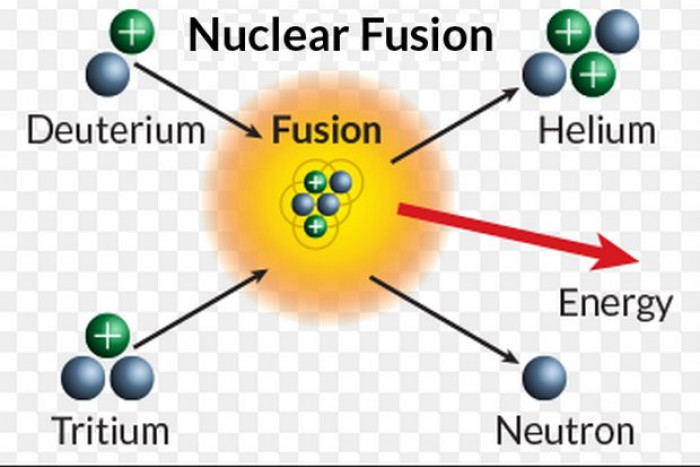
Образование легчайших ядер
14. ОБРАЗОВАНИЕ ЛЕГЧАЙШИХ ЯДЕР 2H, He, Li, Be, B ОБРАЗОВАНИЕ ЛЕГЧАЙШИХ ЯДЕР 2H, He, Li, Be, BИнтервал времени 102 с — 103 с представляет особый интерес. В этот временной интервал остается в основном излучение (и нейтрино), находящееся в тепловом равновесии с небольшой примесью e—, e+ и нуклонов. Основные реакции: e+ + e— <=> + , p + e— → n + e, n + e+ → p + e. В условиях термодинамического равновесия можно
рассматривать вероятность образования нейтрона или протона как вероятность
образования системы с энергией EN, равной энергии покоя нуклона. WN = . Отсюда получаем, что в условиях термодинамического равновесия соотношение между числом нейтронов и протонов будет определяться разностью масс нейтрона и протона
Образование электрон — позитронных пар прекращается при T < 1010 K,
так как энергии фотонов становятся ниже порога образования e+e— — пар (~ 1 МэВ). p + n → d + , в результате которой все нейтроны оказываются связаны в ядра дейтерия. Энергия связи дейтрона всего 2.23 МэВ. Поэтому, легко образуясь, ядра дейтерия также легко распадаются под действием фотонов d + γ <=> p + n. Наиболее эффективно ядерные реакции с образованием легких
ядер начинают происходить, когда температура упадет до 109 K.
Пока время синтеза дейтерия существенно меньше времени
жизни свободного нейтрона концентрация нейтронов существенно меняться не будет и
будет составлять около 15% от полного числа нуклонов.
Выход 7Be, 6Li и 7Li составляет лишь ~ 10-9 — 10-12 от суммарного выхода изотопов по массе. Практически все
нейтроны исчезают, образуя ядра 4He. При плотности вещества
~ 10-3 — 10-4 г/см3 вероятность того, что
нейтрон и протон не провзаимодействуют за время первичного нуклеосинтеза
составляет менее 10 -4. Так как в начале на один нейтрон приходилось 5
протонов, соотношение между числом ядер 4He и p должно быть ~ 1/10,
что и наблюдается в распространенности элементов в современную эпоху.  Лишь с понижением энергии фотонов ниже этой границы
прекращается процесс ионизации вещества. Ядра водорода, дейтерия, гелия и лития
присоединяют электроны и превращаются в нейтральные атомы. Лишь с понижением энергии фотонов ниже этой границы
прекращается процесс ионизации вещества. Ядра водорода, дейтерия, гелия и лития
присоединяют электроны и превращаются в нейтральные атомы. |
Проблема Li, Be, B Легкие ядра — изотопы лития, бериллия и бора 6,7Li, 9Be, 10,11B — не могут образовываться в обычных реакциях
нуклеосинтеза в звездах. Расчеты показывают, что они должны интенсивно
разрушаться в реакциях (p,), (p,) уже при
температурах (2 — 5)·106 K. В этих условиях содержание изотопов Li,
Be, B должно составлять < 10-13 по отношению к водороду. Наблюдаемые же распространен-ности
этих элементов оказываются почти на 2 — 3 порядка выше. Неустойчивая природа
этих трех элементов означает, что они должны быть синтезированы в среде малой
плотности, в условиях достаточно низкой температуры, чтобы предотвратить
сгорание их сразу после образования.
Она предлагает два возможных механизма образования этих
элементов:
На рис. 47, 48 приведены энергетические спектры галактических космических лучей в окрестности Земли. Из приведенных данных можно оценить долю легких элементов, образующихся в результате 1-го и 2-го механизмов. Если взять наблюдаемый поток космических лучей при 10 ГэВ, то примерно 70% легких элементов образуется в результате 1 — го механизма и 30% — в результате 2 — го механизма.
Даже такая упрощенная модель нуклеосинтеза под действием космических лучей приводит к предсказанию абсолютного содержания 6Li, 9Be, 10,11B, которое качественно близко к наблюдаемому (табл. 14). Такое совпадение данных наблюдений с теоретическими оценками накладывает жесткое ограничение на эволюцию Галактики, и, в частности, исключает большие вариации космических лучей в прошлом.
Образование легких элементов в межзвездном веществе
Несмотря на то, что модель в целом хорошо описывает
наблюдаемые распространенности Li, Be, B, в ней есть два недостатка. 7Be + H → 8B + γ, Для выполнения этого необходим либо взрывной процесс с
последующим выносом вещества в холодную часть звезды, либо сильные конвективные
потоки из внутренних областей холодной атмосферы красного гиганта. Аномально
большое содержание 7Li можно также объяснить, если учесть образование
этого элемента на начальном этапе эволюции Вселенной в первичном нуклеосинтезе. |
Химия лития (Z=3) — Химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 591
Литий — редкий элемент, встречающийся в основном в расплавленных породах и соленой воде в очень небольших количествах. Считается, что он не является жизненно важным для биологических процессов человека, хотя он используется во многих лекарственных препаратах из-за его положительного воздействия на мозг человека. Из-за его реактивных свойств люди использовали литий в батареях, реакциях ядерного синтеза и термоядерном оружии.
Считается, что он не является жизненно важным для биологических процессов человека, хотя он используется во многих лекарственных препаратах из-за его положительного воздействия на мозг человека. Из-за его реактивных свойств люди использовали литий в батареях, реакциях ядерного синтеза и термоядерном оружии.
Введение
Литий был впервые идентифицирован как компонент минерального петалита и был открыт в 1817 году Йоханом Августом Арфведсоном, но не был выделен до некоторого времени спустя У. Т. Бранде и сэром Хамфри Дэви. В своих минеральных формах он составляет всего 0,0007% земной коры. Его соединения используются в некоторых видах изделий из стекла и фарфора. Совсем недавно литий стал играть важную роль в сухих батареях и ядерных реакторах. Некоторые соединения лития использовались для лечения маниакально-депрессивных состояний.
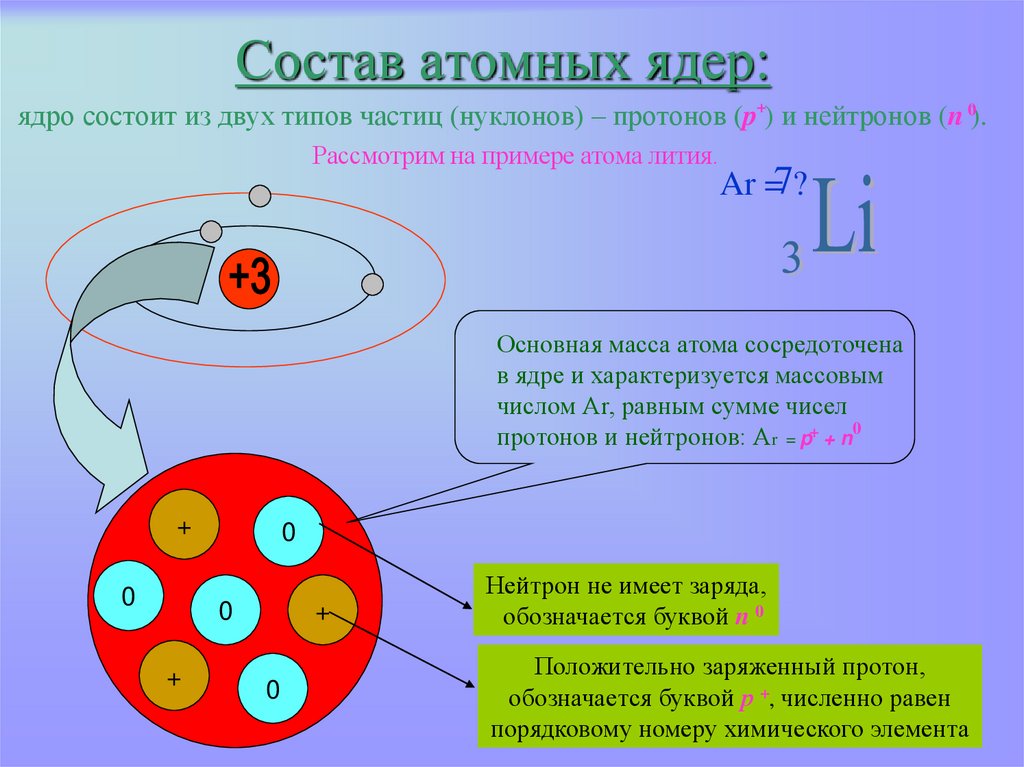
Литий представляет собой щелочной металл с атомным номером 3 и атомной массой 6,941 г/моль. Это означает, что литий имеет 3 протона, 3 электрона и 4 нейтрона (6,941 — 3 = ~4).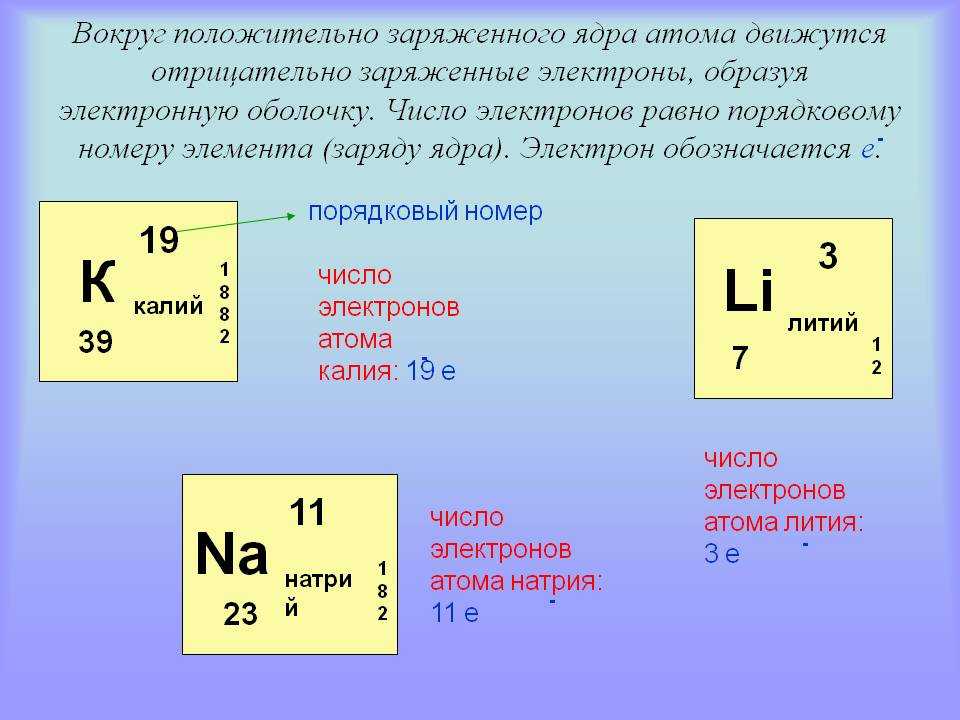 Будучи щелочным металлом, литий является мягким, легковоспламеняющимся и очень реакционноспособным металлом, который имеет тенденцию образовывать гидроксиды. Он также имеет довольно низкую плотность и при стандартных условиях является наименее плотным твердым элементом.
Будучи щелочным металлом, литий является мягким, легковоспламеняющимся и очень реакционноспособным металлом, который имеет тенденцию образовывать гидроксиды. Он также имеет довольно низкую плотность и при стандартных условиях является наименее плотным твердым элементом.
Свойства
Литий — самый легкий из всех металлов, названный в честь греческого слова «камень» (lithos). Это первый представитель семейства щелочных металлов. Он менее плотный, чем вода (с которой реагирует), и при контакте с воздухом образует черный оксид.
| Атомный номер | 3 |
|---|---|
| Атомная масса | 6,941 г/моль |
| Атомный радиус | 152 вечера |
| Плотность | 0,534 г/см 3 |
| Цвет | светло-серебристый |
| Температура плавления | 453,69 К |
| Температура кипения | 1615 К |
| Теплота плавления | 3,00 кДж/моль |
| Теплота парообразования | 147,1 кДж/моль |
| Удельная теплоемкость | 24,860 кДж/моль |
| Первая энергия ионизации | 520,2 кДж/моль |
| Степени окисления | +1, -1 |
| Электроотрицательность | 0,98 |
| Кристаллическая структура | объемно-центрированный куб |
| Магнетизм | парамагнитный |
| 2 стабильных изотопа | 6 Li (7,5%) и 7 Li (92,5%) |
Периодические тенденции лития
Находясь в верхней левой части Периодической таблицы, литий имеет довольно низкую электроотрицательность и сродство к электрону по сравнению с остальными элементами. Кроме того, литий имеет высокий металлический характер и, следовательно, более низкий неметаллический характер по сравнению с другими элементами. Литий имеет более высокий атомный радиус, чем большинство элементов периодической таблицы. В соединениях литий (как и все щелочные металлы) имеет заряд +1. В чистом виде он мягкий и серебристо-белый, имеет относительно низкую температуру плавления (181°C).
Кроме того, литий имеет высокий металлический характер и, следовательно, более низкий неметаллический характер по сравнению с другими элементами. Литий имеет более высокий атомный радиус, чем большинство элементов периодической таблицы. В соединениях литий (как и все щелочные металлы) имеет заряд +1. В чистом виде он мягкий и серебристо-белый, имеет относительно низкую температуру плавления (181°C).
Реакционная способность
Литий относится к группе щелочных металлов 1, которые обладают высокой реакционной способностью и никогда не встречаются в чистом виде в природе. Это связано с их электронной конфигурацией, поскольку они имеют один валентный электрон (рис. 1), который очень легко отдается для создания связей и образования соединений.
_ ↑ ↓ _ _ ↑ __
1S 2 2S 1
Реакции с водой
. В контакте с водным LITHIME -LICTS.
\[ 2Li (т) + 2H_2O (ж) \rightarrow 2LiOH (водн.) + H_2 (г)\]
Из всех металлов группы 1 литий реагирует наименее бурно, медленно выделяя газообразный водород, который может создавать ярко-оранжевое пламя только при использовании значительного количества лития. Это происходит потому, что литий имеет самую высокую энергию активации в своей группе, то есть для удаления одного валентного электрона лития требуется больше энергии, чем для других элементов группы 1, потому что электрон лития находится ближе к его ядру. Атомы с более высокой энергией активации будут реагировать медленнее, хотя литий будет выделять больше тепла в течение всего процесса.
Это происходит потому, что литий имеет самую высокую энергию активации в своей группе, то есть для удаления одного валентного электрона лития требуется больше энергии, чем для других элементов группы 1, потому что электрон лития находится ближе к его ядру. Атомы с более высокой энергией активации будут реагировать медленнее, хотя литий будет выделять больше тепла в течение всего процесса.
Реакции с воздухом
Чистый литий образует гидроксид лития из-за влаги в воздухе, а также нитрид лития (\(Li_3N\)) из газа \(N_2\) и карбонат лития \((Li_2CO_3\ )) из углекислого газа. Эти соединения придают обычно серебристо-белому металлу черный оттенок. Кроме того, он будет гореть с кислородом в виде красного пламени с образованием оксида лития.
\[ 4Li (s) + O_2 (g) \rightarrow 2Li_2O \]
Применение
В своих минеральных формах он составляет всего 0,0007% земной коры. Его соединения используются в некоторых видах изделий из стекла и фарфора. Совсем недавно литий стал играть важную роль в сухих батареях и ядерных реакторах. Некоторые соединения лития использовались для лечения маниакально-депрессивных состояний.
Его соединения используются в некоторых видах изделий из стекла и фарфора. Совсем недавно литий стал играть важную роль в сухих батареях и ядерных реакторах. Некоторые соединения лития использовались для лечения маниакально-депрессивных состояний.
Батареи
Литий можно использовать в качестве литиевой батареи, в которой металлический литий служит анодом. Ионы лития служат в литий-ионных батареях (заряжаемых), в которых ионы лития перемещаются от отрицательного электрода к положительному при разрядке и наоборот при зарядке.
Теплопередача
Литий обладает самой высокой удельной теплоемкостью среди твердых тел. Литий, как правило, используется в качестве охладителя для технологий и приложений теплопередачи.
Источники и извлечение
Литий чаще всего встречается в сочетании с алюминием, кремнием и кислородом с образованием минералов, известных как сподумен (LiAl(SiO 3 ) 2 ) или петалит /
98 касторит LiAlSi 4 O 10 ). Они были найдены на каждом из 6 обитаемых континентов, но добываются они в основном в Западной Австралии, Китае и Чили. Минеральные источники лития становятся менее важными, поскольку в настоящее время разработаны методы использования солей лития, содержащихся в соленой воде.
Они были найдены на каждом из 6 обитаемых континентов, но добываются они в основном в Западной Австралии, Китае и Чили. Минеральные источники лития становятся менее важными, поскольку в настоящее время разработаны методы использования солей лития, содержащихся в соленой воде.Извлечение из минералов
Минеральные формы лития нагревают до достаточно высокой температуры (1200 K — 1300 K) для их измельчения и, таким образом, облегчения последующих реакций. После этого процесса можно применить один из трех методов.
- Использование серной кислоты и карбоната натрия для осаждения железа и алюминия из руды — оттуда на оставшийся материал наносится больше карбоната натрия, что позволяет литию осаждаться, образуя карбонат лития. Его обрабатывают соляной кислотой с образованием хлорида лития.
- Использование известняка для прокаливания руды с последующим выщелачиванием водой с образованием гидроксида лития. Опять же, это обрабатывают соляной кислотой с образованием хлорида лития.

- Использование серной кислоты, а затем выщелачивание водой с образованием моногидрата сульфата лития. Его обрабатывают карбонатом натрия с образованием карбоната лития, а затем соляной кислотой с образованием хлорида лития.
Хлорид лития, полученный любым из трех способов, подвергается окислительно-восстановительной реакции в электролизере для отделения ионов хлорида от ионов лития. Ионы хлора окисляются, а ионы лития восстанавливаются. 9- \rightarrow Ли \;\; \text{(восстановление)}\]
Извлечение из соленой воды
Морская вода естественным образом содержит хлорид лития, который должен быть извлечен в виде карбоната лития, затем повторно обработан, разделен на ионы и восстановлен в той же электролитический процесс, как при извлечении из литиевых руд. В настоящее время для добычи лития используются только три соленых озера в мире: в Неваде, Чили и Аргентине.
Соленая вода направляется в неглубокие пруды, и в течение года или более вода испаряется, оставляя после себя различные соли. Известь используется для удаления соли магния, так что оставшийся раствор содержит довольно концентрированное количество хлорида лития. Затем раствор обрабатывают карбонатом натрия для осаждения пригодного для использования карбоната лития.
Известь используется для удаления соли магния, так что оставшийся раствор содержит довольно концентрированное количество хлорида лития. Затем раствор обрабатывают карбонатом натрия для осаждения пригодного для использования карбоната лития.
Ссылки
- Кипурос, Джордж Дж. и Садоуэй, Дональд Р. «К новым технологиям производства лития». Журнал металлов . Общество минералов, металлов и материалов. Том 50, № 5, май 1998 г .: 24–32.
- Шин, Ю. Дж. ; Ким, И. С.; О, С. К.; Парк, С.К. и Ли, К.С. «Извлечение лития из радиоактивных расплавленных солевых отходов электролизом». Журнал радиоаналитической и ядерной химии. Akadémiai Kiadó and Springer Science+Business Media BV, том 243, № 3, март 2000 г.: 639-643.
- Тахил, Уильям. «Проблемы с литием — последствия будущего производства PHEV для спроса на литий». Международные исследования Меридиана. Январь 2007 г.
Внешние ссылки
- http://en.Wikipedia.org/wiki/Lithium
- http://intelegen.
 com/nutrients/lithium.htm
com/nutrients/lithium.htm - www.scribd.com/doc/11579770/Extraction-Properties-and-Uses-of-Lithium
Задачи
- С какой группой элементов литий легче всего образует соединения?
- Какова электронная конфигурация Li + ?
- Каковы некоторые общие области применения лития?
- Для литий-ионной батареи, содержащей LiCoO 2 , следует ли помещать соединение в анод или катод?
- Учитывая, что 7 Li составляет 7,0160 а.е.м. и 6 Li составляет 6,0151 а.е.м., а их процентное содержание составляет 92,58% и 7,42% соответственно, какова атомная масса лития?
Растворы
- Группа 17 Галогены (литий образует с ними сильные межионные связи, так как галогены сильно электроотрицательны, а литий имеет свободный электрон)
- 1с 2
- Литий-ионные батареи, одноразовые литиевые батареи, пиротехника, создание прочных металлических сплавов и др.

- Анод — литий окислен (LiCoO 2 → Li + + CoO 2 )
- 6,942 г/моль
Авторы и ссылки
- Кэтрин Селонг (UCD), Кевин Фан
Chemistry of Lithium (Z=3) распространяется под лицензией CC BY-NC-SA 4.0, автор, ремикс и/или куратор LibreTexts.
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Лицензия
- CC BY-NC-SA
- Версия лицензии
- 4,0
- Показать страницу TOC
- № на стр.

- Теги
- Воздух
- щелочные металлы
- Щелочные металлы группы 1
- теплопередача
- литий
- Периодические тренды
- реактивный
- Реактивность
Литий — Key Stage Wiki
Содержимое
- 1 Ключевой этап 2
- 1.1 Значение
- 2 Ключевой этап 3
- 2.1 Значение
- 2.2 О литии
- 2.2.1 Молекулярная структура
- 2.2.2 Атомная структура
- 2.2.3 Свойства
- 3 Ключевой этап 4
- 3.
 1 Значение
1 Значение - 3.2 О литии
- 3.2.1 Молекулярная структура
- 3.2.2 Атомная структура
- 3.2.3 Свойства
- 3.
- 4 Вне учебного плана
Key Stage 2
Значение
Литий — это металл.
Key Stage 3
Химический символ лития.
Двухмерное изображение атома лития с 3 протонами и 4 нейтронами в ядре и 3 электронами, вращающимися вокруг ядра.
Значение
Литий — элемент 1-й группы Периодической таблицы элементов с атомным номером 3.
О литии
Молекулярная структура
- Литий имеет химический символ Li.
- Атомы лития соединяются в большом количестве, образуя гигантскую молекулу металла.
Атомная структура
- В ядре лития 3 протона и 4 нейтрона, что дает ему атомный номер 3 и атомную массу 7.
- Атом лития имеет только 1 электрон на внешней оболочке.

Свойства
- Литий является наименее реактивным щелочным металлом.
- Литий более активен, чем углерод в ряду реактивностей, поэтому его необходимо извлекать из руды с помощью электролиза.
- Литий быстро окисляется в присутствии кислорода, поэтому его необходимо хранить в масле.
- Литий сильно реагирует с водой с образованием газообразного водорода и гидроксида лития.
- Литий находится в твердом состоянии при комнатной температуре.
Ключевой этап 4
Химический символ лития.
Двухмерное представление модели Бора изотопа лития-7 с 3 протонами и 4 нейтронами в ядре и 2 электронами в первой оболочке и 1 во внешней оболочке.
Значение
Литий — элемент 1-й группы Периодической таблицы элементов с 3 протонами в ядре.
О литии
Молекулярная структура
- Литий имеет химический символ Li.


 Поэтому для определения соотношения между числом нейтронов и
протонов для T необходимо взять значение, равное 1010 K. К концу
равновесной стадии соотношение между числом нейтронов и протонов, даваемое (45),
следующее: на каждый нейтрон приходится 5 протонов.
Поэтому для определения соотношения между числом нейтронов и
протонов для T необходимо взять значение, равное 1010 K. К концу
равновесной стадии соотношение между числом нейтронов и протонов, даваемое (45),
следующее: на каждый нейтрон приходится 5 протонов. 
 44).
44). Высокие температуры и плотности вещества благоприят-ствовали синтезу легких
элементов.
Высокие температуры и плотности вещества благоприят-ствовали синтезу легких
элементов.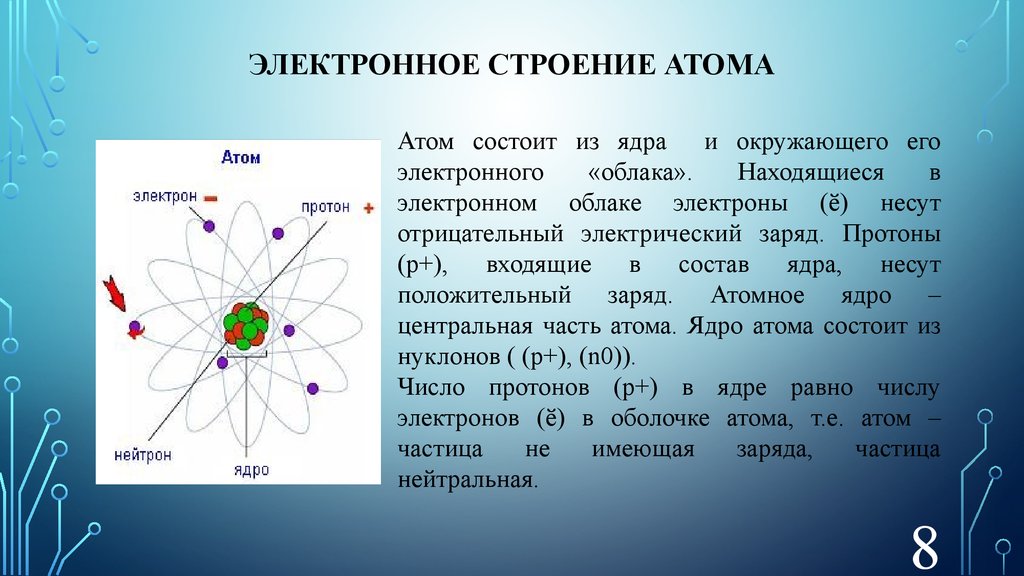 Необходимо было подобрать для этого
соответствующие условия.
Необходимо было подобрать для этого
соответствующие условия.
 Общей закономерностью является то, что наибольший выход имеет изотоп 11B и наименьший — 9Be.
Общей закономерностью является то, что наибольший выход имеет изотоп 11B и наименьший — 9Be. 47. Энергетический спектр наиболее распространенных ядер (кроме
водорода) в галактических космических лучах.
47. Энергетический спектр наиболее распространенных ядер (кроме
водорода) в галактических космических лучах. 3·10-10
3·10-10 Необходима дополнительная информация о низкоэнергичной
компоненте космического излучения на достаточно больших расстояниях от Солнца,
т.к. магнитное поле Солнца может искажать малоэнергичную часть спектра
космического излучения.
Необходима дополнительная информация о низкоэнергичной
компоненте космического излучения на достаточно больших расстояниях от Солнца,
т.к. магнитное поле Солнца может искажать малоэнергичную часть спектра
космического излучения.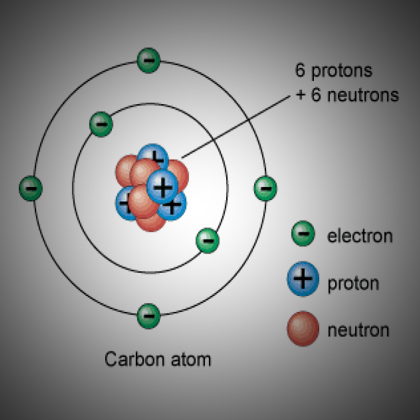


 com/nutrients/lithium.htm
com/nutrients/lithium.htm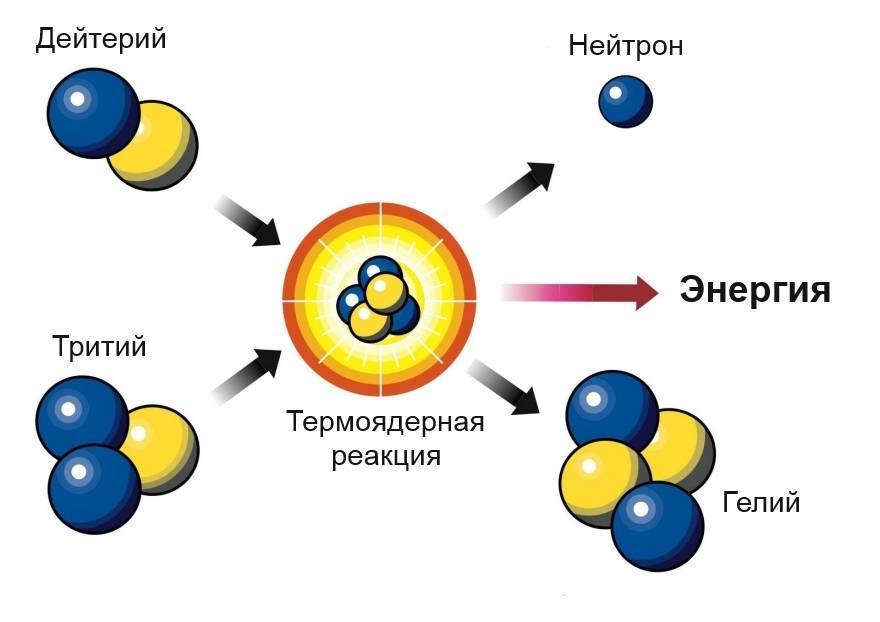
 1 Значение
1 Значение