Лучший ответ по мнению автора | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||
Другие ответы
| ||||||||||||
|
|
| |||||||||||||||||||||||||||||||||||||||||||||||||||
Посмотреть всех экспертов из раздела Учеба и наука > Химия
| Похожие вопросы |
Решено
тезнолог
Напишите изомеры пентановой кислоты изомеры пентаналя
Установите молекулярную формулу предельной карбоновой кислоты натриевой соли, которая содержит 37,5% углерода по массе
Решено
1,2-диметилбензол +KMnO4 ->? уравнение реакции
Химические свойства металлов — с чем реагируют? Свойства и таблица
Поможем понять и полюбить химию
Начать учиться
126. 4K
4K
Свойства металлов начинают изучать на уроках химии в 8–9 классе. В этом материале мы подробно разберем химические свойства этой группы элементов, а в конце статьи вы найдете удобную таблицу-шпаргалку для запоминания.
Металлы — это химические элементы, атомы которых способны отдавать электроны с внешнего энергетического уровня, превращаясь в положительные ионы (катионы) и проявляя восстановительные свойства.
В окислительно-восстановительных реакциях металлы способны только отдавать электроны, являясь сильными восстановителями. В роли окислителей выступают простые вещества — неметаллы (кислород, фосфор) и сложные вещества (кислоты, соли и т. д.).
Металлы в природе встречаются в виде простых веществ и соединений. Активность металла в химических реакциях определяют, используя электрохимический ряд, который предложил русский ученый Н. Н. Бекетов. По химической активности выделяют три группы металлов.
По химической активности выделяют три группы металлов.
Ряд активности металлов
| Li, K, Na, Ca, Ba | Mg, Al, Mn, Zn, Cr, Fe, Ni, Sn, Pb | H2 | Cu, Hg, Ag, Pt, Au |
Общие химические свойства металлов
Взаимодействие с неметаллами
Щелочные металлы сравнительно легко реагируют с кислородом, но каждый металл проявляет свою индивидуальность:
оксид образует только литий
4Li + O 2 = 2Li2O
натрий образует пероксид
2Na + O2 = Na2O2
калий, рубидий и цезий — надпероксид
K + O2 = KO2
Остальные металлы с кислородом образуют оксиды:
2Mg + O2 = 2MgO
2Al + O2 = Al2O3
2Zn + O2 = 2ZnO (при нагревании)
4Cr + 3O2 = 2Cr2O3
Металлы, которые в ряду активности расположены левее водорода, при контакте с кислородом воздуха образуют ржавчину.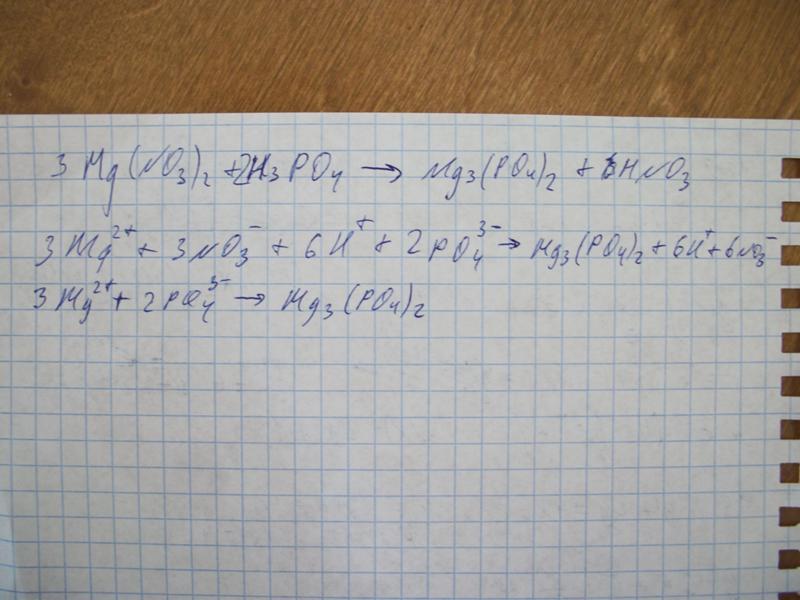 Например, так делает железо:
Например, так делает железо:
4Fe + 3O2 (воздух) + 6H2O(влага)
С галогенами металлы образуют галогениды:
2Na + Cl2 = 2NaCl
Mg + Cl2 = MgCl2
2Al + 3Br2 = 2AlBr3
Zn + Cl2 =ZnCl2
2Cr + 3Cl2 = 2CrCl3
Медный порошок реагирует с хлором и бромом (в эфире):
Cu + Cl2 = CuCl2
Cu + Br2 = CuBr2
При взаимодействии с водородом образуются гидриды:
2Na + H2 = 2NaH
Ca + H2 +СaH2
Zn + H2 =ZnH2
Взаимодействие с серой приводит к образованию сульфидов (реакции протекают при нагревании):
2K + S = K2S
Сa + S = CaS
2Al + 3S = Al2S32Cr + 3S = Cr2S3
Cu +S = CuS
Реакции с фосфором протекают до образования фосфидов (при нагревании):
3K + P = K3P
3Mg + 2P = Mg3P2
3Zn + 2P = Zn3P2
Основной продукт взаимодействия металла с углеродом — карбид (реакции протекают при нагревании).
Из щелочноземельных металлов с углеродом карбиды образуют литий и натрий:
2Li + 2C = Li2C2
Калий, рубидий и цезий карбиды не образуют, могут образовывать соединения включения с графитом:
Ca + 2C = CaC2
С азотом из металлов IA группы легко реагирует только литий. Реакция протекает при комнатной температуре с образованием нитрида лития:
6Li + N2 = 2Li3N
3Mg + N2 = Mg3N2
2Al + N2 = 2AlN
2Cr + N2 = 2CrN
Взаимодействие с водой
Все металлы I A и IIA группы реагируют с водой, в результате образуются растворимые основания и выделяется h3. Литий реагирует спокойно, держась на поверхности воды, натрий часто воспламеняется, а калий, рубидий и цезий реагируют со взрывом:
2Li + 2H2O = 2LiOH + H2
Ca + 2H2O = Ca(OH)2 + H2
Металлы средней активности реагируют с водой только при условии, что металл нагрет до высоких температур. Результат данной реакции — образование оксида.
Результат данной реакции — образование оксида.
Cr + H2O = Cr2O3 + H2
Zn + H2O = ZnO + H2
Неактивные металлы с водой не взаимодействуют.
Взаимодействие с кислотами
Если металл расположен в ряду активности левее водорода, то происходит вытеснение водорода из разбавленных кислот. Данное правило работает в том случае, если в реакции с кислотой образуется растворимая соль.
2Na + 2HCl = 2NaCl + H2
При взаимодействии с кислотами-окислителями, например, азотной, образуется продукт восстановления кислоты, хотя протекание реакции также неоднозначно.
Металлы IА группы:
2K + H2SO4 (раствор) = K2SO4 + H2
8K + 5H2SO4 (конц) = 4K2SO4 + H2S + 4H2O
8Na + 10HNO3 (раствор) = 8NaNO3 + NH4NO3 + 3H2O
3Na + 4HNO3 (конц) = 3NaNO3 + NO + 2H2О
Металлы IIА группы
Mg + H2SO4 (раствор) = MgSO4 + H2
4Mg + 5H2SO4 (конц) = 4MgSO4 + H2S + 4H2O
Mg+ 4HNO3 (конц) = Mg(NO3)2 + 2NO2 + 2H2O
4Mg + 10HNO3 (раствор) = 4Mg(NO3)2 + 2N2O + 5H2O
Такие металлы, как железо, хром, никель, кобальт на холоде не взаимодействуют с серной кислотой, но при нагревании реакция возможна.
Взаимодействие с солями
Металлы способны вытеснять из растворов солей другие металлы, стоящие в ряду напряжений правее, и могут быть вытеснены металлами, расположенными левее:
Zn + CuSO4 = ZnSO4 + Cu
На металлы IА и IIА группы это правило не распространяется, так как они реагируют с водой.
Реакция между металлом и солью менее активного металла возможна в том случае, если соли — как вступающие в реакцию, так и образующиеся в результате — растворимы в воде.
Взаимодействие с аммиаком
Щелочные металлы реагируют с аммиаком с образованием амида натрия:
2Li + 2NH3 = 2LiNH2 + H2
Взаимодействие с органическими веществами
Металлы IА группы реагируют со спиртами и фенолами, которые проявляют в данном случае кислотные свойства:
2Na + 2C2H5OH = 2C2H5ONa + H2
2K + 2C6H5OH = 2C6H5OK + H2
Также они могут вступать в реакции с галогеналканами, галогенпроизводными аренов и другими органическими веществами.
Взаимодействие металлов с оксидами
Для металлов при высокой температуре характерно восстановление неметаллов или менее активных металлов из их оксидов.
8Al + 3Fe3O4 = 4Al2O3 + 9Fe (алюмотермия)
3Са + Cr2O3 = 3СаО + 2Cr (кальциетермия)
Полезные подарки для родителей
В колесе фортуны — гарантированные призы, которые помогут наладить учебный процесс и выстроить отношения с ребёнком!
Вопросы для самоконтроля
С чем реагируют неактивные металлы?
С чем связаны восстановительные свойства металлов?
Верно ли утверждение, что щелочные и щелочноземельные металлы легко реагируют с водой, образуя щелочи?
Методом электронного баланса расставьте коэффициенты в уравнении реакции по схеме:
Mg + HNO3 → Mg(NO3)2 + Nh5NO3 + Н2O
Как металлы реагируют с кислотами?
Подведем итоги
От активности металлов зависит их химические свойства. Простые вещества — металлы в окислительно-восстановительных реакциях являются восстановителями. По положению металла в электрохимическом ряду можно судить о том, насколько активно он способен вступать в химические реакции (т. е. насколько сильно у металла проявляются восстановительные свойства).
Простые вещества — металлы в окислительно-восстановительных реакциях являются восстановителями. По положению металла в электрохимическом ряду можно судить о том, насколько активно он способен вступать в химические реакции (т. е. насколько сильно у металла проявляются восстановительные свойства).
Напоследок поделимся таблицей, которая поможет запомнить, с чем реагируют металлы, и подготовиться к контрольной работе по химии.
Таблица «Химические свойства металлов»
Li, K,Ca, Na, | Mg, Al, Mn, Zn, Cr, Fe, Ni, Sn, Pb | H2 | Cu, Hg, Ag, Pt, Au | |
|---|---|---|---|---|
Восстановительная способность металлов в свободном состоянии | ||||
Взаимодействие металлов с кислородом | Быстро окисляются при обычной температуре | Медленно окисляются при обычной температуре или при нагревании | Не окисляются | |
Взаимодействие с водой | Выделяется водород и образуется гидроксид | При нагревании выделяется водород и образуются оксиды | Водород из воды не вытесняют | |
Взаимодействие с кислотами | Вытесняют водород из разбавленных кислот (кроме HNO3) | Не вытесняют водород из разбавленных кислот | ||
Реагируют с концентрированными азотной и серной кислотами | С кислотами не реагируют, растворяются в царской водке | |||
Взаимодействие с солями | Не могут вытеснять металлы из солей | Более активные металлы (кроме щелочных и щелочноземельных) вытесняют менее активные из их солей | ||
Взаимодействие с оксидами | Для металлов (при высокой температуре) характерно восстановление неметаллов или менее активных металлов из их оксидов | |||
Татьяна Сосновцева
К предыдущей статье
129. 5K
5K
Оксиды
К следующей статье
Химические свойства кислот
Получите план обучения, который поможет понять и полюбить химию
На вводном уроке с методистом
Выявим пробелы в знаниях и дадим советы по обучению
Расскажем, как проходят занятия
Подберём курс
Сбалансируйте следующие уравнения. (a) Mg + HNO3 —> h3 + Mg(NO3)2
Уравновесьте следующие уравнения. (а) Mg + HNO3 —> h3 + Mg(NO3)2 | Channels for Pearson+Recent Channels
- General Chemistry
Chemistry
- General Chemistry
- Organic Chemistry
- Analytical Chemistry
- GOB Chemistry
- Biochemistry
Biology
- General Biology
- Microbiology
- Anatomy & Physiology
- Genetics
- Cell Biology
Math
- College Algebra
- Trigonometry
- Precalculus
Physics
- Physics
Business
- Microeconomics
- Macroeconomics
- Финансовый учет
Социальные науки
- Психология
Начните печатать, затем используйте стрелки вверх и вниз, чтобы выбрать вариант из списка.
Общая химия3. Химические реакцииБалансировка химических уравнений
1:28
минуты
Задача 38d
Вопрос из учебника
Проверенные решения
Наши преподаватели рекомендовали это видео-решение как полезное для решения указанной выше задачи.
273просмотра
Было ли это полезно?
Смотреть дальше
Master Балансировка химических уравнений с небольшим видео-объяснением от Жюля Бруно
Start learning
Related Videos
Related Practice
Balancing Chemical Equations
Professor Dave Explains
292views
How To Balance Chemical Equations
The Organic Chemistry Tutor
399views
Balancing Chemical Equations Practice Problems
Tyler DeWitt
310views
Балансировка химических уравнений
Jules Bruno
1468views
Как сбалансировать химическое уравнение EASY
Научный класс
216views
Уравновешивание химических уравнений Шаг за шагом Практические задачи | How to Pass Chemistry
Melissa Maribel
276views
How to Balance Chemical Equations in 5 Easy Steps: Balancing Equations Tutorial
Wayne Breslyn
684views
Balancing Chemical Equations Example 1
Jules Bruno
1051views
Balancing Химические уравнения Часть 1 | Не запоминай
Don’t Memorize
159views
p2o5-reaction — Googlesuche
AlleBilderVideosNewMapsShoppingBücher
suchoptionen
Du kannst deinesuchsprache in den Einstellungen ändern.
Bilder
ALLAR ANZEIGEN
ALLAR ANZEIGEN
Phosphorus Pentoxide — Wikipedia
EN.Wikipedia.org ›Wiki› Phosphorus_pentoxide
. , кожу, слизистые оболочки и дыхательные пути даже при таких концентрациях, как …
Структура · Применение · Родственные оксиды фосфора · Опасности
Химическая формула: P4O10
Растворимость в воде: экзотермический гидролиз
Температура плавления: 340 °C (644 °F; 613 K)
Температура кипения: 360 °C (возгон)
Фосфорпентоксид — Википедия
de.wikipedia.org › wiki › Фосфорпентоксид
Фосфорпентоксид, общий Дифосфорпентоксид, ist ein Oxid des Elementes Phosphor und gehört … D. Stachel, I. Svoboda, H. Fuess: Phosphorus Pentoxide 233 К. В: Acta …
Тип реакции для P + O2 = P2O5 — YouTube
www.youtube.com › смотреть
18.04.2020 · В этом видео определяем тип химической реакции по уравнению P + O2 = P2O5.. . ». Вы можете подвергнуть риску свое здоровье! Жизнь очень. ..
..
Dauer: 1:19
Прислан: 05.01.2021
Пятиокись фосфора | P2O5 — PubChem
pubchem.ncbi.nlm.nih.gov › соединение › Фосфор…
Экзотермический гидролиз водой с образованием фосфорной кислоты. Реакция с алкоголем аналогична. Будавари, С. (ред.). Индекс Merck — энциклопедия химикатов …
Молекулярная формула: P2O5 или O5P2
Химическая безопасность: Сводка лабораторной химической безопасности (LCSS) Лист данных
Молекулярная масса: 141,94
PubChem CID: 6326975
Механизм дегидратации амида с помощью SOCl2, POCl3 и P2O5 POCl3: Прежде чем перейти к механизмам этих реакций …
Какой продукт образуется при взаимодействии уксусной кислоты с P2O5? — Toppr
www.toppr.com › задать › вопрос
При взаимодействии уксусной кислоты с пятиокисью фосфора получается уксусный ангидрид. решение. расширять. Этот ответ был полезен? голос «за» 0. голос «против» 0.
Проведите следующую химическую реакцию: RCOOH P2O5 Δ — Toppr
www.


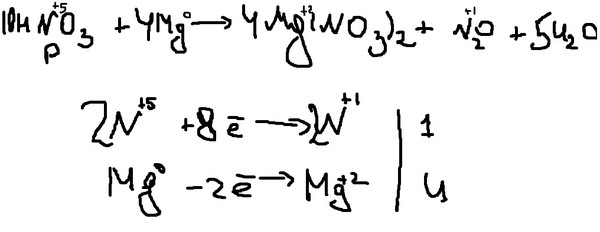 S. Не забывайте выбирать лучший ответ по мнению автора!
S. Не забывайте выбирать лучший ответ по мнению автора!