Свойства гидрида магния (Mgh3) (25 фактов, которые вы должны знать) —
By Рахул Шарма
Гидрид магния является одним из важных соединений магния. Давайте узнаем больше о важных свойствах гидрида магния.
Гидрид магния представляет собой ионное соединение с высоким потенциалом хранение водорода из-за его высокой плотности. Он используется в различных формах, включая сплавы и комбинации с такими материалами, как углеродные нанотрубки или каталитические добавки для хранения водорода.
Теперь давайте рассмотрим номенклатуру, важные свойства и структуру гидрида магния.
Гидрид магния название ИЮПАК
Компания Название ИУАПК Гидрид магния представляет собой гидрид магния.
Химическая формула гидрида магния
Химическая формула гидрида магния: MgH.2.
Номер CAS гидрида магния
Компания CAS номер of мгH2 7693-27-8.
Гидрид магния ChemSpider ID
Компания Идентификатор ChemSpider of мгH2 это 16787263.
Химическая классификация гидрида магния
мгH2 химически классифицируется как,
- Ионное соединение
- Гидрид щелочноземельного металла.
Молярная масса гидрида магния
Молярная масса гидрида магния составляет 26.3207. Расчет показан ниже,
Молярная масса мгH2=MMg+2*МH =24.305+2*1.00784 = 26.3207.
Цвет гидрида магния
Цвет мгH2 белый.
Вязкость гидрида магния
мгH2вязкость не измеряется, так как он разлагается при нагревании.
Молярная плотность гидрида магния
Молярная плотность мгH2 составляет 0. 0550897 моль/см3 так как его плотность 1.45 г/см3.
0550897 моль/см3 так как его плотность 1.45 г/см3.
Температура плавления гидрида магния
Температура плавления мгH2 составляет 307 ° C, хотя он начнет разлагаться и производить H2 и металл Mg при высоких температурах.
мгH2 → Мг + Н2
Состояние гидрида магния при комнатной температуре
мгH2 представляет собой белое кристаллическое твердое вещество при комнатной температуре.
Ионная связь гидрида магния
мгH2 представляет собой ионное соединение; ионная связь образуется между ионами Mg2+ и H- за счет полного переноса электронов.Гидрид магния
Ионный радиус гидрида магния
Радиус не определен для мгH2 С Ионный радиус определяется и измеряется только для атомов, а не для ионного соединения, содержащего три иона.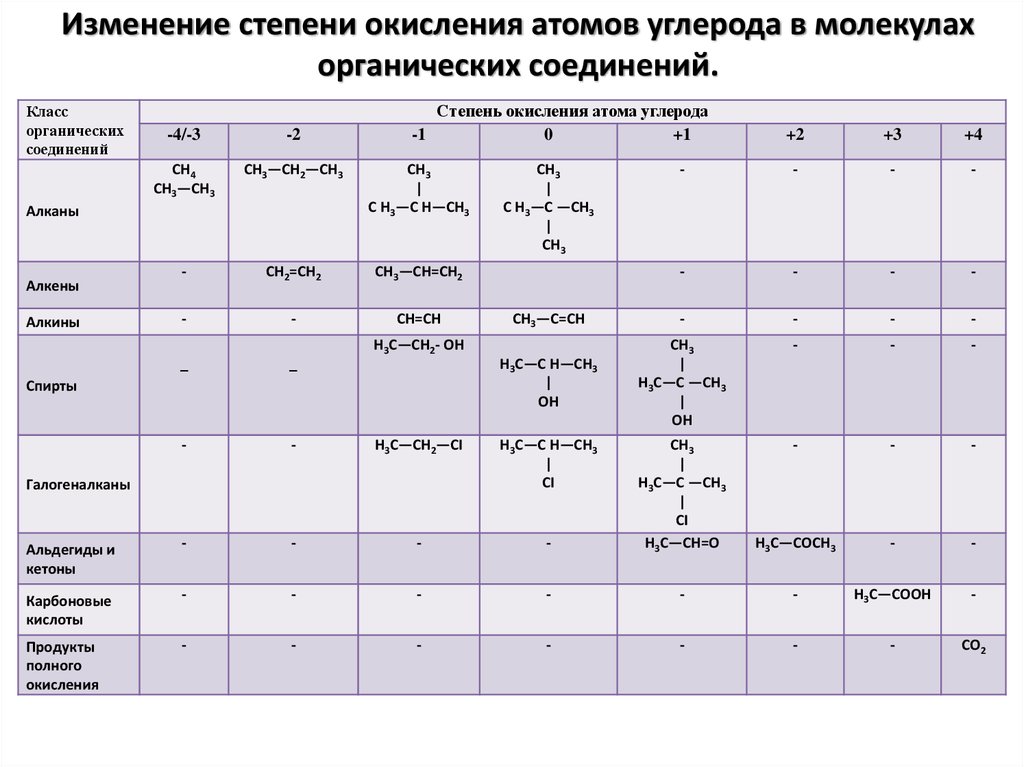
Электронные конфигурации гидрида магния
Электронные конфигурации показывают электроны, распределенные в атомное or молекулярная орбиталь. Давайте узнаем об электронной конфигурации различных атомов в гидриде магния.
Электронная конфигурация Mg2+ в гидриде магния составляет 1 с2 2s2 2p6, что также можно записать в терминах конфигурации благородных газов как [Ne]3s0. Электронная конфигурация H– в гидриде магния составляет 1 с2.
Степень окисления гидрида магния
Атом Mg в мгH2 находится в степени окисления +2. Компания Атом H находится в степени окисления -1.
Гидрид магния щелочной
мгH2 сам по себе является щелочным, но быстро реагирует с H2O с образованием Mg (OH)2 гидрат,
мгH2 + 2H2О → 2 Н2(↑) + Mg(ОН)2
Гидрид магния без запаха
Гидрид магния обладает высокой реакционной способностью и вызывает коррозию и может вызвать раздражение и коррозию при вдыхании, поэтому настоятельно не рекомендуется вдыхать гидрид магния.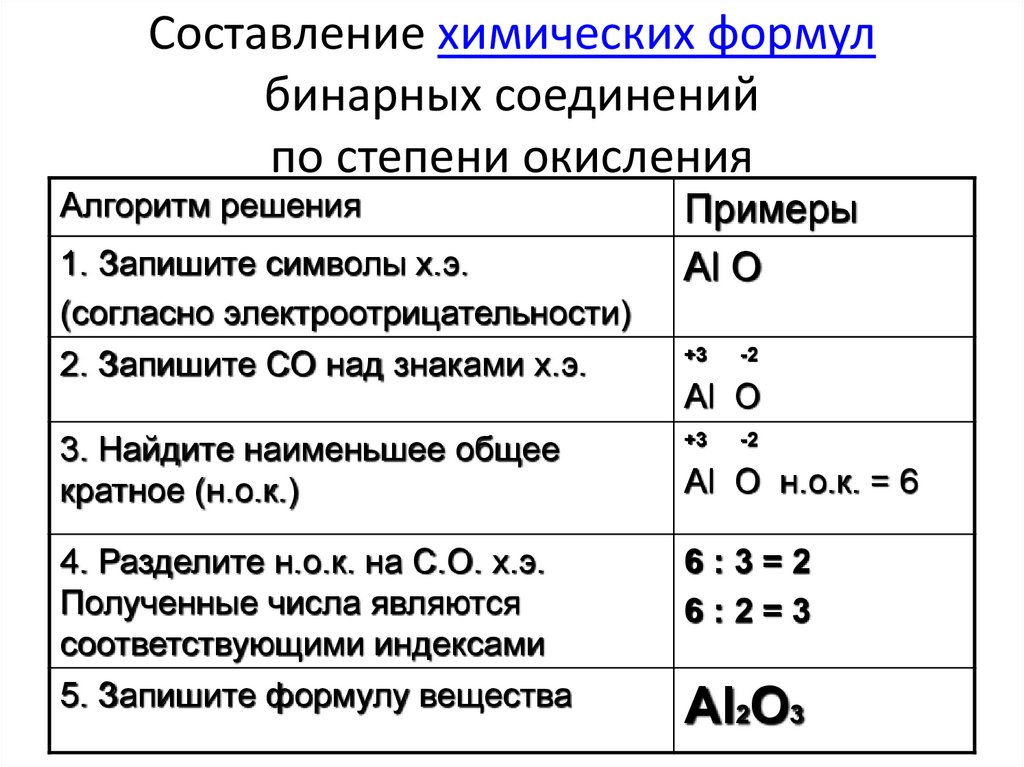
Является ли гидрид магния парамагнитным?
Атомы/молекулы с неспаренным электроном на атомной или молекулярной орбитали являются парамагнитными. Давайте узнаем, если MgH2 является парамагнетиком.
Гидрид магния не является парамагнитным, потому что все электроны гидрида магния спарены как в Mg2+ и Н– ионов.
Гидрид магния гидраты
мгH2 не образует гидратов, так как быстро реагирует с водой.
мгH2 + 2H2О → 2 Н2(↑) + Mg(ОН)2 +2HCl→MgCl2+ 2H2O
Кристаллическая структура гидрида магния
мгH2 имеет структуру рутила при комнатной температуре и давлении, и эта форма известна как α-Mgh3. При высоком давлении были охарактеризованы четыре различные формы Mgh3.
- γ-Mgh3 имеет орторомбическую структуру и принадлежит пространственной группе Pbcn.

- β-Mgh3 имеет кубическую структуру, принадлежащую пространственной группе Pa-3.
- Орторомбическая форма с пространственной группой Pbc2 также была обнаружена при высоком давлении.
- Другая орторомбическая форма с пространственной группой Pnma также была обнаружена при высоком давлении.
Полярность и проводимость гидрида магния
- Гидрид магния является полярным соединением, поскольку он включает перенос электронов от Mg к атомам H.
- Гидрид магния не проводит электричество так как у него нет свободных электронов.
Реакция гидрида магния с кислотой
мгH2 не вступает в прямую реакцию с кислотами. При контакте с водой он быстро образует Mg(OH)2 (гидроксид магния), который затем реагирует с любыми кислотами.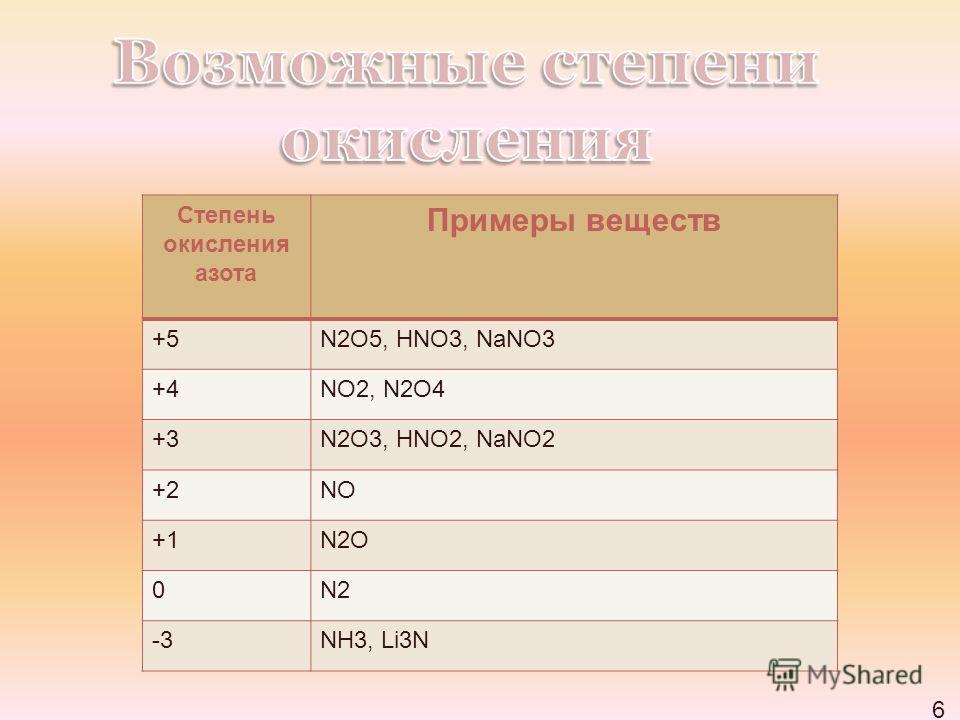
мгH2 + 2H2О → 2 Н2(↑) + Mg(ОН)2 +2HCl→MgCl2+ 2H2O
Реакция гидрида магния с основанием
мгH2 не реагирует с основаниями, потому что они щелочные по своей природе.
Реакция гидрида магния с оксидом
мгH2 реагирует с некоторыми оксидами, восстанавливая их; Это восстановление ускоряется при использовании подходящего катализатора на основе переходного металла, такого как кобальт.
2MgH2 + CO2 -> 2 MgO + CH4
Заключение
Мы узнали о гидриде магния, высокореактивном соединении, особенно полезном в качестве портативной водородной среды для топливных элементов и восстановителей. Они не реагируют с кислотами. Образование гидратов невозможно с водой, так как она быстро вступает в реакцию.
гидриды и их типы, реакции NaH, Cah3, NaHS
Химия
12. 11.21
11.21
10 мин.
h3 — это элемент IА-группы, порядковый № 1. Заряд атомного ядра +1, потому что в ядре 1 протон. Вокруг ядра вращается всего 1 электрон. До завершения уровня атому не хватает 1 электрона. Завершать энергетический уровень атом водорода может различными способами: образовывать летучие водородные соединения и гидриды.
Оглавление:
- Способы завершения энергетического уровня
- Типы гидридов
- Особенности водородных соединений
h3 — это элемент IА-группы, порядковый № 1. Заряд атомного ядра +1, потому что в ядре 1 протон. Вокруг ядра вращается всего 1 электрон. До завершения уровня атому не хватает 1 электрона. Завершать энергетический уровень атом водорода может различными способами:
Способы завершения энергетического уровня
Водород — один из немногих химических элементов, который может иметь как положительную, так и отрицательную степень окисления в соединениях. Как, например, бром ( NaBr -1, Br +1 2O ) и хлор ( NaCl -1, HClO3+5):
Как, например, бром ( NaBr -1, Br +1 2O ) и хлор ( NaCl -1, HClO3+5):
- Может принимать на внешний уровень один недостающий электрон – атом водорода превращается в ион, заряженный отрицательно. Такая реакция происходит при взаимодействии с металлами, которые в соединениях проявляют только положительную степень окисления. Степень окисления водорода будет равна -1, так как заряд отрицательный. Металлы с h3 создают соединения, которые называются гидридами. Способствует их образованию h3 с самыми активными металлами: щелочными и щелочноземельными. Например: NaH (гидрид натрия), Cah3 (гидрид кальция), LiH (гидрид лития), CuH (гидрид меди).
- Может отдавать один электрон со своего внешнего энергетического уровня — остается только ядро атома водорода, состоящее из протона. Таким образом, h3 образует химические соединения с неметаллами, которые при этом будут проявлять только отрицательную степень окисления.
 В соединениях с водородом степень окисления неметалла будет низшая. В этом случае водород становится частицей с положительным зарядом иона или степенью окисления +1. Соединения h3 с неметаллами называют летучие водородные соединения. Например: HCl (соляная кислота/хлороводород), Nh4 (водородное соединение азота — аммиак), Nh5OH (нашатырный спирт), NaHS (гидросульфид натрия).
В соединениях с водородом степень окисления неметалла будет низшая. В этом случае водород становится частицей с положительным зарядом иона или степенью окисления +1. Соединения h3 с неметаллами называют летучие водородные соединения. Например: HCl (соляная кислота/хлороводород), Nh4 (водородное соединение азота — аммиак), Nh5OH (нашатырный спирт), NaHS (гидросульфид натрия).
Помимо способов завершения энергетического уровня, существует классификация гидридов, в соответствии с их характером связи. Они подразделяются на 3 большие группы.
Типы гидридов
Стоит рассмотреть основные группы, поскольку побочные группы (полимерные, интерметаллические и комплексные) являются подвидами основных, а также имеют схожие с ними физические и химические свойства.
Ионные гидриды
Ионные (солеобразные) — соединения h3 с металлами IA и IIA (кроме магния), а также с алюминием. Их главное отличие от двух других видов в том, что они активно реагируют с h3O с образованием щёлочи и выделением h3 в виде газа. Самым ярким представителем ионных гидридов является гидрид натрия.
Их главное отличие от двух других видов в том, что они активно реагируют с h3O с образованием щёлочи и выделением h3 в виде газа. Самым ярким представителем ионных гидридов является гидрид натрия.
Физические свойства: белые твёрдые вещества с кристаллической решёткой, содержащей катион (плюс) металла и гидрид-анион (минус) Н–. Проводят электрический ток. Устойчивы при нормальных условиях (н.у.).
Как и любое вещество (химический элемент, простое вещество или химическое соединение), ионные гидриды обладают свойствами. Они проявляются в процессе реакции и влияют на неё. Химические свойства:
- Разлагаются при нагревании еще до достижения своей температуры плавления: Cah3 = Ca + h3↑.
- При растирании на воздухе воспламеняются: Cah3 + O2 = CaO + h3O.
- Реагирует с водой с образованием щелочи и выделением водорода: 2NaH + h3O = 2NaOH + h3↑.
- Являются сильными восстановителями (при t 700-800°С восстанавливают оксиды до металлов), но их использование в лаборатории осложнено, поскольку они с легкостью реагируют с кислородом и влагой воздуха.

Применение: для получения металлов из их оксидов, удаления окалины с поверхности металлических изделий, как ракетное топливо.
Получение: при взаимодействии металлов с водородом при t 200-600°С:
- h3 + 2Na = (300°C) 2NaH;
- h3 + Ca = (600°C) Cah3.
Ковалентные соединения
Ковалентные — гидриды, образованные неметаллами IV, V, VI и VII групп, а также бором. Например, гидрид углерода/метан Ch5, силан Sih5, гидрид серы/сероводород h3S.
Физические свойства: газообразные, легко воспламеняются на воздухе.
Ковалентные гидриды во многом отличаются от ионных и металлических. Если последние обладают химическими свойствами, схожими с металлами, то свойства ковалентных следует рассмотреть подробнее. Химические свойства:
- При высоких температурах разлагаются практически необратимо: h3S = (около 400°С) S + h3.

- Сильные восстановители.
- Высокая токсичность.
- B2H6 и Sih5 разлагаются водой с выделением водорода: B2H6 + 6h3O → 2h4BO3 + 6h3.
- Гидриды элементов V-VII групп не разлагаются водой.
Применение: для получения полупроводниковых пленочных покрытий, защитных покрытий на поверхности металлов.
Получение: термическое разложение, восстановление галогенидов.
Существуют многочисленные производные ковалентных гидридов, в которых часть атомов h3 замещена атомами галогенов или металлов.
Магний по своим свойствам и химической связи располагается между ионными и ковалентными гидридами. С водой и водными растворами Mgh3 реагирует с выделением h3, но не так энергично, как ионные гидриды.
Соединения железа с водородом крайней неустойчивы и в чистом виде не обнаружены. Формула неустойчивого гидрида железа выглядит так: C5H5Fe.
Металлические соединения
Металлические — соединения переходных металлов. Фактически они являются твёрдым раствором h3 в металле, атомы водорода помещаются в кристаллическую решётку металла. Их образованию всегда способствует адсорбция водорода на поверхности металла.
Фактически они являются твёрдым раствором h3 в металле, атомы водорода помещаются в кристаллическую решётку металла. Их образованию всегда способствует адсорбция водорода на поверхности металла.
Физические свойства: представляют собой кристаллические вещества с металлическим блеском. Обладают интенсивной окраской, проявляют металлические или полупроводниковые свойства. Устойчивы на воздухе. С кислородом и водой реагируют медленно. Магнитными, механическими, тепло- и электропроводными свойствами схожи с металлами.
Химическая связь очень прочная.
Применение: применяются в качестве источников водорода особой чистоты (который используется в топливных элементах), также для удаления водорода из газовых смесей.
Получение: реакция металла с водородом при обычной температуре или при нагревании: Ti + h3 = (150-200°С) Tih3.
При взаимодействии h3 с интерметаллическими соединениями, такими как TiFe, LaNi5, можно получить гидриды интерметаллидов TiFeh3, LaNi5H6, которые с высокой скоростью обратимо поглощают водород при атмосферном давлении.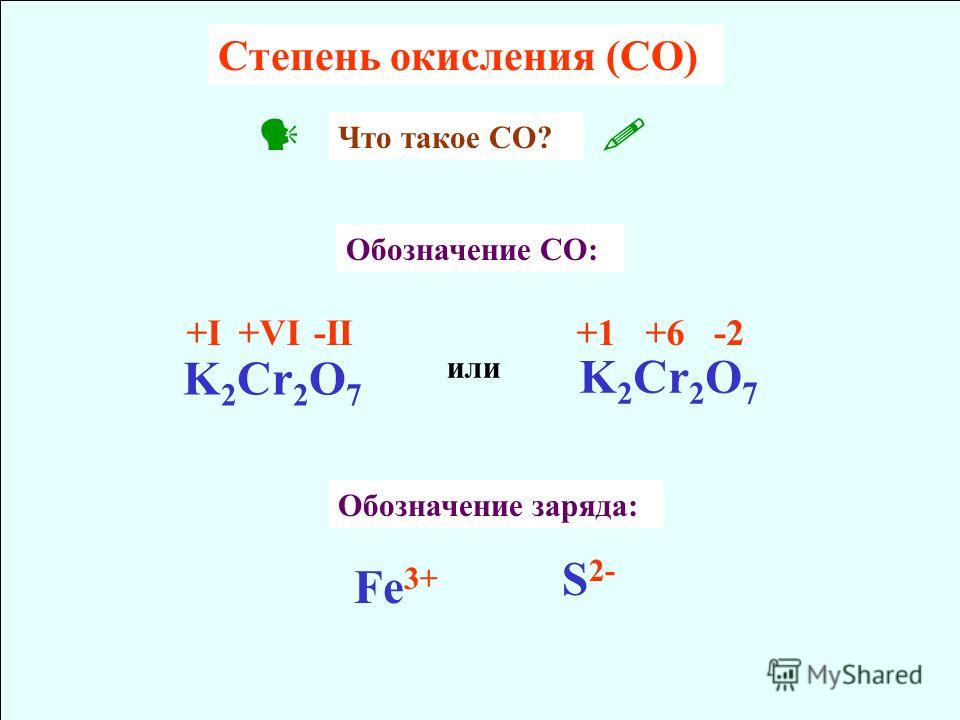
В прикрепленных таблицах указано содержание водорода, температура разложения, плотность и пр., что поможет в более глубоком понимании физических свойств водорода разных типов гидридов.
Особенности водородных соединений
Как и в любом разделе химии, водородные соединения имеют свои исключения. В их числе He, Ne, Ar, Kr, Pm, Os, Ir, Rn, Fr и Ra. Они не образуют бинарные соединения с водородом.
Информация, изложенная выше доказывает то, что химия интереснейший и увлекательный предмет, который стоит потраченного внимания и времени.
WebElements Periodic Table » Магний » дигидрид магния
- Формула: MgH 2
- Формула системы Хилла: H 2 Mg 1
- Регистрационный номер CAS: [7693-27-8]
- Вес формулы: 26.
 321
321 - Класс: гидрид
- Цвет: белый
- Внешний вид: кристаллическое твердое вещество
- Температура плавления: 327°C (дегидрогенизируется до Mg + H 2 )
- Температура кипения:
- Плотность: 1450 кг·м -3
Ниже приведены некоторые синонимы дигидрида магния :
- магния дигидрид
- гидрид магния(II)
- гидрид магния
Степень окисления магния в дигидриде магния составляет 2 .
Синтез
Гидрид магния получают в результате прямого взаимодействия металлического магния и газообразного водорода.
Mg(s) + H 2 (g) → MgH 2 (s)
Твердотельная структура
- Геометрия магния:
- Прототип конструкции:
Элементный анализ
В таблице показано процентное содержание элементов для MgH 2 (дигидрид магния).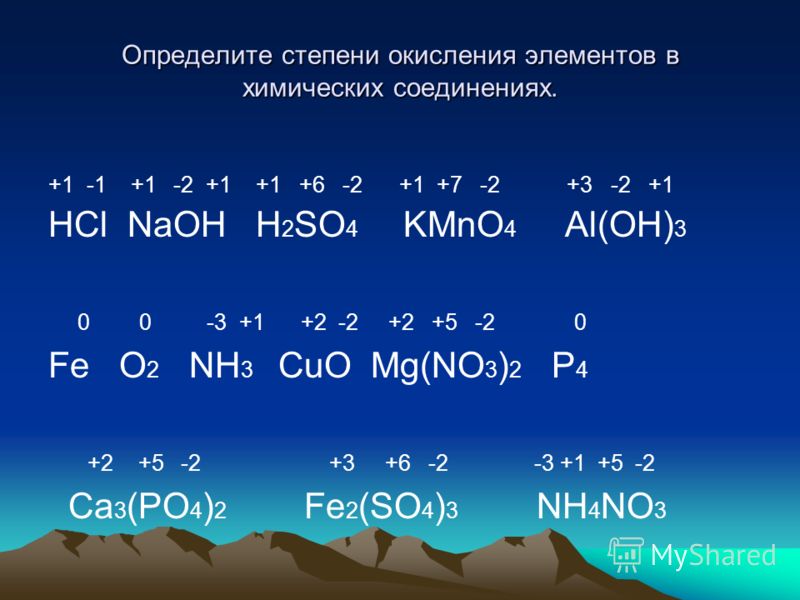
| Элемент | % |
|---|---|
| Н | 7,66 |
| мг | 92,34 |
Изотопная схема MgH
2На приведенной ниже диаграмме показана расчетная изотопная картина для формулы MgH 2 с наиболее интенсивным ионом, установленным на 100%.
Каталожные номера
Данные на страницах этих соединений собраны и адаптированы из основной литературы и нескольких других источников, включая следующие.
- Р.Т. Сандерсон в Chemical Periodicity , Райнхольд, Нью-Йорк, США, 1960 г.
- Н.Н. Гринвуд и А. Эрншоу в Chemistry of the Elements , 2-е издание, Butterworth, UK, 1997.
- Ф.А. Коттон, Г. Уилкинсон, К.А. Мурильо и М. Бохманн, в Advanced Inorganic Chemistry , John Wiley & Sons, 1999.
- А. Ф. Тротман-Дикенсон, (редактор) в Комплексная неорганическая химия , Пергамон, Оксфорд, Великобритания, 1973.

- Р.В.Г. Вайкофф, в Crystal Structures , том 1, Interscience, John Wiley & Sons, 1963.
- A.R.West в Базовая химия твердого тела Химия , John Wiley & Sons, 1999.
- А. Ф. Уэллс в Структурная неорганическая химия , 4-е издание, Оксфорд, Великобритания, 1975.
- Дж.Д.Х. Донней, (ред.) в Определяющие таблицы данных о кристаллах , монография ACA № 5, Американская кристаллографическая ассоциация, США, 1963.
- Д.Р. Лиде, (ред.) в справочнике по химии и физике Chemical Rubber Company , CRC Press, Бока-Ратон, Флорида, США, 77-е издание, 1996 г.
- Дж.В. Меллор в Всесторонний трактат по неорганической и теоретической химии , тома 1–16, Longmans, Лондон, Великобритания, 1922–1937.
- Дж. Э. Макинтайр (редактор) в Словаре неорганических соединений , тома 1–3, Chapman & Hall, Лондон, Великобритания, 1992.
Исследуйте периодические свойства по этим ссылкам
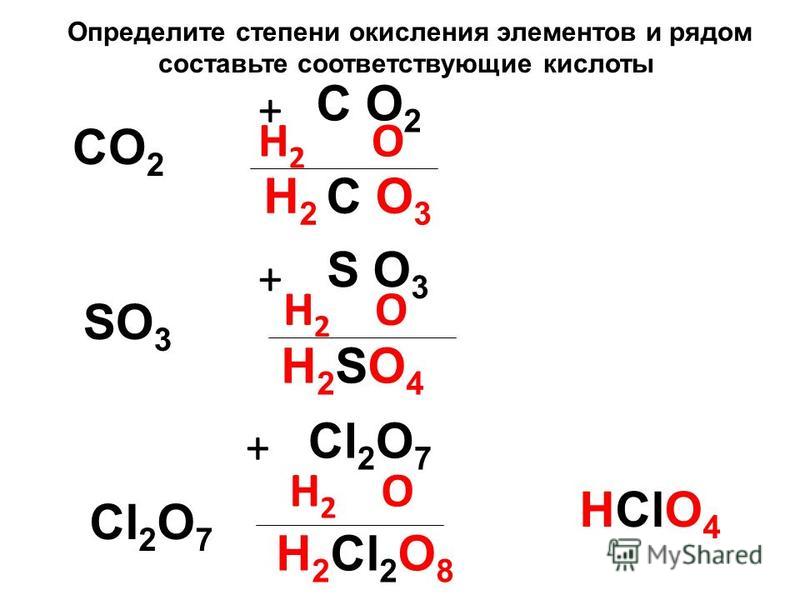
Окислительно-восстановительные реакции
Окислительно-восстановительные реакцииОкислительно-восстановительное (окислительно-восстановительные реакции)
Задача A Зная формулу нейтральной или заряженной молекулы, определите степень окисления для каждого атома в молекуле.
Число окисления: заряд, присвоенный атому в соответствии с набором правил. Его цель — помочь вам отслеживать движение электронов от одного атома или молекулы к другому.
Они не обязательно представляют собой истинный заряд.Правила:
1. Степень окисления атома любого свободного элемента равна НОЛЬ.
Элемент | Число окисления каждого атома |
металлический натрий, Na | 0 |
газообразный гелий He | 0 |
Си | 0 |
Степень окисления любого атома в молекуле одного элемента также равна НОЛЬ.
Элемент | Число окисления каждого атома |
хлор, Cl 2 | 0 |
сера, S 8 | 0 |
Фосфор, Р 5 | 0 |
2. Степень окисления водорода в Н-содержащем соединении
+1.
Соединение | Степень окисления каждого атома Н | Итого вклад от H |
Н 2О | +1 | +2 |
HNO 3 | +1 | +1 |
Н 2 О 2 | +1 | +2 |
Исключение: в гидридах металлов степень окисления водорода составляет
-1.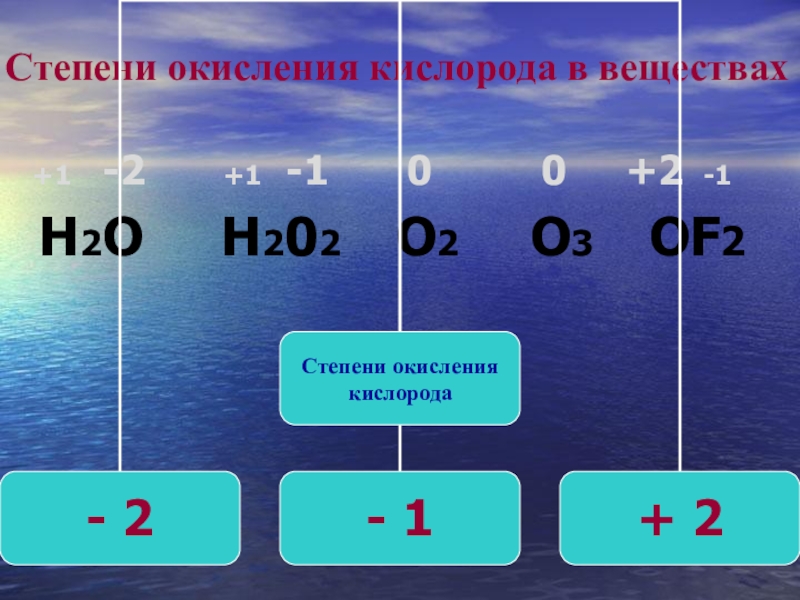
гидрид металла имеет водородную связь с металлом.
Соединение | Число окисления каждого атома Н | Общий вклад H |
CaH 2 | -1 | -2 |
NaH | -1 | -1 |
АлХ 3 | -1 | -3 |
Неплохая смесь того, что мы уже видели:
Соединение | Число окисления каждого атома Н | Общий вклад H |
Х 2С | +1 | +2 |
МгН 2 | -1 | -2 |
Н 2 | 0 | 0 |
3. Степень окисления кислорода
Степень окисления кислорода
Соединение | Степень окисления каждого атома О | Общий вклад O |
Н 2О | -2 | -2 |
№ 2 | -2 | -4 |
№ 3 -1 | -2 | -6 |
Исключение: в пероксидах, содержащих один дополнительный кислород, каждому кислороду присваивается степень окисления -1.
нормальный оксид: H
2 Oперекись: H
2O2
4. Окисление одноатомного иона равно его заряду. Для членов металлических семейств можно обратиться к периодической таблице. Кроме того, галогениды (металл + галоген) будут -1.
Соединение | Число окисления каждого атома металла | Суммарный вклад ионов металлов |
На 2О | +1 = Na | +2 |
Ал 2 С 3 | +3 = Ал | +6 |
CaCl 2 | +2 = Са | +2 |
5. Сумма степеней окисления всех атомов в соединении равна НОЛЬ.
Сумма степеней окисления всех атомов в соединении равна НОЛЬ.
Сумма всех степеней окисления всех атомов в многоатомном ионе равна заряду многоатомного иона.
Пример: H
2 OКаждый водород = +1; кислород -2.
2
(1) + (-2) = 0.Пример: SO
4 -2Каждый O = -2; С неизвестно.
Х +
4(-2) = -2.X = 6. Значит, степень окисления серы равна 6.
Дополнительные примеры:
Используйте пять правил для присвоения степеней окисления каждому элементу в следующем:
- НЕТ 2 -1
Каждый O = -2
х +2(-2) = -1
X = 3. Таким образом, степень окисления N равна +3.
б. КМнО
4К = +1
О = -2
Мн = х
1 + х +
4(-2) =0x = 7 = степень окисления Mn
с. MnO
2х +
2(-2) = 0x = 4. Обратите внимание, как степень окисления Mn может варьироваться от одного соединения к другому.
- С
3
х + 8( + 1) = 0x = -8/3 ( Да. Числа окисления могут быть дробными!)
Упражнения:
1. Используйте пять правил, чтобы присвоить степени окисления каждому элементу в следующем:
а.


 В соединениях с водородом степень окисления неметалла будет низшая. В этом случае водород становится частицей с положительным зарядом иона или степенью окисления +1. Соединения h3 с неметаллами называют летучие водородные соединения. Например: HCl (соляная кислота/хлороводород), Nh4 (водородное соединение азота — аммиак), Nh5OH (нашатырный спирт), NaHS (гидросульфид натрия).
В соединениях с водородом степень окисления неметалла будет низшая. В этом случае водород становится частицей с положительным зарядом иона или степенью окисления +1. Соединения h3 с неметаллами называют летучие водородные соединения. Например: HCl (соляная кислота/хлороводород), Nh4 (водородное соединение азота — аммиак), Nh5OH (нашатырный спирт), NaHS (гидросульфид натрия).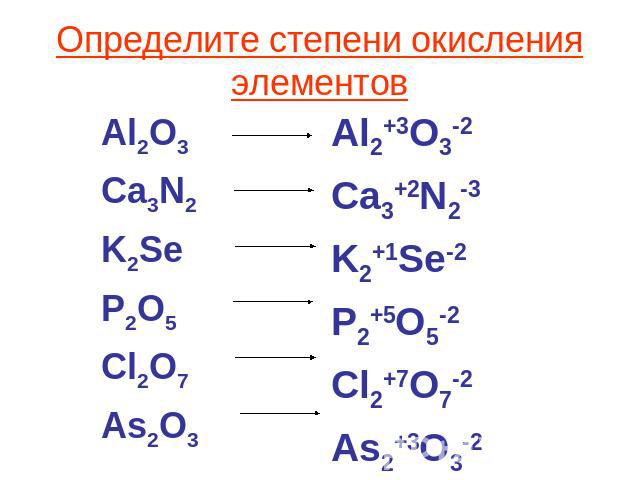

 321
321