2.2. Моль, молярная масса
2.2. Моль, молярная масса2.2. Моль, молярная масса
В химических процессах участвуют мельчайшие частицы – молекулы, атомы, ионы, электроны. Число таких частиц даже в малой порции вещества очень велико. Поэтому, чтобы избежать математических операций с большими числами, для характеристики количества вещества, участвующего в химической реакции, используется специальная единица – моль.
Моль — это такое количество вещества, в котором содержится определенное число частиц (молекул, атомов, ионов), равное постоянной Авогадро
Постоянная Авогадро NA определяется как число атомов, содержащееся в 12 г изотопа 12С:
Таким образом, 1 моль вещества содержит 6,02 • 1023 частиц этого вещества.
Исходя из этого, любое количество вещества можно выразить определенным числом молей ν
 Например, в образце вещества
содержится 12,04 • 1023 молекул. Следовательно,
количество вещества в этом образце составляет:
Например, в образце вещества
содержится 12,04 • 1023 молекул. Следовательно,
количество вещества в этом образце составляет:В общем виде:
где N – число частиц данного вещества;NA – число частиц, которое содержит 1 моль вещества (постоянная Авогадро).
Молярная масса вещества (M) – масса, которую имеет 1 моль данного вещества.
Эта величина, равная отношению массы m вещества к количеству вещества ν, имеет размерность кг/моль или г/моль. Молярная масса, выраженная в г/моль, численно равна относительной относительной молекулярной массе Mr (для веществ атомного строения – относительной атомной массе Ar).
Например, молярная масса метана CH4 определяется следующим образом:

Молярную массу вещества можно вычислить, если известны его масса m и количество (число молей) ν, по формуле:
Необходимо отметить, что значение молярной массы вещества определяется его качественным и количественным составом, т.е. зависит от Mr и Ar. Поэтому разные вещества при одинаковом количестве молей имеют различные массы m.
Пример
Вычислить массы метана CH4 и этана С2H6,
взятых в количестве ν = 2 моль каждого.
Молярная масса метана M(CH4) равна 16 г/моль;
молярная масса этана M(С2Н6) = 2 • 12+6=30 г/моль.
Отсюда: m(CH4) = 2 моль • 16 г/моль = 32 г;
m(С2Н6) = 2 моль • 30 г/моль = 60 г.

Таким образом, моль – это порция вещества, содержащая одно и то же число частиц, но имеющая разную массу для разных веществ, т.к. частицы вещества (атомы и молекулы) не одинаковы по массе.
n(CH4) = n(С2Н6), но m(CH4) (С2Н6)
Вычисление ν используется практически в каждой расчетной задаче.
Формула молекулярной массы элемента в химии
Онлайн калькуляторы
На нашем сайте собрано более 100 бесплатных онлайн калькуляторов по математике, геометрии и физике.
Справочник
Основные формулы, таблицы и теоремы для учащихся. Все что нужно, чтобы сделать домашнее задание!
Заказать решение
Не можете решить контрольную?!
Мы поможем! Более 20 000 авторов выполнят вашу работу от 100 руб!
Определение и формула молекулярной массы
Массы атомов и молекул очень малы, поэтому в качестве единицы измерения удобно выбрать массу одного из атомов и выражать массы остальных атомов относительно нее. Именно так и поступал основоположник атомной теории Дальтон, который составил таблицу атомных масс, приняв массу атома водорода за единицу.
Именно так и поступал основоположник атомной теории Дальтон, который составил таблицу атомных масс, приняв массу атома водорода за единицу.
До 1961 года в физике за атомную единицу массы (а.е.м. сокращенно) принимали 1/16 массы атома кислорода 16О, а в химии – 1/16 средней атомной массы природного кислорода, который является смесью трех изотопов. Химическая единица массы была на 0,03% больше, чем физическая.
В настоящее время за в физике и химии принята единая система измерения. В качестве стандартной единицы атомной массы выбрана 1/12 часть массы атома углерода 12С.
1 а.е.м. = 1/12 m(12С) = 1,66057×10-27 кг = 1,66057×10-24 г.
Относительная атомная и молекулярная масса элемента
При расчете относительной атомной массы учитывается распространенность изотопов элементов в земной коре. Например, хлор имеет два изотопа 35Сl (75,5%) и 37Сl (24,5%).Относительная атомная масса хлора равна:
Ar(Cl) = (0,755×m(35Сl) + 0,245×m(37Сl)) / (1/12×m(12С) = 35,5.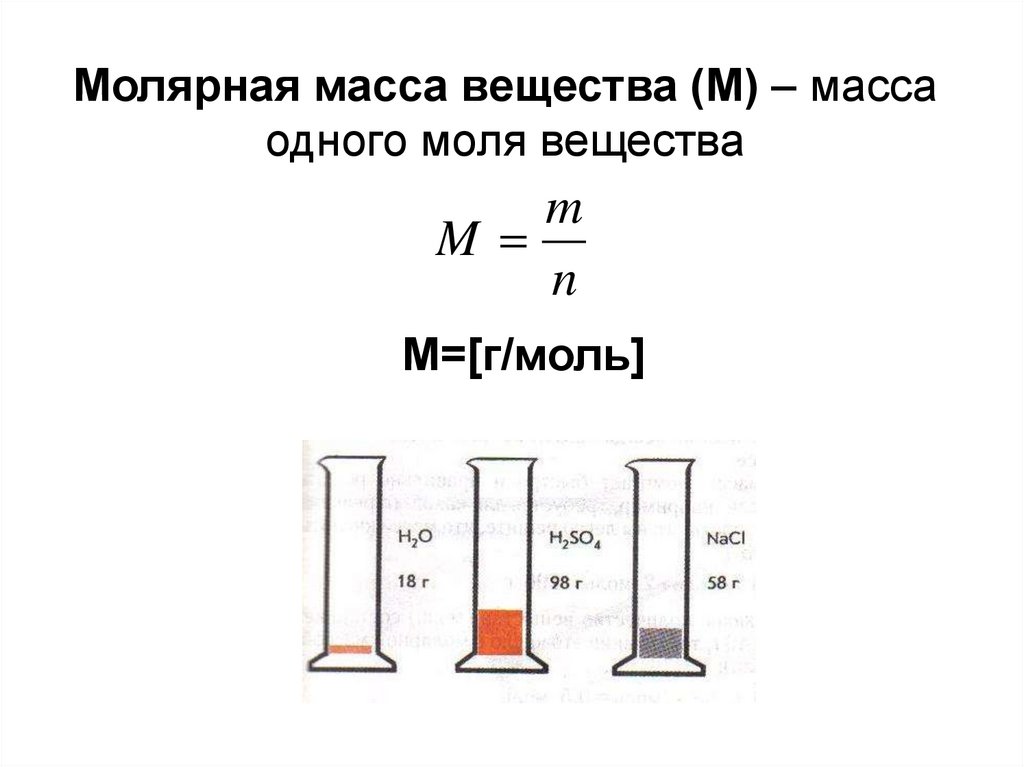
Из определения относительной атомной массы следует, что средняя абсолютная масса атома равна относительной атомной массе, умноженной на а.е.м.:
m(Cl) = 35,5 ×1,66057×10-24 = 5,89×10-23 г.
Относительная молекулярная масса молекулы равна сумме относительных атомных масс атомов, входящих в состав молекулы, например:
Mr(N2O) = 2×Ar(N) + Ar(O) = 2×14,0067 + 15,9994 = 44,0128.
Абсолютная масса молекулы равна относительной молекулярной массе, умноженной на а.е.м.
Число атомов и молекул в обычных образцах веществ очень велико, поэтому при характеристике количества вещества используют специальную единицу измерения – моль.
Моль – это количество вещества, которое содержит столько же частиц (молекул, атомов, ионов, электронов), сколько атомов углерода содержится в 12 г изотопа 12С.
Масса одного атома 12С равна 12 а. е.м., поэтому число атомов в 12 г изотопа 12С равно:
е.м., поэтому число атомов в 12 г изотопа 12С равно:
NA = 12 г / 12 × 1,66057×10-24 г = 1/1,66057×10-24 = 6,0221×10-23.
Таким образом, моль вещества содержит 6,0221×10-23 частиц этого вещества.
Физическую величину NA называют постоянной Авогадро, она имеет размерность [NA] = моль-1. Число 6,0221×10-23 называют числом Авогадро.
Молярная масса вещества
Легко показать, что численные значения молярной массы М и относительной молекулярной массы Mr равны, однако первая величина имеет размерность [M] = г/моль, а вторая безразмерна:
M = NA × m (1 молекулы) = NA × Mr × 1 а.е.м. = (NA ×1 а.е.м.) × Mr = × Mr.
Это означает, что если масса некоторой молекулы равна, например, 44 а.е.м., то масса одного моля молекул равна 44 г.
Постоянная Авогадро является коэффициентом пропорциональности, обеспечивающим переход от молекулярных отношений к молярным.
Примеры решения задач
| Понравился сайт? Расскажи друзьям! | |||
Молярная масса
Коэффициенты преобразования молярной массы
Молярная масса для Элементы Масса в граммах одного моля вещества называется
молярная масса.
Каждый элемент имеет свою уникальную молярную массу. Например, молярная масса углерода
12,011 г/моль, молярная масса магния 24,3050 г/моль. Чтобы понять, почему эти
элементы имеют разные молярные массы, нужно помнить, что атомы
разные элементы содержат разное количество протонов, нейтронов и
электронов, поэтому они имеют разные массы. Атомные массы, данные
в периодической таблице на передней обложке этой книги представляют различные взвешенные
средние массы встречающихся в природе атомов каждого элемента. Например, атомная масса магния (24,3050) показывает нам, что среднее масса атомов магния примерно в два раза больше средней массы атомов углерода (12,011), поэтому масса 6,022 х 10 23 атомов магния (количество атомов в 1 моле магния) примерно в два раза больше массы 6,022 x 10 23 атомы углерода (количество атомов в 1 моле углерода). Таким образом, молярная масса магния составляет 24,3050 г/моль по сравнению с молекулярной массой углерода 12,011 г/моль.
| Молярная масса молекулярных соединений Первый шаг в определение молярной массы молекулярного соединения состоит в том, чтобы определить молекулярная масса соединения, которая представляет собой средневзвешенную массу встречающиеся в природе молекулы соединения. Это находится путем добавления атомные массы атомов в каждой молекуле.
Следовательно, молекулярная масса воды, H 2 O, равна сумме атомных масс двух атомов водорода и одного атома кислорода, которые можно найти в периодической таблице.
Обратите внимание, что атомная масса
каждого элемента умножается на число атомов этого элемента в
молекула соединения. Количество граммы в молярной массе (граммы на моль) молекулярного соединения одинаковы как его молекулярная масса.
Молярная масса Ионные соединения Первый шаг в определение молярной массы ионного соединения заключается в том, чтобы определить его формула массы, которая является средневзвешенное значение массы природной формулы единиц вещества. (Это аналогично атомной массе элемента и молекулярная масса молекулярного вещества.)
Формула массы натрия хлорид равен сумме атомных масс натрия и хлора, которые можно найти в периодической таблице.
Количество граммов в
молярная масса (граммы на моль) любого ионного соединения совпадает с его формулой
масса. |
Как рассчитать молярную массу
Обновлено 30 марта 2020 г.
Автор Riti Gupta
Отзыв: Lana Bandoim, B.S.
Когда вы находитесь в лаборатории, вам приходится работать с множеством различных растворов. Чтобы сделать раствор с правильной концентрацией, вам нужно знать, сколько данного соединения вы добавляете.
Допустим, вам нужно приготовить раствор 1M NaCl для реакции, которую вы проводите. Как узнать, сколько соли нужно взвесить и добавить к данному объему воды?
Для этого вам нужно найти способ соотнести массу соединения (соли) с количеством молей этого соединения. Молярная масса элементов говорит вам о молярной массе соединения, так что вы можете это понять.
Определение молярной массы
Определение молярной массы – это количество граммов вещества, которое содержится в одном моле вещества. Таким образом, единицами измерения являются граммы на моль или г/моль.
Таким образом, единицами измерения являются граммы на моль или г/моль.
Что такое моль вещества? Моль вещества – это определенное количество этого вещества.
Моль — это число: 6,022 x 10 23 . Поскольку частицы соединения настолько малы, вы не можете говорить о них по отдельности, иначе это станет очень громоздким. По этой причине ученые используют моль. Она описывает огромное количество молекул. Граммы на моль, таким образом, описывают массу элемента, когда имеется один моль частиц этого вещества.
Теперь, когда вы знаете, что такое моль и к чему относится молярная масса, где взять это число? Вы можете найти его для каждого элемента периодической таблицы. Если вы посмотрите под символом каждого элемента, вы найдете номер. Молярная масса элементов определяется этим числом, молярная масса , которая также является молекулярной массой .
Молярная масса Примеры
Число под кислородом равно 15,999 (взгляните на периодическую таблицу в Интернете или в своих учебниках). Молярная масса кислорода 15,999 г/моль.
Молярная масса кислорода 15,999 г/моль.
Как насчет молярной массы соединения, а не только элемента?
Чтобы найти молярную массу соединения, вам нужно сложить молярные массы всех элементов в этом соединении.
Взгляните на NaOH, который содержит натрий, кислород и водород. Молярная масса натрия 22,9.9 г/моль, кислорода 15,999 г/моль, водорода 1,008 г/моль.
Сложение их вместе дает:
Таким образом, молярная масса NaOH составляет 30,997 г/моль.
Что делать, если у вас есть соединение, в котором есть элемент с нижним индексом? Например, MgCl 2 ?
В этом случае вам нужно добавить молярную массу магния и удвоенную молярную массу хлора:
Таким образом, молярная масса MgCl2 составляет 95,211 г/моль.
Используя молярную массу
Теперь вы можете ответить на вопрос в начале статьи. Допустим, вам нужно приготовить 1 л 1М раствора NaCl. Как узнать, сколько соли нужно взвешивать?
Сначала вам нужно найти количество молей, необходимое для этого раствора.




