Молярный объем – таблица, формулы (химия, 8 класс)
4.2
Средняя оценка: 4.2
Всего получено оценок: 230.
4.2
Средняя оценка: 4.2
Всего получено оценок: 230.
При изучении химических веществ важными понятиями являются такие величины, как молярная масса, плотность вещества, молярный объем. Так, что же такое молярный объем, и в чем его отличие для веществ в разном агрегатном состоянии?
Молярный объем: общая информация
Чтобы вычислить молярный объем химического вещества необходимо молярную массу этого вещества разделить на его плотность. Таким образом, молярный объем вычисляется по формуле:
Vm=M/p,
где Vm – молярный объем вещества, М – молярная масса, p – плотность. В Международной системе СИ эта величина измеряется в кубический метр на моль (м 3 /моль).
Рис. 1. Молярный объем формула.Молярный объем газообразных веществ отличается от веществ, находящихся в жидком и твердом состоянии тем, что газообразный элемент количеством 1 моль всегда занимает одинаковый объем (если соблюдены одинаковые параметры).
Объем газа зависит от температуры и давления, поэтому при расчетах следует брать объем газа при нормальных условиях. Нормальными условиями считается температура 0 градусов и давление 101,325 кПа.
Молярный объем 1 моля газа при нормальных условиях всегда одинаков и равен 22,41 дм 3 /моль. Этот объем называется молярным объемом идеального газа. То есть, в 1 моле любого газа (кислород, водород, воздух) объем равен 22,41 дм 3 /м.
Молярный объем при нормальных условиях можно вывести, используя уравнение состояния для идеального газа, которое называется уравнением Клайперона-Менделеева:
P*V=n*R*T,
где R – универсальная газовая постоянная, R=8.314 Дж/моль*К=0,0821 л*атм/моль К
Объем одного моля газа V=RT/P=8.314*273.15/101.325=22.413 л/моль, где Т и Р – значение температуры (К) и давления при нормальных условиях.
Рис. 2. Таблица молярных объемов.Закон Авогадро
В 1811 году А. Авогадро выдвинул гипотезу, что в равных объемах различных газов при одинаковых условиях (температуре и давлении) содержится одинаковой число молекул. Позже гипотеза подтвердилась и стала законом, носящим имя великого итальянского ученого. Рис. 3. Амедео Авогадро.
Позже гипотеза подтвердилась и стала законом, носящим имя великого итальянского ученого. Рис. 3. Амедео Авогадро.Закон становится понятен, если вспомнить, что в газообразном виде расстояние между частицами несопоставимо больше, чем размеры самих частиц.
Таким образом, из закона Авогадро можно сделать следующие выводы:
- В равных объёмах любых газов, взятых при одной и той же температуре и при одном и том же давлении, содержится одно и то же число молекул.
- 1 моль совершенно различных газов при одинаковых условиях занимает одинаковый объем.
- Один моль любого газа при нормальных условиях занимает объем 22,41 л.
Следствие из закона Авогадро и понятие молярного объема основаны на том, что моль любого вещества содержит одинаковое число частиц (для газов – молекул), равное постоянной Авогадро.
Чтобы узнать число молей растворенного вещества содержится в одном литре раствора, необходимо определить молярную концентрацию вещества по формуле c=n/V, где n – количество растворенного вещества, выражаемое в молях, V – объем раствора, выражаемый в литрах С – молярность.
Что мы узнали?
В школьной программе по химии 8 класса изучается тема «Молярный объем». В одном моле газа всегда содержится одинаковый объем, равный 22,41 кубический метр/моль. Этот объем называется молярным объемом газа.
Тест по теме
Доска почёта
Чтобы попасть сюда — пройдите тест.
Александр Котков
10/10
Артак Саркисян
10/10
Оценка доклада
4.2
Средняя оценка: 4.2Всего получено оценок: 230.
А какая ваша оценка?
что стоит знать о массе воздуха
Что такое молярная масса?
Молярная масса вещества — это отношение его массы к количеству молей. Для воздуха тоже действует это отношение. Поэтому при проведении вычислений в результате получается масса одного моля. Но не все вещества можно рассчитать подобным образом. Для того, чтобы узнать, чему равна молярная масса воздуха в физике используют специальные формулы. Выражается результат в граммах на моль.
Выражается результат в граммах на моль.
Воздух является смесью различных газов. Из этого следует, что молярная масса воздуха включает в себя молярные массы газов, входящих в его состав. Именно поэтому результаты таких вычислений будут различаться в зависимости от состава воздуха и количества различных газов и примесей в его составе. Существует и усредненный показатель, и средняя молярная масса воздуха равняется 29 г/моль.
Если же при расчетах было выявлено сильное отклонение от нормального показателя без объективных причин, то следует задуматься. Нарушение баланса газов – это очень серьезная проблема, которая очень часто встречается в больших городах. Именно там ежедневно в воздух выбрасывается огромное количество разнообразных веществ, которые меняют состав воздуха. Вредные примеси и их скопления очень плохо влияют на состояние организма человека. Также и увеличение или уменьшение содержания азота, кислорода, углекислого газа и других веществ влечет за собой тоже большие проблемы. Недостаток кислорода губителен для живых организмов и для человека может быть даже смертельно опасным.
Недостаток кислорода губителен для живых организмов и для человека может быть даже смертельно опасным.
Тщательное исследование воздуха может выявить отклонения от нормы и предотвратить их негативное влияние на организм человека. В нашей независимой лаборатории можно заказать комплексное обследование, которое представляет собой проведение исследований на различные показатели и выявление нарушений.
Как же определяется молярная масса воздуха?
Все вещества различаются по массе, и этот показатель является очень индивидуальным. Для сложных веществ учитывается число атомов, находящемся в нем. Так чему равна молярная масса воздуха? Это сумма всех массовых долей элементов, которые входят в данное вещество. В данном случае это молярные массы азота, кислорода, аргона, углекислого газа, водорода и других веществ. Из них азот составляет 78% от общего объема, кислород 21%, а остальные же вещества содержатся в гораздо меньшем количестве.
Существует несколько методов проведения измерения:
- Откачка воздуха из колбы позволяет при помощи уравнения состояния газа позволяет также вычислить этот показатель.
- При помощи классического химического уравнения, в котором находятся все молярные массы газов, входящих в состав воздуха.
- Также существуют уже готовые таблицы, со средними значениями.
Если производить расчеты, следуя определению, что объемы газов являются пропорциональными их количествам, то мы можем выражать среднюю массу как через объем, так и через количество. Поэтому молярная масса воздуха в химии рассчитывается по формуле, включающей в себя отношение массы вещества к его количеству. В сложных веществах надо найти отдельно массы каждого вещества, которое входит в состав.
Но этот способ расчетов по большей части затрагивает ситуации, когда воздух находится в своем обычном состоянии.
Формула, по которой рассчитывается молярная масса влажного воздуха является формулой для смеси газов. При расчетах учитываются доли сухого воздуха и водяного пара, а также соответствующее для них давление и молярные массы. Получается формула выглядит как сумма объема с молярной массой водяного пара и объема с молярной массой сухого воздуха.
Известно, что молярная масса воздуха при нормальных условиях — 29 г/моль. Именно такой показатель принят за средний. Но он может колебаться в зависимости от состава воздуха. Поэтому сильные изменения свидетельствуют о нарушениях баланса газов в воздухе. Так если в воздухе будет содержаться 92% азота, то это будет смертельно опасно для человека. Именно поэтому состав воздуха так важен и необходимо его постоянно контролировать. Сейчас, в результате деятельности человека, наблюдается неблагоприятная экологическая картина и во многом она связана с загрязнением воздуха.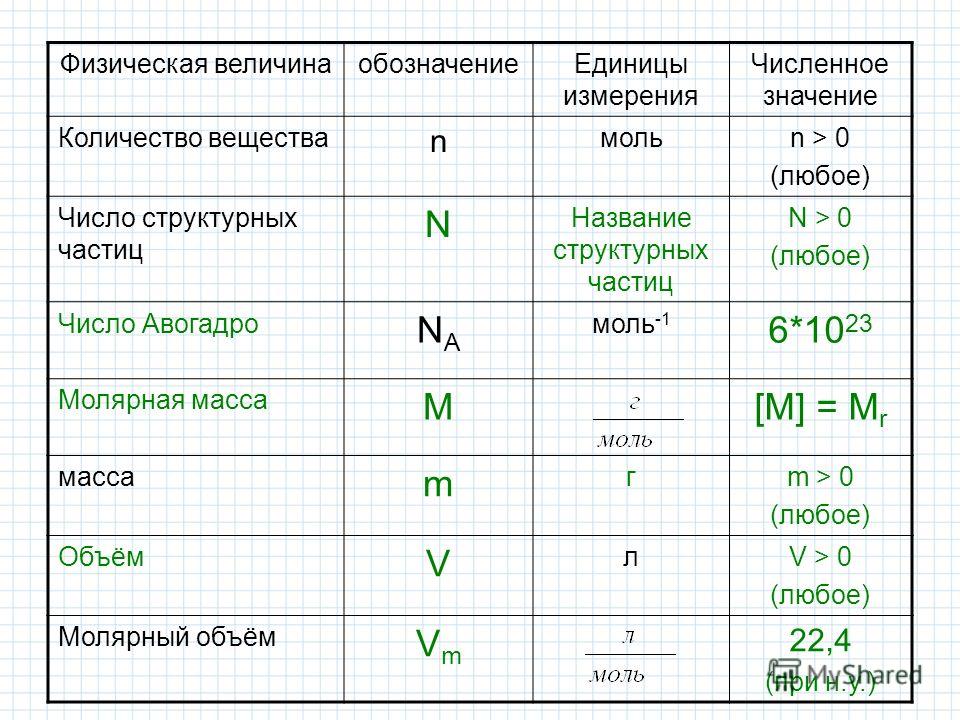
Закажите бесплатно консультацию эколога
Нажимая кнопку «Отправить», я даю свое согласие на обработку моих персональных данных, в соответствии с Федеральным законом от 27.07.2006 года №152-ФЗ «О персональных данных», на условиях и для целей, определенных в Согласии на обработку персональных данных
Сколько азота в воздухе?
Если говорить о воздухе, то нельзя не затронуть тему содержания в нем азота. Он представляет собой бесцветный газ, у которого нет запаха и вкуса. Если разбирать химическую формулу, то молекула азота представляет собой два атома азота, которые скрещены между собой. Именно он составляет большую часть и составляет около 78% от всего объема воздуха.
Но азот может быть и опасным, если превышать его концентрацию. Безопасный азот обычно смешан с водородом в необходимых пропорциях. Азот необходим для разбавления кислорода, ведь чистый кислород тоже может быть губительным для живых организмов. Но если азот будет повышен, то это приведет к гипоксии, то есть понижению уровня кислорода в организме и внутренних органах. Вдыхаемый человеком азот не усваивается в организме, а выдыхается, так как служит только для защиты легких от кислорода.
Человек ежедневно сталкивается с тем, что было создано не без помощи азота. Азот нашел свое применение в различных областях и сейчас мы можем видеть его как в упаковках на прилавках магазинов, так и в медицине. К примеру, жидкую форму азота уже давно используют для транспортировки донорских органов.
Азот нашел свое применение в различных областях и сейчас мы можем видеть его как в упаковках на прилавках магазинов, так и в медицине. К примеру, жидкую форму азота уже давно используют для транспортировки донорских органов.
Растения тоже не могут обойтись без азота и получают его из почвы в виде нитратов. В почве находится большое количество азота. Так потом он попадает в организмы животных, которые едят растения. Главным поставщиком азота являются бактерии, благодаря которым образовывается более ста тонн этого вещества.
Теплопроводность углекислого газа
Углекислым газом называют химическое соединение углерода и кислорода. В отличие от чистого углерода или кислорода, содержание углекислого газа в воздухе намного меньше. В нормальных условиях содержание будет равно 0,003% от общего объема воздуха. В молекулы газа входит один атом углерода и два атома кислорода. Для человека повышенный уровень углекислого газа может быть смертельно опасен, ведь он мешает поступлению кислорода в организм.
Углекислый газ также участвует в круговороте веществ и без него невозможны многие процессы. Так живые существа выделяют его в процессе дыхания, а растения, наоборот, при фотосинтезе поглощают этот газ. Он выделяется при горении углеродсодержащих предметов. Поэтому при пожарах нарушается естественный состав воздуха и увеличивается содержание в нем углекислого газа.
Теплопроводность представляет собой процесс равномерного перераспределения энергии. Эта способность является индивидуальной для каждых веществ, их состояний, а также зависит и от внешних факторов. Процесс непосредственно зависит от температуры и давления. Поэтому были разработаны таблицы, в которых показана зависимость этих показателей друг от друга.
В специальных таблицах уже рассчитаны показатели теплопроводности углекислого газа в различных его состояниях и условиях.
На основе этих таблиц можно сделать вывод, что теплопроводность углекислого газа уменьшается при повышении температуры и наоборот увеличивается если повысить давление.
Также состояние газа тоже влияет на эту зависимость. В газообразном состоянии он более теплопроводен как при увеличении давления, так и при повышении температуры, в отличие от конденсированного состояния.
На основе именно этого свойства газа работают приборы, которые измеряют содержание углекислого газа.
Зачем нужно проводить химический анализ воздуха?
Воздух является важным условием для жизни на земле. Все живые организмы зависят от воздуха и содержащегося в нем кислорода. Поэтому важно, чтобы в нем не содержалось вредных примесей и все показатели были в норме. Нарушение баланса может вызывать многие проблемы и в том числе, и со здоровьем.
Состав воздуха может изменяться не только в результате загрязнения различными предприятиями или автомобилями. Даже мебель или отделочные материалы в вашей квартиры на самом деле могут быть источниками выброса в воздух различных вредных веществ. Сейчас очень часто производители могут нарушать всевозможные нормы и изготовлять мебель из некачественных дешевых материалов. В процессе эксплуатации изделия начинают менять свои свойства и выделять иногда даже ядовитые вещества.
Даже мебель или отделочные материалы в вашей квартиры на самом деле могут быть источниками выброса в воздух различных вредных веществ. Сейчас очень часто производители могут нарушать всевозможные нормы и изготовлять мебель из некачественных дешевых материалов. В процессе эксплуатации изделия начинают менять свои свойства и выделять иногда даже ядовитые вещества.
Для того, чтобы обезопасить себя и своих близких вы можете обратиться в нашу лабораторию «ЭкоТестЭкспресс» и заказать химический анализ воздуха.
Химический анализ представляет собой комплекс различных исследований, который позволяет определить точный состав воздуха, количество содержащихся в нем веществ и примесей. Таким образом можно выявить как нарушения в балансе, так и вредные вещества, которые загрязняют воздух и вызывают различные заболевания.
Наши эксперты-экологи проведут все необходимые измерения и выдадут вам официальные результаты исследования. Также после получения результатов вы можете получить консультацию и понять, какие именно источники вызвали нарушение норм. Своевременное устранение проблемы может сберечь ваше здоровье и комфорт.
Своевременное устранение проблемы может сберечь ваше здоровье и комфорт.
Документы, которые выдает наша лаборатория, являются не только официальными, но и имеют юридическую силу. В случае выявления нарушений такие документы могут быть предъявлены в суд в качестве доказательства.
6.3: Закон Дальтона — Химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 3560
- Стивен Лоуэр
- Университет Саймона Фрейзера
Цели обучения
Убедитесь, что вы полностью поняли следующие основные идеи, представленные ниже.
- Один моль газа занимает объем 22,4 л при STP (стандартная температура и давление, 273K, 1 атм = 103 кПа.
 )
) - Приведенный выше факт позволяет нам связать измеримое свойство плотности газа с его молярной массой .
- Состав смеси газов обычно выражается в виде мольных долей ; убедитесь, что вы знаете, как их вычислить.
- Закон Дальтона о парциальных давлениях гласит, что каждый газ в смеси действует независимо, поэтому общее давление газа на стенки сосуда равно сумме парциальных давлений отдельных компонентов.
Хотя все газы точно следуют закону идеального газа PV = nRT при соответствующих условиях, каждый газ также является уникальным химическим веществом, состоящим из молекулярных единиц, имеющих определенные массы. В этом уроке мы увидим, как эти молекулярные массы влияют на свойства газов, соответствующих закону идеального газа. После этого мы рассмотрим газы, содержащие более одного типа молекул, другими словами, смеси газов. Мы начнем с обзора молярного объема и E. V.E.N. принцип, лежащий в основе нашего понимания газовых смесей.
V.E.N. принцип, лежащий в основе нашего понимания газовых смесей.
Молярный объем газа
Вы помните, что молярная масса чистого вещества равна массе 6,02 x 10 23 ( число Авогадро ) частиц или молекулярных единиц этого вещества. Молярные массы обычно выражаются в граммах на моль (г-моль –1 ) и часто обозначаются как молекулярная масса с. Как было объяснено в предыдущем уроке, равные объемы газов, измеренные при одинаковых температуре и давлении, содержат одинаковое количество молекул (это «четный» принцип , более формально известный как закон Авогадро .) Стандартная температура и давление: 273 К, 1 атм
Величина этого объема будет, конечно, зависеть от температуры и давления, поэтому для удобства сравнения принято определять набор условий Т = 273 К и Р = 1 атм как стандартная температура и давление , обычно обозначается как STP . Подставляя эти значения в уравнение состояния идеального газа и решая V , мы получаем объем 22,414 литра на 1 моль.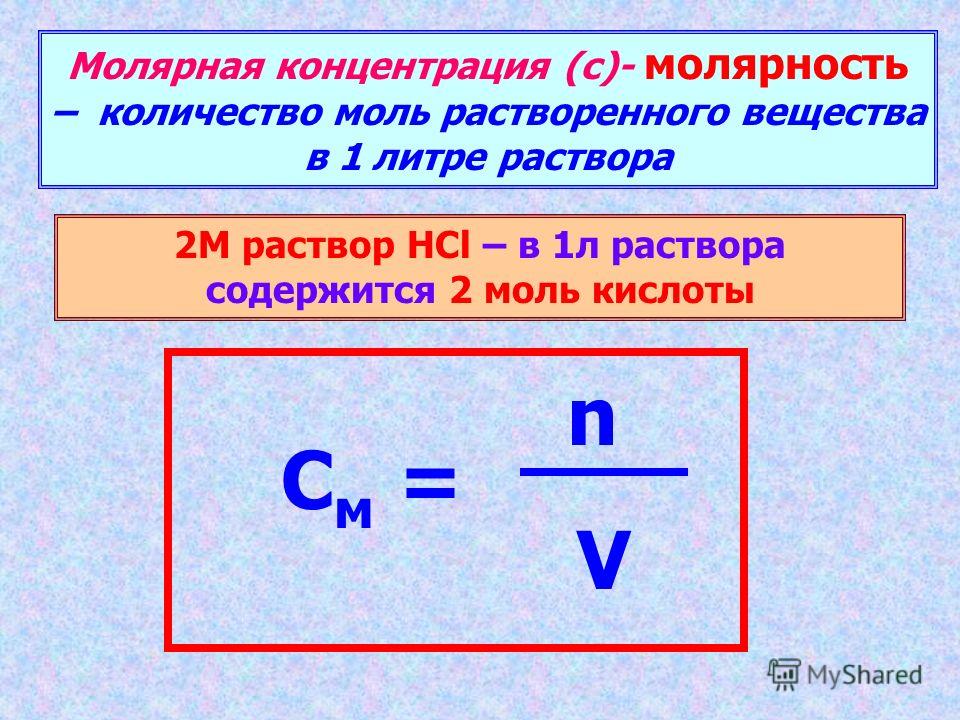
Пример \(\PageIndex{1}\)
Какой будет объем одного моля воздуха при 20°C на вершине Мауна-Кеа, Гавайи (высота 4,2 км), где атмосферное давление составляет примерно 60 кПа ?
Шлаки и шлаковые конусы на вершине Мауна-Кеа зимой. (Общественное достояние; Геологическая служба США)
Раствор
Применить законы Бойля и Шарля в качестве последовательных поправочных коэффициентов к стандартному давлению на уровне моря 101,3 кПа:
, но помните, что это действительно только при STP. Молярный объем при других температурах и давлениях легко найти простой пропорцией. Молярный объем вещества может кое-что сказать нам о том, сколько места занимает каждая молекула, как показывает следующий пример. 9{–7}\, см = 3,4\, нм \нечисло\]
В условиях, при которых применима модель идеального газа (то есть почти всегда, если вы не инженер-химик, имеющий дело с высокими давлениями), «молекула молекула», поэтому объем числа молекул Авогадро не будет зависеть от состава газа. Причина, конечно, в том, что объем газа в основном состоит из пустого пространства; объемы самих молекул пренебрежимо малы.
Причина, конечно, в том, что объем газа в основном состоит из пустого пространства; объемы самих молекул пренебрежимо малы.
Молярная масса и плотность газа
Молекулярная масса (молярная масса) любого газа – это выраженная в граммах масса числа Авогадро его молекул. Это верно независимо от того, состоит ли газ из одного вида молекул или представляет собой смесь. Для смеси газов молярная масса будет зависеть от молярных масс ее компонентов и от фракционного содержания каждого вида молекул в смеси. Термин «средняя молекулярная масса» часто используется для описания молекулярной массы газовой смеси.
Средняя молярная масса (\(\bar{m}\)) смеси газов равна сумме молярных долей каждого газа, умноженной на молярную массу этого вещества:
\[\bar{m}=\sum_i \chi_im_i\]
Пример \(\PageIndex{3}\)
Найдите среднюю молярную массу сухого воздуха, объемный состав которого O 2 (21% ), N 2 (78%) и Ar (1%).
Раствор
Средняя молекулярная масса представляет собой взвешенную по молярным долям сумму молекулярных масс ее компонентов. Мольные доли, конечно, такие же, как и объемные доли (принцип E.V.E.N.)
Мольные доли, конечно, такие же, как и объемные доли (принцип E.V.E.N.)
\[m = (0,21 х 32) + (0,78 х 28) + (0,01 х 20) = 28 \номер \]
Молярные объемы всех газов одинаковы при измерении при одинаковых температуре и давлении. Однако молярные масс различных газов будут различаться. Это означает, что разные газы будут иметь разную плотность (разную массу на единицу объема). Зная молекулярную массу газа, мы можем вычислить его плотность.
Пример \(\PageIndex{4}\)
Гексафторид урана UF 6 Газ используется при изотопном обогащении природного урана. Рассчитайте его плотность при СТП. 9{–1} \nonumber\]
Примечание: нет необходимости искать «формулу» для этого вычисления; просто объедините молярную массу и молярный объем таким образом, чтобы получить правильные единицы измерения.
Что еще более важно, если мы можем измерить плотность неизвестного газа, у нас есть удобный способ оценить его молекулярную массу. Это один из многих важных примеров того, как макроскопическое измерение (выполненное на сыпучем веществе) может дать микроскопическую информацию (то есть об объектах молекулярного масштаба) 9.0034
Это один из многих важных примеров того, как макроскопическое измерение (выполненное на сыпучем веществе) может дать микроскопическую информацию (то есть об объектах молекулярного масштаба) 9.0034
Плотность газа в настоящее время измеряется в промышленности с помощью электромеханических устройств, таких как вибрационные берды, которые могут обеспечивать непрерывную запись в реальном времени в определенных местах, например, внутри трубопроводов. Определение молекулярной массы газа по его плотности известно как метод Дюма , по имени французского химика Жана Дюма (1800-1840), который разработал его. Можно просто измерить вес известного объема газа и преобразовать этот объем в его STP-эквивалент, используя законы Бойля и Чарльза. Вес газа, деленный на его объем STP, дает плотность газа, а плотность умножается на 22,4 моль –1 дает молекулярную массу. Обратите особое внимание на примеры расчета плотности газа, показанные здесь и в вашем учебнике. Ожидается, что вы будете выполнять вычисления такого рода, конвертируя молекулярную массу в плотность газа.
Ожидается, что вы будете выполнять вычисления такого рода, конвертируя молекулярную массу в плотность газа.
Пример \(\PageIndex{5}\)
Рассчитайте приблизительную молярную массу газа, измеренная плотность которого составляет 3,33 г/л при 30°C и 780 торр.
Решение
Найдите объем, который будет занимать 1 л газа при СТП; обратите внимание, что коррекция до 273 К уменьшит объем, а коррекция до 1 атм (760 торр) увеличит его: 9{–1} \nonumber\]
Плотность газовой смеси
Измерение плотности газа может быть полезным средством оценки состава смеси двух различных газов; это широко используется в операциях промышленной химии, в которых необходимо постоянно контролировать состав газовых потоков.
Пример \(\PageIndex{6}\): Углекислый газ и метан
Найдите состав смеси \(\ce{CO2}\) (44 г/моль) и метана \(\ce{Ch5} \) (16 г/моль), плотность которого составляет 1,214 г/л.
Раствор
Плотность смеси этих двух газов будет прямо пропорциональна ее составу, варьируясь от чистого метана до чистого CO 2 . Начнем с нахождения этих двух плотностей:
Начнем с нахождения этих двух плотностей:
Для CO 2 :
(44 г/моль) ÷ (22,4 л/моль) = 1,964 г/л
Для CH 4 :
(16 г/моль) моль) ÷ (22,4 л/моль) = 0,714 г/л
Если x – это мольная доля CO 2 и (1– x ) — мольная доля CH 4 , мы можем написать
1,964 x + 0,714 (1–x) = 1,214
(имеет ли это смысл? Обратите внимание, что если x = 0, плотность будет такой чистого CH 4 , а если бы это было 1, то это был бы чистый CO 2 .)
Расширение приведенного выше уравнения и решение для x дает мольные доли 0,40 для CO 2 и 0,60 для CH 4 .
Выражение состава газовой смеси
Поскольку большая часть объема, занимаемого газом, состоит из пустого пространства, ничто не мешает двум или более видам газов занимать один и тот же объем. Гомогенные смеси такого типа обычно известны как растворы , но их принято называть просто газообразными смесями . Мы можем указать состав газовых смесей разными способами, но наиболее распространенными являются объемов и мольных долей .
Мы можем указать состав газовых смесей разными способами, но наиболее распространенными являются объемов и мольных долей .
Объемные доли
Из закона Авогадро мы знаем, что «равные объемы содержат одинаковое количество молекул». Это означает, что объемы газов, в отличие от объемов твердых тел и жидкостей, аддитивны. Итак, если в разделенном сосуде имеется два объема газа А в одном сечении и один моль газа В в другом (оба при одинаковых температуре и давлении), и мы удаляем перегородку, объем остается неизменным.
Мы можем уточнить состав этой смеси, сказав, что объемная доля числа А равно 1/3, а числа В равно 2/3.Объемные доли часто называют частичными объемами:
\[V_i = \dfrac{v_i}{\sum v_i}\]
Пусть вас не смущает этот тип записи! Знак суммирования Σ (греч. сигма) просто означает сложение против (объемов) каждого газа. Таким образом, если газ А является « i -м» веществом, как в приведенном выше выражении, суммирование идет от i =1 до i =2. Обратите внимание, что мы можем использовать частичные объемы для определения состава смеси, даже если она никогда не была получена путем объединения чистых газов.
Обратите внимание, что мы можем использовать частичные объемы для определения состава смеси, даже если она никогда не была получена путем объединения чистых газов.
Когда мы говорим, что воздух, например, состоит из 21 процента кислорода и 78 процентов азота по объему, это то же самое, что сказать, что такое же процентное соотношение молекул в воздухе состоит из O 2 и N 2 . Точно так же в 1,0 моль воздуха содержится 0,21 моль O 2 и 0,78 моль N 2 (другие 0,1 моль состоят из различных газовых примесей, но в основном это неон). эквивалентность смесям жидкостей или твердых веществ, к которым E.V.E.N. принцип не применяется.
Мольные доли
Последние два числа (0,21 и 0,78) также выражают мольные доли кислорода и азота в воздухе. Мольная доля означает именно то, что написано: доля молекул, состоящих из определенного вещества. Алгебраически это выражается как
\[X_i = \dfrac{n_i}{\sum_i n_i}\]
, поэтому в случае кислорода в воздухе его молярная доля составляет
\[ X_{O_2} = \dfrac {n_{O_2}}{n_{O_2}+n_{N_2}+n_{Ar}}= \dfrac{0,21}{1}=0,21 \nonnumber\] 9{-1}\номер \]
Молярная масса смеси (1,65 г л –1 )(22,4 л моль –1 ) = 37,0 г моль –1 . Молекулярные массы \(O_2\) и \(N_2\) равны 32 и 44 соответственно. 37,0 составляет 5/12 разницы между молярными массами двух чистых газов. Поскольку плотность газовой смеси прямо пропорциональна ее средней молярной массе, мольная доля более тяжелого газа в смеси также равна 5/12:
Молекулярные массы \(O_2\) и \(N_2\) равны 32 и 44 соответственно. 37,0 составляет 5/12 разницы между молярными массами двух чистых газов. Поскольку плотность газовой смеси прямо пропорциональна ее средней молярной массе, мольная доля более тяжелого газа в смеси также равна 5/12:
\[\dfrac{37-32}{44-32}=\ dfrac{5}{12}=0,42 \номер\]
Пример \(\PageIndex{8}\)
Какова молярная доля углекислого газа в смеси, состоящей из равных масс CO 2 (ММ=44) и неона (ММ=20,2)?
Раствор
Примите любую массу, например 100 г, найдите эквивалентное количество молей каждого газа, а затем подставьте в определение мольной доли:
- n CO2 = (100 г ) ÷ (44 г моль –1 ) = 2,3 моль
- n Ne = (100 г) ÷ (20,2 г моль –1 ) = 4,9 моль
- X Ne = (2,3 моль) ÷ (2,3 моль + 4,9 моль) = 0,32
Закон Дальтона о парциальных давлениях
Уравнение состояния идеального газа применимо к смесям так же, как и к чистым газам. Именно с газовой смесью, обычным воздухом, Бойль, Гей-Люссак и Шарль проводили свои ранние эксперименты. Единственная новая концепция, которая нам нужна для работы с газовыми смесями, — это 9.0037 парциальное давление , понятие, изобретенное известным английским химиком Джоном Дальтоном (1766-1844). Дальтон рассудил, что низкая плотность и высокая сжимаемость газов указывают на то, что они состоят в основном из пустого пространства; отсюда следует, что когда два или более различных газа занимают один и тот же объем, они ведут себя совершенно независимо.
Именно с газовой смесью, обычным воздухом, Бойль, Гей-Люссак и Шарль проводили свои ранние эксперименты. Единственная новая концепция, которая нам нужна для работы с газовыми смесями, — это 9.0037 парциальное давление , понятие, изобретенное известным английским химиком Джоном Дальтоном (1766-1844). Дальтон рассудил, что низкая плотность и высокая сжимаемость газов указывают на то, что они состоят в основном из пустого пространства; отсюда следует, что когда два или более различных газа занимают один и тот же объем, они ведут себя совершенно независимо.
Вклад каждого компонента газовой смеси в общее давление газа известен как парциальное давление этого газа. Сам Дальтон сформулировал этот закон простым и ярким способом, показанным слева.
Обычный способ формулировки Закон Дальтона о парциальных давлениях равен
Полное давление газа представляет собой сумму парциальных давлений его компонентов
, что алгебраически выражается как
\[P_{total} =P_1+P_2+P_3 . .. = \sum_i P_i\]
.. = \sum_i P_i\]
или, что то же самое,
\[ P_{total} = \dfrac{RT}{V} \sum_i n_i\]
Также существует аналогичная связь на основе объемные доли , известные как Закон частичных объемов Амагата . Он в точности аналогичен закону Дальтона в том смысле, что он гласит, что общий объем смеси — это просто сумма частичных объемов ее компонентов. Но есть два важных отличия: закон Амагата справедлив только для идеальных газов, которые должны иметь одинаковые температуру и давление. Закон Дальтона не имеет ни одного из этих ограничений. Хотя закон Амагата кажется интуитивно очевидным, иногда он оказывается полезным в приложениях химической технологии. Мы не будем использовать его в этом курсе.
Пример \(\PageIndex{9}\)
Рассчитайте массу каждого компонента, присутствующего в смеси фтора (MW и ксенона (MW 131,3) в колбе объемом 2,0 л. Парциальное давление Xe составляет 350 торр. и полное давление равно 724 торр при 25°C. [\chi_{Xe} = \dfrac{350}{724} = 0,48 \nonnumber\]
и 9{–1}) \times (0,48 \times 0,078\, моль) = 4,9\, г \номер\]
Пример \(\PageIndex{10}\)
Три колбы разного объема, содержащие разные газы при различных давления соединены запорными кранами, как показано. Когда откроются запорные краны,
Когда откроются запорные краны,
- Какое будет давление в системе?
- Какого газа будет больше всего в смеси?
Предположим, что температура однородна, а объем соединительных трубок незначителен.
Решение
Хитрость здесь заключается в том, что общее число молей n T и температура остаются неизменными, поэтому мы можем использовать закон Бойля PV = константа. Мы проработаем детали только для CO 2 , обозначенного нижними индексами a.
Для CO 2 ,
P a V a = (2,13 атм)(1,50 л) = 3,19 л-атм.
Добавление PV изделий на каждую отдельную емкость, получаем
\[\sum P_iV_i = 6,36 л-атм = n_T рт. \nonumber\]
Мы назовем эту сумму P 1 V 1 . После открытия запорных кранов и смешивания газов новые условия обозначаются P 2 V 2 .
Из закона Бойля,
= 6,36 л-атм . В 2 = Σ В i = 4,50 л.
Решая конечное давление P 2 получаем
(6,36 л-атм)/(4,50 л) = 1,41 атм .
Для CO 2 получается (3,19/ RT )/(6,36/ RT ) = 0,501. Поскольку это значение превышает 0,5, мы знаем, что это самый распространенный газ в конечной смеси.
Применение закона Дальтона: сбор газов над водой
Обычный лабораторный метод сбора газообразного продукта химической реакции состоит в том, чтобы поместить его в перевернутую трубку или бутыль, наполненную водой, отверстие которой погружено в емкость большего размера. воды. Эта схема называется пневматический желоб , который широко использовался на заре химии. Попадая в бутылку, газ вытесняет воду и задерживается в верхней части.
Объем газа можно измерить с помощью калиброванной шкалы на бутылке, а как насчет его давления? Полное давление, удерживающее газ, равно атмосферному, передающему свою силу через воду. (Точный расчет также должен учитывать высоту водяного столба в перевернутой трубке.) Но сама жидкая вода всегда находится в равновесии со своим паром, поэтому пространство в верхней части трубки представляет собой смесь двух газов. : собираемый газ и газообразный H 2 O. Парциальное давление H 2 O известно как давление паров воды и зависит от температуры. Чтобы определить количество собранного газа, мы должны использовать закон Дальтона, чтобы найти парциальное давление этого газа.
(Точный расчет также должен учитывать высоту водяного столба в перевернутой трубке.) Но сама жидкая вода всегда находится в равновесии со своим паром, поэтому пространство в верхней части трубки представляет собой смесь двух газов. : собираемый газ и газообразный H 2 O. Парциальное давление H 2 O известно как давление паров воды и зависит от температуры. Чтобы определить количество собранного газа, мы должны использовать закон Дальтона, чтобы найти парциальное давление этого газа.
Пример \(\PageIndex{11}\)
Газообразный кислород собирали над водой, как показано выше. Атмосферное давление 754 Торр, температура 22°С, объем газа 155 мл. Давление паров воды при 22°С равно 19{-1}\right)(295 \mathrm{K})}=.00619 \mathrm{mol}\nonumber\]
Применение закона Дальтона: подводное плавание с аквалангом
Наша дыхательная система предназначена для поддержания надлежащей концентрации кислорода в крови при парциальном давлении O 2 равном 0,21 атм, что соответствует его нормальному значению на уровне моря. Ниже поверхности воды давление увеличивается на 1 атм на каждые 10,3 м увеличения глубины; таким образом, аквалангист на глубине 10,3 м испытывает давление на тело в общей сложности 2 атм. Чтобы легкие не сжались, воздух, которым дышит дайвер, также должен иметь примерно такое же давление.
Ниже поверхности воды давление увеличивается на 1 атм на каждые 10,3 м увеличения глубины; таким образом, аквалангист на глубине 10,3 м испытывает давление на тело в общей сложности 2 атм. Чтобы легкие не сжались, воздух, которым дышит дайвер, также должен иметь примерно такое же давление.
Но при полном давлении 2 атм парциальное давление \(O_2\) в обычном воздухе будет 0,42 атм; на глубине 100 футов (около 30 м) давление \(O_2\) в 0,8 атм было бы слишком высоким для здоровья. По этой причине воздушная смесь в герметичных баллонах, которые носят аквалангисты, должна содержать меньшую долю \(O_2\). Проще всего этого добиться, увеличив содержание азота, но высокое парциальное давление N 2 также может быть опасным, приводя к состоянию, известному как азотный наркоз. Предпочтительным разбавляющим агентом для длительных глубоких погружений является гелий, который имеет очень небольшую тенденцию растворяться в крови даже при высоком давлении.
Эта страница под названием 6. 3: Закон Дальтона распространяется под лицензией CC BY 3.0 и была создана, изменена и/или курирована Стивеном Лоуэром с использованием исходного контента, который был отредактирован в соответствии со стилем и стандартами платформы LibreTexts; подробная история редактирования доступна по запросу.
3: Закон Дальтона распространяется под лицензией CC BY 3.0 и была создана, изменена и/или курирована Стивеном Лоуэром с использованием исходного контента, который был отредактирован в соответствии со стилем и стандартами платформы LibreTexts; подробная история редактирования доступна по запросу.
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Автор
- Стивен Лоуэр
- Лицензия
- СС BY
- Версия лицензии
- 3,0
- Показать страницу TOC
- № на стр.

- Теги
- Закон Дальтона о парциальном давлении
- источник@http://www.chem1.com/acad/webtext/virtualtextbook.html
Воздух – молекулярная масса и состав
Молекулярная масса (или молярная масса) вещества представляет собой массу одного моля вещества и может быть рассчитана путем суммирования молярных масс всех атомов в молекуле.
Компоненты в сухом воздухе
Воздух представляет собой смесь нескольких газов, где в сухом воздухе преобладают два компонента: 21 об.% кислорода и 78 об.% азот . Кислород имеет молярную массу 15,9994 г/моль, а азот имеет молярную массу 14,0067 г/моль. Поскольку оба эти элемента в воздухе двухатомны — O 2 и N 2 , молярная масса газообразного кислорода составляет ок. 32 г/моль, а молярная масса газообразного азота составляет прибл. 28 г/моль.
32 г/моль, а молярная масса газообразного азота составляет прибл. 28 г/моль.
Средняя молярная масса равна сумме мольных долей каждого газа, умноженной на молярную массу этого конкретного газа:
M Смесь = (x 1 *M 1 + …… + x N *M N ) (1)
, где
333333.. ) (1)
333333 года, где
333333333333.. доли каждого газа
M i = молярная масса каждого газа
Молярная масса сухого воздуха с кислородом, азотом и другими компонентами, указанными ниже, составляет 28,9647 г/моль. Состав и содержание каждого газа в воздухе приведены на рисунках и в таблице ниже.
См. также Воздух Плотность при различном давлении, Плотность и удельный вес при различном давлении, Коэффициенты диффузии газов в воздухе, Динамическая (абсолютная) и кинематическая вязкость, Число Прандтля, Удельная теплоемкость при различной температуре и Удельная теплоемкость при различном давлении, Теплопроводность, теплопроводность, свойства в условиях газожидкостного равновесия и свойства воздуха для других свойств воздуха.
Для полной таблицы с Молярной массой и Молярной массой в воздухе — поверните экран!
| Components in dry air | Volume ratio = Molar ratio, compared to dry air | Molar Mass | Molar mass in air | |||
| Name | Формула | [моль/моль воздух ] | [об.%] | [g/mol] [kg/kmol] | [g/mol air ] [kg/kmol air ] | [wt %] |
| Nitrogen | N 2 | 0.78084 | 78.084 | 28.013 | 21. 873983 873983 | 75.52 |
| Oxygen | O 2 | 0.20946 | 20.946 | 31.999 | 6.702469 | 23.14 |
| Argon | Ar | 0.00934 | 0.934 | 39.948 | 0.373114 | 1.29 |
| Carbon dioxide | CO 2 | 0.00033 | 0.033 | 44.010 | 0.014677 | 0.051 |
| Neon | Ne | 0.00001818 | 0.001818 | 20.180 | 0.000367 | 0.0013 |
| Helium | He | 0.00000524 | 0.000524 | 4.003 | 0.000021 | 0.00007 |
| Methane | CH 4 | 0.00000179 | 0.000179 | 16.042 | 0,000029 | 0,00010 |
| Криптон | Кр | 0,0000010 | 0,0001 8 308 | 0. 000084 000084 | 0.00029 | |
| Hydrogen | H 2 | 0.0000005 | 0.00005 | 2.016 | 0.000001 | 0.000003 |
| Xenon | Xe | 0.00000009 | 0.000009 | 131.293 | 0,000012 | 0,00004 |
| Средняя молярная масса воздуха | 28,9647 | |||||
- 1 кг = 2,2046 фунта
Верхнее
Плотность воздуха
. Плотность сухого воздуха может быть рассчитана с использованием 10034 9067
3333333333333333333333333333333333333333333 гг. )
где
P = давление (Па)
R воздух = 287,05 = индивидуальная газовая постоянная [Дж/кг K]
T = абсолютная температура [K]
- 2 Пример: плотность сухой воздух при атмосферном давлении 101,325 кПа (101325 Па) и 0 o C (= 273,15 K) можно рассчитать как
ρ = 101325 [Па] / (287,05 [Дж/кг K]*090 [K]*273,15
= 1,292 [кг/м 3 ]
Водяной пар
Водяной пар почти всегда присутствует в воздухе.

 )
)