Бром — Периодическая Таблица
Группа
17
Период
4
Блок
p
Протоны
Электроны
Нейтроны
35
35
45
Главные Свойства
Атомный номер
35
Атомный вес
79,904
Массовое число
80
Категория
Галогены
Цвет
Красный
Радиоактивность
Нет
От греческого слова бромос, зловоние
Кристаллическая структура
Основоцентрированный Ромб
История
Карл Якоб Левиг открыл бром в 1825 году, ещё будучи студентом химии в Гейдельбергском университете, Германия.
Антуан Балар дистиллировал бром из раствора золы морских водорослей, насыщенного хлором, в 1824 году.
Наконец, он опубликовал свои результаты в 1826 году, предоставив доказательства того, что обнаруженное им вещество было новым элементом.
Бром — единственный неметаллический элемент, который при обычных температурах находится в жидком состоянии
Физические Свойства
Фаза
Жидкость
Плотность
3,122 грамм/см3
Температура плавления
265,95 K | -7,2 °C | 19,04 °F
Температура кипения
331,95 K | 58,8 °C | 137,84 °F
Теплота плавления
5,8 кДж/моль
Теплота парообразования
14,8 кДж/моль
Удельная теплоемкость
0,474 Дж/грамм·K
Избыток на Земле
0,0003%
Избыток во Вселенной
7×10-7%
Изображение разработчиков: Images-of-elements
Pure liquid bromine
Номер CAS
7726-95-6
Номер PubChem CID
24408
Атомные Свойства
Атомный радиус
120 pm
Ковалентный радиус
120 pm
Электроотрицательность
2,96 (Шкала Полинга)
Ионизационный потенциал
11,8138 эВ
Атомный объем
23,5 см3/моль
Теплопроводность
0,00122 W/см·K
Состояния окисления
-1, 1, 3, 4, 5, 7
Применения
Бром используется в производстве фумигантов, огнезащитных средств, составов для очистки воды, красителей, лекарств и дезинфицирующих средств.
Бромид калия используется в качестве источника ионов бромида для производства бромида серебра для фотопленки.
Бром также используется для уменьшения загрязнения ртутью угольных электростанций.
Бром ядовит и вызывает ожоги кожи
Изотопы
Стабильные изотопы
79Br, 81Br
Нестабильные изотопы
67Br, 68Br, 69Br, 70Br, 71Br, 72Br, 73Br, 74Br, 75Br, 76Br, 77Br, 78Br, 80Br, 82Br, 83Br, 84Br, 85Br, 86Br, 87Br, 88Br, 89Br, 90Br, 91Br, 92Br, 93Br, 94Br, 95Br, 96Br, 97Br
Важные Ссылки
Википедия
Encyclopaedia BritannicaWolfram AlphaChemicoolRSC Visual ElementsWebElements
СеленBrКриптон
обзор новостей из мира элементарных частиц
Авторизация Регистрация
Сброс пароля
Подпишитесь на «СР-КУРЬЕР» Быстрая и маленькая, как атом, газета — доставляем свежие новости из «Росатома», России и мира прямиком в ваш почтовый ящик
Больше не показывать
Вы знаете больше и готовы рассказать?
У вас есть интересная история или вы знаете больше о теме, по которой мы уже выпустили материал.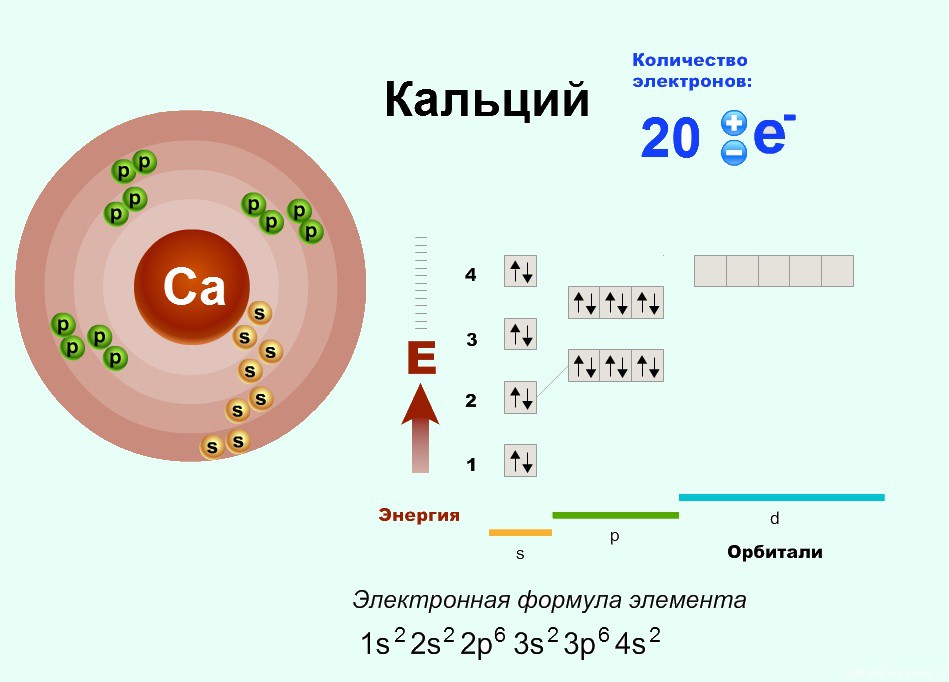 Поделитесь с СР любой идеей. Ждем ваших сообщений!
Поделитесь с СР любой идеей. Ждем ваших сообщений!
Прикрепить файл
Отправить
Специалисты в области субатомной физики не унимаются: в последние полгода они расщепляли ядра, двигали зеркала квантовым шумом, ловили протоны и делали множество других интересных вещей. Мы подготовили очередной обзор новостей из мира элементарных частиц.
Российские ученые получили новые данные о загадочной X(3872). Ее обнаружили в 2003 году в эксперименте Belle. «Как правило, уже через пару лет после открытия у специалистов появляется понимание, что представляет собой частица. X(3872) уникальна в том смысле, что на протяжении уже 17 лет у нас все еще нет представления о ее структуре, — говорит научный сотрудник Института теоретической и экспериментальной физики Иван Беляев. — Нам были известны лишь необычные свойства: во‑первых, при большой массе X(3872) ее ширина очень мала, а во‑вторых, масса частицы совпадает с суммой масс двух других частиц: D-ноль-мезона и возбужденного D-ноль-мезона».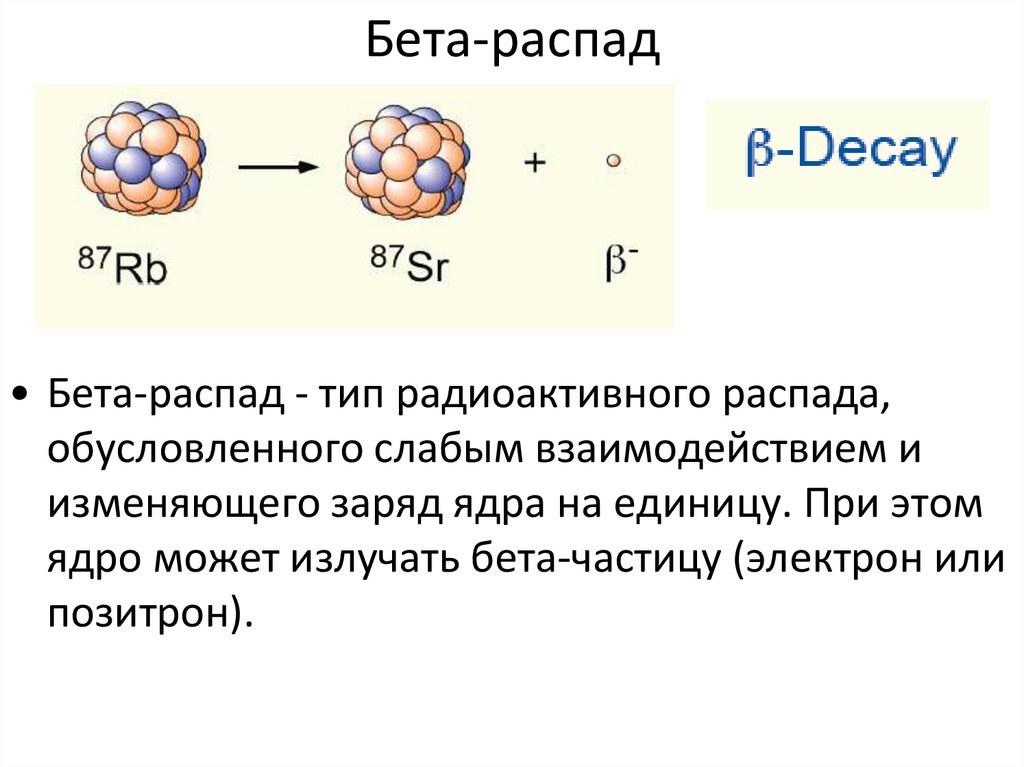
Внести ясность помогли специалисты Института ядерной физики им. Будкера СО РАН — участники коллаборации LHCb в ЦЕРНе. Эксперименты на детекторе КЕДР позволили получить точные значения ширины и массы X(3872), а также сделать некоторые предположения о ее природе. «Используя нетривиальный для области энергий эксперимента LHCb метод поиска полюсов комплексной амплитуды, ученые «пощупали» форму X(3872)», — рассказывает Иван Беляев. Форму описал главный научный сотрудник ИЯФ СО РАН Семен Эйдельман: это гибрид, в котором иногда проявляются молекулярные свойства, а иногда свойства кваркония (вид мезона, состоящий из кварка и антикварка одного и того же аромата).
Пошатнули фундаментУченые из Мичиганского университета обнаружили нарушение симметрии атомного ядра, сообщает журнал Heritage Daily. Они хотели понять, как во Вселенной образуются химические элементы, и имитировали вспышки нейтронных звезд на ускорителе. В ходе экспериментов получили короткоживущий стронций‑73 — редкий изотоп, который не встречается на Земле, но может существовать в течение коротких периодов во время сильных рентгеновских вспышек на поверхности нейтронных звезд.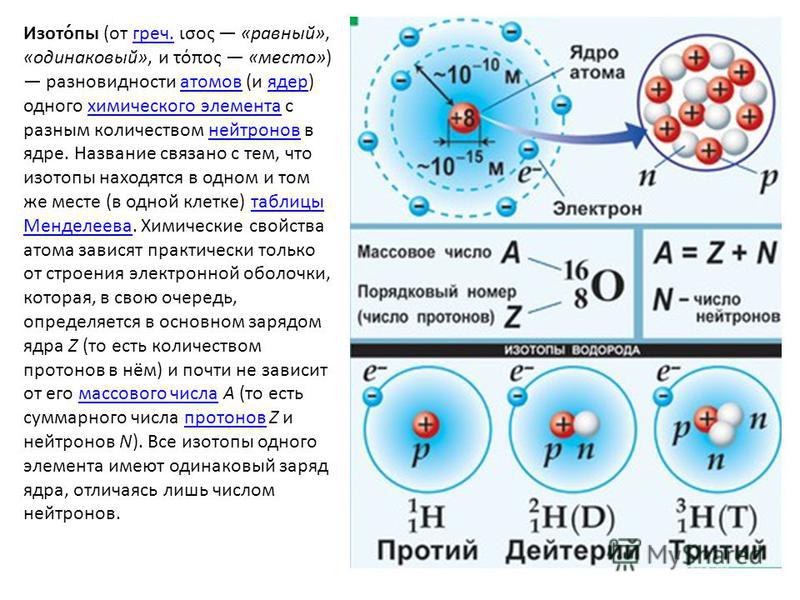 Этот изотоп содержит 38 протонов и 35 нейтронов.
Этот изотоп содержит 38 протонов и 35 нейтронов.
Свойства полученного изотопа сопоставляли с известными свойствами брома‑73, содержащего 35 протонов и 38 нейтронов. Ядра брома‑73 считаются «зеркальными партнерами» ядер стронция‑73. Зеркальная симметрия в ядрах существует из-за сходства между протонами и нейтронами, и это одна из фундаментальных основ ядерной физики.
Но сюрпризом стало то, что при распаде стронций‑73 ведет себя совершенно иначе, чем бром‑73. «Стронций‑73 и бром‑73 должны быть идентичными по структуре, но, как это ни удивительно, мы идентичность не обнаружили, — сказал Эндрю Роджерс, участник исследовательской группы. — Выявление симметрий, существующих в природе, — очень мощный инструмент для физиков. Когда симметрия разрушается, это говорит о том, что что-то не так в нашем понимании и нужно присмотреться повнимательнее». Открытие ставит новые вопросы о силах, действующих в ядре атома.
Поставщик протоновПосле двух лет модернизации и восстановительных работ Большой адронный коллайдер возвращается к своим обязанностям. Началом очередного этапа в жизни коллайдера стало включение на полную мощность линейного ускорителя частиц Linac‑4, нового поставщика протонов в кольцо БАКа.
Началом очередного этапа в жизни коллайдера стало включение на полную мощность линейного ускорителя частиц Linac‑4, нового поставщика протонов в кольцо БАКа.
В 2018 году Linac‑2, который подавал протоны в ускорительный комплекс ЦЕРНа с 1978 года, был окончательно выведен из эксплуатации. Его место занял 86-метровый Linac‑4. До середины августа этого года ускоритель вырабатывал только низкоэнергетические лучи, используя для разгона свою правую половину. В конце августа было первое включение ускорителя «на всю длину», с лучами максимальной мощности. На этапе тестирования лучи отправляются в ловушку, которая поглощает высокоэнергетические частицы, не производя потоков вторичного излучения. Циркулировать в кольце БАКа они начнут с сентября 2021 года.
Пришельцы из ниоткудаВ субатомном мире происходят странные с точки зрения макромира вещи: частицы могут «телепортироваться», обмениваться информацией, находясь на огромном расстоянии друг от друга, одна частица может быть в двух местах одновременно. Среди феноменов квантового царства есть флуктуации: даже в вакууме вдруг, откуда ни возьмись, могут появиться квантовые частицы, которые оставляют после себя квантовый шум. И как выяснили ученые Массачусетского технологического института, этот шум может двигать объекты видимого мира.
Среди феноменов квантового царства есть флуктуации: даже в вакууме вдруг, откуда ни возьмись, могут появиться квантовые частицы, которые оставляют после себя квантовый шум. И как выяснили ученые Массачусетского технологического института, этот шум может двигать объекты видимого мира.
Экспериментаторы взяли 40-килограммовое зеркало и создали рядом с ним квантовые флуктуации. Зеркало сдвинулось на одну сикстиллионную долю метра. «Размер атома водорода составляет 10–10 м, и мы использовали его в качестве опорной величины для измерения смещения», — рассказал один из участников проекта, Ли Маккаллер. По мнению ученых, воздействие квантового мира на макромир происходит повсеместно. Может, это получится использовать?
Кандидаты в спиновые жидкостиСуществование квантовых спиновых жидкостей было предсказано почти 40 лет назад, в 2012 году предположение подтвердилось экспериментально. В этом экзотическом состоянии вещество устойчиво к внешним возмущениям, что весьма перспективно для создания кубитов квантовых компьютеров. Поэтому физики очень хотят научиться синтезировать спиновые жидкости.
Поэтому физики очень хотят научиться синтезировать спиновые жидкости.
Расчеты ученых из Университета Арканзаса — важный шаг в этом направлении. За годы предыдущих исследований удалось подобрать лишь два материала, у которых достижимо состояние квантовой жидкости: RuCl3 и Na2IrO3. Американцы существенно расширили этот список. Они обратили внимание на материалы с более высокими квантовыми числами спинов. Моделирование показало, что при физическом воздействии для настройки магнитных состояний можно получить десятки вариантов спиновых жидкостей. Если расчеты подтвердят экспериментально, ждем революцию в квантовых вычислениях.
Есть интересная история?
Напишите нам
Читайте также:
Спецвыпуск «Росатом» — 15 лет
Скачать
Спецвыпуск «Росатом» — 15 лет
Скачать
Бром — протоны — нейтроны — электроны
Бром является третьим по легкости галогеном и представляет собой дымящую красно-коричневую жидкость при комнатной температуре, которая легко испаряется с образованием газа аналогичного цвета. Таким образом, его свойства занимают промежуточное положение между свойствами хлора и йода.
Таким образом, его свойства занимают промежуточное положение между свойствами хлора и йода.
Протоны и нейтроны в броме
Бром — это химический элемент с атомным номером 35 , что означает, что в его ядре 35 протонов. Общее количество протонов в ядре называется атомный номер атома и обозначен символом Z . Таким образом, общий электрический заряд ядра равен +Ze, где e (элементарный заряд) равен 1,602 x 10 -19 кулонов .
Общее число нейтронов в ядре атома называется числом нейтронов атома и обозначается символом N . Число нейтронов плюс атомный номер равняется атомному массовому числу: N+Z=A . Разница между числом нейтронов и атомным номером известна как избыток нейтронов : D = N – Z = A – 2Z.
Для стабильных элементов обычно используется множество стабильных изотопов. Изотопы — это нуклиды с одинаковым атомным номером и, следовательно, одним и тем же элементом, но различающиеся числом нейтронов. Массовые числа типичных изотопов Брома равны 79; 81.
Массовые числа типичных изотопов Брома равны 79; 81.
Основные изотопы брома
Бром встречается только в двух природных изотопах: 79 Br и 81 Br.
Бром-79 состоит из 35 протонов, 44 нейтронов и 35 электронов.
Бром-81 состоит из 35 протонов, 46 нейтронов и 35 электронов.
Природные изотопы
Типичные нестабильные изотопы
Электроны и электронная конфигурация
Количество электронов в электрически нейтральном атоме равно количеству протонов в ядре. Следовательно, число электронов в нейтральном атоме Бром равно 35. На каждый электрон действуют электрические поля, создаваемые положительным зарядом ядра и другими (Z – 1) отрицательными электронами в атоме.
Поскольку количество электронов и их расположение ответственны за химическое поведение атомов, атомный номер идентифицирует различные химические элементы. Конфигурация этих электронов следует из принципов квантовой механики. Количество электронов в электронных оболочках каждого элемента, особенно в самой внешней валентной оболочке, является основным фактором, определяющим поведение его химической связи. В периодической таблице элементы перечислены в порядке возрастания атомного номера Z.
Конфигурация этих электронов следует из принципов квантовой механики. Количество электронов в электронных оболочках каждого элемента, особенно в самой внешней валентной оболочке, является основным фактором, определяющим поведение его химической связи. В периодической таблице элементы перечислены в порядке возрастания атомного номера Z.
Электронная конфигурация Брома : [Ar] 3d10 4s2 4p5 .
Возможные степени окисления +1,3,5/-1 .
Наиболее распространенное применение брома
Бром занимает промежуточное положение по реакционной способности между хлором и йодом и является одним из наиболее реакционноспособных элементов. Широкий спектр броморганических соединений используется в промышленности. Некоторые получают из брома, а другие получают из бромистого водорода, который получают путем сжигания водорода в броме. Бромированные антипирены представляют собой товар, приобретающий все большее значение, и представляют собой наиболее широкое коммерческое применение брома. Например, Полибромированные дифениловые эфиры или ПБДЭ представляют собой класс броморганических соединений, которые используются в качестве антипиренов.
Например, Полибромированные дифениловые эфиры или ПБДЭ представляют собой класс броморганических соединений, которые используются в качестве антипиренов.
О протонах
Протон — это одна из субатомных частиц, составляющих материю. Во Вселенной протонов много, и они составляют примерно половины всей видимой материи. Он имеет положительный электрический заряд (+1e) и массу покоя, равную 1,67262 × 10 −27 кг ( 938,272 МэВ/c 2 ) — немного легче, чем у нейтрона, но почти в 1836 раз больше, чем у электрона. Протон имеет средний квадратный радиус около 0,87 × 10 −15 м, или 0,87 фм, и его спин — ½ фермиона.
Протоны существуют в ядрах обычных атомов вместе с их нейтральными аналогами, нейтронами. Нейтроны и протоны, обычно называемые нуклонами , связаны друг с другом в атомном ядре, где они составляют 99,9% массы атома. Исследования в области физики частиц высоких энергий в 20 веке показали, что ни нейтрон, ни протон – это не наименьший строительный блок материи.
Исследования в области физики частиц высоких энергий в 20 веке показали, что ни нейтрон, ни протон – это не наименьший строительный блок материи.
О нейтронах
Нейтрон — это одна из субатомных частиц, составляющих материю. Во Вселенной много нейтронов, составляющих больше половины всей видимой материи. У него нет электрического заряда , а масса покоя равна 1,67493 × 10-27 кг, что немного больше, чем у протона, но почти в 1839 раз больше, чем у электрона. Нейтрон имеет средний квадратный радиус около 0,8 × 10–15 м или 0,8 фм и является фермионом со спином ½.
Атомные ядра состоят из протонов и нейтронов, которые притягиваются друг к другу ядерной силой , а протоны отталкиваются друг от друга электрической силой из-за своего положительного заряда. Эти две силы конкурируют, что приводит к различной устойчивости ядер. Существуют только определенные комбинации нейтронов и протонов, которые образуют стабильных ядер .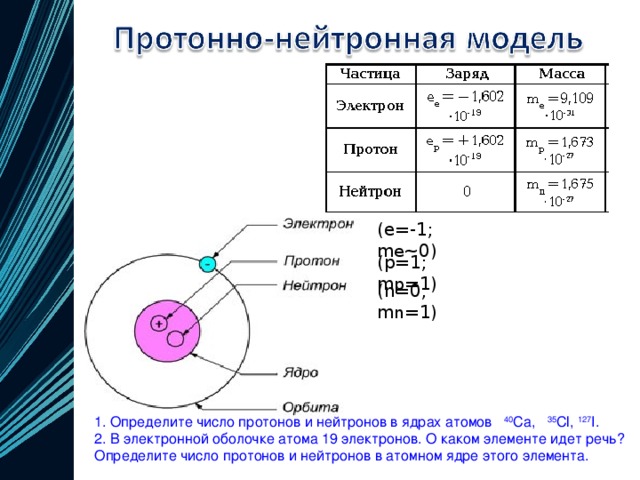
Нейтроны стабилизируют ядро , потому что они притягивают друг друга и протоны , что помогает компенсировать электрическое отталкивание между протонами. В результате с увеличением числа протонов для образования стабильного ядра требуется увеличивающееся соотношение нейтронов и протонов . Если нейтронов слишком много или слишком мало для данного количества протонов, полученное ядро не является стабильным и подвергается радиоактивному распаду. Нестабильные изотопы распадаются по различным путям радиоактивного распада, чаще всего альфа-распад, бета-распад или захват электронов. Известно много других редких типов распада, таких как спонтанное деление или испускание нейтронов. Следует отметить, что все эти пути распада могут сопровождаться последующий выброс гамма-излучения . Чистые альфа- или бета-распады очень редки.
Об электронах и электронной конфигурации
Периодическая таблица представляет собой табличное отображение химических элементов, организованных на основе их атомных номеров, электронных конфигураций и химических свойств. Электронная конфигурация — это распределение электронов атома или молекулы (или другой физической структуры) на атомных или молекулярных орбиталях. Знание электронной конфигурации различных атомов полезно для понимания структуры периодической таблицы элементов.
Электронная конфигурация — это распределение электронов атома или молекулы (или другой физической структуры) на атомных или молекулярных орбиталях. Знание электронной конфигурации различных атомов полезно для понимания структуры периодической таблицы элементов.
Каждое твердое тело, жидкость, газ и плазма состоят из нейтральных или ионизированных атомов. Химические свойства атома определяются количеством протонов, фактически количеством и расположением электронов . Конфигурация этих электронов следует из принципов квантовой механики. Количество электронов в электронных оболочках каждого элемента, особенно в самой внешней валентной оболочке, является основным фактором, определяющим поведение его химической связи. В периодической таблице элементы перечислены в порядке возрастания атомного номера Z.
Это принцип запрета Паули, который требует, чтобы электроны в атоме занимали разные энергетические уровни вместо того, чтобы все они конденсировались в основном состоянии. Упорядочивание электронов в основном состоянии многоэлектронных атомов начинается с самого низкого энергетического состояния (основного состояния) и постепенно перемещается оттуда вверх по энергетической шкале, пока каждому из электронов атома не будет присвоен уникальный набор квантовых чисел. Этот факт имеет ключевое значение для построения периодической таблицы элементов.
Упорядочивание электронов в основном состоянии многоэлектронных атомов начинается с самого низкого энергетического состояния (основного состояния) и постепенно перемещается оттуда вверх по энергетической шкале, пока каждому из электронов атома не будет присвоен уникальный набор квантовых чисел. Этот факт имеет ключевое значение для построения периодической таблицы элементов.
Первые два столбца в левой части таблицы Менделеева занимают s подоболочки. Из-за этого первые две строки периодической таблицы помечены как блок s . Точно так же блок p представляет собой крайние правые шесть столбцов периодической таблицы, блок d представляет собой 10 средних столбцов периодической таблицы, а блок f представляет собой раздел из 14 столбцов, который обычно изображается как отделенный от основной части таблицы Менделеева. Она могла бы быть частью основной части, но тогда таблица Менделеева была бы довольно длинной и громоздкой.
Для атомов с большим количеством электронов это обозначение может стать длинным, поэтому используется сокращенное обозначение. Электронная конфигурация может быть представлена в виде основных электронов, эквивалентных благородному газу предыдущего периода, и валентных электронов (например, [Xe] 6s2 для бария).
Степени окисления
Степени окисления обычно представляются целыми числами, которые могут быть положительными, нулевыми или отрицательными. Большинство элементов имеют более одной возможной степени окисления. Например, углерод имеет девять возможных целочисленных степеней окисления от -4 до +4.
Текущее определение степени окисления в Золотой книге ИЮПАК:
«Степень окисления атома — это заряд этого атома после ионной аппроксимации его гетероядерных связей…»
, и термин «степень окисления» является почти синонимом. Элемент, который не сочетается ни с какими другими элементами, имеет степень окисления 0. Степень окисления 0 встречается у всех элементов — это просто элемент в его элементарной форме. Атом элемента в соединении будет иметь положительную степень окисления, если у него удалены электроны. Точно так же добавление электронов приводит к отрицательной степени окисления. Мы также различаем возможные и распространенные степени окисления каждого элемента. Например, кремний имеет девять возможных целочисленных степеней окисления от -4 до +4, но только -4, 0 и +4 являются обычными степенями окисления.
Степень окисления 0 встречается у всех элементов — это просто элемент в его элементарной форме. Атом элемента в соединении будет иметь положительную степень окисления, если у него удалены электроны. Точно так же добавление электронов приводит к отрицательной степени окисления. Мы также различаем возможные и распространенные степени окисления каждого элемента. Например, кремний имеет девять возможных целочисленных степеней окисления от -4 до +4, но только -4, 0 и +4 являются обычными степенями окисления.
Сводка
| Элемент | Бром |
| Количество протонов | 35 |
| Количество нейтронов (типичные изотопы) | 79; 81 |
| Число электронов | 35 |
| Электронная конфигурация | [Ар] 3d10 4s2 4p5 |
| Степени окисления | +1,3,5/-1 |
Источник: www. luciteria.com
luciteria.com
Свойства других элементов
Другие свойства брома
| 1 | Найдите количество нейтронов | Н | |
| 2 | Найдите массу 1 моля | Н_2О | |
| 3 | Весы | H_2(SO_4)+K(OH)→K_2(SO_4)+H(OH) | |
| 4 | Найдите массу 1 моля | Х | |
| 5 | Найдите количество нейтронов | Фе | |
| 6 | Найдите количество нейтронов | ТК | |
| 7 | Найдите электронную конфигурацию | Х | |
| 8 | Найдите количество нейтронов | Са | |
| 9 | Весы | CH_4+O_2→H_2O+CO_2 | |
| 10 | Найдите количество нейтронов | С | |
| 11 | Х | ||
| 12 | Найдите количество нейтронов | О | |
| 13 | Найдите массу 1 моля | СО_2 | |
| 14 | Весы | C_8H_18+O_2→CO_2+H_2O | |
| 15 | Найдите атомную массу | Х | |
| 16 | Определите, растворимо ли соединение в воде | Н_2О | |
| 17 | Найдите электронную конфигурацию | На | |
| 18 | Найдите массу отдельного атома | Х | |
| 19 | Найдите количество нейтронов | № | |
| 20 | Найдите количество нейтронов | Аи | |
| 21 | Найдите количество нейтронов | Мн | |
| 22 | Найдите количество нейтронов | Ру | |
| 23 | Найдите электронную конфигурацию | О | |
| 24 | Найдите массовые проценты | Н_2О | |
| 25 | Определите, растворимо ли соединение в воде | NaCl | |
| 26 | Найдите эмпирическую/самую простую формулу | Н_2О | |
| 27 | Найдите числа окисления | Н_2О | |
| 28 | Найдите электронную конфигурацию | К | |
| 29 | Найдите электронную конфигурацию | мг | |
| 30 | Найдите электронную конфигурацию | Са | |
| 31 | Найдите количество нейтронов | Рх | |
| 32 | Найдите количество нейтронов | На | |
| 33 | Найдите количество нейтронов | Пт | |
| 34 | Найдите количество нейтронов | Быть | Быть |
| 35 | Найдите количество нейтронов | Кр | |
| 36 | Найдите массу 1 моля | Н_2SO_4 | |
| 37 | Найдите массу 1 моля | HCl | |
| 38 | Найдите массу 1 моля | Фе | |
| 39 | Найдите массу 1 моля | С | |
| 40 | Найдите количество нейтронов | Медь | |
| 41 | Найдите количество нейтронов | С | |
| 42 | Найдите числа окисления | Х | |
| 43 | Баланс | CH_4+O_2→CO_2+H_2O | |
| 44 | Найдите атомную массу | О | |
| 45 | Найдите атомный номер | Х | |
| 46 | Найдите количество нейтронов | Пн | |
| 47 | Найдите количество нейтронов | Ос | |
| 48 | Найдите массу 1 моля | NaOH | |
| 49 | Найдите массу 1 моля | О | |
| 50 | Найдите электронную конфигурацию | Фе | |
| 51 | Найдите электронную конфигурацию | ||
| 52 | Найдите массовые проценты | NaCl | |
| 53 | Найдите массу 1 моля | К | |
| 54 | Найдите массу отдельного атома | На | |
| 55 | Найдите количество нейтронов | Н | |
| 56 | Найдите количество нейтронов 92О | ||
| 60 | Упростить | ч*2о | |
| 61 | Определите, растворимо ли соединение в воде | Х | |
| 62 | Определение плотности на STP | Н_2О | |
| 63 | Найдите числа окисления | NaCl | |
| 64 | Найдите атомную массу | Он | Он |
| 65 | Найдите атомную массу | мг | |
| 66 | Найдите число электронов | Х | |
| 67 | Найдите число электронов | О | |
| 68 | Найдите число электронов | С | |
| 69 | Найдите количество нейтронов | ПД | |
| 70 | Найдите количество нейтронов | рт. |
